Per scuola elementare ESEMPIO PER APPLICARE METODO SPERIMENTALE







- Slides: 17

Per scuola elementare ESEMPIO PER APPLICARE METODO SPERIMENTALE OSSERVAZIONE-REGISTRAZIONE DATI-INTERPRETAZIONE Isolanti e conduttori elettroliti e non elettroliti Conducibilità elettrica di una soluzione elettrolitica Opportuno schermo completo cliccare quando serve…

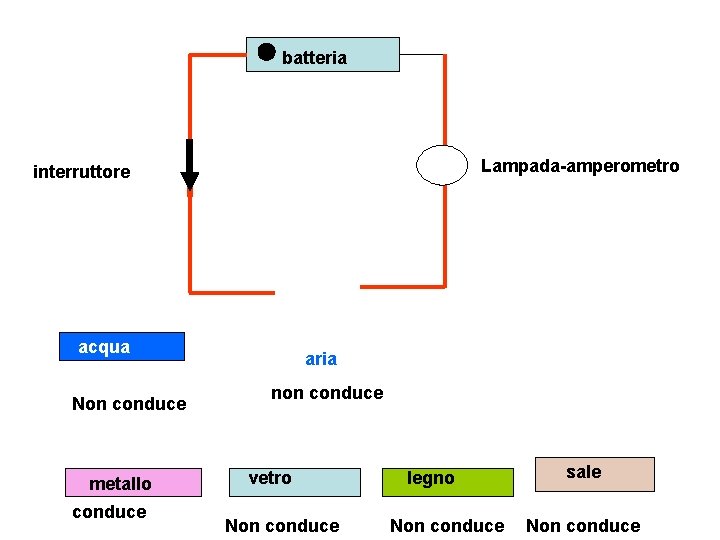
batteria Lampada-amperometro interruttore acqua Non conduce metallo conduce aria non conduce vetro Non conduce legno Non conduce sale Non conduce

Osservazioni e definizioni relative all’esperimento Alcune sostanze inserite nel circuito elettrico non permettono il passaggio della corrente elettrica : esempio aria, acqua, legno, vetro, alcool, soda, zucchero…. . Mentre altre lo permettono: metalli in genere Si denisce isolante la sostanza che non consente passaggio della corrente Si definisce conduttore la sostanza che permette passaggio della corrrente Altro esperimento usando soluzioni


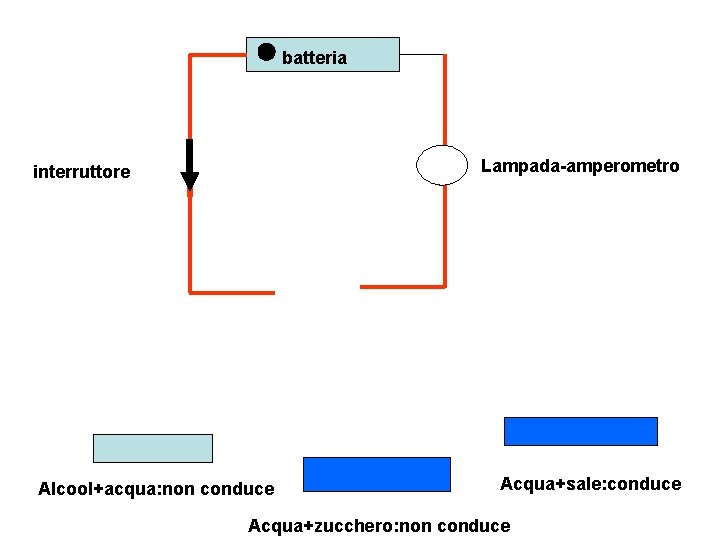
batteria Lampada-amperometro interruttore Alcool+acqua: non conduce Acqua+sale: conduce Acqua+zucchero: non conduce

Osservazioni su risultato esperimento: mentre era attendibile che mescolando tra loro sostanze tutte isolanti come acqua+ alcool acqua+ zucchero acqua+ sale Non dovesse formarsi una soluzione conduttrice si trova invece che soluzione tra acqua (isolante) e sale(isolante) produce una soluzione conduttrice Si definisce non elettrolita la sostanza che in soluzione non rende conduttrice la soluzione stessa(es. zucchero, alcool. . ) Si definisce elettrolita la sostanza che rende conduttrice la soluzione (esempio: Sali, acidi, idrossidi o basi) Come spiegare tale diverso comportamento? Vedi esperimento con soluzioni elettrolitiche

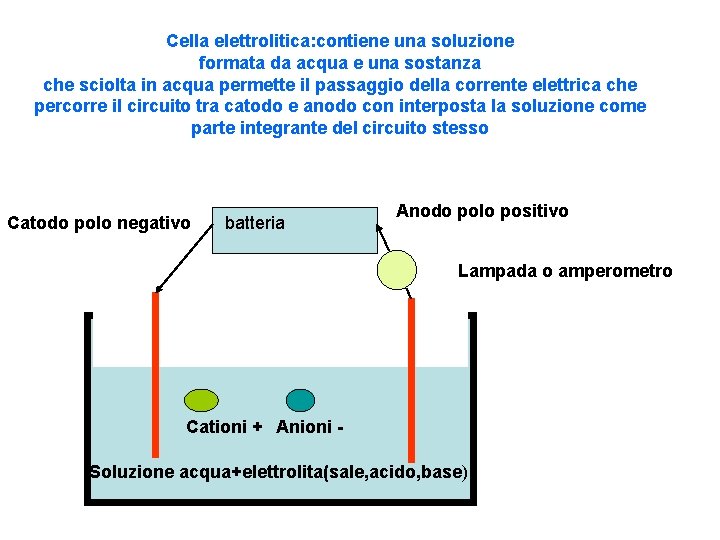
Cella elettrolitica: contiene una soluzione formata da acqua e una sostanza che sciolta in acqua permette il passaggio della corrente elettrica che percorre il circuito tra catodo e anodo con interposta la soluzione come parte integrante del circuito stesso Catodo polo negativo batteria Anodo polo positivo Lampada o amperometro Cationi + Anioni Soluzione acqua+elettrolita(sale, acido, base)


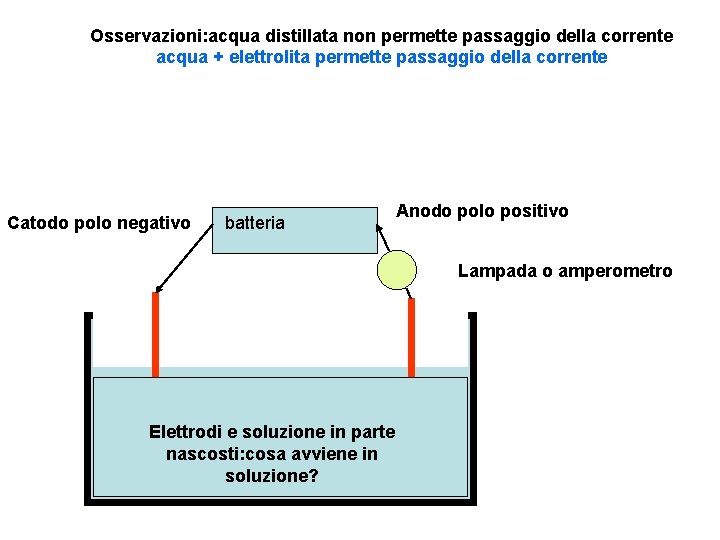
Osservazioni: acqua distillata non permette passaggio della corrente acqua + elettrolita permette passaggio della corrente Catodo polo negativo batteria Anodo polo positivo Lampada o amperometro Cationi + Anioniin- parte Elettrodi e soluzione nascosti: cosa avviene in soluzione?

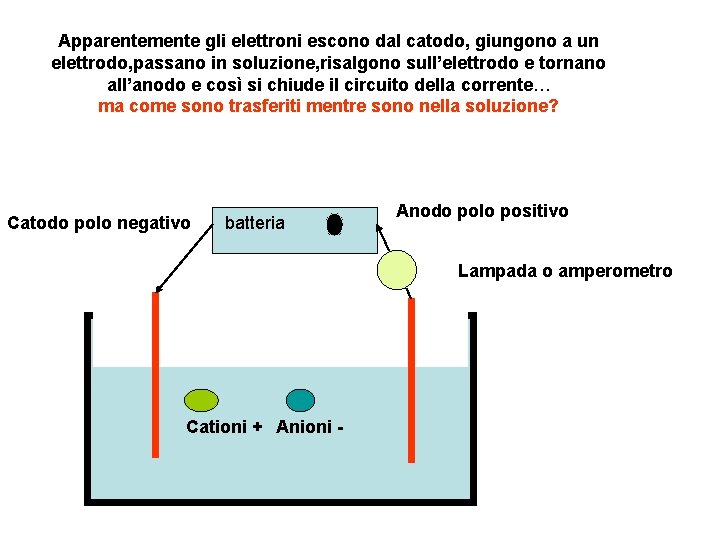
Apparentemente gli elettroni escono dal catodo, giungono a un elettrodo, passano in soluzione, risalgono sull’elettrodo e tornano all’anodo e così si chiude il circuito della corrente… ma come sono trasferiti mentre sono nella soluzione? Catodo polo negativo batteria Anodo polo positivo Lampada o amperometro Cationi + Anioni -

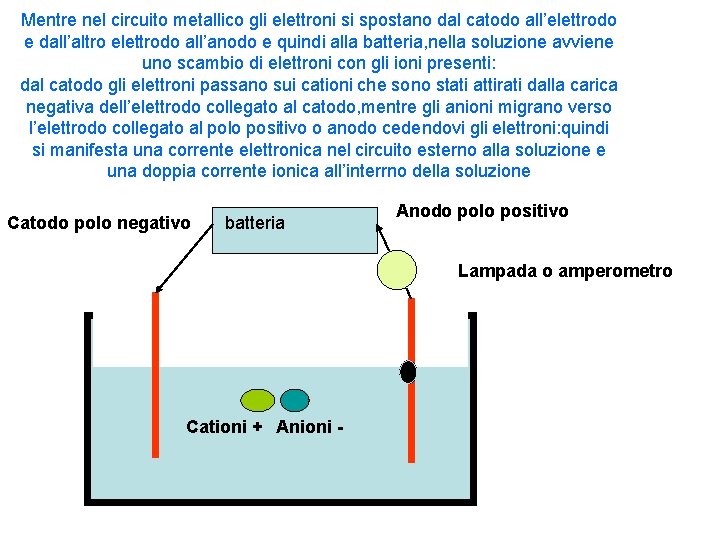
Mentre nel circuito metallico gli elettroni si spostano dal catodo all’elettrodo e dall’altro elettrodo all’anodo e quindi alla batteria, nella soluzione avviene uno scambio di elettroni con gli ioni presenti: dal catodo gli elettroni passano sui cationi che sono stati attirati dalla carica negativa dell’elettrodo collegato al catodo, mentre gli anioni migrano verso l’elettrodo collegato al polo positivo o anodo cedendovi gli elettroni: quindi si manifesta una corrente elettronica nel circuito esterno alla soluzione e una doppia corrente ionica all’interrno della soluzione Catodo polo negativo batteria Anodo polo positivo Lampada o amperometro Cationi + Anioni -

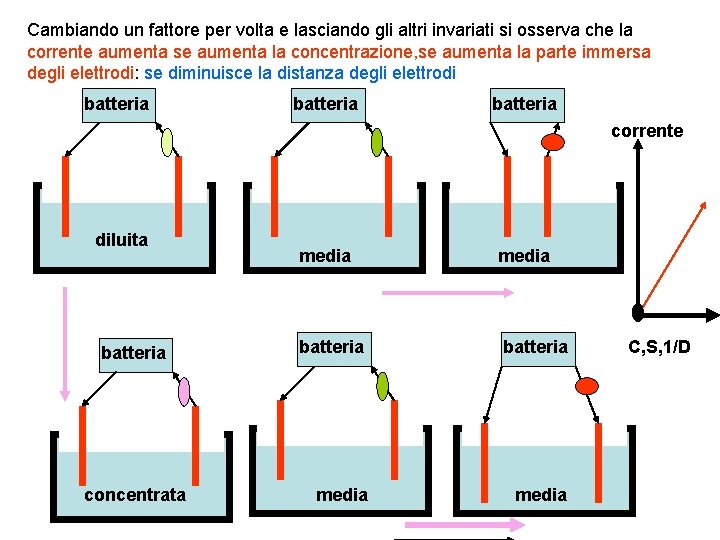
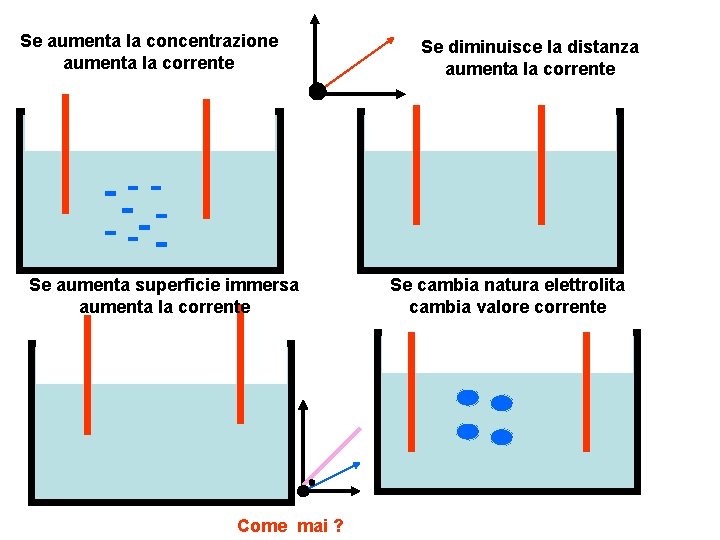
Cambiando un fattore per volta e lasciando gli altri invariati si osserva che la corrente aumenta se aumenta la concentrazione, se aumenta la parte immersa degli elettrodi: se diminuisce la distanza degli elettrodi batteria corrente diluita batteria concentrata media batteria media C, S, 1/D


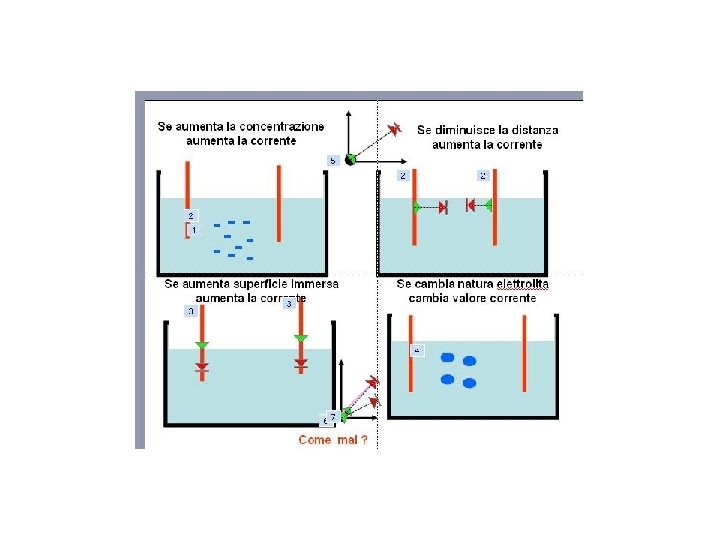
Se aumenta la concentrazione aumenta la corrente Se aumenta superficie immersa aumenta la corrente Come mai ? Se diminuisce la distanza aumenta la corrente Se cambia natura elettrolita cambia valore corrente


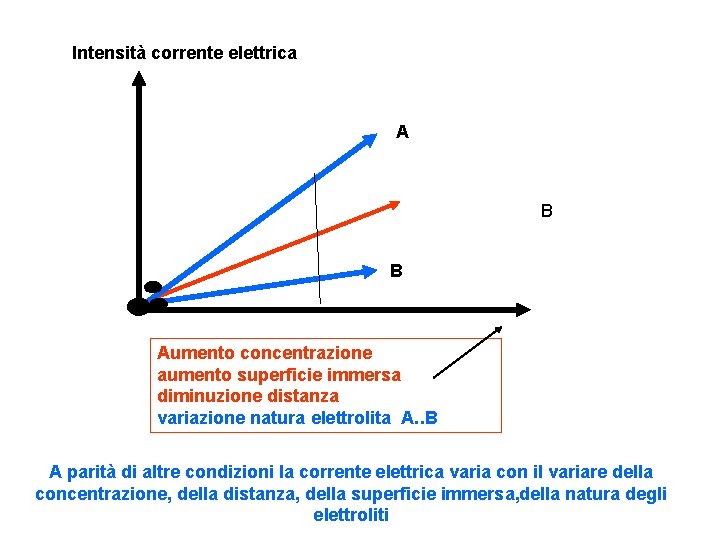
Intensità corrente elettrica A B B Aumento concentrazione aumento superficie immersa diminuzione distanza variazione natura elettrolita A. . B A parità di altre condizioni la corrente elettrica varia con il variare della concentrazione, della distanza, della superficie immersa, della natura degli elettroliti

Ipotesi: se il meccanismo che permette il passaggio della corrente elettrica in tutto il circuito è quello prima descritto, è chiaro che maggiore è il numero degli ioni che interagiscono, maggiore sarà il valore della corrente effetto dello scambio di elettroni tra elettrodi e soluzione; più vicini sono gli elettrodi più frequentemente possono interagire ioni ed elettrodi; più ampia è la parte immersa degli elettrodi maggiore è la possibilità che contemporaneamente possano interagire più ioni; se cambia la natura degli elettroliti può cambiare il valore della corrente per vari motivi: perché da ogni particella derivano 2 o più ioni; perché ogni particella porta una carica semplice o multipla; perché tutte o in parte le particelle si suddividono in ioni. Aumentando la temperatura aumenta anche la corrente elettrica perché aumenta la velocità di spostamento degli ioni in soluzione. 100 CA 100 AC 100 C + 100 A 30 C + 30 A + 70 CA
 Metodo sperimentale esempio
Metodo sperimentale esempio Le muffe quarta elementare
Le muffe quarta elementare Onomatopee pascoli
Onomatopee pascoli Giovanni pascoli in breve
Giovanni pascoli in breve Disegno di ricerca sperimentale
Disegno di ricerca sperimentale Sistema internazionale di misura
Sistema internazionale di misura Metodo induttivo sperimentale
Metodo induttivo sperimentale Metodo scientifico esempio concreto
Metodo scientifico esempio concreto Fasi del metodo scientifico sperimentale
Fasi del metodo scientifico sperimentale Metodo deduttivo e induttivo
Metodo deduttivo e induttivo Scuola moretti punta marina
Scuola moretti punta marina Descrizione pastore tedesco scuola primaria
Descrizione pastore tedesco scuola primaria Scuola elementare govoni ferrara
Scuola elementare govoni ferrara Ic masi atripalda
Ic masi atripalda Scuola primaria cadorago
Scuola primaria cadorago Istituto comprensivo san zeno naviglio
Istituto comprensivo san zeno naviglio Scuola elementare lido adriano
Scuola elementare lido adriano Icgullo
Icgullo































