Pemeriksaan helmint Oleh Nurhalina Rn Cara Koleksi spesimen




















































- Slides: 56

Pemeriksaan helmint Oleh Nurhalina Rn

Cara Koleksi spesimen tinja • Untuk menentukan metode koleksi thdp spesimen yang dicurigai mengandung parasit atau elemen parrasit. • Koleksi yg digunakan suatu laboratorium harus didasarkan atas pengetahuan tentang nilai atau keterbatasan dari masing-masing metode tersebut. • Untuk menentukan hasil pemeriksaan laboratorium yang didasarkan atas penemuan dan identifikasi parasit, salah satu aspek terpenting adalah saat melakukan koleksi spesimen atau fiksasi awal organisme.

Keamanan • Semua spesime harus ditangani dengan hati-hati, karena setiap spesimen adalah sumber infeksius yang potensial (bakteri, virus, jamur da parasit). • Hal 2 yg harus diperhatikan untuk keamanan adalah : ü pemberian label yang benar ; nama pasien, nama dokter, nmr identfikasi, tgl dan waktu pengambilan spesimen. yg menunjukan jenis pemeriksaan laboratorium yg diminta. ü Riwayat perjalanan yg penting ü Spesimen harus disertai dgn formulir permintaan ü Tempat khusus yang dirancang untuk menangani spesimenn (mungkin diperlukan lemari khsus dengan peralatan tertentu). ü Tempat pengumpulan yang baik untuk sentrifus; ü Cara-cara pembuangan limbah yang baik ü Peraturan yang melarang, makan, minum, merokok dll di lab. ü Penggunaan atau penyiapan eter asetat yang tepat ü Dan apabila tersedia tehnik kutur organisme dan atau inokulasi binatang yang benar. ü Semua pedoman umum harus diterapkan dalam pemeriksaan parasitologi diagnostik yg dilaksanakan dlm lab mikrobiologi.

Prosedur pengambilan spesimen • Pada pasien di Rs, prosedur pre analitik utk menemukan parasit usus harus selalu dilakukan sebelum pemeriksaan radiologis dgn barium. • Spesimen tinja yg mengandung barium tdk dapat digunakan untuk pemeriksaan cacing dan protozoa usus (tidak terdeteksi selama 510 hari) setlh barium diberikan kpd pasien. • Obat-abat tertentu yg mempengaruhi deteksi protozoa usus antara lain minyak meneral, bismuth, antibiotik (seperti tetrasiklin yg mempengaruhi flora usus), anti malaria, antasid, anti diare dan preparat anti diare yg tdk dpt diabsorbsi. ( tdk dapat ditemukan selama 1 minggu-samppai bbrp minggu) • Pengambilan spesimen harus ditund setelah pemberian obat 2 an tsbt (5 -10 hari berturut-turut) dan paling sedikit 2 minggu (juner, 1962)

Koleksi spesimen • Spesimen tinja harus dikumpulkan dalam tempat penampungan yang bersih dan bermulut lebr; seringkali dipilih karton berlilin atau plastik dgn tutup yg rapat. (agr spesimen tdk tumpah dan menjg kelembaban spesimen) • Spesimen tdk boleh terkontaminasi dgn air atau urin karena air dapat mengandung organisme bentuk bebas yg menyerupai parasit manusia, sedangkan urin dapat menghancurkan organisme 2 yg bergerak (motil)

Tempat penimpanan spesimen

Jumlah spesimen yg diperiksa • Untuk pemeriksaan parasit dalam tinja, biasanya diajurkan 3 spesimen yg diperiksa. • 2 spesimen dikumpulkan setelah defikasi normal • 1 spesimendikumpulkan setelah pemberian obat pencahar seperti magnesium sulfat atau soda fosfo fleet. • Pencahr yg bahan dasarnya minyak, , tidak dianjurkan. • Apabila pasien dicuruai menderita amebiasis intestinal dianjurkan untuk mengambil 6 spesimen (dapat menjamin ditemukannya 90 % iinfeksi amebik, sawist & Faust, 1942) • Pasien yg menerima pengobatan utk infeksi protozoa hrs diperiksa 3 -4 minggu setelah pengobatan. Sedangkan pd pengobatan untuk infeksi tanea, dianjurkan 5 -6 minggu setelah pengobatan.

Jumlah spesimen

• Jumlah sampel yg dibutuhkan minimal 20 -30 mg/tinja padat atau 2 -3 sendok makan tinja cair. • Bila ditemukan muskus atau darah maka sampel diambil dr tempat tersebut krn parasit biasanya terdapat disitu. • Tdk boleh menggunakan tinja yg ditampung di kloset atau terkontaminasi barium atau produk x-ray

Persiapan Penderita • Terangkan cara penampungan apa yang akan diperiksa • Penderita diminta untuk defekasi pada penampung faces bermulut besar • Jangan kencing di tempat penampungan • Jangan meletakkan kertas toilet pada penampung karena akan berpengaruh terhadap hasil

Waktu Koleksi • 1 dari 3 spesimen yg dinajurkan di atas harus diikirim pd hari yg berbeda, kalau memungkinkan setiap selang satu hari atau satu seri dari 3 spesimen dlm waktu tidak lebih dari 10 hari. • Apabila yg diperlukan 6 spesimen, koleksi pd hari yg berbeda atau tdk lebih dari 14 hari. • Byk organisme terutama protozoa usus jumlahya dalam tinja tidak tetap setiap hari sehingga utk pemeriksaan yg adekuat dibutuhkan minimal 3 spesimen dlm 1 seri pemeriksaan. (lincicome, 1942).

Jenis spesimen, stabilitas spesimen dan kebutuhn utk pengawetan • Untuk menemukan tropozoit motil (amoeba atau flagelata) dianjurkan spesimen segar. • Untuk pemeriksaan spesimen cair, harus dikerjakan dalam 30 menit setelah dikeluarkan, bukan saat spesimen sampai di laboratorium. • Apabila dalam wkt tersebut tdk mungkin dikerjakan maka spesimen harus diberi pengawet. • Spesimen yg lunak harus diperiksa dalam 1 jam setelah dikeluarkan ; harus digunakan pengaset apabl dlm 1 jam tdk mmungkin diperiksa. • Untuk spesimen padat tdk perlu segera dperiksa dapat diperiksa setiap saat dalam 24 jam. Dalam hal ini sebbagian spesimen dapat diawetkan sisanya dapat disimpan di dala, lemari es. • .

• Umumnya tropozoit hanya ditemukan dalam spesimen cair. Kista dan tropozoit dapat ditemukan dalam spesimen yg lunak. • Namun hanya kista yg ditemukan dalam spesimen yg padat • Telur cacing lebih tahan tanpa pengawet daripada protozoa usus. • Sebelum diperiksa spesimen tinja tidak boleh diinkubasi atau dibekukan.

Pengawetan Spesimen • Keterlambatan pemeriksaan di laboratorium, dapat disebbkan karena bebban pekerjaan di lab atau karn jarak/ waktu yg dibutuhkan spesimen untuk mencapai tempat tsbt. • Pengawetan dapt menggunakan formalin, merthiolat (thimerosal), iodine formalin (MIF), sodimu acetate-acetic acid formalin (SAF), larutan schaudinn dan polyvinil alchohol (PVA).


Elemen-elemn dalam pemeriksaan makroskopik • Tropozoit dan kista protozoa usus • Telur dan larva cacing • Sel darah merah_yg menunjukan adanya ulserasi atau masalah perdarahan lainnya • Sel darah putih (polymorfonuklear nutrofil (PMN)) yg menunjukan adanya peradangan. • Makrofag, yang mungkin ada pada infeksi bakteri atau parasit. • Sel darah putih (eosinofil), yg biasanya menunjukan adanya respon imun (yang mungkin berhubungan dgn infeksi parasit) • Kristal Charcot-Leyden, yg dapat ditemukan bila terjadi disintegrasi eosinofil (dapat/ tidak berhubungan dengan infeksi parasit) • Jamur (candida, Sp), • Sel-sel tanaman, butiran tepung sari atau spora jamur yg dapat menyerupai telur cacing atau kist protozoa. • Serat-serta tanaman atau akar rambut atau rambut binatang yg dddapat menyerupai larva cacing

Tinja terdiri dari : Sisa makanan yg tdk dapat dicerna Pigmen dan garam empedu Sekresi intestinal termasuk mukus Lekosit yg migrasi dari jaringan darah Epitel Bakteri Material organik terutama kalsium dan fosfat Makanan yg td dicernah dalam jumlah yg sangat kecil • gas • •


Tehnik Pemeriksaan cacing Parasit

Pemeriksaan Tinja 1. a. b. c. Secara makroskopis Warnah tinja Bau tinja Adanya lendir, darah atau potongan jaringan, sisa makanan yg belum dicernah, bahan sisa pengobatan, dll d. Konsistensi tinja ; padat, lunak, cair

• Sebelum melakukan pemeriksaan terlebih dahulu harus diketahui habitat dari parasit. • Pemeriksaan telur-telur cacing dari tinja terdiri dari dua macam cara pemeriksaan, yaitu secara kualitatif dan kuantitatif. Pemeriksaan kualitatif dilakukan dengan menggunakan metode natif, metode apung, dan metode harada mori. Sedangkan pemeriksaan kuantitatif dilakukan dengan menggunakan metode kato. Berikut adalah prinsip kerja dari berbagai metode pemeriksaan parasit pada feses (Beaver, P. C. , Yung. R. C. , Cupp. E. W. 1984).

Metode Natif • Metode ini dipergunakan untuk pemeriksaan secara cepat dan baik untuk infeksi berat, tetapi untuk infeksi yang ringan sulit ditemukan telur-telurnya. Cara pemeriksaan ini menggunakan larutan Na. Cl fisiologis (0, 9%) atau eosin 2%. Penggunaa eosin 2% dimaksudkan untuk lebih jelas membedakan telur-telur cacing dengan kotoran disekitarnya. • Eosin memberikan latar belakang merah terhadap telur yang berwarna kekuning-kuningan dan untuk lebih jelas memisahkan feces dengan kotoran yang ada. Kekurangan dari metode ini adalah hanya dilakukan untuk infeksi berat, infeksi ringan sulit terditeksi. Kelebihann meotde ini adalah mudah dan cepat dalam pemeriksaan telur cacing semua spesies, biaya yang di perlukan sedikit, peralatan yang di gunakan sedikit (Soejoto dan Soebari, 1996).


Metode Apung (flotation) (Soejoto dan Soebari, 1996). • Metode ini digunakan larutan Na. Cl jenuh atau larutan gula jenuh yang didasarkan atas BD (Berat Jenis) telur sehingga telur akan mengapung dan mudah diamati. Metode ini digunakan untuk pemeriksaan feses yang mengandung sedikit telur. Cara kerjanya didasarkan atas berat jenis larutan yang digunakan, sehingga telur-telur terapung dipermukaan dan juga untuk memisahkan partikel-partikel yang besar yang terdapat dalam tinja. Pemeriksaan ini hanya berhasil untuk telur-telur Nematoda, Schistostoma, Dibothriosephalus, telur yang berpori-pori dari famili Taenidae, telur-telur Achantocephala ataupun telur Ascaris yang infertil. • Kekurangan dari metode ini adalah penggunaan feses banyak dan memerlukan waktu yang lama, perlu ketelitian tinggi agar telur di permukaan larutan tidak turun lagi. Kelebihan dari metode ini adalah dapat di gunakan untuk infeksi ringan dan berat, telur dapat terlihat jelas. Dalam praktikum pemeriksaan feses ini, metode apung yang kami gunakan sebagai acuan yang terdiri dari sentrifugasi dan disentrifugasi.

a) Sentrifugasi • 100 ml Na. Cl jenuh (33%) dimasukan kedalam beker glass. • 10 gram feses sampel pertama diambil menggunakan lidi dan dimasukan kedalam larutan Na. Cl jenuh (33%) kemudian di aduk sehingga larut. • Bila terdapat serat-serat selulosa di saring menggunakan penyaring teh. • Hasil saringan dituangkan ke dalam tabung reaksi sampai pada permukaan tabung reaksi. • Di sentrifugasi selama 10 menit. • Permukaan sampel pada tabung reaksi di ambil dengan menggunakan jarum ose secara swab dan di oleskan pada objek glass, kemudian di tutup dengan menggunakan cover glass. • Di amati di bawah mikroskop.

b. Tanpa sentrifuge • 100 ml Na. Cl jenuh (33%) dimasukan kedalam beker glass. • 10 gram feses sampel kedua diambil menggunakan lidi dan dimasukan kedalam larutan Na. Cl jenuh (33%) kemudian di aduk sehingga larut. • Bila terdapat serat-serat selulosa di saring menggunakan penyaring teh. • Hasil saringan dituangkan ke dalam tabung reaksi sampai cembung pada permukaan tabung reaksi. • Didiamkan selama 5 -10 menit dan ditutup dengan cover glass dan segera angkat. • Di letakkan di atas objek glass preparat dengan cairan berada di antara objek glass dan cover glass, kemudian di periksa di bawah mikroskop. Selanjutnya cara kerja tersebut di ulang pada sampel feses ketiga.

Metode Harada Mori • Metode ini digunakan untuk menentukan dan mengidentifikasi larva cacing Ancylostoma Duodenale, Necator Americanus, Srongyloides Stercolaris dan Trichostronngilus yang didapatkan dari feses yang diperiksa. Teknik ini memungkinkan telur cacing dapat berkembang menjadi larva infektif pada kertas saring basah selama kurang lebih 7 hari, kemudian larva ini akan ditemukan didalam air yang terdapat pada ujung kantong plastik. Kekurangan dari metode ini adalah hanya dilakukan untuk identifikasi infeksi cacing tambang, waktu yang dibutuhkan lama dan memerlukan peralatan yang banyak. Kelebihan dari metode ini adalah lebih mudah dilakukan karena hanya untuk mengidentifikasi larva infektif mengingat bentuk larva jauh lebih besar dibandingkan dengan telur.

Bahan yang diperlukan adalah kantong plastic dengan ujung sempit dan tertutup, berukuran 17 x 3 cm, kertas saring dengan ujung runcing berukuran 15 x 2, 5 cm, air bersih, api lilin, lidi, dan bahan pemeriksaan tinja. Teknik pemeriksaan : • Oleskan sejumla tinja pada bagian tengah kertas saring. • Masukkan kertas saring yang sudah dioles tinja ke dalam kantong plastic dengan ujung runcing lebih dahulu sehingga ujung runcing kertas saring masuk ke bagian sempit kertas saring menjadi basah dan air akan tertampung. • Kemudian disiram air ledeng sihingga cacing tertinggal dalam saringan. • Hasil saringan ditampung dalam suatu bejana kaca yang melebar( petridish besar) dan dilarutkan dengan air. • Pemeriksaan dilakukan dengan kaca pembesar (loupe) dan dilakukan pada dasar meja yang hitam warnanya. • Perhitungan cara mudah dapat dilakukan dengan meberi garis- garis yang sejajar pada dasar bejana. • Untuk mendeterminai cacing dilakukan di bawah mikroskop. •

4. Metode kato • Teknik sediaan tebal (cellaphane covered thick smear tecnique) atau disebut teknik Kato. Metode ini digunakan untuk menemukan adanya telur cacing parasit dan menghitung jumlah telur cacing yang terdapat pada feses. Pengganti kaca tutup seperti teknik digunakan sepotong “cellahane tape”. Teknik ini lebih banyak telur cacing dapat diperiksa sebab digunakan lebih banyak tinja. Teknik ini dianjurkan untuk Pemeriksaan secara massal karena lebih sederhana dan murah. Morfologi telur cacing cukup jelas untuk membuat diagnosa. Pada metode ini diadakan penambahan melachite green untuk memberi latar belakang hijau. Anak-anak mengeluarkan tinja kurang lebih 100 gram/hari, dewasa mengeluarkan tinja kurang lebih 150 gram/hari. Jadi, misalnya dalam 1 gram feces mengandung 100 telur maka 150 gram tinja mengandung 150. 000 telur.

• Kekurangan dari metode ini adalah bahan feses yang digunakan banyak. Kelebihan dari metode ini adalah dapat mengidentifikasi tingkat cacing pada penderita berdasar jumlah telur dan cacing, baik di kerjakan di lapangan, dapat digunakan untuk pemeriksaan tinja masal karena murah dan sederhana, cukup jelas untuk melihat morfologi sehingga dapat didiagnosis. • Perbandingan cacing jantan dan betina biasanya 1: 2 sehingga kita dapat menghitung jumlah cacing dalam usus penderita tersebut. Beratnya penyakit cacing berdasarkan jumlah cacing dalam tubuh seseorang atau jumlah telur pada tiap gram tinja dari hasil pemeriksaan dengan metode Stoll dapat dilihat dari daftar di bawah ini.

• Pemeriksaan telur cacing kuantitatif dengan metode Kato Katz. Alat dan bahan yang diperlukan yaitu gelas benda, selotip dengan tebal 40 mm, ukuran 3 x 3 cm, kawat kasa dengan ukuran lubang tertentu dipotng dengan ukuran 3 x 3 cm, karton yang tebal diberi lubang dengan volume tertentu sehingga tinja yang dicetak dengan karton tersebut dapat diketahui beratnya, lidi dan kertas minyak, larutan Malachitegreen yang terdiri dari : 100 ml gliserin ditambah 100 ml aquadest ditambah 1 ml Malachitegreen 3% (Soejoto dan Soebari, 1996).



Pemeriksaan tinja dengan metode kosentrasi • Pemeriksaan tinja dengan metode sedimentasi ( metode faust dan russel) • Pemeriksaan tinja secara flotasi dgn larutan Na. Cl jenuh (metode willis) • Pemeriksaan tinja dgn tehnik kato • Pemeriksaan tinja dengan modifikasi kato katz • Pemeriksaan tinja dgn tehnik formalin-eter (Ritchie) • Tehnik AMS III (Acid-sodium sulfate-trithone-ether concetration-(armi med sch) • Tehnik hitung telur (Stool) • Sediaan tinja langsung kaca tutup metode beaver

Pemeriksaan tinja khusus • Beberapa macam telur dalam tinja tdk dapat menentukan spesiesnya seperti cacing tambang : 1. Cara biakan harada mori 2. Cara biakan modifikasi harada mori 3. Cara biakan medium arang 4. Cara biakan medium pasir 5. Cara pembiakan telur


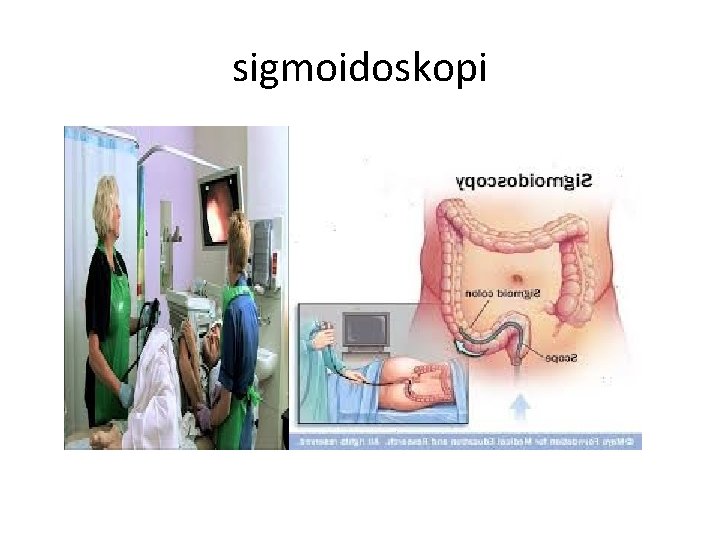
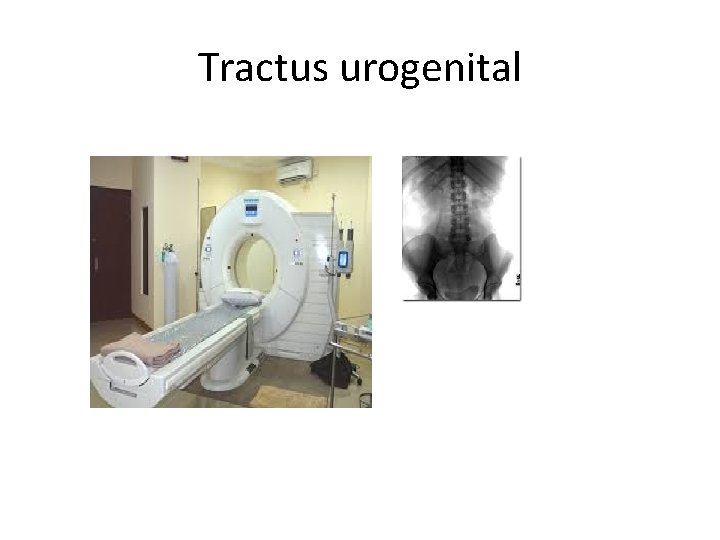
Tehnik pemeriksaan spesimen lainnya 1. Pemeriksaan cacing kremi : ANAL SWAB 2. Pemeriksaan bahan sigmoidoskopi, Ø parasit yg mungkin ditemukan : E. Hystolica &telur caing Ø Cara pengambilan bahan : cara aspirasi/ dikerok Ø Cara pemeriksaan spesimen : cara langsung, sediaan permanen 3. Tractus urogenital Ø Parasit yg mungkin ditemukan : T. vaginalis, mirofilaria, S. haemotobium Ø Pemeriksaan spesimen : sediaan langsung, sediaan permanen. 4. Dahak : Larva dari ascaris lumbricoides, cacing tambang dan telur paragonismus wetermanii. 5. Kulit ; dengan iirisan kulit , contoh Onchocerca volvulus 6. Kelenjar limfe : Toxoplasma, filaria

Anal swap


sigmoidoskopi


Tractus urogenital

Pemeriksaan dahak


Nematoda Usus • Ascaris Lumbricoides : pemeriksaan tinja secara langsung, keluar sendiri (mulut, tinja, hidung), • Cacing tambang : sediaan langsung dan biakan harada mori • Trichuris trichiura : Pemeriksaann tinja secara langsung • Stringloides stercoralis : larva rhabditiform : tinja segar, aspirasi duodenum Larva filaform dan dws : biakan 2 x 24 jam • Oxyuris vermikularis : Anal Swab


Nematoda Jaringan 1. W. Branchofti : q Dgn parasit : mikrofilaria dalam darah, PCR q. Dgn radiologi : USG, linfosintigrafi q. Dgn immunologi : ICT, deteksi antibodi 2. B. malayi dan B. Timori q. Dgn parasit = W. brancofti q. Dgn radiologi : tdk ada q. Dgn immunologi : deteksi Ig. G 4

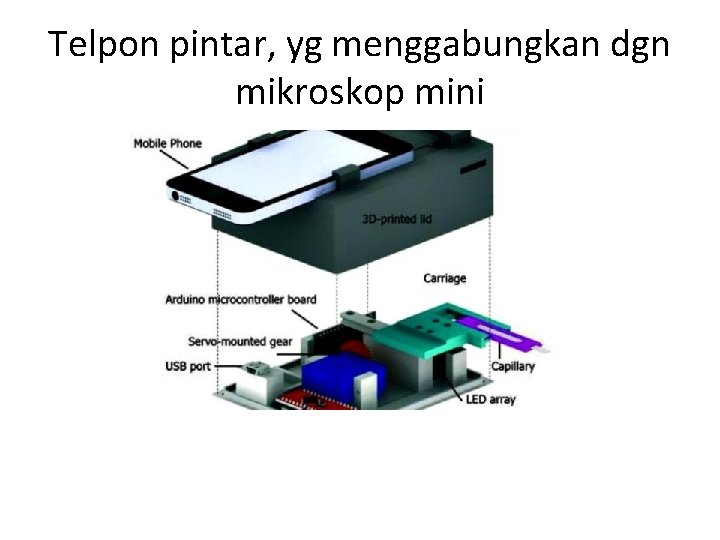
Sediaan darah tipis dan tebal vs telpon pintar

Telpon pintar, yg menggabungkan dgn mikroskop mini

Trematoda 1. F. Hepatica : • Telur dalam tinja, cairan duodenum, empedu • Reaksi serologis : ELISA • Imunodiagostik : deteksi Ag • USG dgn fasioliasis bilier 2. P. Westermani • Telur dalam sputu/ cairan pleura • Reaksi serologis

3. Trematoda usus : telur dalam tinja 4. Trematoda darah : • Telur dalam tinja, urin, jaringan biopsi • Reaksi serologi

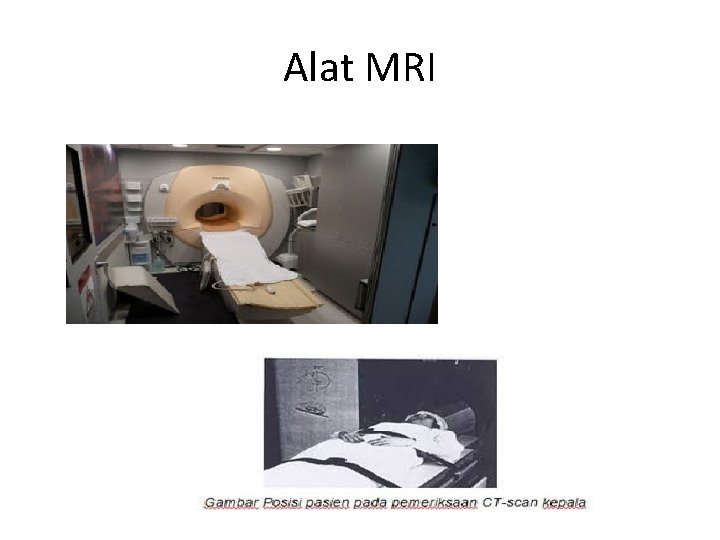
Cestoda • T. saginata = T. Solium 1. Proglotid keluar aktif dengan tinja/ keluar spontan 2. Telur dalam tinja atau swab 3. Dengan sisterkosis : • Hispatologi • CT scan. MRI • Deteksi antibodi : Elisa, Western blot (EIBT), counter immuno electrophoresis (CIE) • Deteksi coproantigen pd tinja • PCR

Pemeriksaan Elisa

PCR ELISA

Alat MRI

 Duktilitas
Duktilitas Sifat material
Sifat material Catatan spesimen adalah
Catatan spesimen adalah Tujuan pemeriksaan subsequent events
Tujuan pemeriksaan subsequent events Jenis koleksi referensi
Jenis koleksi referensi Manajemen kontrol lingkungan tempat penyimpanan koleksi
Manajemen kontrol lingkungan tempat penyimpanan koleksi Jenis koleksi yang dilayankan pada layanan referensi
Jenis koleksi yang dilayankan pada layanan referensi Arkitek kota puisi moden
Arkitek kota puisi moden Bersatu hati
Bersatu hati Koleksi data yang dinamakan pada medium storan
Koleksi data yang dinamakan pada medium storan Peribahasa tentang beringat-ingat
Peribahasa tentang beringat-ingat Tipe data koleksi
Tipe data koleksi Lagu melayu tradisional
Lagu melayu tradisional O
O Ujian sap
Ujian sap Cara setting ulang koneksi jaringan
Cara setting ulang koneksi jaringan Untuk memeriksa hasil pemasangan konektor rj45
Untuk memeriksa hasil pemasangan konektor rj45 Contoh pendekatan melalui paguyuban
Contoh pendekatan melalui paguyuban Jenis pengguna jalan raya
Jenis pengguna jalan raya Apa tegese pengalaman lucu
Apa tegese pengalaman lucu Cara cara bermain bola tampar
Cara cara bermain bola tampar Cara pembuatan magnet dengan cara digosok yang benar adalah
Cara pembuatan magnet dengan cara digosok yang benar adalah Merujuk
Merujuk Peralatan di stor sukan
Peralatan di stor sukan Halcon cara cara
Halcon cara cara Kesan alkohol terhadap organ manusia
Kesan alkohol terhadap organ manusia Perspektif desain dalam komunikasi
Perspektif desain dalam komunikasi Pemeriksaan penunjang meniere disease
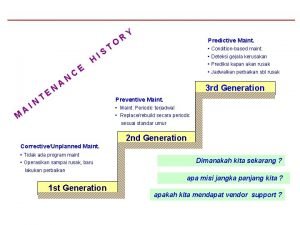
Pemeriksaan penunjang meniere disease Pemeriksaan jembatan
Pemeriksaan jembatan Kresendi
Kresendi Metode pemberian indeks kertas kerja
Metode pemberian indeks kertas kerja Kartu e untuk tes daya lihat
Kartu e untuk tes daya lihat Pemeriksaan purna bakti
Pemeriksaan purna bakti Histologi leukosit
Histologi leukosit Program pemeriksaan undercarriage
Program pemeriksaan undercarriage Uji presipitasi adalah
Uji presipitasi adalah Yang termasuk jenis perkiraan laba rugi adalah
Yang termasuk jenis perkiraan laba rugi adalah Pemeriksaan akuntansi 2
Pemeriksaan akuntansi 2 Dr syarif indra sps
Dr syarif indra sps Skor gcs
Skor gcs Tachipneu
Tachipneu Pemeriksaan kepala dan leher
Pemeriksaan kepala dan leher Pemeriksaan fisik head to toe
Pemeriksaan fisik head to toe Sst rem tromol
Sst rem tromol Pengkajian sistem imun
Pengkajian sistem imun Pemeriksaan bilirubin urine metode harrison
Pemeriksaan bilirubin urine metode harrison Bradipneu
Bradipneu Skor gcs
Skor gcs Cara mengetahui selaput dara sudah robek atau belum
Cara mengetahui selaput dara sudah robek atau belum Contoh laporan pemeriksaan kelaikan fungsi bangunan gedung
Contoh laporan pemeriksaan kelaikan fungsi bangunan gedung Iktus kordis
Iktus kordis Pengertian kertas kerja pemeriksaan
Pengertian kertas kerja pemeriksaan Maksud dana apungan tunai runcit
Maksud dana apungan tunai runcit Apakah maksud fomema
Apakah maksud fomema Pemeriksaan liabilitas jangka pendek
Pemeriksaan liabilitas jangka pendek Apa saja upaya yang bisa dilakukan dalam setting ulang wan
Apa saja upaya yang bisa dilakukan dalam setting ulang wan Etika dalam pemeriksaan psikologis
Etika dalam pemeriksaan psikologis