PELARUT AIR DAN NON AIR UNTUK SENYAWA ANORGANIK


















































- Slides: 61

PELARUT AIR DAN NON AIR UNTUK SENYAWA ANORGANIK

SEMOGA KELAS INI DIBERKATI

PELARUT (SOLVENT) Pelarut dikelompokkan berdasarkan 5 parameter: ○ konstanta dielektrik ○ kemampuan terhadap autoionisasi (self ionization) ○ sifat keasaman dan kebasaan ○ kompleksasi ○ kemampuan oksidasi-reduksi Sifat-sifat yang menentukan kegunaan pelarut: ○ Daerah suhu pelarut dalam keadaan cair ○ tetapan dielektriknya ○ sifat sebagai donor dan aseptor ○ keasaman protonik atau kebasaan ○ sifat dan derajat otodisosiasi

Daftar ketakcampuran beberapa pelarut

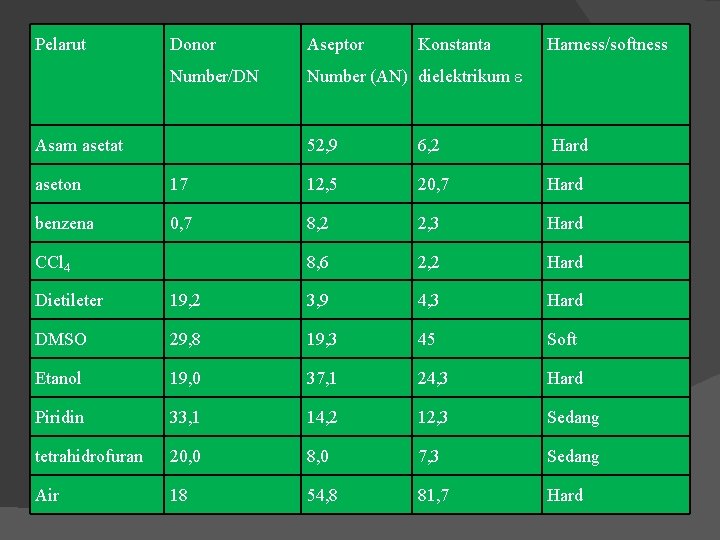
Pelarut Donor Aseptor Number/DN Number (AN) dielektrikum Asam asetat Konstanta Harness/softness 52, 9 6, 2 Hard aseton 17 12, 5 20, 7 Hard benzena 0, 7 8, 2 2, 3 Hard 8, 6 2, 2 Hard CCl 4 Dietileter 19, 2 3, 9 4, 3 Hard DMSO 29, 8 19, 3 45 Soft Etanol 19, 0 37, 1 24, 3 Hard Piridin 33, 1 14, 2 12, 3 Sedang tetrahidrofuran 20, 0 8, 0 7, 3 Sedang Air 18 54, 8 81, 7 Hard

Pelarut Air, pelarut Universal Non-air ○ Anorganik: asam-basa ○ Organik Non-pelarut: leburan

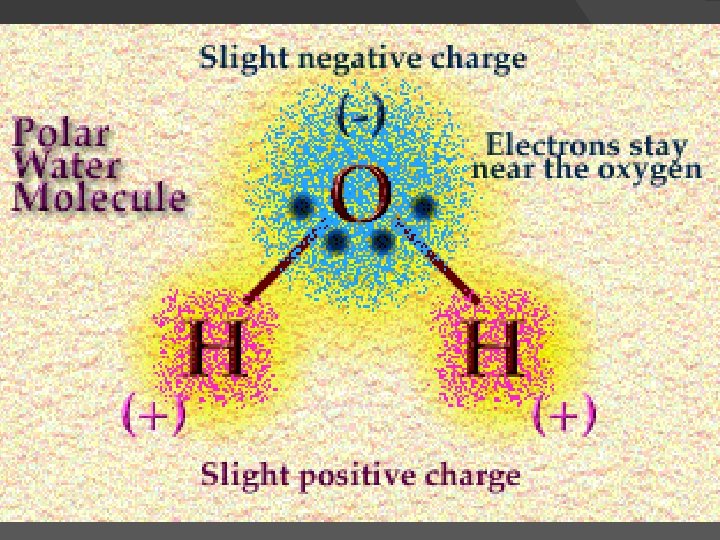
Pelarut air Tetapan dielektrik ~81, 7 cocok untuk pelarut senyawa ion Universal, melimpah titik beku 0 o. C dan titik didih 100 o. C, cocok untuk daerah kerja mahluk hidup ~ 2540 o. C Penanganannya mudah Air dapat mengalami auto ionisasi 2 H 2 O H 3 O+ dan OH-





Dalam air Zat terionisasi menjadi elektrolit gas (kovalen polar) HCl H 3 O+ + Clpadatan basa Na. OH Na+ + OHgaram Na. Cl Na+ + Clkompleks K 4[Fe(CN)6] K+ + [Fe(CN)6]4 - Zat tidak terionisasi Glukosa C 6 H 12 O 6 larutan C 6 H 12 O 6 Brom Br 2 air Br 2

Reaksi dengan air Logam alkali/alkali tanah Na +H 2 O Na+ +H 2 +OH Hidrolisis Cu. SO 4 Cu 2+ +SO 422 H 2 O 2 OH- + 2 H+ Cu. SO 4 + 2 H 2 O Cu(OH)2(s) + SO 42 - + 2 H+ Hidrolisis tidak hanya pada garam, juga pada asam-basa lemah Hidrasi MX(s) M(aq) n+ + X(aq)y. Fe. Cl 2 + 6 H 2 O Fe(H 2 O)6 2+ + 2 Cl

Reaksi pertukaran ion Dalam air ion-ion dapat bertukar pasangan Na. OH(aq) + HCl(aq) H 2 O + Na+ + Cl. Ba. Cl 2(aq) + Cu. SO 4(aq) Ba. SO 4(s) + 2 Cl- + Cu 2+ Ba. Cl 2(aq) + 2 Ag. NO 3(aq) 2 Ag. Cl(s) + 2 NO 3 - + Ba 2+ Ag. NO 3(aq) + Cu. SO 4(aq) ? Ag. NO 3(aq) + HCl(aq) ? Ag. NO 3(aq) + Na. OH(aq) ? HCl(aq) + Cu. SO 4(aq) ? Na. OH(aq) + Cu. SO 4(aq) ? Ba. Cl 2(aq) + Na. OH(aq) ? Tuliskan persamaan reaksi secara lengkap dan benar

Kriteria Larut LARUT: suatu zat disebut larut bila dalam air menghasilkan konsentrasi minimal 0. 1 M pada temperatur ruang. TIDAK LARUT : Suatu zat disebut tidak larut bila konsentrasi dalam pelarut air pada temperatur ruang kurang dari 0. 001 M. AGAK LARUT: diantara kedua keadaan tersebut.

Perubahan Energi dalam Proses Pelarutan Agar suatu zat dapat larut ada 3 tahapan: 1. Partikel solut harus terpisah satu sama lain 2. Beberapa partikel solven harus terpisah untuk memberi ruang bagi partikel solut 3. Partikel solut dan solven harus bercampur menjadi satu Energi akan diserap saat terjadi pemisahan partikel sebaliknya energi akan dilepas ketika partikel bergabung dan tertarik satu sama lain Kesimpulannya pelarutan akan disertai perubahan entalpi

Proses pelarutan dan energi pelarutan Proses pelarutan adalah proses ketika kation dalam fasa gas atau anion dalam fasa gas bereaksi dengan pelarut dalam fasa cair, diperoleh kation terlarut atau anion terlarut. Energi yang dibebaskan disebut energi pelarutan. M+ (g) + solvent pelarutan X- (g) + solvent M+(sol) + E X-(sol) + E

Proses hidrasi dan energi hidrasi Proses hidrasi adalah proses ketika kation dalam fasa gas atau anion dalam fasa gas bereaksi dengan air sehingga dihasilkan kation terhidrasi atau anion terhidrasi dengan melepaskan energi. Energi yang dilepaskan disebut energi hidrasi. M+ (g) + H 2 O (l) atau aq hidrasi X- (g) + H 2 O (l) atau aq M+(aq) + E X-(aq) + E

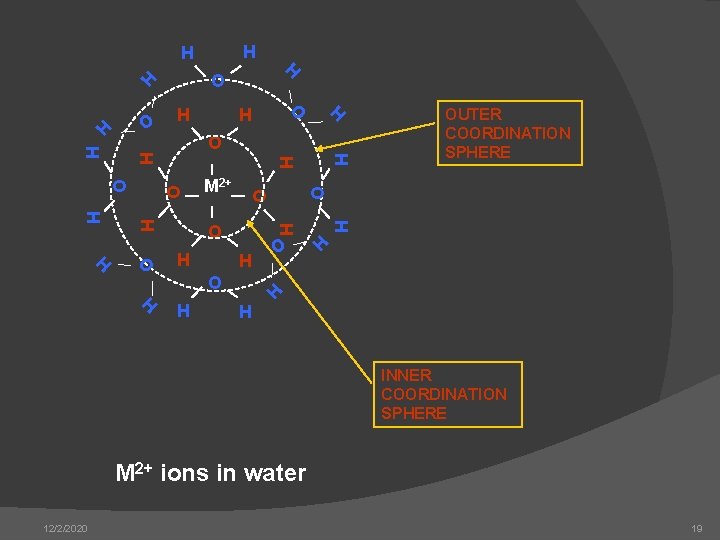
H H H O O HO H H H M 2+ OUTER COORDINATION SPHERE O O H H H O H H H O O O H H H INNER COORDINATION SPHERE M 2+ ions in water 12/2/2020 19

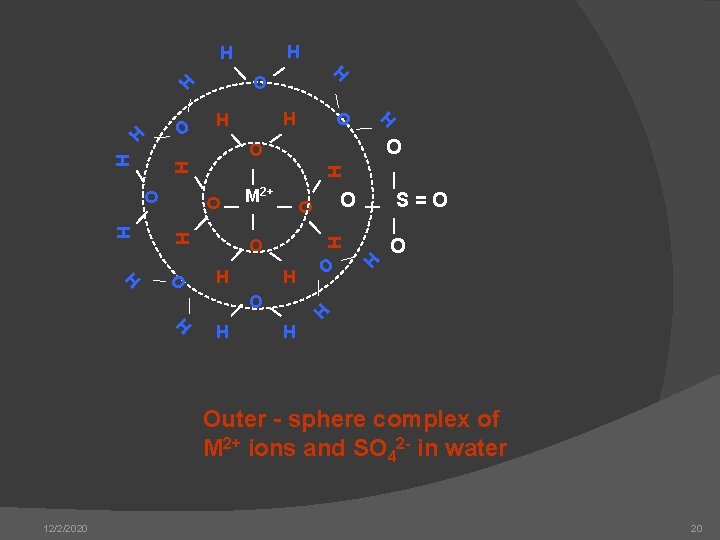
H H O M 2+ O S=O H H O H O H H H H O H O H H H Outer - sphere complex of M 2+ ions and SO 42 - in water 12/2/2020 20

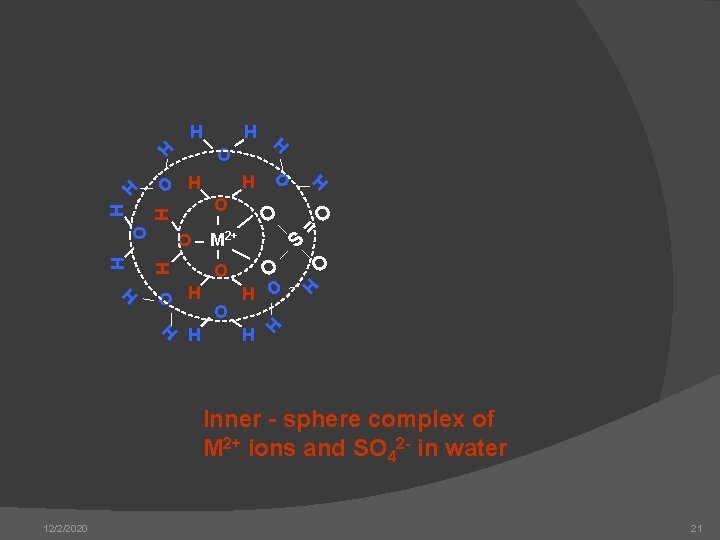
H H O O S = O H O O H H H O M 2+ O O H H O HH H O H H H Inner - sphere complex of M 2+ ions and SO 42 - in water 12/2/2020 21

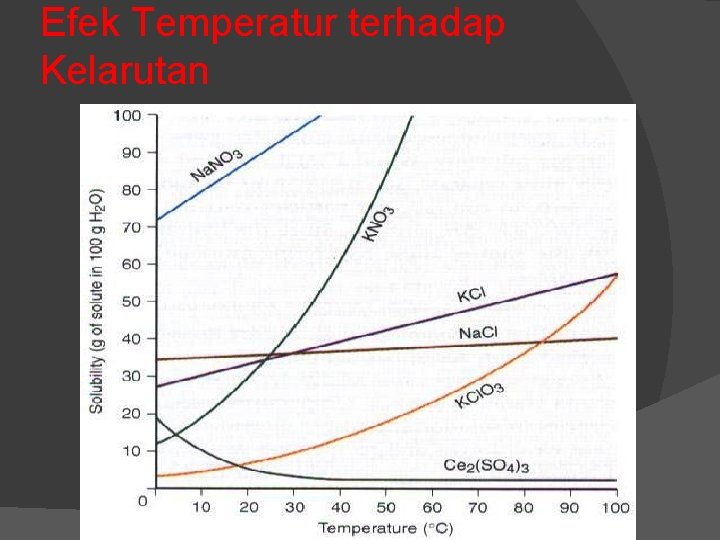
Efek Temperatur terhadap Kelarutan

Kelarutan garam anorganik Garam-garam Natrium, kalium dan amonium merupakan garam-garam yang mudah larut dalam air. Garam-garam nitrat juga mudah larut dalam pelarut air. Garam-garam klorida, bromida dan iodida umumnya mudah larut dalam air kecuali garam timbal(II), raksa(I), perak(I) dan tembaga(I). Garam-garam sulfat mudah larut dalam air kecuali garam barium(II), stronsium(II) dan timbal(II).

senyawa anorganik dalam air Oksida umumnya tidak larut kecuali oksida dari natrium, kalium, stronsium dan barium. Kalsium oksida agak larut. Hidroksida umumnya tidak larut kecuali hidroksida dari natrium, kalium, stronsium dan barium. Kalsium hidroksida agak larut. Sulfida umumnya tidak larut kecuali sulfida dari natrium, kalium, amonium, magnesium, kalsium, stronsium dan barium. Garam-garam kromat, fosfat dan karbonat umumnya tidak larut, kecuali garam natrium, kalium dan amonium

Pelarut Non Air Misalnya NH 3(l), HF(l), HCN(l), SO 2(l) Mampu melarutkan bahan-bahan anorganik Mempunyai sifat waterlike Dapat mengalami auto ionisasi

Amonia, pelarut bersifat basa Mudah di dapat dan mudah penanganannya Mempunyai ikatan H yang lebih lemah daripada H 2 O sehingga t. d dan t. l lebih rendah daripada H 2 O Titik beku -77 o. C dan titik didih -33 o. C, daerah kerjanya rendah dibawah RT dan sempit Mampu membentuk senyawa kompleks yang larut: Ag. Cl+ NH 3 [Ag(NH 3) 2]+ Autoionisasi 2 NH 3 (l) NH 4+(am) + NH 2 -(am) ion amonium ion amida p. Kam = 33,



Tetapan dielektrik = 22. 7 pada -50 o. C, mampu menurunkan kelarutan senyawa ion Untuk molekul yang mengandung banyak elektron, seperti senyawa iod dan senyawa non polar seperti hidrokarbon, NH 3 merupakan pelarut yang lebih baik dibanding H 2 O Perbedaan dengan air, kemampuan NH 3 dalam melarutkan logam-logam alkali tanpa aksi kimia yang jelas. Larutan yang dihasilkan berwarna biru tua dan logam-logam terlarut dapat diperoleh kembali dg penguapan pelarut

Logam alkali tanah larut dalam NH 3 secara kimia, karena pada penguapan pelarut, logam yang di dapat dalam bentuk heksaamin, M(NH 3)6 Senyawa nitrit, nitrat, tiosianat dan kebanyakan sianida larut dalam NH 3 Mayoritas senyawa F oksida, hidroksida sulfat, fosfat, karbonat, sulfit, sebagian besar sulfida tdk larut dalam NH 3 Halida, selain F kelarutan menurun dari I ke Cl Sebagian besar senyawa I larut, Br kurang larut dan untuk Cl, hanya NH 4 Cl, Be. Cl 2, dan Na. Cl yang dapat larut. Sifat alamiah anion lebih mempengaruhi kelarutan

Keuntungan : - kurangnya kecenderungan NH 3 untuk terlibat dalam reaksi dengan solut (solvolisis) Kelemahan : - peralatan yang digunakan lebih rumit dan butuh teknik khusus sifat fisik NH 3 Ct : t. d NH 3 murni : -33, 35 o. C shg harus bekerja pada T rendah untuk menghindari tekanan yang tinggi - NH 3 sangat higroskopis shg harus ditangani dengan seksama agar kelembaban udara tidak masuk dalam sistem NH 3

Larutan logam-NH 3(l) Tingkat autoionisasi relatif rendah sehingga NH 3(l) murni tidak dapat terionisasi dengan sendirinya secara sempurna NH 3 + NH 3 NH 4+ + NH 2 Oleh karena itu, larutan logam-logam alkali dalam NH 3(l) stabil pada T kamar dalam waktu lama. 2 NH 3 + 2 Na. NH 2 + H 2 Dengan adanya sedikit katalis Fe. O, reaksi berlangsung sgt cepat

• Logam alkali/alkali tanah larut dalam amonia membentuk larutan berwarna biru, dapat menghantarkan arus listrik (konduktivitas tergantung pada kation logam). • bila ditambahkan logam alkali berlebih berwarna bronze, bila amonia diuapkan terbentuk logam alkali kembali M + NH 3 M+ + [e(NH 3)x]2[e(NH 3)x]H 2 + 2 NH 2 Reaksi tsb lebih lambat dibanding reaksi logam alkali dalam air.

Reaksi asam-basa Asam lemah dalam air, dengan amonia menjadi asam kuat CH 3 COOH + NH 3 CH 3 COO- + NH 4+ Molekul netral dalam air menjadi asam lemah dalam amonia NH 2 -CO-NH 2 + NH 3 NH 4+ + NH 2 -CO-NH- Garam NH 4+ akan bertindak sebagai asam, sedangkan amida, imida maupun nitrida akan bertindak sebagai basa dalam NH 3(l)

Reaksi netralisasi Menurut Bronsted, netralisasi adalah proses dimana asam bereaksi dengan basa menghasilkan asam dan basa yang lain atau reaksi antara asam dan basa menghasilkan garam dan pelarut. Asam 1 + basa 2 asam 2 + basa 1 asam + basa garam + pelarut NH 4+ + NH 22 NH 3 NH 4 I + KNH 2 2 NH 3 + KI NH 4 I, NH 4 NO 3, NH 4 NCS sangat larut dalam amonia, larutan yang pekat dapat bereaksi dengan logam menghasilkan H.

Reaksi Pengendapan Apabila 2 ion yang kurang larut bertemu dan berinteraksi akan membentuk endapan Dalam air KCl(aq) + Ag. NO 3(aq) Ag. Cl (s) + NO 3 - + K+ Dalam amonia Ag. Cl (am) + KNO 3(am) KCl(s) + NO 3 - + Ag+ Amonia lebih basa dari air dan tetapan dielektrik lebih rendah

Senyawa yang tidak larut dalam NH 3(l) berbeda dangan senyawa yang tidak larut dalam H 2 O(l) Sebagian besar senyawa klorida tidak larut dalam NH 3(l) kecuali Na. Cl, NH 4 Cl, dan Be. Cl 2 Kebanyakan nitrat larut dalam NH 3(l) sehingga dapat digunakan untuk metode pengendapan. Beberapa halida yang tidak larut akan mengendap sebagai amina kompleks

Garam KNH 2 Lebih larut dari pada Na. NH 2 Kalium amida dalam air tidak menghasilkan ion amida, reaksinya sbb: KNH 2(s) + H 2 O(l) NH 3(aq) + K+(aq) +OH-(aq)

Reaksi pembentukan kompleks Dalam larutan air, penambahan ion CN- pada ion Ag+ menghasilkan endapan taklarut Ag. CN, tapi jika endapan tersebut ditambahkan ion CNberlebih akan terbentuk kompleks Ag(CN)2 yang larut Reaksi yang sama juga terjadi pada NH 3(l) Dalam air Zn 2+ + 2 OH- Zn(OH )2 Zn(OH ) 42 hidroksida berlebih Dalam amonia Zn 2+ + 2 NH 2 - Zn(NH 2 )2 Zn(NH 2 ) 42 amida berlebih

Reaksi Redoks Sama dengan dalam H 2 O(l) Ketika gas O 2 memasuki larutan logam Na dalam NH 3(l) terlebih dahulu dihasilkan hidroksida dan amida, baru diikuti oksidasi amida menjadi nitrit 2 Na + 1/2 O 2 Na. OH + Na. NH 2 + NH 3 4 Na. NH 2 + 3 O 2 2 Na. OH + 2 Na. NO 2 + 2 NH 3 Larutan logam-logam alkali dan alkali tanah dalam NH 3(l) bertindak sebagai donor elektron (reduktor)

Oksidasi oleh KMn. O 4 dalam NH 3(l) lebih lemah daripada dalam H 2 O(l). KMn. O 4 tereduksi dengan cepat menjadi K 2 Mn. O 4 dan Mn. O 2 oleh kalium. Reduksi diikuti oleh reaksi lambat K 2 Mn. O 4 yang tereduksi lanjut menjadi Mn. O KMn. O 4 juga tereduksi menjadi K 2 Mn. O 4 oleh KNH 2 Dalam NH 3(l) larutan logam merupakan reduktor kuat karena adanya elektron bebas dalam larutan yang dengan mudah didonorkan pada akseptor elektron, sedangkan kekuatan oksidatornya lemah

Reaksi lain dalam Pelarut Amonia • Spesi kimia basa yang lebih kuat dari ion amida menjadi basa kuat dalam amonia H- + NH 3 NH 2 - + H 2 O 2 - + NH 3 NH 2 - + OH- • Amonia dapat menyebabkan disproporsionasi belerang 5 S 8 + 16 NH 3 4 S 4 N- + 4 S 62 - + 12 NH 4+ S 62 - 2 S 3 - ion ini berwarna biru, dalam aluminosilikat membentuk ultramarine blue (pigmen biru)

Asam sulfat, Pelarut bersifat asam tetapan dielektrik ~110, jadi sangat baik sebagai pelarut senyawa ion, tetapi viskositasnya ~ 25 x lebih besar dari viskositas air pelarutan dalam asam sulfat menjadi sangat lambat. auto ionisasi menghasilkan sulfat terprotonasi H 3 SO 4+ dan bisulfat HSO 4 Bersifat sebagai oksidator dan dehydrator


Reaksi dengan Asam sulfat Asam lemah dalam air menjadi basa dalam asam sulfat CH 3 COOH + H 2 SO 4 HSO 4 - + CH 3 C(OH) 2+ asam kuat dalam air dapat bersifat sebagai asam lemah dalam asam sulfat. HCl. O 4 + H 2 SO 4 H 3 SO 4+ + Cl. O 4 Non-elektrolit dalam air dapat bersifat basa dalam asam sulfat NH 2 -CO-NH 2 + H 2 SO 4 HSO 4 - + NH 2 -CO-NH 3+

Asam super = kombinasi asam fluorosulfat dengan antimon pentafluorida, Sb. F 5+2 HSO 3 F FSO 3 Sb. F 5 - + H 2 SO 3 F asam super dapat melarutkan lilin (alkana berantai lurus) Contoh asam super lainnya: Sb. F 5+2 HF H 2 F+ + Sb. F 6 -

Tutorial-2 Tuliskan reaksi pelarutan 1. perak bromida dalam amonia 2. Kalium nitrat dalam amonia 3. Logam kalium dalam amonia 4. Logam perak dalam amonia Tuliskan reaksi 1+2 2+3 1+3 2+4 1+4 3+4

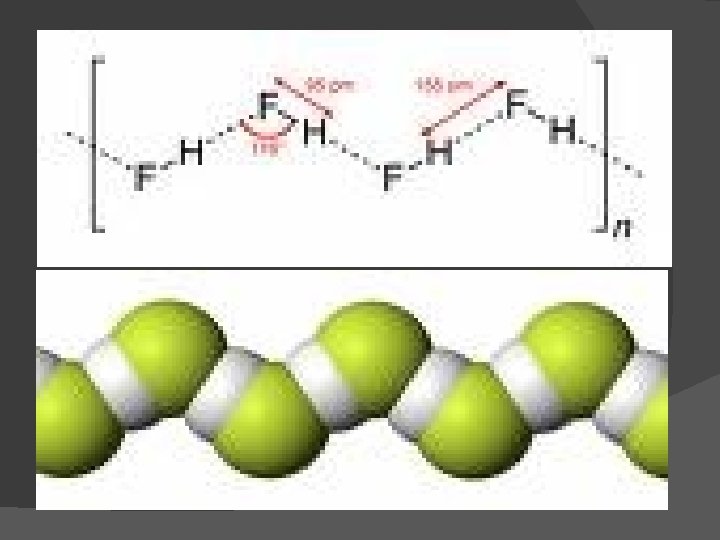
Hidrogen Fluorida HF sebagai pelarut : • t. l = -83 o. C • T. d = 19, 4 o. C • Tetapan dielektriknya tinggi sifat pelarut yang baik • Melarutkan beberapa garam tanpa diubah seperti pada H 2 O • Aktivitas kimia ekstrim sedikit sekali anion larut tanpa perubahan


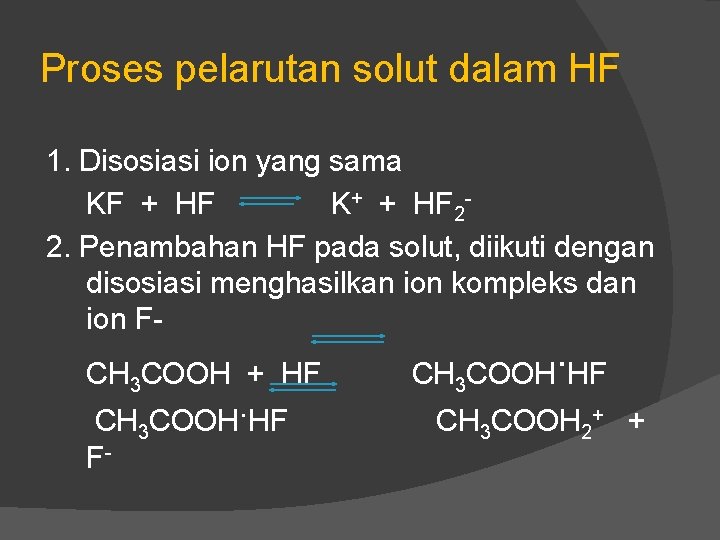
Proses pelarutan solut dalam HF 1. Disosiasi ion yang sama KF + HF K+ + HF 22. Penambahan HF pada solut, diikuti dengan disosiasi menghasilkan ion kompleks dan ion FCH 3 COOH + HF CH 3 COOH. HF F- . CH COOH HF 3 CH 3 COOH 2+ +

3. Reaksi kimia solut dengan F KCN + HF penggantian anion HCN + KF 4. Reaksi kimia yang lebih rumit H 2 SO 4 + 2 HF HOSO 2 F + H 3 O+ + F-

Oksida dan hidroksida biasanya bereaksi keras dengan HF membentuk F- dan H 2 O bereaksi dengan pelarut berlebih menghasilkan hidronium dan ion bifluorida. OH- + HF F - + H 2 O + 2 HF H 3 O+ + HF 2 Mayoritas senyawa Cl, Br, dan I tidak larut dan bereaksi dengan pelarut menghasilkan hidrogen halida. KCl + HF HCl + KF

K dan Na sulfat larut dengan mudah tapi sebelumnya diubah menjadi asam sulfat dan kemudian menjadi asam fluosulfonat H 2 SO 4 + 2 HF HOSO 2 F + H 3 O+ + F - Sebagian besar sulfat yang lain tidak dapat larut Asam nitrat dan beberapa garam nitrat larut dalam HF Na. NO 3 + 4 HF Na+ + H 2 NO 3+ + 2 HF 2 Hanya fluorida, fluoborat dan perklorat yang

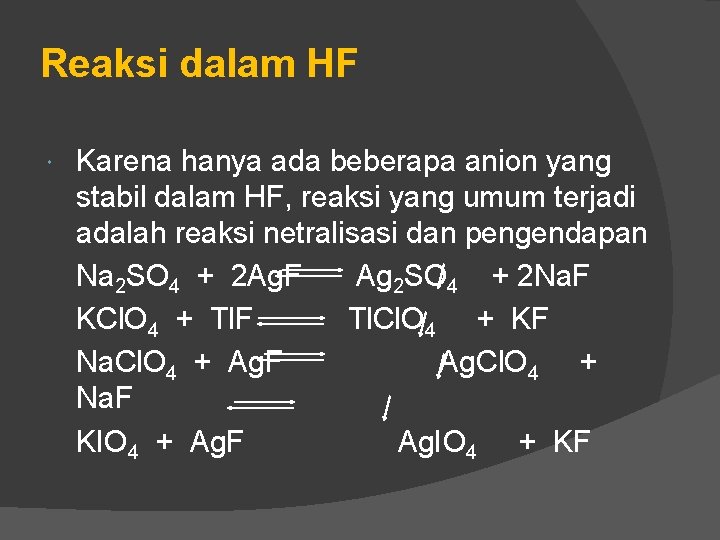
Reaksi dalam HF Karena hanya ada beberapa anion yang stabil dalam HF, reaksi yang umum terjadi adalah reaksi netralisasi dan pengendapan Na 2 SO 4 + 2 Ag. F Ag 2 SO 4 + 2 Na. F KCl. O 4 + Tl. F Tl. Cl. O 4 + KF Na. Cl. O 4 + Ag. F Ag. Cl. O 4 + Na. F KIO 4 + Ag. F Ag. IO 4 + KF

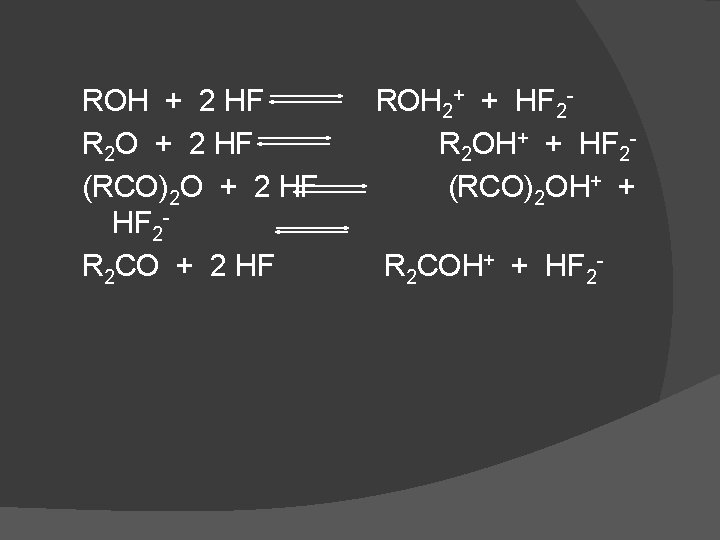
Beberapa senyawa organik larut dalam HF dan menghasilkan larutan dengan konduktivitas tinggi Reaksi solvasi dimana molekul organik menerima proton dan membentuk ion kompleks positif Reaksi tipe tersebut terjadi pada alkohol, fenol, eter, aldehid, asam-asam anhidrida.

ROH + 2 HF R 2 O + 2 HF (RCO)2 O + 2 HF HF 2 R 2 CO + 2 HF ROH 2+ + HF 2 R 2 OH+ + HF 2(RCO)2 OH+ + R 2 COH+ + HF 2 -

Belerang Dioksida (SO 2) SO 2 (l) sebagai pelarut : - Waterlike - T. d = -10 o. C Range fasa cair luas pelarut - T. b = -75 o. C - Terionisasi lemah : SO 2 + SO 2+ + SO 32 - Meskipun µ = 1, 61 D, tapi range cair dan BM menyebabkan SO 2 (l) tidak berasosiasi sebanyak NH 3 dan HF karena SO 2 (l) tidak mempunyai atom H yang dapat digunakan untuk ikatan H - ε = 17, 27 meskipun < air tapi tetap dapat

Larutan garam dalam SO 2 (l) mempunyai konduktivitas listrik tinggi, membuktikan bahwa pelarut merupakan media pengion Kelarutan senyawa-senyawa anorganik dalam SO 2 (l) sangat bervariasi dan dalam rentang nilai yang tinggi Kecuali I, sebagian besar kelarutannya kecil (0, 2 -2, 0 g/100 ml) Alkali dan alkal tanah-iodida mudah larut tapi kelarutannya menurun dari Br ke F Oleh karena urutan kelarutan alkali halida dalam SO 2 >< NH 3, dapat digunakan 2 pelarut tersebut untuk memisahkan Cs dan Pb dari

SO 2 (l) juga pelarut yang sempurna untuk senyawa organik dan dapat digunakan sebagai media reaksi-reaksi organik seperti Fiedel Crafts, sulfonasi dan brominasi. Merupakan pelarut yang lebih baik untuk senyawa-senyawa kovalen daripada elektrovalen Industri menggunakan sifat-sifat pelarut SO 2 (l) untuk pemurnian produk petroleum

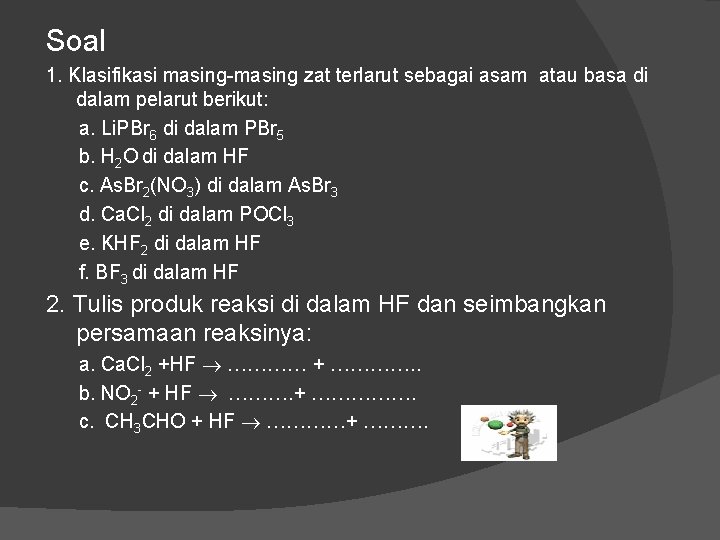
Soal 1. Klasifikasi masing-masing zat terlarut sebagai asam atau basa di dalam pelarut berikut: a. Li. PBr 6 di dalam PBr 5 b. H 2 O di dalam HF c. As. Br 2(NO 3) di dalam As. Br 3 d. Ca. Cl 2 di dalam POCl 3 e. KHF 2 di dalam HF f. BF 3 di dalam HF 2. Tulis produk reaksi di dalam HF dan seimbangkan persamaan reaksinya: a. Cl 2 +HF ………… + …………. . b. NO 2 - + HF ………. + ……………. c. CH 3 CHO + HF …………+ ……….

Thanks
 Types of reaction in non aqueous solvents
Types of reaction in non aqueous solvents Pelarut anorganik
Pelarut anorganik Isomer 2 metilsiklopentanol
Isomer 2 metilsiklopentanol 4 isopropil heptana
4 isopropil heptana Senyawa karbon anorganik
Senyawa karbon anorganik Enzim senyawa organik atau anorganik
Enzim senyawa organik atau anorganik Tentukan jumlah atom cp cs ct ck
Tentukan jumlah atom cp cs ct ck Hubungan air tanah dan tanaman
Hubungan air tanah dan tanaman Contoh senyawa non stoikiometrik
Contoh senyawa non stoikiometrik Senyawa non humik
Senyawa non humik Perbedaan antara larutan elektrolit dan non elektrolit
Perbedaan antara larutan elektrolit dan non elektrolit Meta-bromoisopropilbenzena
Meta-bromoisopropilbenzena Je sers un sauveur tendre
Je sers un sauveur tendre Pelarut klorofil
Pelarut klorofil Ekstraksi craig
Ekstraksi craig Pelarut organik
Pelarut organik Pelarut bcg berapa cc
Pelarut bcg berapa cc Reagen carr price
Reagen carr price Kumpulkan botol minum dari setiap anggota kelompok
Kumpulkan botol minum dari setiap anggota kelompok Tuzlarning olinishi
Tuzlarning olinishi Jenis reaksi
Jenis reaksi Normal koşullar
Normal koşullar Atom
Atom Sifat sifat unsur dan senyawa periode 3
Sifat sifat unsur dan senyawa periode 3 Bilangan koordinasi
Bilangan koordinasi Lambang unsur silicium
Lambang unsur silicium 40 gram suatu oksida besi (senyawa besi dan oksigen)
40 gram suatu oksida besi (senyawa besi dan oksigen) 40 gram suatu oksida besi (senyawa besi dan oksigen)
40 gram suatu oksida besi (senyawa besi dan oksigen) Struktur resonansi no3-
Struktur resonansi no3- Senyawa alkana
Senyawa alkana Pengertian unsur senyawa dan campuran
Pengertian unsur senyawa dan campuran Campuran homogen adalah
Campuran homogen adalah Molekul senyawa adalah
Molekul senyawa adalah Contoh barang non rivalry
Contoh barang non rivalry Denah sanitasi air kotor
Denah sanitasi air kotor Senyawa optis aktif
Senyawa optis aktif Atom senyawa
Atom senyawa Senyawa amfibolik adalah
Senyawa amfibolik adalah Senyawa amfibolik
Senyawa amfibolik Senyawa halogen adalah
Senyawa halogen adalah Sifat fisika dan kimia gas mulia
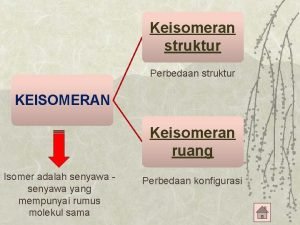
Sifat fisika dan kimia gas mulia Jelaskan terjadinya keisomeran struktur
Jelaskan terjadinya keisomeran struktur Isomer optik
Isomer optik Pengertian hidrokarbon alifatik
Pengertian hidrokarbon alifatik Analisis kualitatif senyawa obat
Analisis kualitatif senyawa obat Rumus umum alkena
Rumus umum alkena Nama senyawa ch3 - ch(ch3) - o - ch2 - ch3.
Nama senyawa ch3 - ch(ch3) - o - ch2 - ch3. Sifat sifat senyawa hidrokarbon
Sifat sifat senyawa hidrokarbon Senyawa turunan alkana kelas 12
Senyawa turunan alkana kelas 12 Senyawa diol
Senyawa diol Propanon
Propanon Penguraian termal aseton pada suhu 600
Penguraian termal aseton pada suhu 600 Zat pereaksi
Zat pereaksi Struktur kimia glikosida
Struktur kimia glikosida Rumus bangun alkuna
Rumus bangun alkuna Kegunaan alkil
Kegunaan alkil 1 kloro 2 3 dimetil pentana
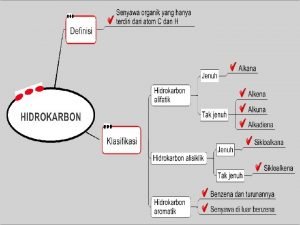
1 kloro 2 3 dimetil pentana Apa yang dimaksud dengan senyawa hidrokarbon? *
Apa yang dimaksud dengan senyawa hidrokarbon? * Mengapa kopi dan teh dikategorikan sebagai bahan penyegar
Mengapa kopi dan teh dikategorikan sebagai bahan penyegar Disakarida dalam susu
Disakarida dalam susu 4-etil-3-metilheptana
4-etil-3-metilheptana Reaktivitas aldehid dan keton
Reaktivitas aldehid dan keton