Pedpisy pro regulaci liv e v i t























































































- Slides: 91


Předpisy pro regulaci léčiv e v i t Правила государственного контроля. . . sla i g Le Protože je častokrát problematické se orientovat v této "legislativní džungli", je vhodné si uvést některé základní principy, předpisy nebo doporučení jednotlivých států nebo organizací. States, Union l European Union (EU) l U. S. A. l others 11/2002 Поскольку часто ориентироваться в этих “законодательных джунглях” совсем не просто, имеет смысл привести отдельные главные принципы или рекомендации отдельных стран либо организаций. National and International autorities l PIC/S l FDA Profesiomal organizations l ICH l ISPE l WHO l PDA Z. Pavelek: Legislativa regulace léčiv 2



e v i t sla i g Le Европейский Союз (EU) m Evropská komise (European Commission) - představuje zákonodárnou a výkonnou moc m Rada EU (Council of European Union) - stvrzuje právní akty m Evropský parlament (European Parliament) - zahrnuje politické subjekty jednotlivých členských států m Evropský soudní dvůr (Court of Justice) m Европейская комиссия (European Commission) – представляет законодательную и исполнительную власть m Совет ЕС (Council of European Union) – утверждает законодательные акты m Европейский парламент (European Parliament) – охватывает политические субъекты отдельных стран-членов ЕС m Evropský auditorský dvůr (Court m Европейский суд (Court of Justice) of Auditors) m Европейский аудиторский орган (Court of Auditors) 11/2002 Z. Pavelek: Legislativa regulace léčiv 5

e v i t sla i g Le Европейский Союз (EU) m европейские органы m evropské orgány l European Central Bank l Европейский центральный банк - European Central Bank l European Investment Bank l Европейский инвестиционный банк European Investment Bank l Economic and Social Committee l Социально-экономический Комитет - Economic and Social Committee of the Regions l Комитет по регионам - Committee of the Regions l European Ombudsman m evropské agentury - ustavené pro řešení technických, vědeckých a organizačních otázek 11/2002 l Европейский посредник по жалобам на действия государственных учреждений - European Ombudsman m европейские агентства - учрежденные для рассмотрения организационных вопросов, проблематики науки и техники Z. Pavelek: Legislativa regulace léčiv 6


Předpisy EU / Правила ЕС Předpisy EU e v i t sla i doporučení (recomendation) g Le m nejsou závazná pro členské státy, ale je doporučeno jejich použití rozhodnutí (decision) m jsou závazná pro členské státy, kterým jsou adresovány pravidla (rules) a pokyny (guideline) m řídicí principy m рекомендации (recomendation) не обязательны для стран-членов ЕС, но их использование рекомендовано m решения (decision) обязательны для тех стран-членов ЕС, которым они адресованы m правила (rules) и указания (guideline) руководящие принципы 11/2002 Z. Pavelek: Legislativa regulace léčiv 8

Regulace léčiv v EU Государственный контроль лекарственных e v i at l s i средств в ЕС Leg m Nařízením EEC/2309/93 ustavena l Evropská agentura pro hodnocení léčivých přípravků l EMEA, The European Agency for the Evaluation of Medicinal Products m Постановления № EEC/2309/93 было создано m“Европейское агентство по оценке качества лекарственных препаратов” m. EMEA, The European Agency for the Evaluation of Medicinal Products 11/2002 Z. Pavelek: Legislativa regulace léčiv 9







e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU The Rules governing medicinal products for human use in the European Community Правила для медицинских лекарственных средств в рамках Европейского Сообщества Pravidla pro léčiva pro humánní použití v rámci Evropského společenství 11/2002 Z. Pavelek: Legislativa regulace léčiv 16

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU m Volume 1 Pharmaceutical legislation l Medicinal products for human use l Tento svazek zahrnuje výčet základních směrnic a regulativů týkajících se regulace humánních léčiv v EU. l Настоящий том содержит перечень основных директив и положений, касающихся регулирования производства лекарственных средств для человека в Евросоюзе. 11/2002 Z. Pavelek: Legislativa regulace léčiv 17

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU m Volume 2 Notice to applicants l Medicinal products for human use m Volume 2 A Procedures for marketing authorisation l legislativní základ pro povolení prodeje a distribuce l приводится законодательная база для выдачи разрешения на продажу и распространение l procedury (centralizovaná, vzájemného uznávání, odkazující se) pro podávání žádostí o povolení prodeje a distribuce l процедуры (централизованная, взаимного признания, ссылающаяся) подачи заявления на получение разрешение на продажу и распространение m Volume 2 B Presentation and content of the dossier l forma registračních dosiérů (část I, III, IV) l форма регистрационных досье (часть I, III, IV) 11/2002 Z. Pavelek: Legislativa regulace léčiv 18

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU m. Volume 3 Guidelines l Medicinal products for human use l pokyny ICH / указания ICH l požadavky na jakost, bezpečnost a účinnost / требования по качеству, безопасностью и эффективностью m. Volume 3 A Quality and biotechnology l pokyny pro jakost / указания по качеству l biotechnologické pokyny / биотехнологические указания 11/2002 Z. Pavelek: Legislativa regulace léčiv 19

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU m Volume 3 B Safety and the environment l farmako-toxikologické pokyny / фармакотоксикологические нормы l pokyny prostředí / указания по среде l informace o léčivech / информация о лекарственных средствах m Volume 3 C Efficacy and information on the medicinal product l klinické pokyny (obecně a GCP) / клинические нормы (общие и GCP) l klinické pokyny (terapeutické třídy) / клинические нормы (терапевтические классы) 11/2002 Z. Pavelek: Legislativa regulace léčiv 20

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU Volume 4 Good Manufacturing practices Medicinal products for human and vererinary use m základní zásady a požadavky na správnou výrobní praxi m главные принципы и требования надлежащей практике производства 11/2002 Z. Pavelek: Legislativa regulace léčiv 21

Pokyny EU / Правила ЕС Pokyny EU e v i t sla i g Le Volume 4 - Общие требования GMP: 1. Quality Management / Обеспечение качества 2. Personnel / Персонал 3. Premises and Equipment / Помещения и оборудование 4. Documentation / Документация 5. Production / Производство 6. Quality Control / Контроль качества 7. Contract Manufacture and Analysis / Контракты на производство продукции и проведение анализов 8. Complaints and Product Recall / Рекламации и отзыв продукции 9. Self Inspection / Самоконтроль 11/2002 Z. Pavelek: Legislativa regulace léčiv 22


e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU GMP Volume 4 - Специфические требования GMP: 6. Manufacture of Medicinal Gases / Производство медицинских газов 7. Manufacture of Herbal Medicinal Products / Производство лекарственных средств растительного происхождения 8. Sampling of Starting and Packaging Materials / Отбор проб исходных и упаковочных материалов 9. Manufacture of Liquids, Creams and Ointments / Производство жидкостей, кремов и мазей 10. Manufacture of Pressured Metered Dose Aerosol Preparations for Inhalation / Производство аэрозолей для ингаляций 11/2002 Z. Pavelek: Legislativa regulace léčiv 24

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU GMP Volume 4 - Специфические требования GMP: 11. Computerised Systems / Компьютерные системы 12. Use of Ionising Radiation in the Manufacture of Medicinal Products / Использование ионизирующего излучения в производстве лекарственных средств 13. Manufacture of Investigational Medicinal Products / Производство лекарственных средств для клинических исследований 14. Manufacture of Products derived from Human Blood or Human Plasma / Массовое производство продукции из человеческой крови или плазмы 11/2002 Z. Pavelek: Legislativa regulace léčiv 25


e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU GMP m. Volume 5 Pharmaceutical legislation l Veterinary medicinal products l Tento svazek zahrnuje výčet základních směrnic a regulativů týkajících se regulace veterinárních léčiv v EU. l Данный том содержит перечень основных директив и положений, относящихся к регулированию производства лекарственных средств для ветеринарии в Евросоюзе. 11/2002 Z. Pavelek: Legislativa regulace léčiv 27

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU m Volume 6 Notice to applicants l Veterinary medicinal products m Volume 6 A Procedures for marketing authorisation l legislativní základ pro povolení prodeje a distribuce l приводится законодательная база оптовой реализации l procedury (centralizovaná, vzájemného uznávání, odkazující se) pro podávání žádostí o povolení prodeje a distribuce l процедуры (централизованная, взаимного признания, ссылающиеся) подачи заявления на получение разрешение на продажу и распространение m Volume 6 B Presentation and content of the dossier l forma registračních dosiérů (část I, III, IV) l форма регистрационных досье (часть I, III, IV) 11/2002 Z. Pavelek: Legislativa regulace léčiv 28

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU m Volume 7 Guidelines l Veterinary medicinal products m Volume 7 A General, efficacy, environmental risk assessment l obecné pokyny / общие указания l pokyny pro testování účinnosti veterinárních léčiv / указания по тестированию эффективности лекарственных средств для ветеринарии l ohodnocení rizika prostředí / оценка риска для среды m Volume 7 B Immunologicals, quality l pokyny pro výrobu a kontrolu veterinárních imunologických preparátů / указания по производству и контролю иммунологических лекарственных средств для ветеринарии l pokyny pro jakost / указания по качеству 11/2002 Z. Pavelek: Legislativa regulace léčiv 29

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU m Volume 8 Maximum residue limits l Veterinary medicinal products l Uvádí požadavky na limity reziduí ve veterinárních léčivech. l Приводятся требования по максимально допустимым пределам содержания остатков в лекарственных средствах для ветеринарии. 11/2002 Z. Pavelek: Legislativa regulace léčiv 30

e v i t sla i g Le Pokyny EU / Правила ЕС Pokyny EU m Volume 9 Pharmacovigilance l Medicinal products for human and veterinary use l Uvádí požadavky na provádění farmaceutického dohledu při používání humánních a veterinárních léčiv. l Приводятся требования по выполнению фармацевтического надзора при использовании лекарственных средств для человека и ветеринарии. 11/2002 Z. Pavelek: Legislativa regulace léčiv 31





e v i t sla i g Le Směrnice EU Директивы ЕС 2001/82/EC "Community code relating to medicinal products for veterinary use"(Kodex vztahující se na léčiva pro veterinární použití) (Кодекс, распространяющийся на лекарственные препараты для ветеринарии) l obdobný obsah l отличается подобным содержанием 11/2002 Z. Pavelek: Legislativa regulace léčiv 36



e v i t sla i g Le США - федеральныe законы Léčiva podléhají v USA kontrole vzhledem k existenci a působení čtyř federálních zákonů: l "Federal Food, Drug and Cosmetic Act„ l "Generic Drug Enforcement Act„ l "Fair Packiging and Labelling Act„ l "Public Health Services Act" В США лекарственные средства подлежат контролю в связи с наличием и действием четырех федеральных законов: : l "Federal Food, Drug and Cosmetic Act„ l "Generic Drug Enforcement Act„ l "Fair Packiging and Labelling Act„ l "Public Health Services Act" 11/2002 Z. Pavelek: Legislativa regulace léčiv 39

e v i t sla i g Le Code of Federal Regulation Title 21 -Food and Drugs m Detailní předpisy jsou ve sbírce federálních nařízení (CFR) a doplňují federální zákony / Правила публикуются в Своде федеральных правил (CFR) и представляют, тем самым, расширение федеральных законов l 210 Current good manufacturing practice in manufacturing, processing, packing, or holding of drugs; general l 211 Current good manufacturing practice for finished pharmaceuticals 11/2002 Z. Pavelek: Legislativa regulace léčiv 40


e v i t sla i g Le Velká Británie Великобритания m Již v roce 1968 zde vychází "The United Kindom Medicines Act", který řídí regulaci léčiv. m V roce 1971 vyšly první vydání "Rules and Guidance for Pharmaceutical Manufacturers" ("Orange guide"). m Výkonnou složkou pro regulaci léčiv v UK je Medicinal Control Agency (MCA), která: m řídí registraci léčiv m uděluje licence pro domácí výrobce 11/2002 m Уже в 1968 году в стране вышел “The United Kindom Medicines Act”, который регулирует контроль лекарственных препаратов. m В 1971 году вышло первое издание "Rules and Guidance for Pharmaceutical Manufacturers" ("Orange guide"). m Исполнительный орган контроля лекарственных средств в UK Medicinal Control Agency (MCA), который: m регулирует регистрацию лекарственных средств m и выдачу лицензий отечественным производителям Z. Pavelek: Legislativa regulace léčiv 42

e v i t sla i g Le Austrálie Австралия m "Code of GMP„ m представляет собой утвержденные нормативы и методы по GMP m představuje schválené normy a praktiky mezi vládou a průmyslem m Státní autorita "Therapeutic Goods Administration" (TGA) má značné pravomoce v oblasti regulace léčiv (tj. registrace, udělování licencí a inspekční činnost) 11/2002 m Государственный надзорный орган „Therapeutic Goods Administration” (TGA) наделен значительными правомочиями в области контроля лекарственных средств (т. е. регистрации, выдачи лицензий и собственно контрольной деятельности) Z. Pavelek: Legislativa regulace léčiv 43

e v i t sla i g Le Japonsko Япония „GMP Regulations of Japan“ (1992) Regulace SVP v Japonsku přípravky, aktivní látky, kosmetika diagnostika Státní autorita: Ministry of Health and Welfare “GMP Японские правила” разработаны требования по производству лекарственных средств, активных веществ, косметики, диагностических средств Государственный надзорный орган: Ministry of Health and Welfare 11/2002 Z. Pavelek: Legislativa regulace léčiv 44

Pharmaceutical Inspection Co-operation Schema e v i t PIC/S a l s i Leg m PIC (Pharmaceutical Inspection Convention) l 1970, EFTA (European Free Trade Association) l "Konvence pro vzájemné uznávání inspekcí, týkajících se výroby farmaceutických produktů„ l „Конвенция о взаимном признании инспекций в отношении производства фармацевтической продукции“ l The Convention for the Mutual Recognition of Inspections in respect of the Manufacture of Pharmaceutical Products 11/2002 Z. Pavelek: Legislativa regulace léčiv 45



e v i t sla i g Le PIC/S m v listopadu 1995 - PIC Scheme (Pharmaceutical Inspection Co-operation Scheme) jako rozšíření PIC m PIC Scheme a PIC fungují paralelně a jsou označovány jako PIC/S m. В ноябре 1995 - PIC Scheme (Pharmaceutical Inspection Co-operation Scheme) как расширение PIC m. PIC Scheme и PIC работают параллельно, неся название PIC/S 11/2002 Z. Pavelek: Legislativa regulace léčiv 48



e v i t sla i g Le PIC/S – hlavní rozdíly основные различия PIC Scheme schéma neformální ujednání PIC Scheme nelegální status mezi zdravotními autoritami výměna informací система неформальное соглашение нелегальный статус между авторитетными органами по здравоохранению обмен информацией 11/2002 Z. Pavelek: Legislativa regulace léčiv 51

e v i t sla i g Le PIC/S – hlavní rozdíly основные различия PIC konvence PIC formální dohoda конвенция legální status формальное соглашение mezi zeměmi vzájemné uznávání inspekcí легальный статус между странами взаимное признание инспекций 11/2002 Z. Pavelek: Legislativa regulace léčiv 52

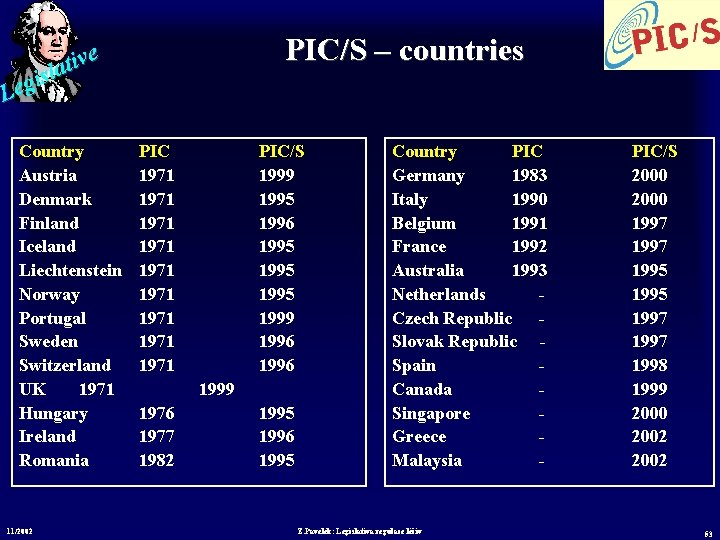
PIC/S – countries e v i t sla i g Le Country Austria Denmark Finland Iceland Liechtenstein Norway Portugal Sweden Switzerland UK 1971 Hungary Ireland Romania 11/2002 PIC 1971 1971 1971 PIC/S 1999 1995 1996 1995 1999 1996 1999 1976 1977 1982 1995 1996 1995 Country PIC Germany 1983 Italy 1990 Belgium 1991 France 1992 Australia 1993 Netherlands Czech Republic Slovak Republic Spain Canada Singapore Greece Malaysia - Z. Pavelek: Legislativa regulace léčiv PIC/S 2000 1997 1995 1997 1998 1999 2000 2002 53




PIC/S – předpisy / правила předpisy / e v i t sla i g Le m semináře vyústí do vytvoření pracovní skupin expertů (Expert Circles) m семинары обычно выливаются в создание рабочих групп экспертов (Expert Circles) l prodiskutovat a vyměňovat si informace ze specifických oblastí GMP l возможность обсуждения и обмена информацией из специфических областей GMP l vypracování l разработать n návrhů doplňků pokynů GMP n n doporučení (Recommendation) проекты приложений правил GMP n n vysvětlujících pokynů (Explanatory Notes) рекомендаций (Recommendation) n пояснительных записок (Explanatory Notes) m kooperace PIC/S s EMEA m кооперация PIC/S с EMEA 11/2002 Z. Pavelek: Legislativa regulace léčiv 57

e v i t sla i g Le PIC/S - Правила PIC/S - m Правила (guides) m Pokyny (guides) l PH 1/97: Guide to GMP for Medicinal Products - shodují se s pokyny GMP pro EC; mezi rozdíly patří: 11/2002 n PIC/S používají pojmu „autorizovaná osoba“, kdežto EC používá pojmu „kvalifikovaná osoba“ n odkazy na směrnice EU byly odstraněny n PIC/S nepokrývá veterinární produkty n v současnosti nejsou PIC/S přijaty doplňky 4, 5 a 16 l PH 1/97: Guide to GMP for Medicinal Products - в степени тождественно с руководством по GMP для EC, к основным различиям следует отнести: n PIC/S пользуются понятием “авторизованное лицо”, в то время, как EC пользуется понятием “уполномоченное лицо” n ссылки на директивы ЕС были аннулированы n PIC/S не охватывает лекарственные средства для ветеринарии n в настоящее время PIC/S не приняла приложения 4, 5 и 16 Z. Pavelek: Legislativa regulace léčiv 58

e v i t sla i g Le PIC/S - Правила PIC/S - m. Pokyny (guides) l PE 005 -1: GMP Guide for Blood Establishments l PE 007 -1: GMP Guide for Active Pharmaceutical Ingredients - shoduje se s doporučením ICH Q 7 A m. Правила (guides) l PE 005 -1: GMP Guide for Blood Establishments l PE 007 -1: GMP Guide for Active Pharmaceutical Ingredients - данное руководство соответствует рекомендации ICH Q 7 A 11/2002 Z. Pavelek: Legislativa regulace léčiv 59

PIC/S - Правила PIC/S - e v i at l s i Leg m Doporučení / Рекомендации (recomendations) l PE 012 -1: "Sterility Testing„ l PH 2/95: "Quality System for Official Medicines Control Laboratories„ l PI 002 -1: Quality System Requirements for Pharmaceutical Inspectorates l PI 006 -1: "Validation Master Plan, Installation and Operational Qualification, Non-sterile Process Validation, Cleaning Validation„ l PI 007 -1: "Validation of Aseptic Processes„ l PI 014 -1: Isolators used for Aseptic Processing and Sterility Testing 11/2002 Z. Pavelek: Legislativa regulace léčiv 60

e v i t sla i g Le PIC/S - Правила PIC/S - m SOP a vysvětlující pokyny / СОП и пояснительные указания (explanatory notes) l PI 005 -1: Guidance on Parametric Release l PI 009 -1: Aide-Memoire on the Inspection of Utilities l PI 010 -1: SOP - Procedure for Handling Rapid Alerts and Recalls Arising from Quality Defects l PE 008 -1: Explanatory Note for Industry on the Preparation of a Site Master File 11/2002 Z. Pavelek: Legislativa regulace léčiv 61




e v i t sla i g Le FDA - Регистрация лекарственных средств IND, Investigational New Drugs не прошедшие испытания, новые лекарственные препараты dosud nevyzkoušená nová léčiva NDA, New Drug Applications заявления на новые лекарственные средства žádosti o nová léčiva ANDA, Abbreviated New Drug Applications сокращенные заявления на новые лекарства zkrácené žádosti o nová léčiva DMF, Drug Master File 11/2002 Z. Pavelek: Legislativa regulace léčiv 65

e v i t sla i g Le FDA - деятельность FDA - Udělování licencí domácím výrobcům a dodavatelům выдача лицензий отечественным производителям и поставщикам 11/2002 Z. Pavelek: Legislativa regulace léčiv 66


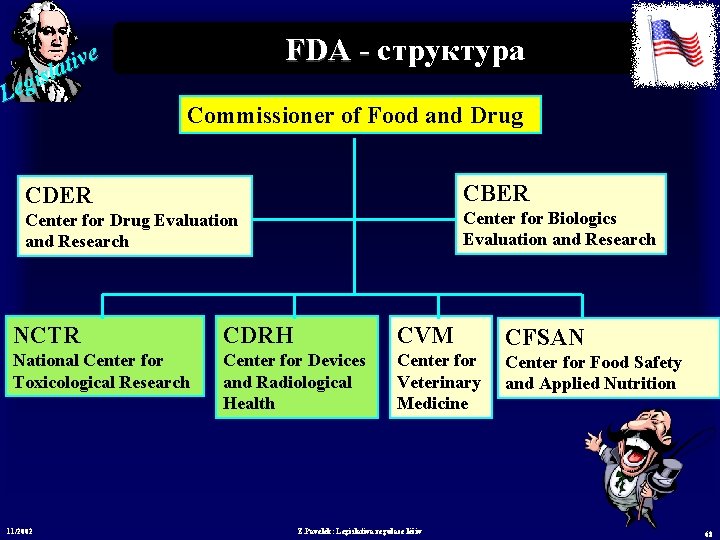
e v i t sla i g Le FDA - структура FDA - Commissioner of Food and Drug CBER CDER Center for Biologics Evaluation and Research Center for Drug Evaluation and Research NCTR CDRH CVM CFSAN National Center for Toxicological Research Center for Devices and Radiological Health Center for Veterinary Medicine Center for Food Safety and Applied Nutrition 11/2002 Z. Pavelek: Legislativa regulace léčiv 68

FDA – inspekční pokyny / указания по FDA – inspekční pokyny / контролю e v i t sla i g Le m Biotechnology Inspection Guide m Guide to Inspections of Bulk Pharmaceutical Chemical m Guide to Inspections of High Purity Water Systems m Guide to Inspections of Microbiological Pharmaceutical Quality Control Labs m Guide to Inspections of Pharmaceutical Quality Control Laboratories m Guide to Inspections of Validation of Cleaning Processes m Guide to Inspections of Dosage from Drug Manufacturers-c. GMP’s m Guide to Inspections of Oral Solid Dosage Forms Pre/Post Appr. Issues 11/2002 Z. Pavelek: Legislativa regulace léčiv 69

FDA – inspekční pokyny / указания по FDA – inspekční pokyny / контролю e v i t sla i g Le m Guide to Inspections of Sterile Drug Substance Manufacturers m Guide to Inspections of Topical Drug Products m Guide to Inspections of Oral Solutions and Suspensions m Guide to Inspections of Computerised Systems in the Food Processing Industry m Guide to Inspections of Foreign Medical Device Manufacturers m Guide to Inspections of Foreign Pharmaceutical Manufacturers m Inspection Technical Guide 11/2002 Z. Pavelek: Legislativa regulace léčiv 70

e v i t sla i g Le FDA – pokyny pro výrobce указания для производителей m Good Laboratory Practice Regulations m Guideline for Submitting Samples and Analytical Data for Methods Validation m Guideline on General Principles of Process Validation m Guideline on Sterile Drug Products Produced by Aseptic Processing m Guideline for Drug Master File 11/2002 Z. Pavelek: Legislativa regulace léčiv 71

e v i t sla i g Le ICH International Conference on Harmonization of Technical Requirements for Registration of Pharmaceutical for Human Use Mezinárodní konference o harmonizaci technických požadavků na registraci farmaceutických výrobků pro humánní použití Международная конференция по гармонизации технических требований к регистрации фармацевтической продукции для людей USA EU Japan 11/2002 Z. Pavelek: Legislativa regulace léčiv 72

e v i t sla i g Le ICH m Committee on Proprietary Medicinal Products (CPMP) m European Federation of Pharmaceutical Industries' Associations (EFPIA) m Ministry of Health and Welfare, Japan (MHW) m Japan Pharmaceutical Manufactures of Association (JPMA) m US Food and Drug Administration (FDA) m Pharmaceutical Research and Manufacturers of America (Ph. RMA) существуют: WHO, EFTA и Canada 11/2002 Z. Pavelek: Legislativa regulace léčiv 73


e v i t sla i g Le ICH - Expert Working Groups Safety решает вопросы доклинической токсичности и соответствующих тестов otázky předklinické toxicity Efficacy занимается программами клинических исследований и мониторинга безопасности programy klinického testování a monitorování bezpečnosti 11/2002 Z. Pavelek: Legislativa regulace léčiv 75

e v i t sla i g Le ICH - Expert Working Groups Multidisciplinary решает вопросы коммуникации по контролю и планирование изучения токсичности с учетом клинических исследований regulační komunikace a plánování studií toxicity v klinických studiích Quality решает вопросы фармацевтических разработок и спецификаций farmaceutický vývoj a specifikace 11/2002 Z. Pavelek: Legislativa regulace léčiv 76

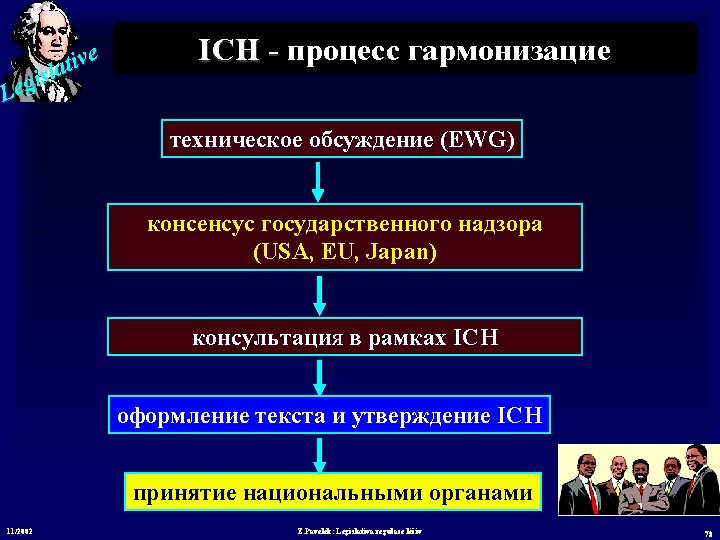
e v i t sla i g Le ICH - proces harmonizace Technická diskuse (EWG) Konsenzus regulačních autorit (USA, EU, Japan) Konzultace v ICH Finalizace textu a schválení ICH Implementace národními autoritami 11/2002 Z. Pavelek: Legislativa regulace léčiv 77


e v i t sla i g Le ICH – pokyny / указания ICH – pokyny / Q 1 A(R): Stability Testing of New Drugs and Products Q 1 B Photostability Testing Q 1 C: Stability Testing for New Dosage Forms Q 1 D: Bracketing and Matrixing Designs for Stability Testing of Drug Substances and Drug Products Q 1 E: Evaluation of Stability Data Q 1 F: Stability Data Package for Registration in Climatic Zones III and IV 11/2002 Z. Pavelek: Legislativa regulace léčiv 79

e v i t sla i g Le ICH – pokyny / указания ICH – pokyny / Q 2 A Validation of Analytical Procedures: Definitions and Terminology Q 2 B Validation of Analytical Procedures: Methodology Q 3 A(R): Impurities in New Drug Substances Q 3 B(R): Impurities in New Drug Products Q 3 C Impurities: Residual Solvents Q 4: Pharmacopoeial Harmonisation 11/2002 Z. Pavelek: Legislativa regulace léčiv 80

e v i t sla i g Le ICH – pokyny / указания ICH – pokyny / Q 5 A Viral Safety Evaluation Q 5 B Genetic Stability Q 5 C Stability of Products Q 5 D Cell Substrates Q 6 A Specifications: Chemical Substances Q 6 B Specifications: Biotechnological Substances Q 7 A Good Manufacturing Practice for Active Pharmaceutical Ingredients" 11/2002 Z. Pavelek: Legislativa regulace léčiv 81

e v i t sla i g Le World Health Organization, WHO (ВОЗ) , WHO m v roce 1948, jako orgán Organizace spojených národů m je organizována prostřednictvím sekretariátu a regionálními úřady v jednotlivých oblastech světa m в 1948 году как один из органов Организации объединенных наций m организована посредством секретариата и региональных учреждений в отдельных регионах мира 11/2002 Z. Pavelek: Legislativa regulace léčiv 82


e v i t sla i g Le World Health Organization, WHO (ВОЗ) m expertní komise vydávají pokyny a zprávy l např. WHO/PHARM/93. 562 "Guidelines on the Validation of Manufacturing Processes„ m pro GMP vydala WHO pokyny srovnatelné s EU či USA m создает и руководит работой комиссий экспертов, которые издают указания и отчеты m например WHO/PHARM/93. 562 „Guidelines on the Validation of Manufacturing Processes“ m для области GMP ВОЗ выпустила собственные указания, которые сравнимы с европейскими и американскими 11/2002 Z. Pavelek: Legislativa regulace léčiv 84

e v i t sla i g Le International Society for Pharmaceutical Engineering ISPE технические технически указание указани - FDA m poskytovat praktický přístup farmaceutickým technikům m připravovat výukové programy m sbírat a zobecňovat současné praktické zkušenosti m poskytovat informace a vytvářet předpisy m предоставлении доступа к практике фармацевтическим техникам m подготовке программ обучения m сборе и обобщении современного практическогоопыта m предоставлении информации и разработке правил 11/2002 Z. Pavelek: Legislativa regulace léčiv 85

e v i t sla i g Le ISPE - Указания ISPE - P M GA Volume 1: Bulk Pharmaceutical Chemical Facilities Výrobní jednotky pro nerozplňované farmaceutické chemikálie Производственные единицы нерасфасованного фармацевтического химиката Volume 2: Oral Solid Dossage Forms Orální pevné lékové formy Твердые лекарственные формы для приема внутрь Volume 3: Sterile Manufacturing Facilities Výrobní jednotky pro sterilní výrobu Производственные единицы для стерильного производства 11/2002 Z. Pavelek: Legislativa regulace léčiv 86

e v i t sla i g Le ISPE - Указания ISPE - Volume 4: Water and Steam Systems Vodní a parní systémy Системы воды и пара Volume 5: Commissioning and Qualification Guide Pokyny pro předávání a kvalifikace Указания по передачи и квалификации 11/2002 Z. Pavelek: Legislativa regulace léčiv 87

e v i t sla i g Le Parenteral Drug Association - PDA m společná zasedání a koordinaci činností s FDA m trénink personálu v oblastech GMP m výzkum specifických procesů spojených s výrobou léčiv m совместные заседания и координацию деятельности с FDA m тренинг персонала в областях GMP m исследование специфических процессов, связанных с производством лекарственных средств 11/2002 Z. Pavelek: Legislativa regulace léčiv 88

e v i t sla i g Le Parenteral Drug Association - PDA m vydávání vědeckých a technických zpráv pro řešení různých oblastí GMP m vydávání zpráv a publikací z konferencí m vydávání literatury pro GMP m издание научных и технических отчетов для решения различных областей GMP m издание отчетов и публикаций с конференций m издание литературы по GMP 11/2002 Z. Pavelek: Legislativa regulace léčiv 89

PDA - Technical Reports e v i t sla i g Le No. 1 ”Validation of Steam Sterilization Cycles” No. 3 ”Validation of Dry Heat Processes Used for Sterilization and Depyrogenation” No. 8 „Parametric Release of Parenteral Solutions Sterilized by Moist Heat Sterilization” No. 11 ”Sterilization of Parenterals by Gamma Radiation” No. 13 ”Fundamentals of a Microbiological Enviromental Monitoring Program” No. 18 ”Validation of Computer-Related Systems” No. 21 ”Bioburden Recovery Validation” No. 22 ”Process Simulation Testing for Aseptically Filled Products” 11/2002 Z. Pavelek: Legislativa regulace léčiv 90

PDA - Technical Reports e v i t sla i g Le No. 25 "Blend Uniformity Analysis: Validation and IPC“ No. 26 ”Sterilizing Filtration of Liquids” No. 27 ”Pharmaceutical Package Integrity” No. 29 ”Points to Consider Cleaning Validation” No. 30 ”Parametric Release of Sterile Pharmaceuticals Terminally Sterilized by Moist Heat” No. 31 ”Validation and Qualification of Computerized Laboratory Data Acquisition Systems” No. 32 "Auditing of Suppliers Providing Computer Products and Services for Regulated Pharmaceutical Operations” No. 33 „Evaluation, Validation and Implementation of New Microbiological Testing Methods” 11/2002 Z. Pavelek: Legislativa regulace léčiv 91