PCR Prof Vincenzo Nigro Dipartimento di Patologia Generale






































- Slides: 52

PCR Prof. Vincenzo Nigro Dipartimento di Patologia Generale, Seconda Università degli Studi di Napoli Telethon Institute of Genetics and Medicine (TIGEM)


1978 Prima diagnosi molecolare sul DNA *Primo ormone umano ricombinante (insulina) *Premio Nobel agli scopritori degli enzimi di restrizione *Identificato l’AIDS *Prodotto il depakene (epilessia) *Prima bambina in provetta (Luise) *Appare sul mercato l’Apple Computer ed i floppy disk

Com’era l’analisi genetica prima della PCR? § Il Southern blotting (1975) permetteva un’analisi approssimativa dei geni (RFLPs, inserzioni & delezioni) § Il sequenziamento del DNA (1978) richiedeva che I geni venissero prima clonati in appositi vettori (plasmidi o fago l) § La costruzione di genoteche e lo screening potevano richiedere molti mesi e le genoteche dovevano essere preparate per ciascun individuo analizzato

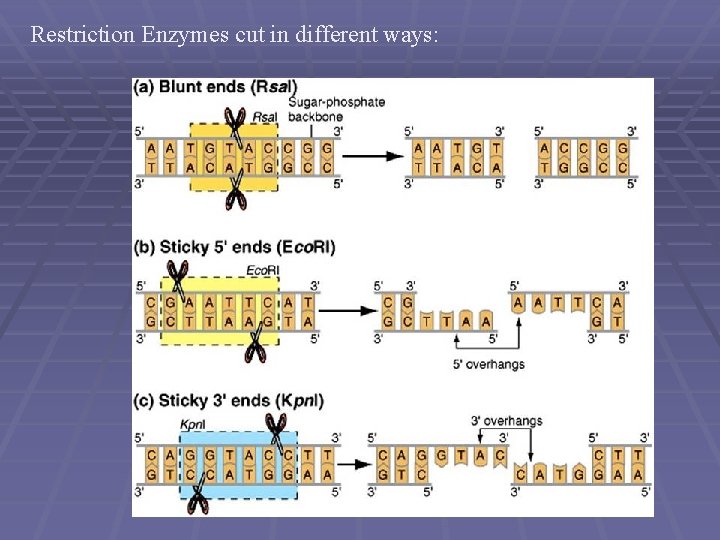
Restriction Enzymes cut in different ways:

L’invenzione della PCR § Ideata da Kary Mullis nel 1983 § La prima pubblicazione è apparsa nel 1985 § Premio Nobel per la chimica nel 1995

1985 Descritta la reazione di PCR Parte il progetto genoma umano Costo giornale £ 650 Tazzina Caffè £. 400

Polymerase Chain Reaction - PCR La PCR rappresenta la seconda rivoluzione nelle tecniche di manipolazione del DNA E’ essenzialmente una tecnica di amplificazione del DNA PCR (singola molecola) amplificazione Molte molecole

Polymerase Chain Reaction § Metodo per l’amplificazione esponenziale di sequenze di DNA § Ingredienti di base § Stampo di DNA o RNA § 2 primers complementari a differenti regioni dello stampo § DNA polimerasi termostabile § 4 nucleotidi § il buffer appropriato

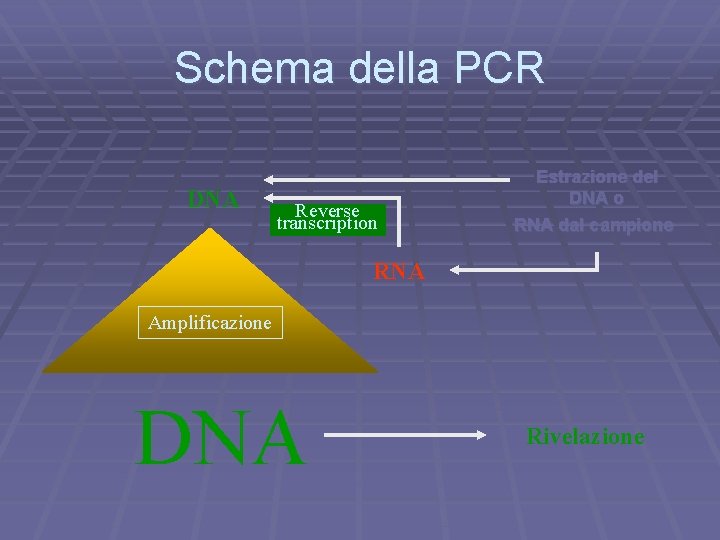
Schema della PCR DNA Reverse transcription Estrazione del DNA o RNA dal campione RNA Amplificazione DNA Rivelazione

TIPICA MISCELA DI REAZIONE 25 o 50 l in una provetta micro Eppendorf (0. 2 o 0. 5 ml) COMPONENTE VOLUME Concentrazione finale 10 X PCR Buffer 5 l 1 X 10 X d. NTPs (2 m. M) 5 l 200 M Forward primer (5 pmols/ l) 5 l 0. 5 M Reverse primer (5 pmols/ l) 5 l 0. 5 M (25 pmols/50 l) DNA genomico stampo 2 l 1 g polimerasi termostabile (5 U/ l) 0. 2 l 1 unità H 2 O (a 50 l di volume finale) 27. 8 l

I cicli della PCR § 30– 35 cicli ciascuno comprendente: § denaturazione (95°C), 10 -40 sec § annealing (50– 65°C), 30 -120 sec § polimerizzazione (68 -72°C), il tempo dipende dalla lunghezza del frammento

Thermal cycler, Applied. Biosystems

Thermal Cyclers, MJ Research

Thermal Cyclers, MJ Research

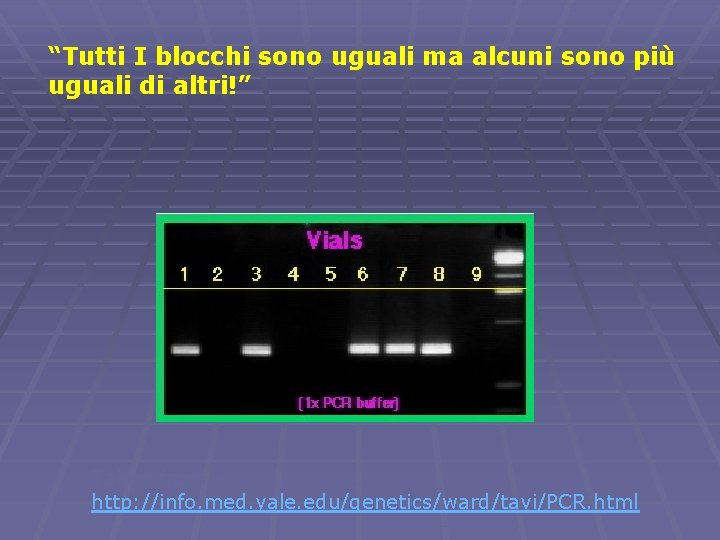
“Tutti I blocchi sono uguali ma alcuni sono più uguali di altri!” Taken from http: //info. med. yale. edu/genetics/ward/tavi/PCR. html

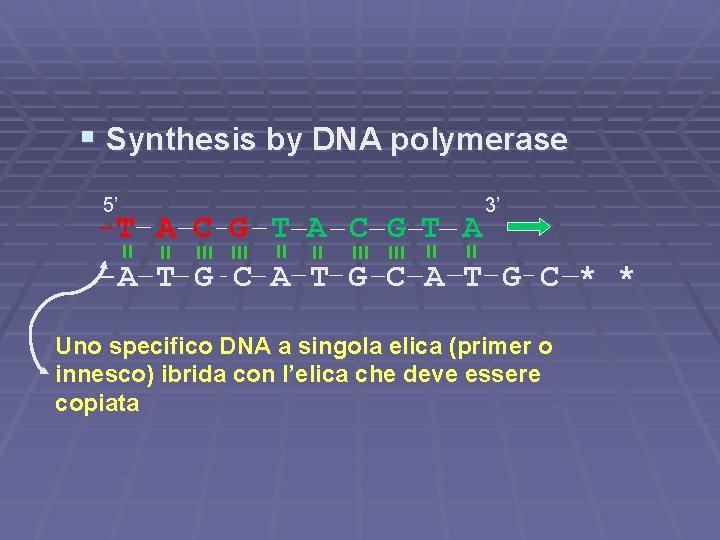
§ Synthesis by DNA polymerase 5’ 3’ -T A C G T A -A T G C * * Uno specifico DNA a singola elica (primer o innesco) ibrida con l’elica che deve essere copiata

Come funziona la PCR § Come fa la polimerasi a sapere quando fermarsi una volta che ha raggiunto l’altro primer? § PCR animation alla “Dolan DNA Learning Center, CSHL, Cold Spring Harbor”

Quanto è potente la PCR? § La PCR può amplificare fino ad ottenere una quantità utilizzabile di DNA (visibile su gel) in meno di 2 ore § Lo stampo di DNA non necessita di particolari purificazione se il frammento da amplificare è di dimensioni ridotte (fino a 1000 bp) § Il prodotto della PCR può essere digerito con enzimi di restrizione, sequenziato o clonato § La PCR può amplificare una singola molecola di DNA (es. uno spermatozoo)

Elettroforesi su gel : Separa le molecule per dimensione separazione orizzontale --> Agarosio = DNA ed RNA separation verticale --> Acrilamide = DNA, proteine ed RNA le molecole più piccole migrano nel gel più velocemente

Elettroforesi su gel: visualizzazione diretta delle molecole separazione orizzontale --> Agarosio = DNA ed RNA

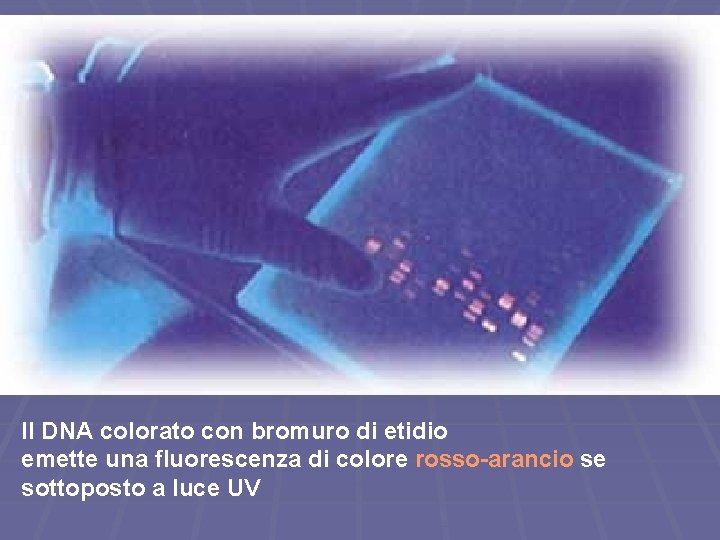
Il DNA colorato con bromuro di etidio emette una fluorescenza di colore rosso-arancio se sottoposto a luce UV

THE GENOMIC SEQUENCE Fifty years after the double helix, the reference DNA sequence of Homo sapiens is now available for downloading. Annotation of genes and other features is in progress. Download Sequence Data

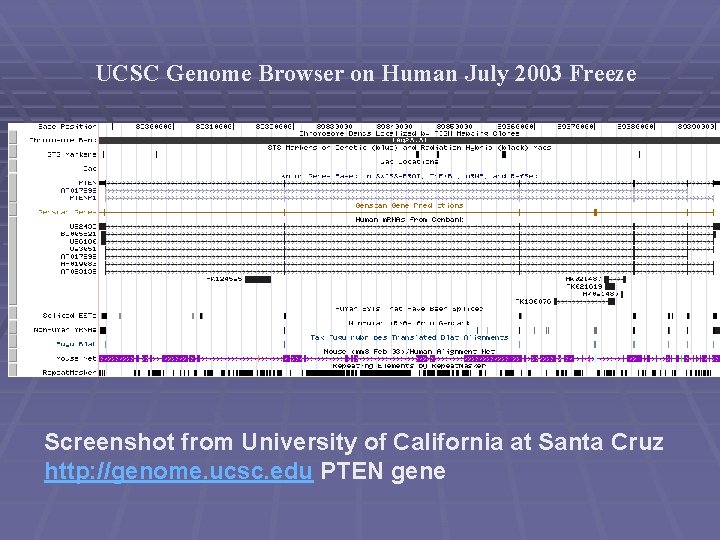
UCSC Genome Browser on Human July 2003 Freeze Screenshot from University of California at Santa Cruz http: //genome. ucsc. edu PTEN gene

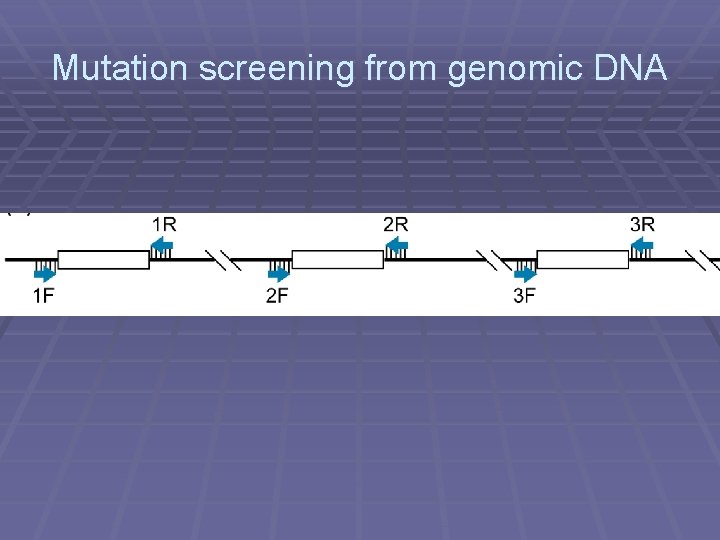
Mutation screening from genomic DNA

Mutation screening from RNA by RT-PCR

Quante copie? § Nessun prodotto fino al 3° ciclo § L’accumulazione non è un raddoppiamento completo dopo ciascun ciclo § Dopo 32 cicli ci dovrebbero essere max 1, 073, 741, 764 copie di lunghezza definita (~1 109)

How Big A Target? § Amplification products are typically in the size range 100 -1500 bp. § Longer targets are amplifiable — >25 kb. § Requires modified reaction buffer, cocktails of polymerases, and longer extension times. § Limited by the integrity of the starting target DNA — > 50 kb.

Designing PCR Primers § Primers should be ~20 bases long. § The G/C content should be 45– 55%. § The annealing temperatures should be within 1°C of one another. § The 3´-most base should be a G or C. § The primers must not base pair with each other or with themselves or form hairpins. § Primers must avoid repetitive DNA regions.

Primers That Form Dimers § A primer may form a dimer with itself or with the other primer. 5´-ACCGGTAGCCACGAATTCGT-3´ ||||| 3´-TGCTTAAGCACCGATGGCCA-5´ § Primer dimers can be an excellent, but unwanted, substrate for the Taq polymerase.

Primers That Form Hairpins § A primer may be self-complementary and be able to fold into a hairpin: 5´-GTTGACTTGATA ||||| T 3´-GAACTCT § The 3´ end of the primer is base-paired, preventing it annealing to the target DNA.

Optimising the PCR Reaction § Annealing temperature of the primers. § The concentration of Mg 2+ in the reaction. § The extension time. § (The denaturing and annealing times. ) § (The extension temperature. ) § (The amount of template and polymerase — “more is less”. )

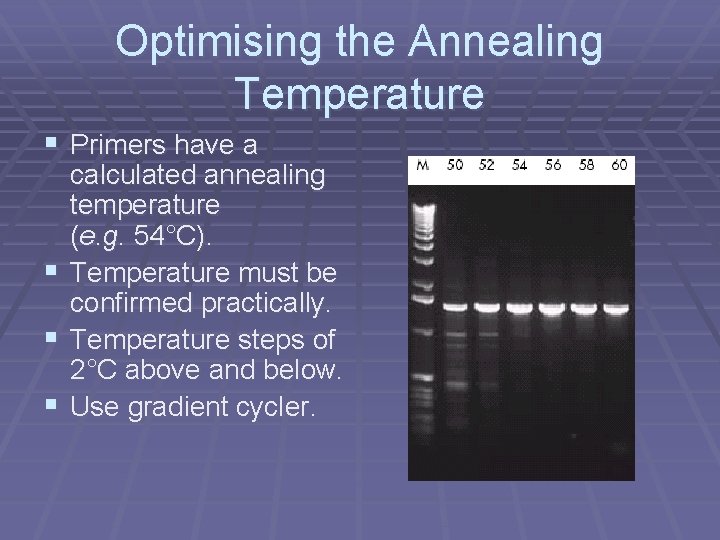
Optimising the Annealing Temperature § Primers have a calculated annealing temperature (e. g. 54°C). § Temperature must be confirmed practically. § Temperature steps of 2°C above and below. § Use gradient cycler.

2+ Optimising the Mg Concentration § The fidelity of the PCR depends on [Mg 2+]. § Vary [Mg 2+] in steps of 0. 5 m. M. § Sometimes a compromise between yield and specificity.

ADDITIVi? DMSO Formamide Glicerolo QIAGEN – Q Stratagene - Perfect Match

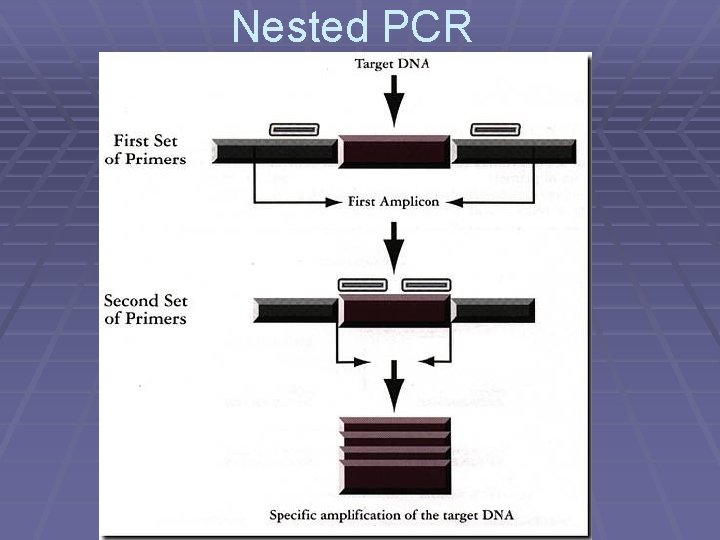
Nested PCR

False positive PCR § Contamination § at the time of specimen collection § during transport § in the laboratory from other patient samples or positive control material § negative controls used to detect contamination § Primers are not specific enough § do additional confirmatory tests § PCR for other targets, additional tests to confirm the identity of the product


General applications of PCR (1)

General applications of PCR (2)

Restriction site polymorphism analysis by PCR

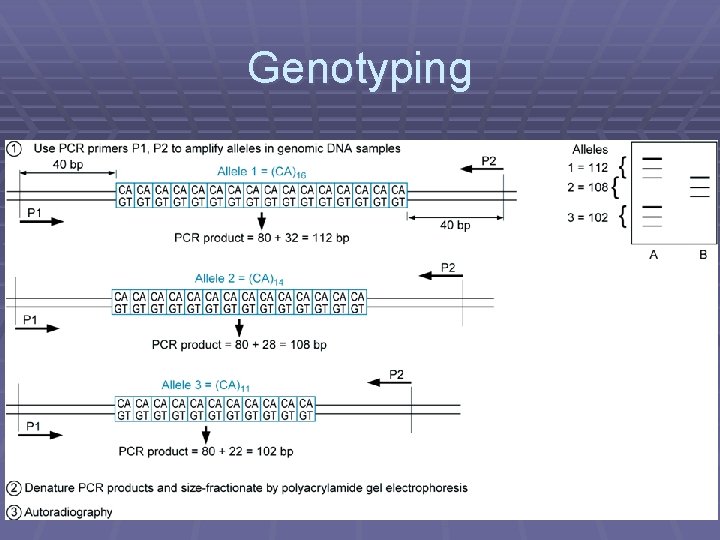
Genotyping

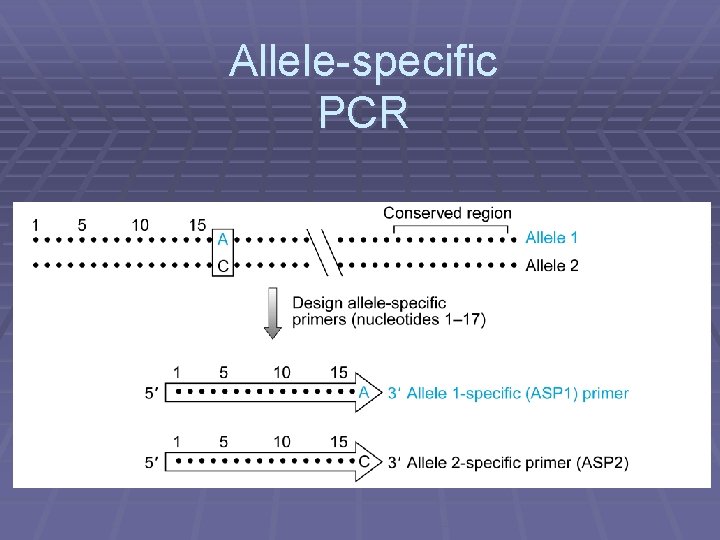
Allele-specific PCR


Fidelity of the Reaction § Taq DNA polymerase lacks the 3´ 5´ proof-reading activity commonly present in other polymerases. § Taq mis-incorporates 1 base in 104. § A 400 bp target will contain an error in 33% of molecules after 20 cycles. § Error distribution will be random.

Do Errors Matter? § Yes, if you want to clone the amplified DNA — an individual molecule may harbour several mutations. § No, if you want to sequence the amplified DNA or cut it with restriction enzymes. § Use a proof-reading thermo-stable enzyme rather than Taq.

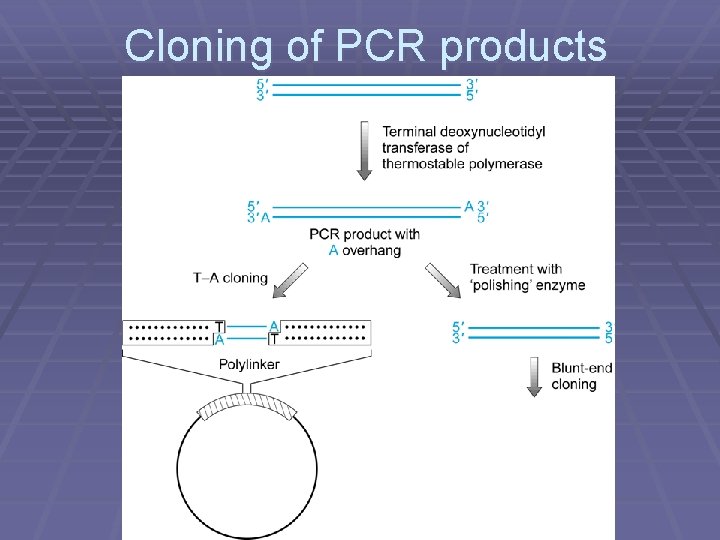
Cloning PCR Products § Products should be ligatable into blunt- ended restriction enzyme site. § Lower than expected efficiency. § Products are not truly blunt-ended. § Taq polymerase adds a single nontemplated base (usually A) to the 3´ end: NNNNNNN…NNNNNNNA ANNNNNNN…NNNNNNN

Cloning of PCR products

Can I PCR Amplify RNA? § Not directly — the DNA polymerase requires a DNA template and will not copy RNA. § m. RNA can first be copied into c. DNA using reverse transcriptase. § c. DNA is a template for PCR — it need not be double-stranded.

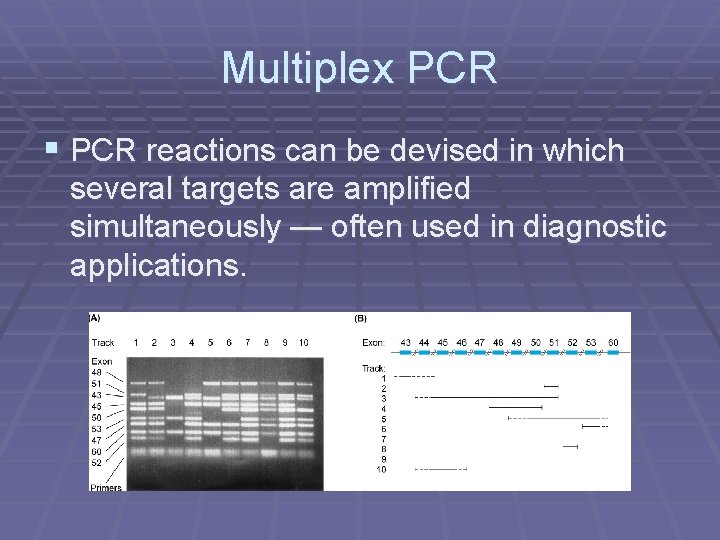
Multiplex PCR § PCR reactions can be devised in which several targets are amplified simultaneously — often used in diagnostic applications.

Sequencing PCR products

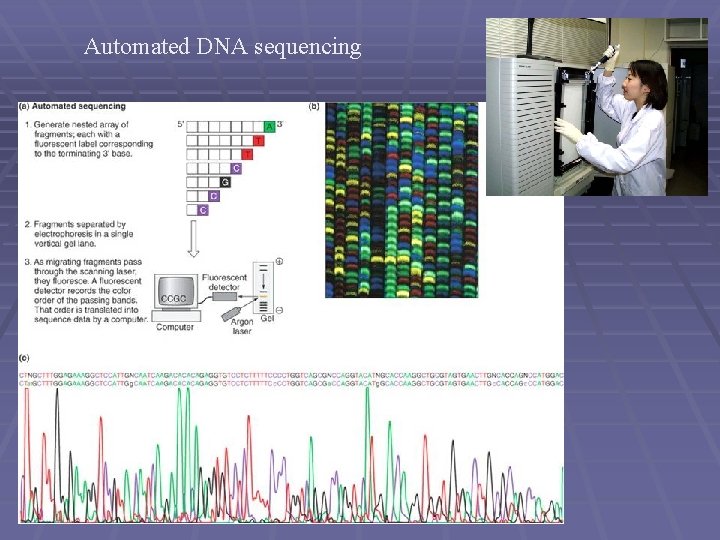
Automated DNA sequencing
 Nigro & nigro pc
Nigro & nigro pc Jan nigro poet
Jan nigro poet Elementi di fisica meccanica e termodinamica mazzoldi
Elementi di fisica meccanica e termodinamica mazzoldi Google imagens
Google imagens Neuropatia metabolica
Neuropatia metabolica Patologia
Patologia Hemolinfatica
Hemolinfatica Ofaloncele
Ofaloncele Patologia
Patologia Fagocitosis
Fagocitosis Corpusculi mallory
Corpusculi mallory Infarto renal
Infarto renal Patologia anorectal
Patologia anorectal Acincia
Acincia Patologia sociale
Patologia sociale Patologia usac
Patologia usac Hymenolepis diminuta patologia
Hymenolepis diminuta patologia Patologia
Patologia Q es la patologia
Q es la patologia Patologia vegetale molecolare
Patologia vegetale molecolare Patologia sociale
Patologia sociale Neoplasia
Neoplasia Patologia
Patologia Tabela perímetro cefálico por idade
Tabela perímetro cefálico por idade Bujiraj
Bujiraj Informe de patología estructural
Informe de patología estructural Vincenzo liberatore
Vincenzo liberatore Vincenzo liberatore
Vincenzo liberatore Vincenzo camuccini la mort de césar
Vincenzo camuccini la mort de césar Vincenzo pilone chirurgo
Vincenzo pilone chirurgo Vincenzo civerchio
Vincenzo civerchio Vincenzo vagnoni
Vincenzo vagnoni Vincenzo baraniello
Vincenzo baraniello Robert s wright
Robert s wright Vincenzo pisciuneri
Vincenzo pisciuneri Vincenzo liberatore
Vincenzo liberatore Vincenzo quotes italian
Vincenzo quotes italian Vincenzo pisciuneri
Vincenzo pisciuneri Vincenzo lucchese
Vincenzo lucchese Docs. google. com/forms
Docs. google. com/forms Vincenzo vigna
Vincenzo vigna Di vincenzo criteria
Di vincenzo criteria Itc benini melegnano
Itc benini melegnano Vincenzo peruggia
Vincenzo peruggia Vincenzo papa
Vincenzo papa Vincenzo busiello
Vincenzo busiello Iwcd
Iwcd Vincenzo caglioti
Vincenzo caglioti Patera vincenzo
Patera vincenzo Vincenzo vagnoni
Vincenzo vagnoni Vincenzo cutello
Vincenzo cutello Vincenzo innocente
Vincenzo innocente Vincenzo pisciuneri
Vincenzo pisciuneri