Partie 2 Les configurations lectroniques et les tendances




































- Slides: 36

Partie 2 Les configurations électroniques et les tendances périodiques

1. Quelle est la formule pour calculer le nombre maximal d’électrons (théorique) dans un niveau d’énergie ? 2 2 n

2. Comment sont identifiés les sous-niveaux d’énergie ? Par les lettres s, p, d et f.

3. Quel est le nombre maximal d’électrons dans une orbitale ? 2 électrons par orbitale

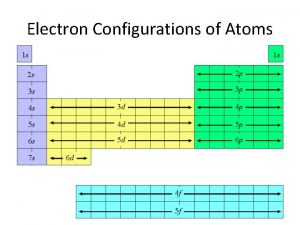
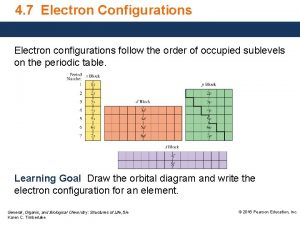
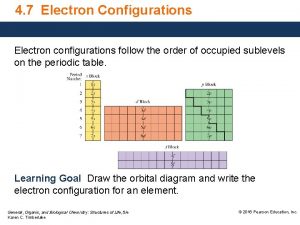
4. Indique l’ordre dans lequel les orbitales sont remplies. 1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d 7 p

5. Combien y a-t-il d’orbitales dans le sous-niveau : a) f ? 7 b) d ? 5 c) s ? 1 d) p ? 3

6. Dans la configuration électronique, que représente l’exposant ? Le nombre d’électrons dans le sous-niveau

7. Quel élément est représenté par 1 s 2 2 p 4 ? oxygène

8. Écrivez la configuration électronique du brome. 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 5

9. Écrivez la configuration électronique de l’erbium. 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 12

10. Quel élément a la configuration électronique 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 1 ? scandium

11. Dans la notation de Lewis, que représente chacun des 4 côtés du symbole ? Une orbitale de type s et 3 orbitales de type p

12. Dans la notation de Lewis, que représente chaque point ? Un électron

13. Quel nom donne-t-on aux électrons du niveau le plus élevé ? Électrons de valence

14. Quel est le nombre maximal d’électrons de valence ? 8

15. De quel côté du tableau périodique trouve-t-on a) les métaux ? À gauche (et au centre) b) les non-métaux ? À droite

16. Qu’est-ce que les éléments d’une même famille ont en commun ? Le même nombre d’électrons de valence

17. Dans le tableau périodique, qu’est-ce que : un groupe ? Une colonne une famille ? Une colonne une période ? Une rangée

18. Qu’est-ce qu’un a) anion ? Un ion négatif b) cation ? Un ion positif

19. Définissez « énergie d’ionisation » L’énergie minimale pour arracher un électron à un atome gazeux.

20. Comment varie l’énergie d’ionisation dans une période ? Elle augmente plus on avance dans la période

21. Dans quelle période les éléments possèdent-ils la plus grande énergie d’ionisation ? La période 1 La période 7

22. Quel groupe d’éléments possède la plus forte énergie d’ionisation ? La famille 18

23. Dans quelle période les éléments possèdent-il le plus grand rayon atomique ? La période 17

24. Quel groupe d’éléments possède le plus grand rayon atomique ? La famille 18

25. Quel est l’élément qui a la plus grande énergie d’ionisation ? Hydrogène Hélium Francium Radon

26. Quel est l’élément qui le plus petit rayon atomique, selon la tendance ? Hydrogène Hélium Francium Radon

27. Quel élément a la plus petite énergie d’ionisation ? Hydrogène Hélium Francium Radon

28. Quel élément a le plus grand rayon atomique ? Hydrogène Hélium Francium Radon

29. Pourquoi les éléments ayant un petit rayon atomique ont-il une grande énergie d’ionisation ? Les petits atomes ont leurs électrons près du noyau C’est donc difficile de les enlever, ça demande beaucoup d’énergie

Hélium 1 s 2 He )2 He

Potassium 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 K )2 )8 )8 )1 K

Beryllium 1 s 2 2 s 2 Be )2 )2 Be

Aluminium 1 s 2 2 p 6 3 s 2 3 p 1 Al )2 )8 )3 Al

Phosphore 1 s 2 2 p 6 3 s 2 3 p 3 P )2 )8 )5 P

Chlore 1 s 2 2 p 6 3 s 2 3 p 5 Cl )2 )8 )7 Cl
 Electrons in atoms section 3 electron configuration
Electrons in atoms section 3 electron configuration Ac load line analysis of transistor
Ac load line analysis of transistor Stable electronic configuration
Stable electronic configuration Stable electron configurations are likely to contain
Stable electron configurations are likely to contain S electrons
S electrons Excited state electron configuration
Excited state electron configuration Bipolar transistor configurations
Bipolar transistor configurations Chapter 5 electrons in atoms
Chapter 5 electrons in atoms Electrons configurations
Electrons configurations Electron configuration rules
Electron configuration rules Ceedar innovation configurations
Ceedar innovation configurations Stable electron configurations are likely to contain
Stable electron configurations are likely to contain Flexible pavement and rigid pavement
Flexible pavement and rigid pavement Isoelectronic series
Isoelectronic series C n o f electron affinity
C n o f electron affinity Partie théorique et pratique
Partie théorique et pratique Tableau des centièmes
Tableau des centièmes Partie intérieure de la terre
Partie intérieure de la terre Planowanie potrzeb materiałowych mrp
Planowanie potrzeb materiałowych mrp Gastro entérologue définition
Gastro entérologue définition Partie du corps du dauphin
Partie du corps du dauphin Fonction partie entiere
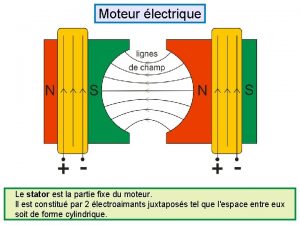
Fonction partie entiere Partie fixe d'un moteur
Partie fixe d'un moteur Partie de poisson
Partie de poisson Chimie partie 2
Chimie partie 2 La synecdoque
La synecdoque Partie de campagne renoir
Partie de campagne renoir Partie prenante management
Partie prenante management Partie décimale
Partie décimale La route de chlifa résumé partie 2
La route de chlifa résumé partie 2 Parts de la flor
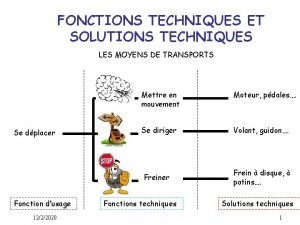
Parts de la flor Les fonctions techniques et les solutions techniques
Les fonctions techniques et les solutions techniques Allez vous en sur les places paroles
Allez vous en sur les places paroles Les constellations les plus connues
Les constellations les plus connues Organisateur textuel debut
Organisateur textuel debut Les mot variables
Les mot variables Les lettres en français
Les lettres en français