P I E S S I N A







































































- Slides: 91

P I E S S I N A N I O K F I K DE AM N N I A D MOD R E T Dosen: M. Agus Sahbana, S. T. , MT. 1

Apa yaa Termodinamika itu? ? Untuk apa belajar Termodinamika itu? ? 2

Termodinamika adalah : ilmu yang mempelajari hukum yang mengatur perubahan energi dari suatu bentuk ke bentuk lain, aliran dan kemampuan energi melakukan usaha.

Termodinamika: ilmu tentang energi, yang secara Jadi. . membahas tentang hubungan antara energi spesifik panas (kalor) dengan kerja (gaya? Termodinamika digunakan untuk menganalisis dan merancang sesuatu sesuai dengan kebutuhan manusia dengan menggabungkan prinsip-prinsip termodinamika dan Mesin Mobil Iptek lainnya seperti: Turbin mekanika Pembangkit Listrik tenaga fluida, perpindahan kalor dan massa. refrigerator Nuklir 4

INDIKATOR : Setelah mempelajari bab ini, siswa diharapkan mampu : §Menganalisis keadaan gas karena perubahan suhu, tekanan, dan volume. §Menggambarkan perubahan keadaan gas dalam diagram P-V. §Memformulasikan hukum I termodinamika dan penerapannya. §Mengaplikasikan hukum II termodinamika pada masalah fisika sehari-hari. §Memformulasikan siklus Carnot. §Merumuskan proses reversibel dan tak reversibel.

DUA ISTILAH YANG BERKAITAN ERAT DALAM TERMODINAMIKA, YAITU: 6

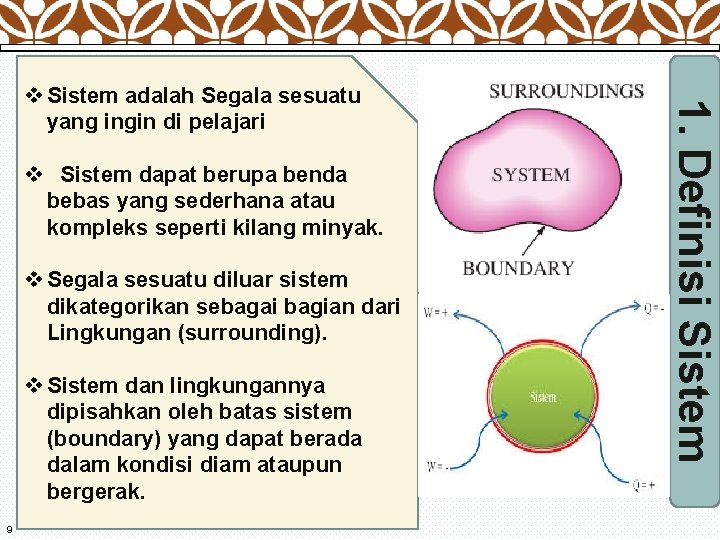
ØSistem adalah : sesuatu yang menjadi subyek pembahasan atau fokus perhatian. ØLingkungan adalah : segala sesuatu yang tidak termasuk dalam sistem atau segala keadaan di luar sistem.

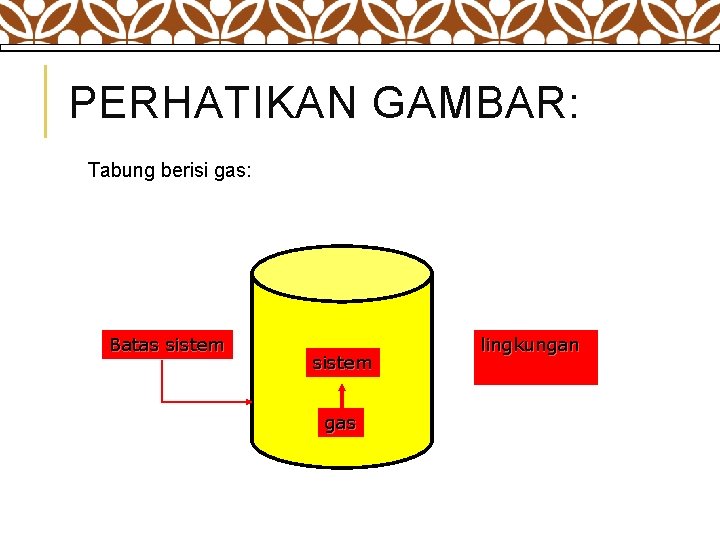
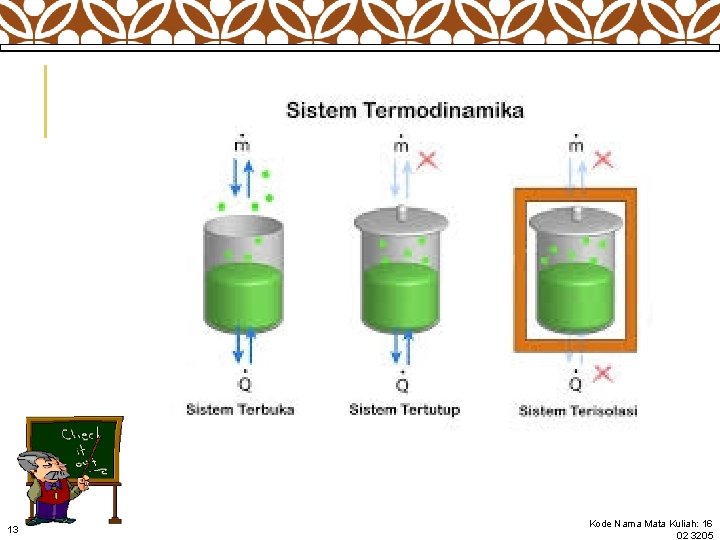
PERHATIKAN GAMBAR: Tabung berisi gas: Batas sistem gas lingkungan

v Sistem dapat berupa benda bebas yang sederhana atau kompleks seperti kilang minyak. v Segala sesuatu diluar sistem dikategorikan sebagai bagian dari Lingkungan (surrounding). v Sistem dan lingkungannya dipisahkan oleh batas sistem (boundary) yang dapat berada dalam kondisi diam ataupun bergerak. 9 1. Definisi Sistem v Sistem adalah Segala sesuatu yang ingin di pelajari

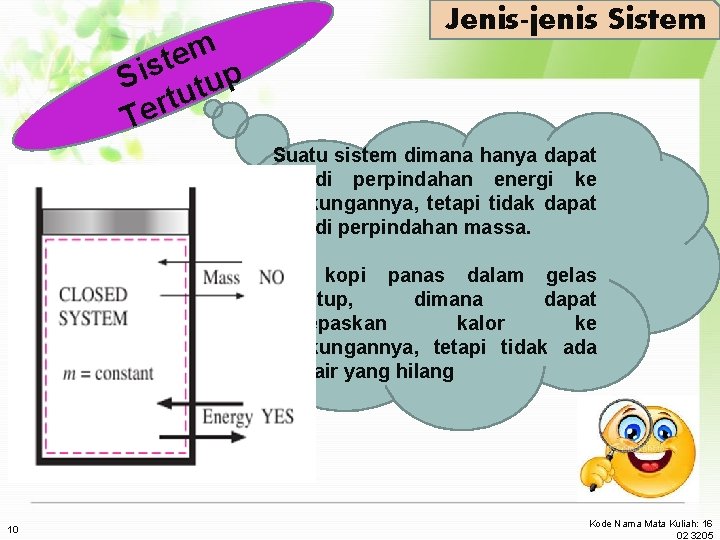
m e t s p Si u t r Te Jenis-jenis Sistem Suatu sistem dimana hanya dapat terjadi perpindahan energi ke lingkungannya, tetapi tidak dapat terjadi perpindahan massa. Ex: kopi panas dalam gelas tertutup, dimana dapat melepaskan kalor ke lingkungannya, tetapi tidak ada uap air yang hilang 10 Kode Nama Mata Kuliah: 16 02 3205

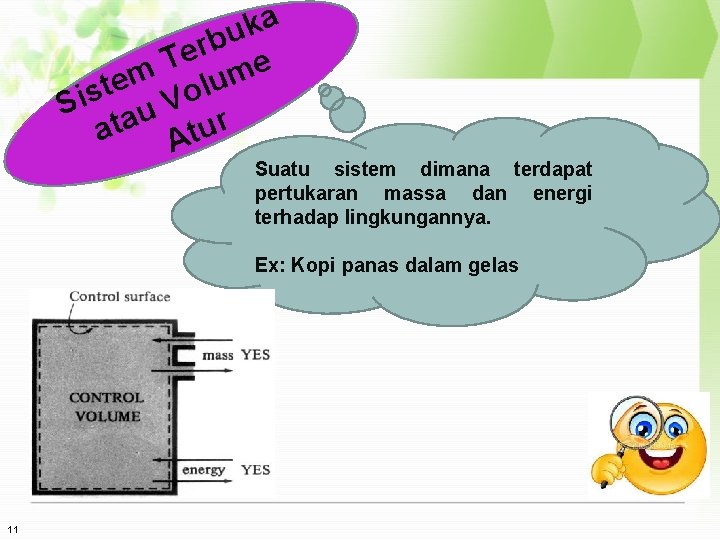
a k u b r e T e m lum e t Sis au Vo at Atur Suatu sistem dimana terdapat pertukaran massa dan energi terhadap lingkungannya. Ex: Kopi panas dalam gelas 11

m e t s Si olasi s i r Te Suatu sistem dimana tidak dapat terjadi perpindahan massa maupun energi ke lingkungannya. Ex: Kopi dalam termos 12 Kode Nama Mata Kuliah: 16 02 3205

13 Kode Nama Mata Kuliah: 16 02 3205

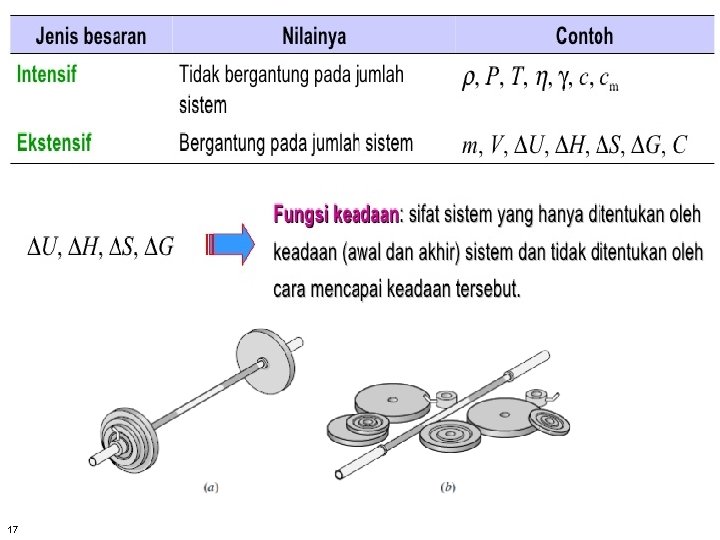
2. SISTEM DAN PERILAKUNYA PROPERTY Sifat (property) adalah segala sesuatu yang berada dalam sistem. Ex: massa, volume, energi, temperatur STATE Keadaan (state) adalah kondisi sistem yang dapat ditentukan oleh sifatnya. Ex : steady state dan unsteady state SIKLUS TERMODINAMIKA Merupakan suatu urutan proses yang berawal dan berakhir pada keadaan yang sama. Ex : Uap air yang bersikulasi dalam suatu unit pembangkit listrik. 14 Kode Nama Mata Kuliah: 16 02 3205

HUKUM TERMODINAMIKA DIBAGI 2 YAITU : v. Hukum pertama, yaitu : prinsip kekekalan energi yang memasukkan kalor sebagai mode perpindahan energi. v. Hukum kedua, yaitu : bahwa aliran kalor memiliki arah, dengan kata lain, tidak semua proses di alam adalah reversibel (dapat dibalikkan arahnya)

USAHA, KALOR, DAN ENERGI DALAM Pengertian Usaha dan Kalor. ØUsaha adalah: ukuran energi yang dipindahkan dari sistem ke lingkungan atau sebaliknya. ØEnergi mekanik sistem adalah : energi yang dimiliki sistem akibat gerak dan koordinat kedudukannya.

17

PENGERTIAN ENERGI DALAM ØEnergi dalam adalah : suatu sifat mikroskopik zat, sehingga tidak dapat di ukur secara langsung. ØSecara umum perubahan energi dalam ( U), di rumuskan : U = U 2 – U 1

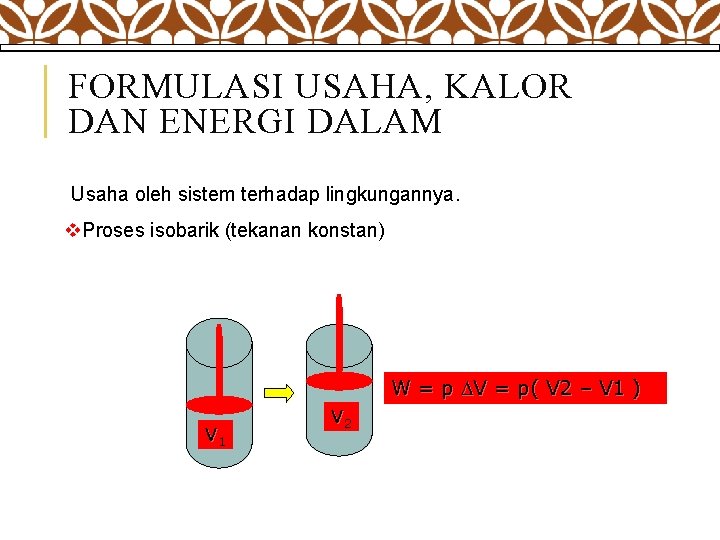
FORMULASI USAHA, KALOR DAN ENERGI DALAM Usaha oleh sistem terhadap lingkungannya. v. Proses isobarik (tekanan konstan) W = p V = p( V 2 – V 1 ) V 1 V 2

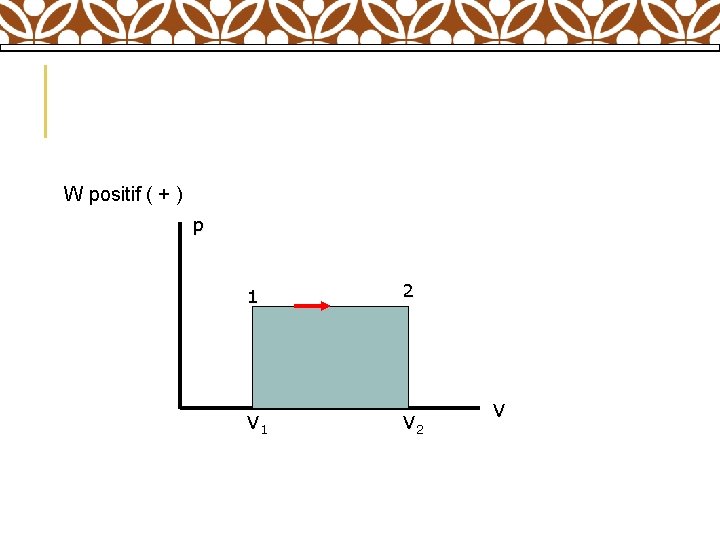
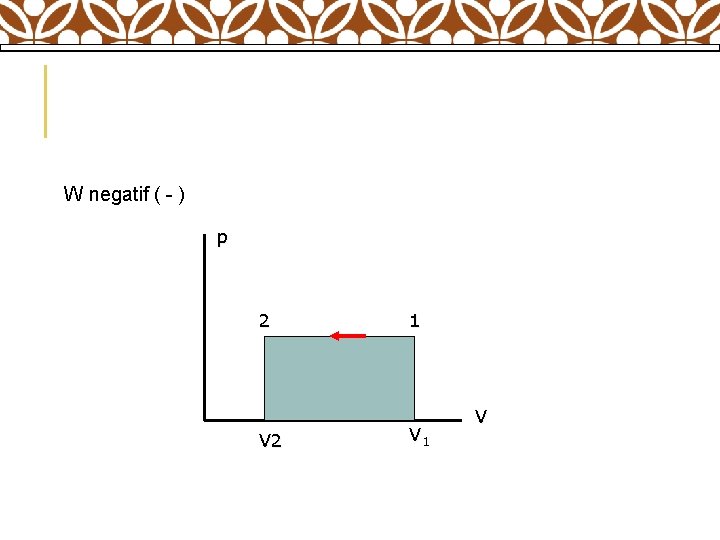
Perjanjian tanda : ØUsaha bertanda positif (+), jika sistem melakukan usaha pada lingkungan (gas memuai V 2 > V 1). ØUsaha bertanda negatif (-), jika lingkungan melakukan usaha pada sistem ( gas memampat V 2 V 1 ).

CONTOH SOAL 1 Sejenis gas berada dalam wadah yang memiliki volum 2 m 3 dan tekanan 4 atm. Hitung usaha luar yang dilakukan gas jika : a. Gas memuai pada tekanan tetap sehingga volumnya mejadi dua kali semula. b. Gas dimampatkan pada tekanan tetap sehingga volumnya mejadi sepertiga semula. (1 atm = 1, 0 x 105 N/m 2)

PENYELESAIAN v. Diket : V 1 = 2 m 3 p = 4 atm = 4 x 105 N/m 2 v. Ditanya : W, jika: a. V 2 = 2 V 1 b. V 2 =

JAWAB : a. W = p V = p ( V 2 – V 1 ) = p ( 2 V 1 – V 1) = p. V 1 = ( 4 x 10 5 ) 2 W = 8 x 105 J

b. W = p V = p ( V 2 – V 1) = p ( 1/3 V 1 – V 1) = p (-2/3 )V 1 = (-2/3)p. V 1 = (-2/3) 4 x 10 5 x 2 W = - 5, 33 x 105 J

GRAFIK P - V Dari grafik diperoleh : ØUsaha yg dilakuka oleh atau pada sistem gas sama dg luas daerah di bawah grafik p-V dg batas volum awal dan volum akhir. p 1 p 2 Luas = usaha V 1 V 2

FASE (Phase) 26 FASE DAN ZAT MURNI Fase menggambarkan sejumlah materi yang homogen dalam komposisi kimia maupun struktur fisiknya, dimana seluruh materinya berada dalam keadaan padat, cair, uap atau gas. Ex: 1. cairan minyak dan air dalam sebuah gelas, maka terdapat cairan dua fase yang tidak dapat bersatu. 2. Alkohol dan air, jika disatukan maka akan membentuk cairan fase tunggal Kode Nama Mata Kuliah: 16 02 3205

Zat Murni (Pure Substance) Adalah Sesuatu yang memiliki komposisi kimia yang sama dan tetap. Zat murni bisa muncul dalam 1 atau lebih fase, namun komposisi kimianya harus sama dan tetap di setiap fasenya. Ex: Cairan air dan uap air akan membentuk sistem berfase dua, namun kandungan kimianya tetap sama, H 2 O 27

Kesetimbangan (equilibrium) Dalam termodinamika, dikenal beberapa macam keadaan setimbang, antara lain: Ø keadaan setimbang mekanik Ø keadaan setimbang termal, dan Ø keadaan setimbang kimiawi 28 Kesetimbangan mekanik, yaitu kesetimbangan yang terjadi apabila tekanan di setiap titik di dalam sistem mempunyai harga yang konstan. Kesetimbangan termal, yaitu kesetimbangan yang terjadi apabila temperatur di setiap titik di dalam sistem mempunyai harga sama. Kesetimbangan kimiawi, yaitu kesetimbangan yang terjadi apabila struktur materi (komposisi) di dalam sistem tidak berubah. Kode Nama Mata Kuliah: 16 02 3205

contoh sederhana berkaitan dengan perpindahan energi antara sistem dan lingkungan yang melibatkan Kalor dan Kerja: Proses Pembuatan Popcorn 29

CONTOH SOAL 2 Sejumlah gas pada keadaan A berubah ke keadaan B (lihat gambar). a. Bagaimana cara anda menghitung usaha luar yang dilakukan gas ? b. Hitung usaha luar tersebut. p (x 105 N/m 2) 5 A B 2 8 36 V(x 10 -3 m 3)

PENYELESAIAN : a. U = luas trapesium b. Usaha luar:

USAHA DALAM PROSES SIKLUS Dari grafik diperoleh: p “usaha yang dilakukan oleh (atau pada) sistem gas yang menjalani suatu proses siklus sama dengan luas daerah yang dimuat oleh siklus tersebut (luas daerah yg diasir)” Lintasan 1 A B Lintasan 2 V

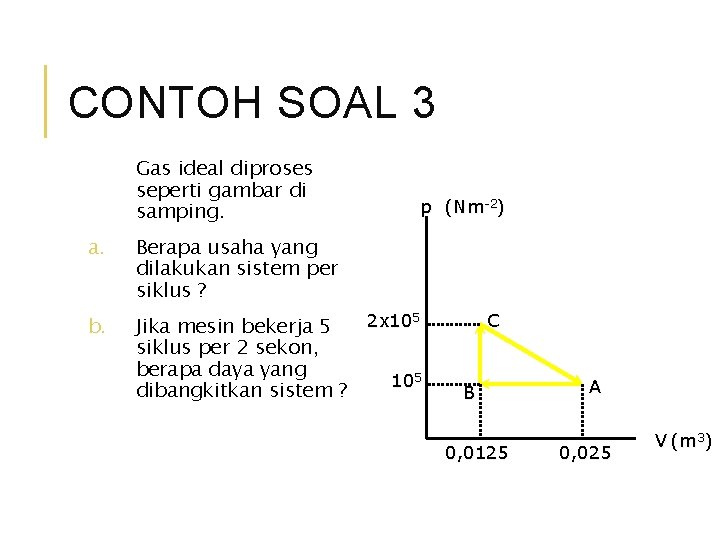
CONTOH SOAL 3 Gas ideal diproses seperti gambar di samping. a. Berapa usaha yang dilakukan sistem per siklus ? b. Jika mesin bekerja 5 siklus per 2 sekon, berapa daya yang dibangkitkan sistem ? p (Nm-2) 2 x 105 C B 0, 0125 A 0, 025 V (m 3)

PENYELESAIAN : a. Usaha yg dilakukan sistem per siklus. W = luas ABC = AB x BC/2 = ( 0, 0125 – 0, 025) x (2 x 105 – 1 x 105)/2 = (- 0, 0125) x (1/2) x 105 = - 0, 00625 x 105 W = - 6, 25 x 102 J

b. Usaha dlm 5 siklus = 5 x – 6, 25 x 102 = - 3, 125 x 103 J maka daya selama 2 sekon adalah :

q. Formulasi Kalor Q = mc T = C T q. Formulasi Energi Dalam v. Gas monoatomik

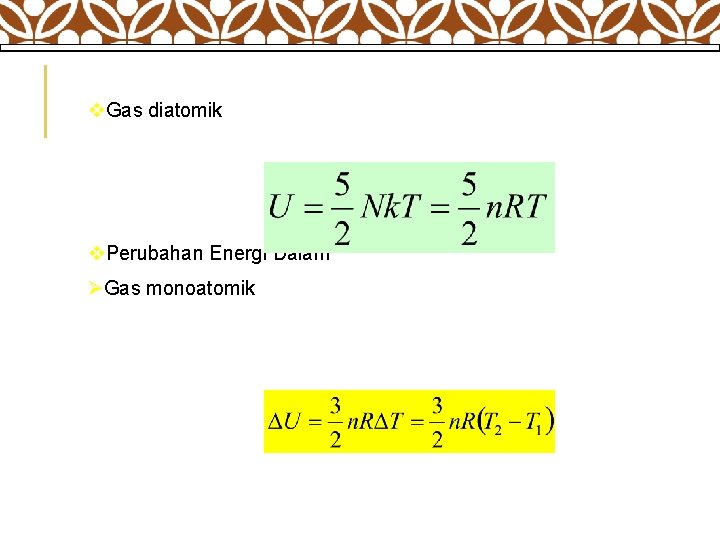
v. Gas diatomik v. Perubahan Energi Dalam ØGas monoatomik

ØGas diatomik ØDari dua persamaan perubahan energi dalam di atas dapat disimpulkan : “Perubahan energi dalam U hanya bergantung pada keadaan awal dan keadaan akhir dan tidak bergantung pada lintasan yang ditempuh oleh sistem”

BEBERAPA PROSES TERMODINAMIKA GAS Proses Isobarik ( tekanan tetap ) A. Usaha yang dilakukan oleh sistem terhadap lingkungan (V 2 > V 1). W = p ( V 2 – V 1)

W positif ( + ) p 1 2 V 1 V 2 V

B. Usaha yang dilakukan lingkungan terhadap sistem (V 2 V 1). W = p ( V 2 – V 1 )

W negatif ( - ) p 2 V 2 1 V

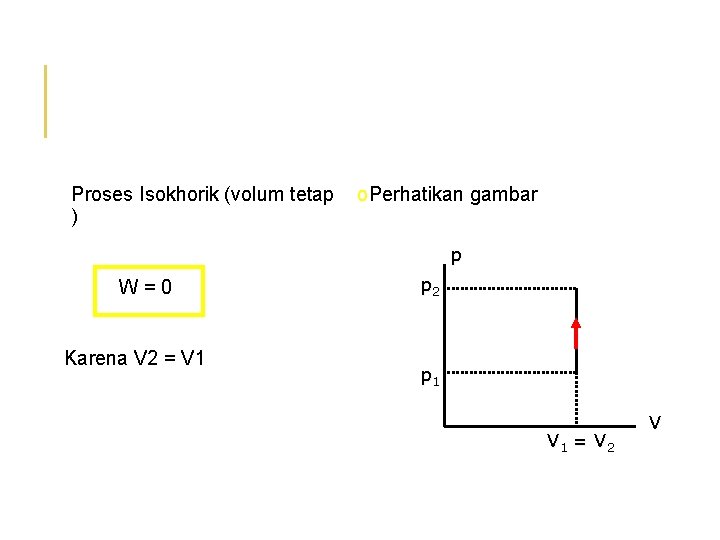
Proses Isokhorik (volum tetap o. Perhatikan gambar ) p W = 0 Karena V 2 = V 1 p 2 p 1 V 1 = V 2 V

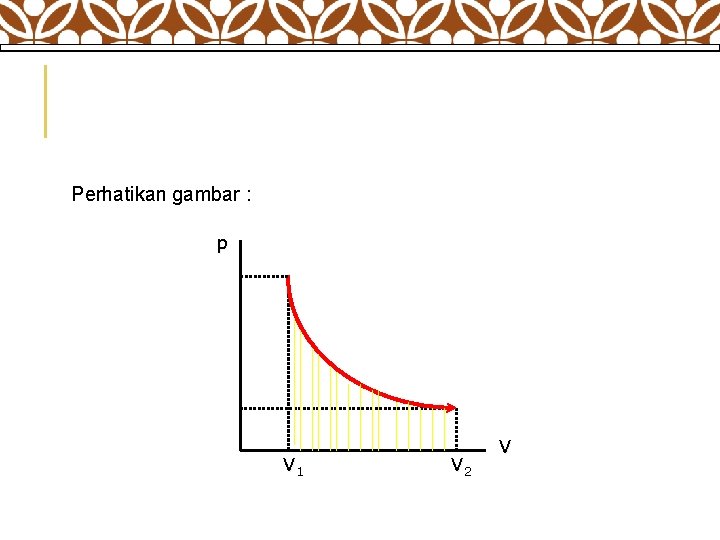
Proses Isotermal ( suhu tetap ) Dari persamaan : p. V = n. RT diperoleh :

ØSehingga usaha yang dilakukan sistem (gas) dirumuskan :


Perhatikan gambar : p V 1 V 2 V

CONTOH SOAL 4 v. Suhu tiga mol suatu gas ideal 373 K. Berapa besar usaha yang dilakukan gas dalam pemuaian secara isotermal untuk mencapai empat kali volum awalnya ?

PENYELESAIAN ØDiket : n = 3 mol T = 373 K V 2 = 4 V 1 R = 8, 31 J/mol ØDitanya : W

ØJawab :

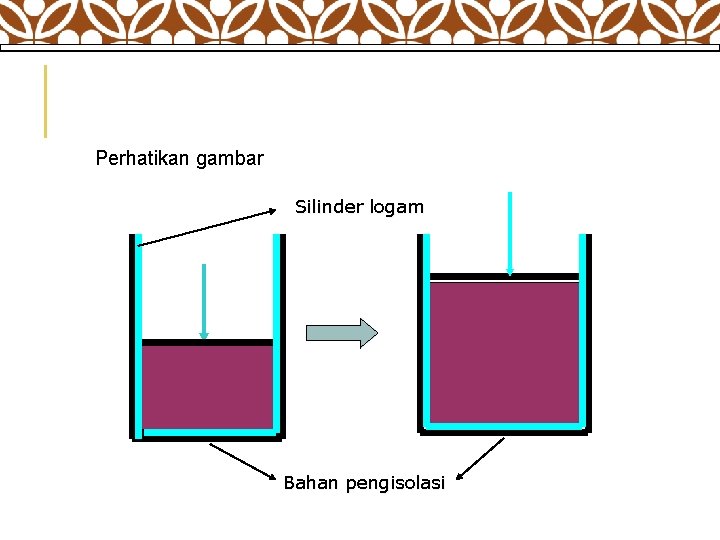
Proses Adiabatis adalah : suatu proses keadaan gas di mana tidak ada kalor yang masuk ke dalam atau keluar dari sistem ( Q = 0 )

Perhatikan gambar Silinder logam Bahan pengisolasi

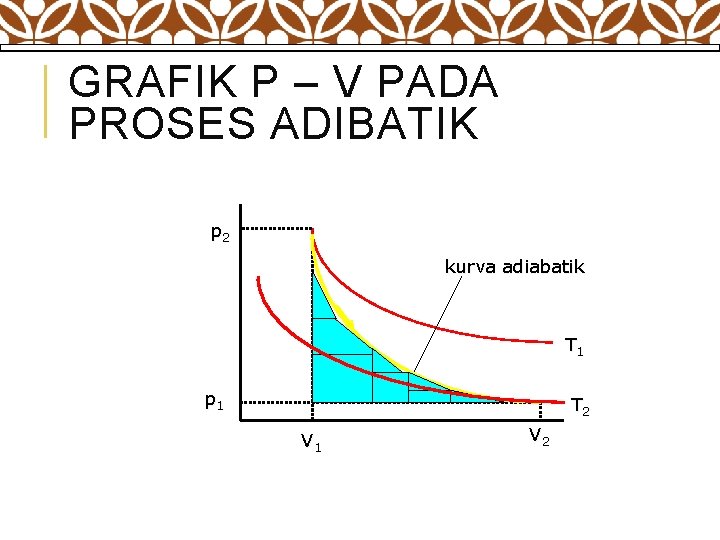
GRAFIK P – V PADA PROSES ADIBATIK p 2 kurva adiabatik T 1 p 1 T 2 V 1 V 2

Usaha dalam proses adiabatik secara matematis di rumuskan :

Contoh proses adiabatis: ØPemuaian gas dalam mesin diesel ØPemuaian gas dalam sistem pendingin ØLangkah kompresi dalam mesin pendingin

CONTOH SOAL 5 Suatu gas ideal monoatomik = 5/3 dimampatkan secara adiabatik dan volumnya berkurang dengan faktor pengali dua. Tentukan faktor pengali bertambahnya tekanan.

Diket : = 5/3 V 1 = 2 V 2 atau V 2 = (1/2)V 1 Ditanya : p 2

Jawab :

Dua Sifat Terukur Volume Spesifi k Tekana n 59 Volume yang dimiliki benda tiap per satuan massanya (kebalikan dari densitas) Gaya yang bekerja pada suatu bidang per satuan luas bidang tersebut

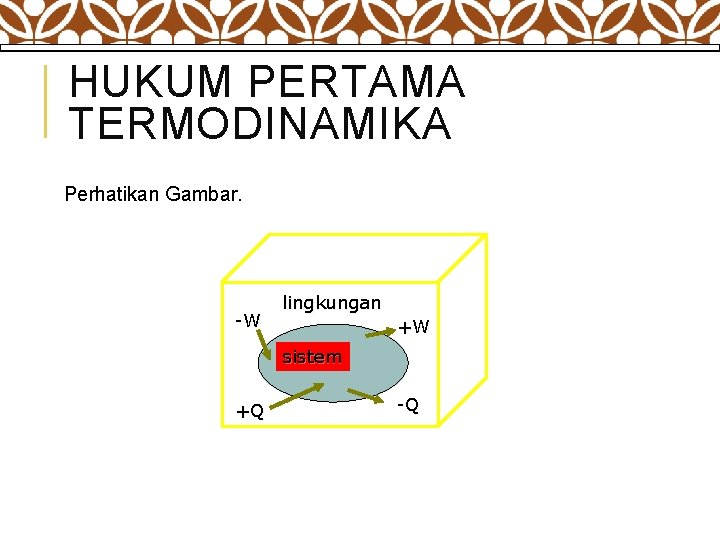
HUKUM PERTAMA TERMODINAMIKA Perhatikan Gambar. -W lingkungan +W sistem +Q -Q

Secara matematis hukum I Termodinamika, dirumuskan : U = U 2 -U 1= Q – W +Q = sistem menerima kalor -Q = sistem mengeluarkan kalor +W = sistem melakukan usaha -W = sistem dikenai usaha

CONTOH SOAL 6 v. Suatu sistem menyerap 1500 J kalor dari lingkungannya dan melakukan 2200 J usaha pada lingkungannya. Tentukan perubahan energi dalam sistem. Naik atau turunkah suhu sistem?

Diket : Q = 1500 J W = 2200 J Ditanya : U

Jawab : U = Q – W = 1500 – 2200 = - 700 J Karena energi dalam sistem bernilai negatif maka suhu sistem menurun (T 2 T 1)

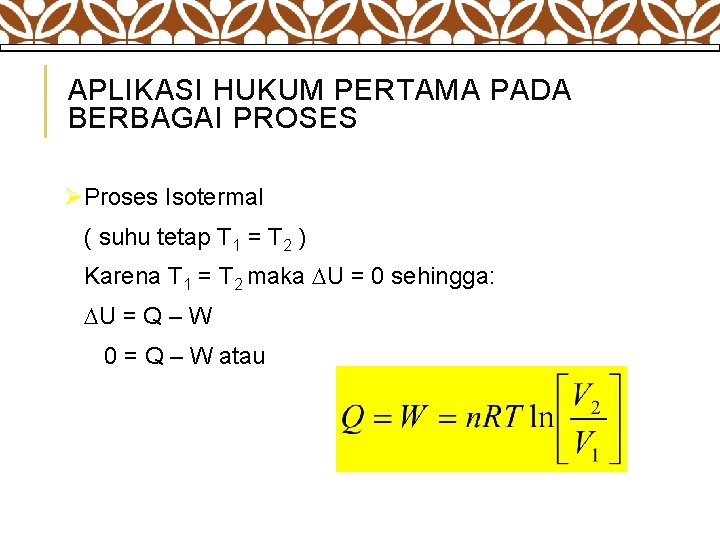
APLIKASI HUKUM PERTAMA PADA BERBAGAI PROSES ØProses Isotermal ( suhu tetap T 1 = T 2 ) Karena T 1 = T 2 maka U = 0 sehingga: U = Q – W 0 = Q – W atau

PROSES ISOKHORIK ( VOLUME TETAP ) Karena V = 0, maka W = 0 sehingga persamaannya menjadi: U = Q – W U = Q – 0 U = Q

PROSES ISOBARIK ( TEKANAN KONSTAN ) Dirumuskan : U = Q – W = Q – p ( V 2 – V 1 )

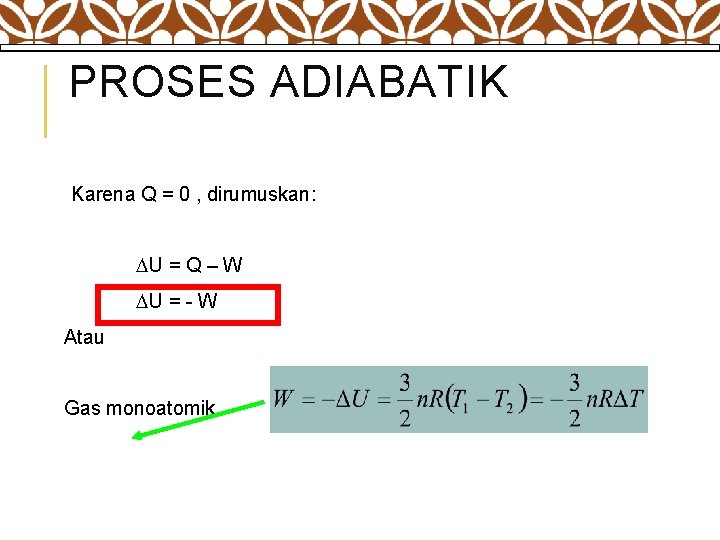
PROSES ADIABATIK Karena Q = 0 , dirumuskan: U = Q – W U = - W Atau Gas monoatomik

CONTOH Sebanyak 2, 4 mol gas oksigen (O 2) pada 47 o. C dimampatkan melalui proses adiabatik sehingga suhu mutlaknya meningkat menjadi tiga kali semula. Berapa besar usaha yang harus diberikan pada gas O 2? ( R = 8, 3 J mol-1 K-1).

PENYELESAIAN : Diket : n = 2, 4 mol T 1 = 47 + 273 = 320 K T 2 = 3 T 1 R = 8, 3 J. mol -1. K-1 Ditanya : W (gas diatomik)

Jawab :

KAPASITAS KALOR GAS Kapasitas kalor gas dirumuskan :

o. Kapasitas kalor pada tekanan tetap ( Cp ) adalah : kalor yg diperlukan untuk menaikkan suhu suatu zat satu kelvin pada tekanan tetap. dirumuskan :

o. Kapasitas kalor pada volume tetap ( Cv ) adalah : kalor yg diperlukan untuk menaikkan suhu suatu zat satu kelvin pada volume tetap. dirumuskan :

Usaha yang dilakukan pada tekanan tetap dirumuskan:

CONTOH Lima kilogram gas N 2 dipanaskan pada tekanan tetap sehingga suhunya naik dari 10 o. C menjadi 130 o. C. Jika Cv = 0, 177 kal/go. C dan Cp = 0, 248 kal/go. C, hitung : a. Kenaikan energi dalam. b. Usaha luar yang dilakukan gas.

Diket : m = 5 kg T 1 = 10 + 273 = 283 K T 2 = 130 + 273 = 403 K Cv = 0, 177 kal/go. C Cp = 0, 248 kal/go. C Ditanya : a. U b. W

Jawab : a. U = Qp – n. R (T 2 – T 1) = Cp (T 2 -T 1) – n. R(T 2 -T 1) = Cp (T 2 -T 1) – (Cp-Cv)(T 2 -T 1) =(Cp – Cp + Cv) (T 2 -T 1) = (Cv )(T 2 -T 1) = 0, 177 (403 – 283) = 0, 177 x 120 = 21, 24 kalori

b. W = (Cp – Cv) T = ( 0, 248 – 0, 177)120 = 0, 071 x 120 = 8, 52 kalori

KAPASITAS KALOR MOLAR ( CM ) Adalah : kalor yang diperlukan untuk menaikkan suhu satu mol zat dalam satu kelvin. Secara matematis dirumuskan :

v. Kapasitas molar pada tekanan tetap ( Cp, m ) dirumskan :

v. Kapasitas kalor molar pada volume tetap ( Cv, m ) dirumuskan :

Hubungan antara Cp, m dengan Cv, m. dirumuskan : Cp, m – Cv, m = R

KALOR JENIS GAS (C) Dirumuskan :

Kalor jenis gas pada tekanan tetap dan volume tetap. dirumuskan :

Hubungan antara cp dg cv dirumuskan :

CONTOH SOAL Kalor jenis nitrogen pada volume tetap Cv = 0, 177 kal. g-1 K-1. Jika massa molekul nitrogen adalah 28 kg. kmol-1, tentukan kalor jenis nitrogen pada tekanan tetap.

Diket : cv = 0, 177 kal. g-1 K-1 = 743, 4 J/kg. K M = 28 kg. kmol-1 R = 8314 J/kmol K 1 k = 4, 2 J Ditanya : cp

Jawab : cp – cv = R/M cp = R/M + cv cp = 8314/ 28 + 743, 4 cp = 296, 9 + 743, 4 cp = 1040, 3 J/kg. K

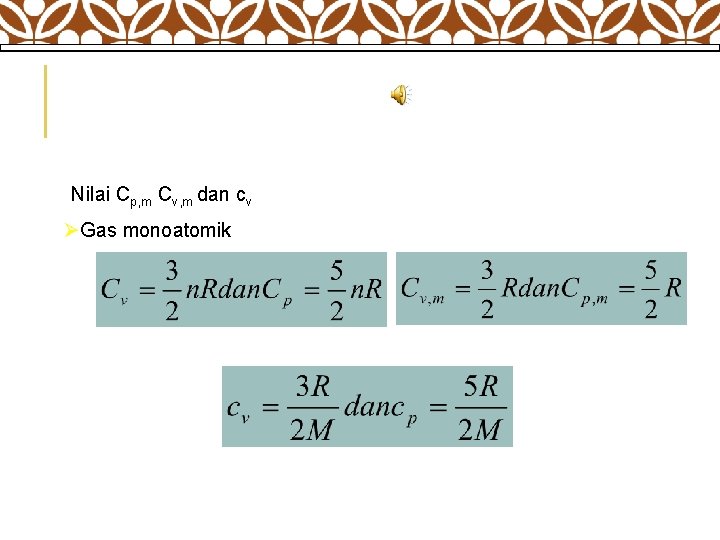
Nilai Cp, m Cv, m dan cv ØGas monoatomik

Tetapan Laplace dirumuskan :