Oxydation rduction Une oxydation est une perte dlectron





- Slides: 7

Oxydation, réduction… • Une oxydation est une perte d’électron Une réduction est un gain d’électron Réduction Ox + e— Red Oxydation (OIL) (l’oxydant fixe les électron) 3+ +les Fe 2+ Fe e—électrons) (le réducteur cède … oxydation Cu 2+ + e— Cu+ … réduction • Les couples redox sont toujours donnés dans le sens Ox/Red Fe 3+/Fe 2+ Cu 2+/Cu+ • IMPORTANT : penser H = H+ + e— Forme oxydée Forme réduite NAD+ + 2 H+ + 2 e— NADH + H+ « ajouter H revient à ajouter des électrons… Transporter des électrons peut se faire en transportant des H… »

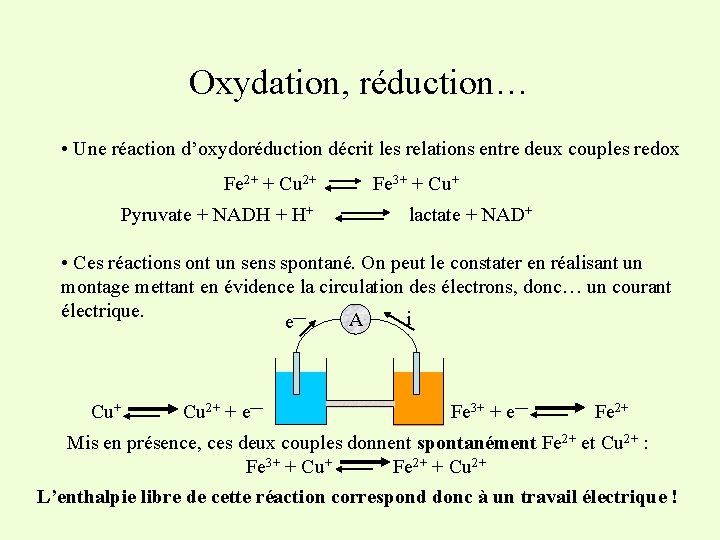
Oxydation, réduction… • Une réaction d’oxydoréduction décrit les relations entre deux couples redox Fe 2+ + Cu 2+ Pyruvate + NADH + H+ Fe 3+ + Cu+ lactate + NAD+ • Ces réactions ont un sens spontané. On peut le constater en réalisant un montage mettant en évidence la circulation des électrons, donc… un courant électrique. i A e— Cu+ Cu 2+ + e— Fe 3+ + e— Fe 2+ Mis en présence, ces deux couples donnent spontanément Fe 2+ et Cu 2+ : Fe 3+ + Cu+ Fe 2+ + Cu 2+ L’enthalpie libre de cette réaction correspond donc à un travail électrique !

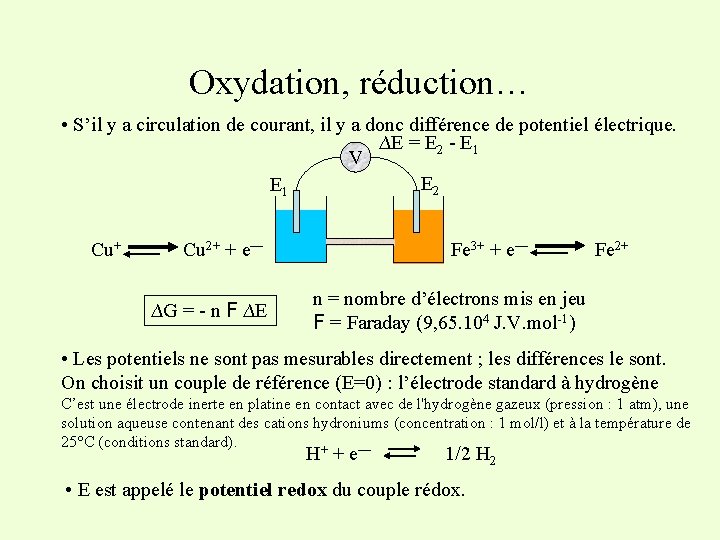
Oxydation, réduction… • S’il y a circulation de courant, il y a donc différence de potentiel électrique. ∆E = E 2 - E 1 V E 2 E 1 Cu+ Cu 2+ + e— ∆G = - n F ∆E Fe 3+ + e— Fe 2+ n = nombre d’électrons mis en jeu F = Faraday (9, 65. 104 J. V. mol-1) • Les potentiels ne sont pas mesurables directement ; les différences le sont. On choisit un couple de référence (E=0) : l’électrode standard à hydrogène C’est une électrode inerte en platine en contact avec de l'hydrogène gazeux (pression : 1 atm), une solution aqueuse contenant des cations hydroniums (concentration : 1 mol/l) et à la température de 25°C (conditions standard). + — H +e 1/2 H 2 • E est appelé le potentiel redox du couple rédox.

Potentiel rédox • Le potentiel redox décrit l’aptitude à capter les électrons (à être réduit) Fe 3+ + e— Cu 2+ + e— Fe 2+ Cu+ Eo= 0, 770 V Eo= 0, 158 V Le fer sera donc plus facilement réduit que le cuivre Mis en présence, ces deux couples donneront spontanément Fe 2+ et Cu 2+ : Fe 3+ + Cu+ Fe 2+ + Cu 2+ Si nous sommes dans les conditions standard : ∆E = 0, 770 - 0, 158 = 0, 612 V REMARQUE IMPORTANTE : ∆E >0, donc ∆G < 0 (ici = -59 k. J. mole-1) : réaction spontanée… Les électrons passent donc spontanément vers des potentiels rédox CROISSANTS

Loi de Nernst • Comme ∆G, le potentiel redox varie en fonction des conditions. On définit donc des conditions standards qui permettent d’obtenir E° (chimie) et E°’ (biologie) • Soit la réaction : ox 1 + red 2 (somme de : ox 1 + e— red 2 red 1 + ox 2 red 1 ox 1 + e—) Pour cette réaction : ∆G = ∆G°’ + RT ln K , avec K = ∆G = - n. F ∆E, et ∆G°’ = - n. F ∆E°’ D’où : (loi de Nernst) Pouvez-vous préciser ce « d’où » ? …

Loi de Nernst Réaction : ox 1 + red 2 red 1 + ox 2 ∆G = ∆G°’ + RT ln K , avec K = ∆G = - n. F ∆E, et ∆G°’ = - n. F ∆E°’ D’où : comme Il vient - n. F ∆E = - n. F ∆E°’ + RT ln K et ∆E = E 1 -E 2 (cf équation)

Petits calculs… Au cours de la respiration cellulaire se produit la réaction spontanée: 4 cytochrome c 2+ + 4 H+ + O 2 4 cytochrome c 3+ + 2 H 2 O Qui est oxydé ? Qui est réduit ? Les potentiels standards sont : E° = 0, 815 et E° = 0, 235 V A quoi correspondent-t-ils ? Demis réactions redox : O 2 + 2 H+ + 2 e— H 2 O cytochrome c 3+ + e— cytochrome c 2+ Donc au cours de la respiration : l’oxygène est donc réduit en eau, le cytochrome c est oxydé. Le plus fort potentiel correspond au couple qui accapare les électrons : O 2 /H 2 O a donc un potentiel rédox de 0, 815 cytochrome c 3+/ cytochrome c 2+ a un potentiel rédox de 0, 235 E O 2 /H 2 O Remarque : la « règle » du gamma pour prévoir le sens d’une réaction… cytochrome c 3+/ cytochrome c 2+