Oxigntartalm szerves vegyletek I Egyszer funkcis csoportot tartalmaz




























- Slides: 38

Oxigéntartalmú szerves vegyületek I. Egyszerű funkciós csoportot tartalmazó vegyületek Azok a szerves molekulák amelyekben szén- és hidrogénatomokon kívül oxigénatomot is tartalmazó funkciós csoport(ok) is van(nak). • Molekuláikban C, H és O atom található • Az oxigénatom a funkciós csoport részeként többféle módon épülhet be a molekulába • Funkciós csoport: olyan atomcsoport, amely a vegyület tulajdonságit meghatározza.

Az oxigéntartalmú szerves vegyületek csoportosítása p Egy oxigénatomos funkciós csoportot tartalmazó vegyületek n hidroxivegyületek R–OH hidroxilcsoport R–O–R étercsoport C=O oxocsoport alkoholok p fenolok p n p éterek oxovegyületek p aldehidek p ketonok R–CHO =O n formilcsoport R–C–R karbonilcsoport Összetett (oxigéntartalmú) funkciós csoportot tartalmazó vegyületek karboxilcsoport R–COOH n karbonsavak R 1–COO–R 2 észtercsoport n észterek

Hidroxivegyületek hidroxil-csoportot tartalmazó vegyületek —OH Funkciós csoport kapcsolódása alapján lehetnek: 1. 2. Alkoholok: a hidroxil-csoport telített vagy telítetlen szénatomhoz kapcsolódik Fenolok: a hidroxil-csoport aromás szénatomhoz kapcsolódik

Az alkoholok olyan szerves vegyületek, amelyek molekuláiban telített szénatomhoz kapcsolódó hidroxilcsoport van. R–OH R: alkilcsoport elnevezése • -ol végződést illesztünk a megfelelő szénhidrogén nevéhez. • A főlánc számozását azon a láncvégen kezdjük, melyhez a hidroxilcsoport közelebb esik. Pl. : 4 CH 3–OH metanol CH 3–CH 2–OH propan-1 -ol CH 3 2 1 CH 3–CH–CH–CH 3 3 OH 3 -metilbután-2 -ol

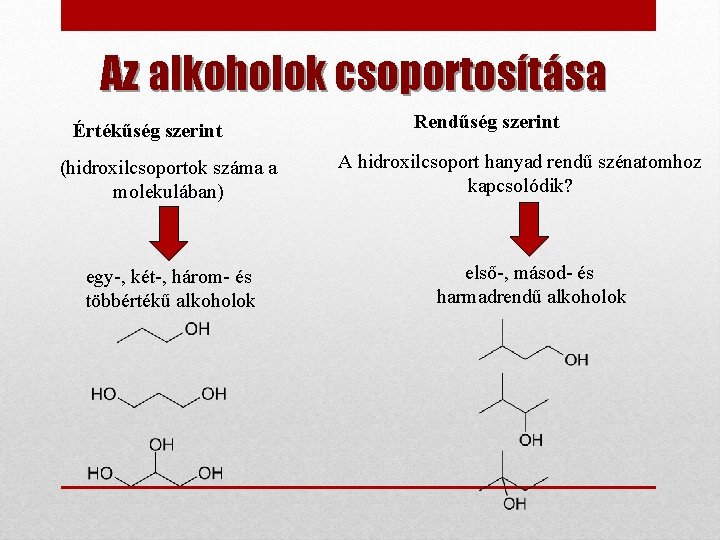
Az alkoholok csoportosítása Értékűség szerint (hidroxilcsoportok száma a molekulában) egy-, két-, három- és többértékű alkoholok Rendűség szerint A hidroxilcsoport hanyad rendű szénatomhoz kapcsolódik? első-, másod- és harmadrendű alkoholok

Az alkoholok fizikai tulajdonságai • Halmazállapotuk folyékony vagy szilárd növekedésével a halmazállapot szilárdul) (szénatom számuk • olvadáspontjuk a szénhidrogénekhez képest magasabb (oka: hidrogénkötés kialakítása) • oldhatóságuk vízben jó (szénatomszám növekedésével csökken) • jól oldódnak (szénatomok számától függetlenül) etanolban, éterben • tiszta alkoholok, ill. vizes oldatuk az elektromos áramot nem vezeti (az alkoholok vízben nem disszociálnak)

Az alkoholok kémiai tulajdonságai • vizes oldatuk semleges • alkáli- és alkáliföldfémekkel redoxireakcióba lépnek, hidrogén képződése közben 2 R-OH + 2 Na = 2 R-O- + 2 Na+ + H 2 • melegítve éterre és vízre bomlanak 2 R-OH = R-O-R + H 2 O • enyhe oxidáció során megfelelő oxovegyületté (a primer alkoholok aldehiddé, a szekunderek ketonná) alakulnak át R-CH 2 OH + Cu. O = R-CH═O + Cu + H 2 O • Karbonsavakkal vízkilépéssel észtereket képeznek: R 1 -OH + R 2 -COOH = R 2 -C(═O)-O-R 1

Az alkoholok előállítása • telítetlen szénhidrogének vízaddíciójával CH 2═CH 2 + H 2 O = CH 3 -CH 2 -OH • alkoholátok vízben való oldásával R-ONa + H 2 O = R-OH + Na. OH felhasználása • vegyipari alapanyagként más oxigéntartalmú vegyületek előállítására • oldószerként • fagyálló folyadék • kozmetikai alapanyag • élelmiszeripar

Az alkoholok fontosabb képviselői Metanol (metil-alkohol, faszesz – CH OH) 3 • Színtelen, jellegzetes szagú, (standard körülmények között) kis sűrűségű folyadék • vízzel jól elegyedik • Kitűnő oldószer • Éghető: 2 CH 3 OH + 3 O 2 → 2 CO 2 + 4 H 2 O • Oxidálódva formaldehiddé, majd hangyasavvá alakul • Fontos vegyipari alapanyag és alternatív hajtóanyag. • Veszélyes méreg: 50 -75 g tiszta metanol elfogyasztása halálos

Az alkoholok fontosabb képviselői Etanol (etil-alkohol, borszesz – C H OH) 2 • • • 5 Színtelen, kellemes illatú folyadék. A víznél kisebb sűrűségű (0, 8 g/cm 3). Vízzel és apoláris oldószerekkel (benzin, toluol) is kitűnően elegyedik Viszonylag magas a forráspontja (78, 4 °C) Gyúlékony, meggyújtva kékes lánggal ég: C 2 H 5 OH + 3 O 2 → 2 CO 2 + 3 H 2 O • Vizes oldata semleges kémhatású • Nátriummal hidrogéngáz fejlődése közben reagál: 2 C 2 H 5 OH + 2 Na → 2 C 2 H 5 O- + 2 Na+ + H 2 • felhasználása: o szeszes italok o vegyipari alapanyag és oldószer (kozmetikai ipar, illatszeripar, lakkipar, bánat…) o gyógyászat: fertőtlenítés (a 70%-os etanol oldat már baktériumölő) o hajtóanyag (bioetanol) és adalék

Az alkoholok fontosabb képviselői glikol (C H O 2 • • 6 2 – etán-1, 2 -diol) színtelen, sűrűn folyó, édes ízű folyadék felhasználása: o PET palackok gyártása o fagyálló folyadékok glicerin (C H O - propán-1, 2, 3 -triol) 3 • • • 9 3 színtelen, sűrűn folyó, édes ízű folyadék nem mérgező a növényi olajok és állati zsírok egyik alkotórésze bőrápoló krémek fontos komponense fagyálló folyadékok alkotója

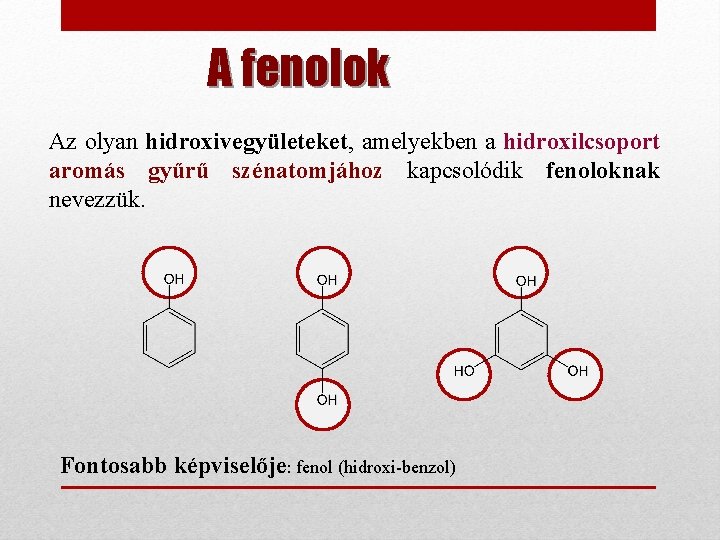
A fenolok Az olyan hidroxivegyületeket, amelyekben a hidroxilcsoport aromás gyűrű szénatomjához kapcsolódik fenoloknak nevezzük. Fontosabb képviselője: fenol (hidroxi-benzol)

A fenol fizikai tulajdonságai • Aromás szerkezetű, dipólusmolekula • Színtelen, szilárd, jellegzetes szagú, kristályos anyag. • MÉRGEZŐ • Vízben kis mértékben oldódik (a hidroxil-csoportnak köszönhetően). • Apoláris oldószerekben jól oldódik (a benzolgyűrű apoláris jellege miatt). • Op. , fp. : magas, a molekulák közt kialakuló hidrogénkötések miatt.

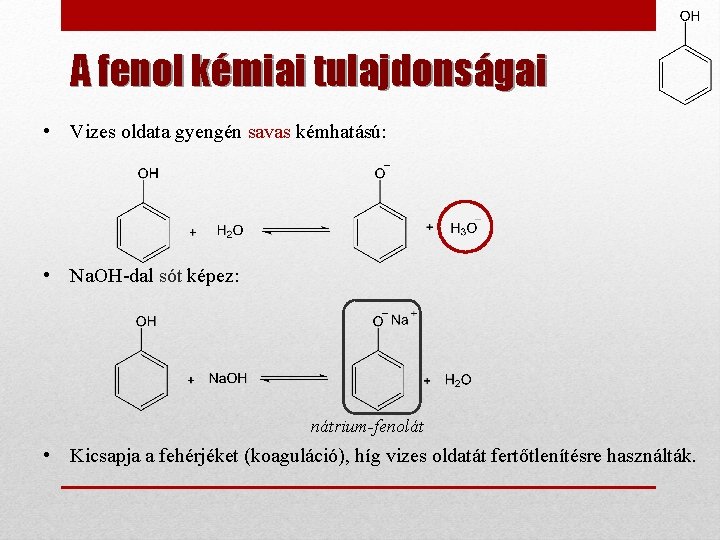
A fenol kémiai tulajdonságai • Vizes oldata gyengén savas kémhatású: • Na. OH-dal sót képez: nátrium-fenolát • Kicsapja a fehérjéket (koaguláció), híg vizes oldatát fertőtlenítésre használták.

A fenol Előfordulása: • kőszénkátrányban • fenyőfa törzse és tűlevele is tartalmazza • vegyületeiben igen elterjedt (lignin) Előállítása: • Régen a kőszénkátrányból nyerték ki desztillációval. • Ma elsősorban benzolból gyártják.

A fenol Felhasználása: • Fontos műanyagipari kiindulási anyag (pl. polikarbonát). • Számos aromás vegyület (festék, gyógyszer (pl. : aszpirin, torokfertőtlenítők), növényvédő szer, illatszer) nyersanyaga. Élettani hatása: • MÉRGEZŐ (kicsapja a fehérjéket!) • Bőrre kerülve fekélyt okoz

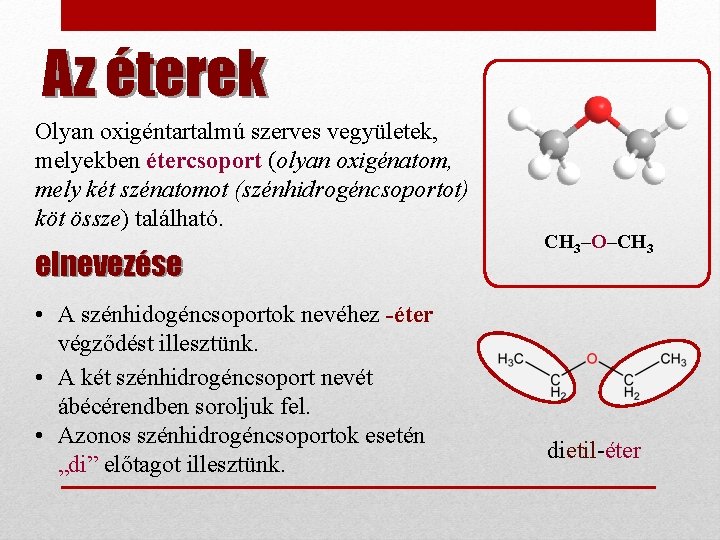
Az éterek Olyan oxigéntartalmú szerves vegyületek, melyekben étercsoport (olyan oxigénatom, mely két szénatomot (szénhidrogéncsoportot) köt össze) található. elnevezése • A szénhidogéncsoportok nevéhez -éter végződést illesztünk. • A két szénhidrogéncsoport nevét ábécérendben soroljuk fel. • Azonos szénhidrogéncsoportok esetén „di” előtagot illesztünk. CH 3–O–CH 3 dietil-éter

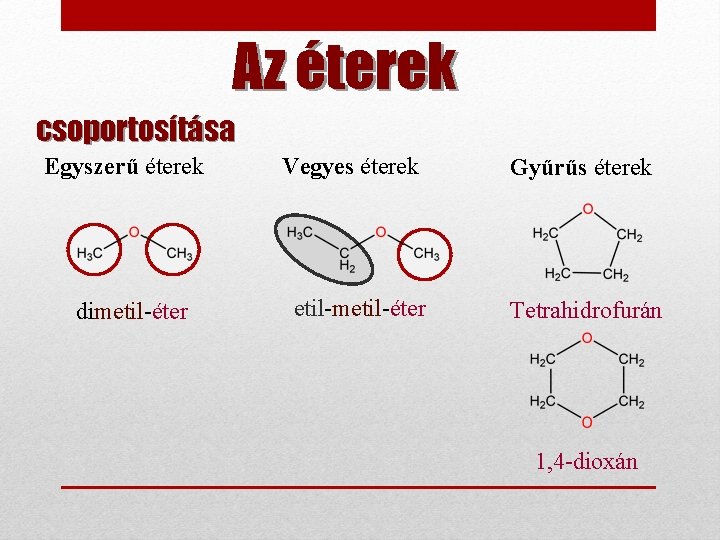
Az éterek csoportosítása Egyszerű éterek dimetil-éter Vegyes éterek etil-metil-éter Gyűrűs éterek Tetrahidrofurán 1, 4 -dioxán

Az éterek szerkezete • Az oxigén nem befolyásolja jelentősen a molekula alakját. • Az éterek molekulái gyakorlatilag apolárisak, kismértékben polárisak. • Összegképletük: Cn. H 2 n+2 O (az alkoholokkal szerkezeti izomerek) C 2 H 6 O

Az éterek tulajdonságai • Fizikai tulajdonságaik a szénhidrogénekéhez hasonló • Kisebb szénatomszámú éterek folyadékok (kivéve a dimetil-étert, amely gáz halmazállapotú), a nagyobb szénatomszámúak (17 -18 -tól) kristályosak • Forráspontjuk lényegesen alacsonyabb a megfelelő alkoholokénál (nem képesek hidrogén-kötés kialakítására) • Jó oldószerek

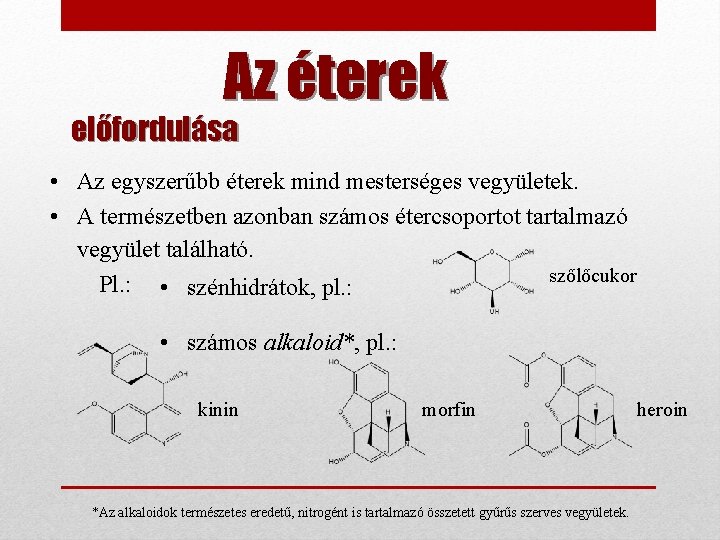
Az éterek előfordulása • Az egyszerűbb éterek mind mesterséges vegyületek. • A természetben azonban számos étercsoportot tartalmazó vegyület található. szőlőcukor Pl. : • szénhidrátok, pl. : • számos alkaloid*, pl. : kinin morfin *Az alkaloidok természetes eredetű, nitrogént is tartalmazó összetett gyűrűs szerves vegyületek. heroin

előállítása Az éterek • Az egyszerű (szimmetrikus) étereket alkoholból állítjuk elő vízelvonással: 2 R–OH (alkohol) R–O–R + H 2 O (éter) felhasználása • • vegyipari alapanyagok gyógyászatban (altató-, ill. bódítószerek) oldószerként kozmetikai készítmények (kéz- és fogkrémek)

Az éterek Fontosabb képviselői dietil-éter (C 2 H 5 -O-C 2 H 5) • • • gyorsan párolgó gyúlékony alacsony forráspontú folyadék oldószer (régen altatásra használták) tetrahidrofurán (C 4 H 8 O) • oldószer (PVC gyártás, lakkok) PEG: polietilén-glikol (C 2 H 4 O)n • • gyógyászat újratölthető elemek egyik fontos komponense PUR-ok (poliuretánok) rugalmas szegmense kéz- és fogkrémek fontos alkotója

Az oxovegyületek Olyan oxigéntartalmú szerves vegyületek, amelyekben oxocsoport található. Az oxocsoport kettős kötésű oxigénatom C=O A láncközi szénatomhoz kapcsolódó oxocsoportot tartalmazó vegyületeket ketonoknak nevezzük. CH 3–CH 2 C=O H R–CHO formilcsoport CH 3–CH 2 C=O =O A láncvégi szénatomhoz kapcsolódó oxocsoportot tartalmazó vegyületeket aldehideknek nevezzük. R–C–R karbonilcsoport

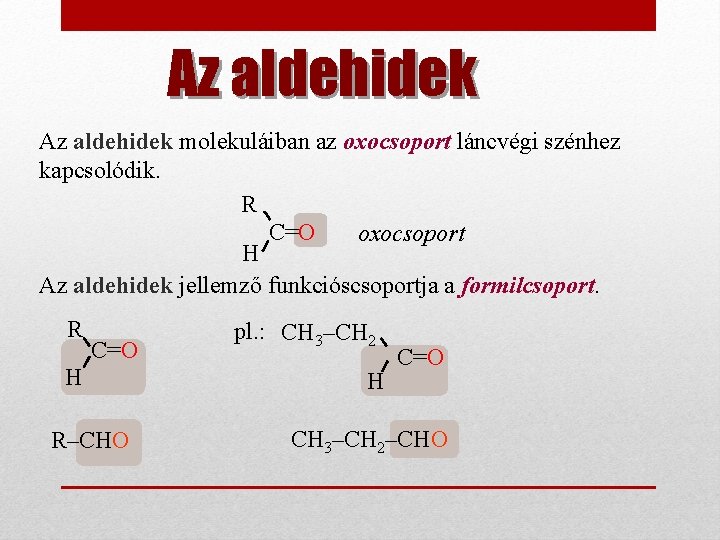
Az aldehidek molekuláiban az oxocsoport láncvégi szénhez kapcsolódik. R C=O oxocsoport H Az aldehidek jellemző funkcióscsoportja a formilcsoport. R C=O H R–CHO pl. : CH 3–CH 2 H C=O CH 3–CH 2–CHO

Elnevezése Az aldehidek • Az szénhidrogén nevéhez az –al végződést illesztjük. metanal propanal • A legfontosabb aldehideknek hétköznapi (régies) neve is van (és többnyire ezt használjuk). • metanal = formaldehid • etanal = acetaldehid • Az oxocsoport helyzetét nem kell számmal megadni… …

Az aldehidek Szerkezete • A formilcsoport poláris, ezért a kisszénatomszámú aldehidek dipólusmolekulák • Polaritása a szénatomok számától függ (a szénlánc növekedésével a szénhidrogénlánc apoláris jellege válik dominánssá) • A telített, egyértékű aldehidek homológsorának összegképlete (nyílt lánc esetében): Cn. H 2 n. O illetve Cx. H 2 x+1 -COH • A funkciós csoport mentén hidrogénkötés kialakítására képes apoláris CH 3–CHO CH 3–CH 2–CH 2–CHO poláris

Az aldehidek Fizikai tulajdonságok • A formaldehid (metanal) gáz halmazállapotú • A nagyobb (C 2 -C 11) szénatomszámúak folyékonyak vagy szilárdak • Forráspontjuk o a megfelelő szénhidrogénekénél magasabb (dipólus-dipólus kölcsönhatás) o a megfelelő alkoholokénál alacsonyabb (hidrogénkötés) • Vízben való oldhatóságuk a kisebb molekulák esetén jó (H-kötés), de nem korlátlan • A kis szénatomszámú aldehidek kellemetlen, szúrós szagú anyagok. • A C 8 -C 14 szénatomszámú aldehidek illatanyagok. fahéjaldehid vanillin

Az aldehidek Kémai tulajdonságok • Addícióra képesek • Vizes oldatuk kémhatása semleges. • Könnyen oxidálhatók karbonsavvá (tehát erélyes redukálószerek). • Az aldehidek redukciójakor elsőrendű (primer) alkoholok képződnek • Fontos kimutatási reakció: o ezüsttükör próba: 2 Ag+ + 2 OH- + HCOH = 2 Ag + HCOOH + H 2 O o Fehling reakció: 2 Cu 2+ + 4 OH- + HCOH = 2 Cu. OH* + HCOOH + H 2 O *A sárga csapadékból hevítés hatására vízvesztéssel vörös csapadék keletkezik 2 Cu. OH = Cu 2 O + H 2 O sárga csap. vörös csap.

Az aldehidek Előállításuk A telített, nyíltláncú aldehidek a megfelelő szénatomszámú elsőrendű alkoholok oxidációjával állíthatók elő. (alcohol dehidrogenatus = dehidrogénezett alkohol) Felhasználásuk • műanyaggyártás során (pl. fenoplasztok, karbamidgyanták) • színezékek gyártása • fertőtlenítés

Az aldehidek Fontosabb képviselői Formaldehid (metanal) • • • Színtelen, szúrós szagú, mérgező gáz. A fehérjéket kicsapja, ezért sejtméreg! Vízben jól oldódik. 40%-os vizes oldata a formalin. Adja az ezüsttükör-próbát és a Fehlingpróbát. • Kékes lánggal ég Acetaldehid (etanal) • • színtelen kellemetlen szagú folyadék forráspontja alacsony tulajdonságai a metanalhoz hasonlóak

A ketonok molekuláiban az oxocsoport láncközi vagy gyűrűs szénatomhoz kapcsolódik. R C=O oxocsoport R A ketonok jellemző funkcióscsoportja a karbonilcsoport. R R C=O pl. : CH 3–CH 2 C=O

Elnevezése A ketonok • Néhány esetben triviális nevet használunk (pl. aceton) • Az azonos szénatomszámú szénhidrogén nevéhez –on végződést illesztjük. • Az oxocsoport helyét az –on végződés elé tett számmal adjuk meg. VAGY • A karbonilcsoporthoz kapcsolódó szénhidrogéncsoportok nevét ábécérendben felsoroljuk és a –keton végződést illesztjük hozzájuk. O O O CH 3–C–CH 3 1 2 3 dimetil-keton CH 3–CH 2–CH 3 1 2 3 dietil-keton = Pent-1 -én-3 -on = pentán-3 -on = propán-2 -on CH 2=CH–C–CH 2–CH 3 1 2 3 etil-vinil-keton

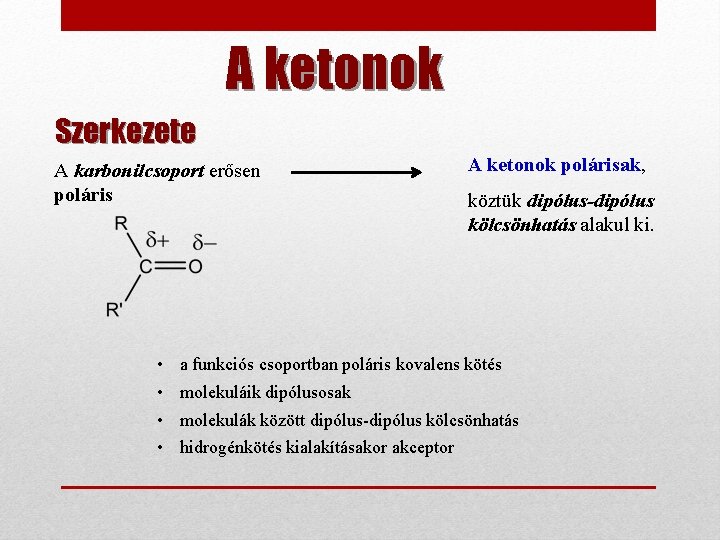
A ketonok Szerkezete A karbonilcsoport erősen poláris • • A ketonok polárisak, köztük dipólus-dipólus kölcsönhatás alakul ki. a funkciós csoportban poláris kovalens kötés molekuláik dipólusosak molekulák között dipólus-dipólus kölcsönhatás hidrogénkötés kialakításakor akceptor

A ketonok Fizikai tulajdonságok • A legkisebb vegyület halmazállapota folyadék • Olvadás- és forráspontjuk azonos szénatomszám esetén az étereknél és az észtereknél magasabb (erősebben dipólusosak). Nagy szénatomszám esetén a funkciós csoport hatása már elenyésző, ezért a nagy szénatomszámú vegyületek op. -ja jelentősen nem különbözik az azonos C-atomszámú szénhidrogénekétől. • Vízoldékonyság: az aceton esetében korlátlanul, a 4 -szénatomos már erősen korlátozottan oldódik. • A kismolekulájú vegyületek jellegzetes, édeskés szagúak.

A ketonok Kémiai tulajdonságok • Nehezebben oxidálhatók karbonsavakká mint az aldehidek. • Nem adják sem az ezüsttükör- sem a Fehling-próbát. • Az oxidáció C–C kötés hasadást eredményez. • A ketonok redukciójakor másodrendű (szekunder) alkoholok keletkeznek.

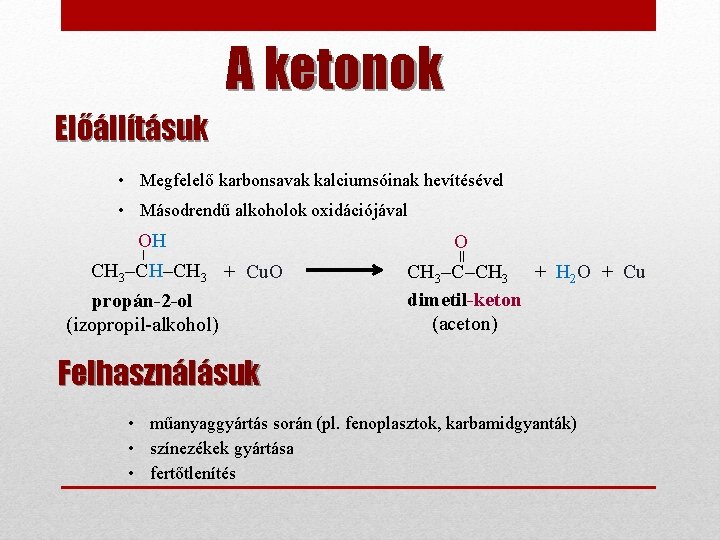
A ketonok Előállításuk • Megfelelő karbonsavak kalciumsóinak hevítésével • Másodrendű alkoholok oxidációjával O CH 3–C–CH 3 + H 2 O + Cu dimetil-keton (aceton) = – OH CH 3–CH–CH 3 + Cu. O propán-2 -ol (izopropil-alkohol) Felhasználásuk • műanyaggyártás során (pl. fenoplasztok, karbamidgyanták) • színezékek gyártása • fertőtlenítés

A ketonok Fontosabb képviselői • Aceton (propanon, dimetil-keton) o o o kellemes szagú illékony tűzveszélyes színtelen folyadék vízzel és szerves oldószerekkel is korlátlanul elegyedik jó oldószer (pl. : körömlakk lemosó) • Kámfor (izoprénvázas keton). • 1, 2 -benzokinon (o-benzokinon) • 1, 4 -benzokinon (p-benzokinon)