OXIANIONES Oxianiones Los oxianiones que aqu se consideran






































- Slides: 43

OXIANIONES

Oxianiones • Los oxianiones que aquí se consideran comprenden a los grupos de partículas representadas por la formula general: XOmn- • En donde X, que puede ser un metal o no metal, está enlazado en forma covalente a cierto numero de átomos de oxígeno. • La carga neta sobre las partículas depende del número de oxígenos y del estado de oxidación del átomo central.

Oxianiones • En forma más general, los oxianiones también incluyen a las series poliméricas: Xa. Omn- • En las cuales algunos de los oxígenos se encuentran unidos a dos átomos de X lo que crea una estructura tipo cadena.

Formación De Oxianiones • Los oxianiones pueden ser formados por varios elementos. • Excepciones: – Los gases inertes – El flúor (el único elemento más electronegativo que el oxígeno) – Los metales que forman solamente iones de bajo potencial iónico (grupo I y II y los miembros más grandes del grupo III) – Algunos metales inactivos – El oxígeno mismo.

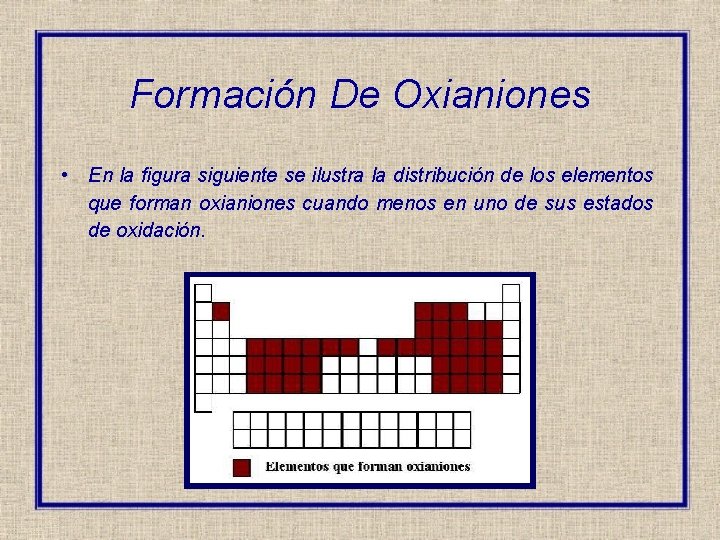
Formación De Oxianiones • En la figura siguiente se ilustra la distribución de los elementos que forman oxianiones cuando menos en uno de sus estados de oxidación.

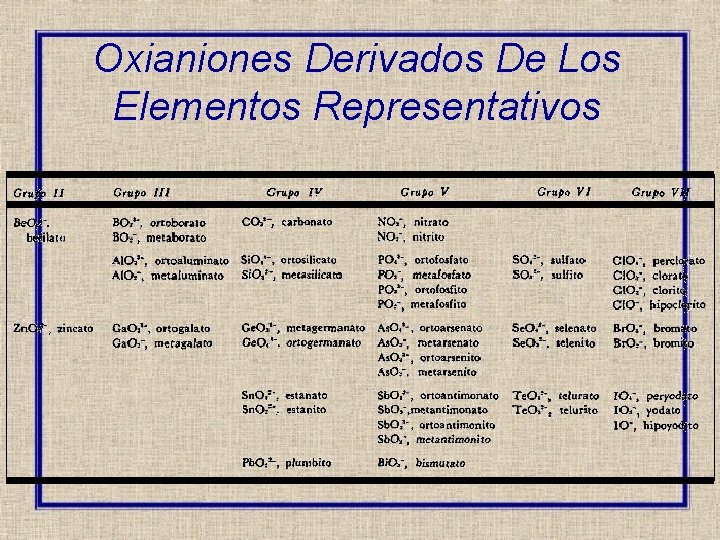
Oxianiones Derivados De Los Elementos Representativos

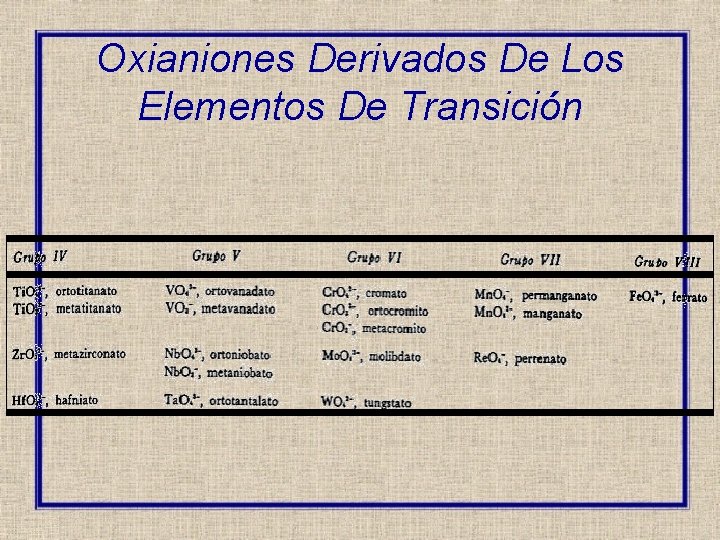
Oxianiones Derivados De Los Elementos De Transición

Formación De Oxianiones • Se sabe que uno o más de los oxígenos de un oxianión puede interaccionar con agua por eliminación de protones para producir los correspondientes grupos oxhidrilos enlazados al átomo central.

Formación De Oxianiones • El átomo central se puede coordinar con moléculas de agua adicionales por medio de reacciones de hidratación.

¿Cómo Se Nombran Los Oxianiones? • Al nombrar los oxianiones y sus compuestos es necesario distinguir entre los varios estados de oxidación observados; es el caso del cloro que forma cinco aniones. Cl-, Cl. O 2 -, Cl. O 3 -, Cl. O 4 - • Los diferentes oxianiones se nombran añadiendo varios sufijos y prefijos a la misma raíz. Cl. O 4 - Perclorato Cl. O 3 - Clorato Cl. O 2 - Clorito Cl. O- Hipoclorito

Estado De Oxidación

Del Átomo Central • Cuando se asignan números de oxidación a los oxianiones: – Se le atribuye al oxígeno el par electrónico compartido con el átomo central. – Así en la práctica el átomo central siempre tiene un número de oxidación positivo. • Obteniendo, números de oxidación nones para los halógenos y en caso de aumentar o disminuir los oxígenos unidos, cambia el número de electrones de valencia asignado al halógeno de dos en dos.

Elementos Del Grupo IV • Tienen un número par de electrones de valencia por lo que tienen un número de oxidación par positivo en sus oxianiones. • Se observan sólo los estados VI y IV, como se muestra con el azufre: • Las estructuras electrónicas del selenio y telurio son similares.

Elementos Del Grupo V • Con número non de electrones de valencia, adquieren números de oxidación nones en los oxianiones, como se puede observar con el fósforo: • Se observan estructuras electrónicas similares para los oxianiones del arsénico y antimonio, pero no para el nitrógeno.

Nitrógeno • Está unido a un oxígeno menos que los otros elementos del grupo V en los correspondientes estados de oxidación. • La estructura resonante del ion nitrato se representa por las tres estructuras electrónicas formales: • Está en el estado de oxidación (V), ya que todos los electrones se le asignan formalmente a los oxígenos (-II). • En la estructura del ion nitrito, el nitrógeno tiene un estado de oxidación (III).

Fósforo, Arsénico Y Antimonio • Forman oxianiones que tienen la misma formula empírica del nitrato y del nitrito (PO 3 -, As. O 3 -, Sb. O 3 -, PO 2 -, As. O 2 - y Sb. O 2 -), pero estos iones son poliméricos con formulas moleculares (PO 3 -)x, (PO 2 -)x, etc. • Las estructuras tienen cadenas largas con átomos de oxígeno y fósforo alternados. • Para un mismo estado de oxidación los dos tipos de estructuras se indican añadiendo a los nombres el prefijo: – -oto- para la estructura con uniones simples. – -meta- para las poliméricas. – Así PO 43 - es ion ortofosfato y (PO 3 -)x es ion metafosfato.

Elementos Del Grupo IV • Presentan los estados de oxidación (II) y (IV). • La transición de comportamiento no metálico a metálico desde el carbono hasta el plomo se refleja en las diferentes estabilidades de los dos estados de oxidación observados en los oxianiones. • Carbono, silicio y germanio muestran sólo el estado (IV); estaño y plomo forman oxianiones en ambos estados (II) y (IV).

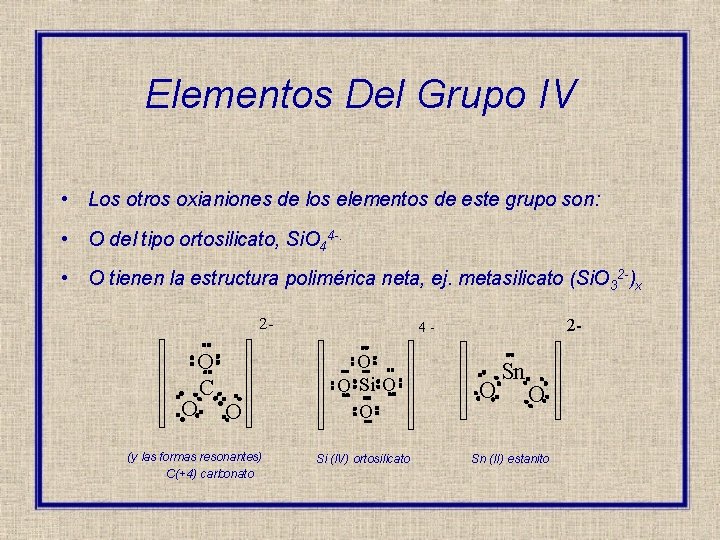
Elementos Del Grupo IV • Los otros oxianiones de los elementos de este grupo son: • O del tipo ortosilicato, Si. O 44 -. • O tienen la estructura polimérica neta, ej. metasilicato (Si. O 32 -)x 2 - O C O O (y las formas resonantes) C(+4) carbonato 2 - 4 - O O Si (IV) ortosilicato O Sn (II) estanito

Los Metales De Transición • Las estructuras de sus oxianiones no se representan fácilmente con fórmulas electrónicas. • Excepto para aquellos en los cuales el metal está en su máximo estado de oxidación.

Los Metales De Transición • En la serie Ti. O 44 -, VO 43 -, Cr. O 42 -, Mn. O 4 -, el estado de oxidación del átomo central es igual a su número de grupo.

Oxianiones Formados Por Los Metales De Transición • Las fórmulas electrónicas son menos útiles, ya que no se aplica la saturación de valencia. Algunos ejemplos de estos iones son Fe. O 42 -, Co. O 3 -, Cr. O 33 -. • Entre los elementos del mismo grupo hay semejanzas muy marcadas en los estados de oxidación máximos. También se puede observar que dos iones del mismo grupo, pero de diferentes familias como: Cr. O 42 - – SO 42 -, Mn. O 4 - – Cl. O 4 - , VO 43 - – PO 43 - , y Ti. O 44 - – Si. O 44 - • Se parecen mucho entre sí en ciertas propiedades tales como fuerza de oxidación y solubilidad de sus sales

Fuerza De Los Oxiácidos • El grado de disociación de los oxiácidos se determina por el equilibrio siguiente. H 2 O + Hn. XOm H 3 O+ + Hn-1 XOm • El grado de transferencia de protones al agua en el equilibrio se puede correlacionar con la estructura y el potencial iónico del ion central, Xn+, en donde n es el estado de oxidación.

Fuerza De Los Oxiácidos • Considerando la estructura general • La ruptura de la unión X-O es característica del comportamiento básico y la ruptura de la unión O-H es peculiar del comportamiento ácido. • Cuando ambas uniones se pueden romper por tratamiento con un reactivo adecuado esta sustancia es anfótera. • La unión O-H se rompe más fácil cuando X tienen un potencial iónico alto.

Fuerza De Los Oxiácidos • Para los oxiácidos de un elemento dado, mientras mayor sea el estado de oxidación, más fuerte es el ácido, ya que el potencial iónico aumenta con el estado de oxidación. HCl. O 4 > HCl. O 3 > HCl. O 2 > HCl. O HNO 3 > HNO 2 H 2 SO 4 > H 2 SO 3

Fuerza De Los Oxiácidos • Si dentro de un grupo periodico se considera a los ácidos cuyos átomos centrales tienen el mismo estado de oxidación, el primer miembro de dicho grupo forma el oxiácido más fuerte: HCl. O 3 > HBr. O 3 > HIO 3 H 2 SO 4 > H 2 Se. O 4 > H 6 Te. O 6

Fuerza De Los Oxiácidos • Tambein se pueden comparar las fuerzas de los ácidos formados por los elementos de un periodo dado, en donde cada uno está en su estado de oxidación máximo: HCl. O 4 > H 2 SO 4 > H 3 PO 4 > H 4 Si. O 4 HNO 3 > H 2 CO 3 > H 3 BO 3 H 3 Se. O 4 > H 3 As. O 4 > H 2 Ge. O 3

Constantes De Ionización De Algunos Ácidos

Fuerza De Los Oxiácidos • A parir de la aplicación del principio de elctroneutralidad a los oxianiones se deduce una regla práctica, útil para diferenciar cualitativamente entre ácidos fuertes y débiles. • Se observa que los oxianiones que tienen un carga ionica menor de ½- por átomo de oxígeno forman ácidos fuertes, los que tienen más de ½- dan ácidos débiles y los que tienen exactamente ½- pueden ser débiles o fuertes

Comportamiento De Oxianiones En Solución Acuosa • Los oxianiones interaccionan de manera diferente con moléculas de agua, iones H+ y OH -, dependiendo de: – – • El tamaño. La carga del átomo central. El número de átomos de oxígeno unidos. La carga iónica. Si las uniones entre el átomo central y los oxígenos tiene suficiente polaridad para que dicho átomo sea neutro, se puede aplicar directamente el principio de electroneutralidad para determinar la carga residual sobre cada oxígeno.

Comportamiento De Oxianiones En Solución Acuosa Por ejemplo: – Los átomos de oxígeno en los iones perclorato, ortofosfato y ortoarsenito tienen las cargas ¼-, ¾- y 1 - respectivamente, lo que explica la carga negativa del ion. – La atracción de estos iones por centros de carga positiva aumenta en la misma proporción.

Comportamiento De Oxianiones En Solución Acuosa • En solución básica: – La concentración del ion hidronio es muy baja. – Los protones disponibles son aquellos de las moléculas de agua. – Las interacciones posibles son: 1. Una reacción de hidrólisis en la cual los oxígenos se convierten en grupos OH-: PO 43 - + H 2 O HOPO 32 - + OHSi. O 44 - + H 2 O HOSi. O 33 - + OH-

Comportamiento De Oxianiones En Solución Acuosa 2. Una reacción de hidratación que también convierte los átomos de oxígeno en OH-, pero con un aumento en el número de coordinación del átomo central: Sn. O 22 - + 2 H 2 O Sn(OH)42 Zn. O 22 - + 2 H 2 O Zn(OH)42 - • Los dos tipos de reacciones pueden presentarse simultaneamente como en: Sb. O 43 - + 4 H 2 O Sb(OH)6 - + 2 OH-

LOS OXIANIONES COMO AGENTES OXIDANTES • Los oxianiones son de los agentes oxidantes más útilies. • Se utilizan oxianiones de metales para oxidar no-metales, ya que los productos de la oxidación del no-metal y el oxoanión se separan fácilmente: Cr 2 O 72 - + 6 Cl- + 14 H+ 2 Cr 3+ + 3 Cl 2 + 7 H 2 O

LOS OXIANIONES COMO AGENTES OXIDANTES • Usualmente esta reacción se efectúan en solución ácida, en donde el potencial de reducción del oxianión es mucho mayor. • Esto se aclara examinando las medias reacciones de reducción, por ejemplo:

LOS OXIANIONES COMO AGENTES OXIDANTES • El proceso implica eliminar los oxígenos del oxianión. • El ion hidrógeno ayuda a lograr este proceso, ya que se forma agua como producto; el ion OH favorece el proceso inverso. • Por ejemplo:

LOS OXIANIONES COMO AGENTES OXIDANTES • Cuando todas las concentraciones son igual a uno, el potencial de la media celda es el potencial normal, ya que log 1= 0, pero la concentración de H+ varía, entonces la ecuación se reduce a: • A PH = 0 (H+ = 1 M), E = 0. 96 v, pero a p. H = 7 E = 0. 41 v

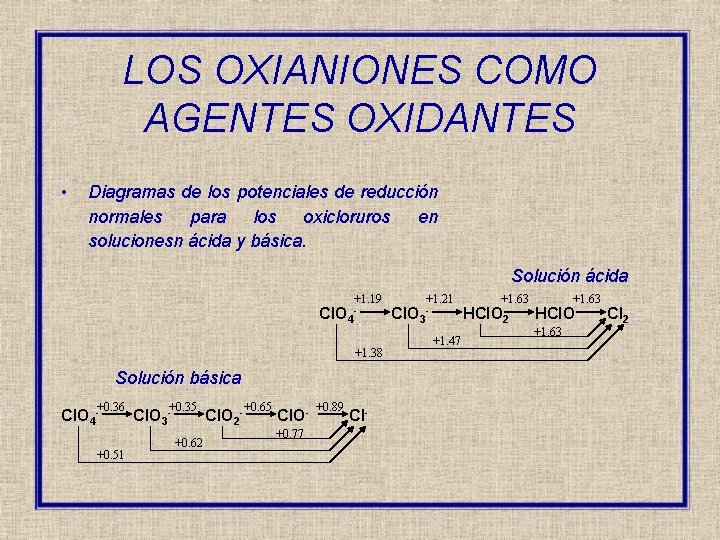
LOS OXIANIONES COMO AGENTES OXIDANTES • Diagramas de los potenciales de reducción normales para los oxicloruros en solucionesn ácida y básica. Solución ácida Cl. O 4 +1. 19 - +1. 38 Solución básica +0. 36 Cl. O 4 - +0. 51 +0. 35 Cl. O 3 - +0. 62 Cl. O 2 - +0. 65 Cl. O+0. 77 +0. 89 Cl- Cl. O 3 +1. 21 - +1. 47 +1. 63 HCl. O 2 +1. 63 HCl. O +1. 63 Cl 2

PREPARACIÓN DE OXIANIONES • La gran variedad de propiedades de los oxianiones, particularmente su facilidad de formación, impide la aplicación de un método universal para su preparación • La mayoría de aniones que existen en la naturaleza son oxianiones: – Los silicatos son los principales – Se conocen grandes depósitos constituyentes de rocas como el rocosos de fosfatos Ca(PO 4)2, granito y el basalto. borax (Na. B 4 O 7 • 10 H 2 O) y – Los carbonato se encuentran como piedras calizas, en mármol y dolomita (Ca. CO 3 • Mg. CO 3). colemanita (Ca 2 B 6 O 11). – Todas estas son fuentes importantes de los correspondientes oxianiones.

PREPARACIÓN DE OXIANIONES • Existen otros oxianiones que se encuentran en la naturaleza, pero que usualmente se preparan a partir de sustancias más disponibles y que contienen el mismo no-metal en un estado de oxidación menor, o bien a partir del propio elemento. • Para los procesos de oxidación se usa oxígeno gaseoso y peróxidos. Los óxidos no metálicos formados así, dan soluciones del oxiácido cuando se tratan con agua.

PREPARACIÓN DE OXIANIONES • • El ácido nítrico y nitratos se preparan por oxidación de amoníaco usando el proceso de Ostwald: El bióxido de azufre se puede oxidar aún más en presencia de un catalizador:

PREPARACIÓN DE OXIANIONES • Los halógenos no se combinan fácilmente con el oxígeno gaseoso, es más conveniente preparar los oxianiones en solución. • Los halógenos elementales se disuelven en solución básica para dar una mezcla de iones halogenuro e hipohalogenito a temperatura ambiente. • A mayor temperatura se forman los oxianiones halogenatos:

PREPARACIÓN DE OXIANIONES • El perclorato se forma por descomposición térmica del clorato: • El ion permanganato se prepara por la acción de poderosos oxidantes sólidos sobre Mn 2+ en solución ácida:

PREPARACIÓN DE OXIANIONES • El ion dicromato se forma por oxidación de Cr 3+ usando estos mismos reactivos. • En solución básica son más efectivos los oxidantes suaves:
 Antimonio numero de oxidacion
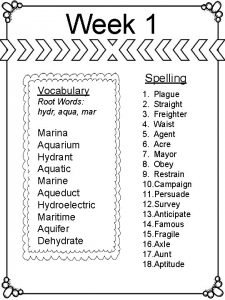
Antimonio numero de oxidacion Aqua root word meaning
Aqua root word meaning Goole doc
Goole doc Tetra root word
Tetra root word Aqu med
Aqu med Aqu agregat
Aqu agregat Logo aqu
Logo aqu Quick key
Quick key Nosotros estamos cazándolos
Nosotros estamos cazándolos Cv aqu
Cv aqu He aqu
He aqu Ejemplos de oxianiones
Ejemplos de oxianiones Las misiones se hacen con los pies
Las misiones se hacen con los pies Que los mejores momentos sean los que están por llegar
Que los mejores momentos sean los que están por llegar Cienes dieces y unos
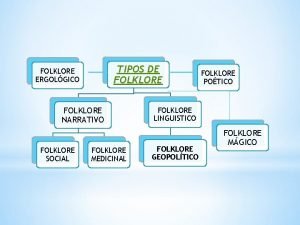
Cienes dieces y unos Que es folklore geopolitico
Que es folklore geopolitico Puede un sacerdote perdonar pecados
Puede un sacerdote perdonar pecados El cuento de los dos reyes y los dos laberintos
El cuento de los dos reyes y los dos laberintos Cuantas clases forman un período
Cuantas clases forman un período H3au nomenclatura
H3au nomenclatura Variables que afectan a los gases
Variables que afectan a los gases Signo sensible del bautismo
Signo sensible del bautismo Lo que nos debemos los unos a los otros
Lo que nos debemos los unos a los otros Cuales son los derechos civiles
Cuales son los derechos civiles Un una unas unos
Un una unas unos Que cante los niños letra
Que cante los niños letra Ventana de johari
Ventana de johari Bienaventurado el que lee y los que oyen
Bienaventurado el que lee y los que oyen La palabra pero
La palabra pero Piensas que a pesar de que los compañeros de andrea
Piensas que a pesar de que los compañeros de andrea Actividades del perdon
Actividades del perdon De qué crees que tratara este texto
De qué crees que tratara este texto A que subgenero pertenece el cuento de la cenicienta
A que subgenero pertenece el cuento de la cenicienta Por que se afirma que los moche estuvieron bien alimentados
Por que se afirma que los moche estuvieron bien alimentados Como identificar los puntos cardinales
Como identificar los puntos cardinales Texto literario poema
Texto literario poema La gente que me gusta letra mario benedetti
La gente que me gusta letra mario benedetti Plus aussi moins
Plus aussi moins Quien dice lo que no debe escucha lo que no quiere
Quien dice lo que no debe escucha lo que no quiere Qqqqu
Qqqqu Mas vale paso que dure que trote que canse
Mas vale paso que dure que trote que canse La gente que me gusta de mario benedetti
La gente que me gusta de mario benedetti 10 deberes de los padres para con los hijos
10 deberes de los padres para con los hijos La estructura de un texto expositivo consta de tres partes
La estructura de un texto expositivo consta de tres partes