OS ELEMENTOS DO GRUPO 14 Este grupo contm















































![OXOCARBONOS Oxocarbonos: Compostos de fórmula geral [Cn. On] 2 Onde n varia de 3 OXOCARBONOS Oxocarbonos: Compostos de fórmula geral [Cn. On] 2 Onde n varia de 3](https://slidetodoc.com/presentation_image_h/a084d5d876f63d0aa2c8d13742d16531/image-58.jpg)
































- Slides: 93

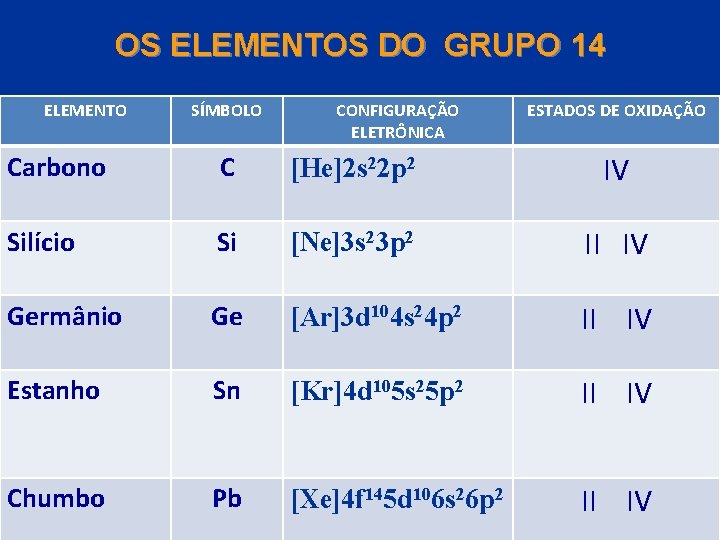
OS ELEMENTOS DO GRUPO 14 Este grupo contém um não metal (o carbono), dois semimetais (o silício e o germânio) e três metais (o estanho, chumbo e o fleróvio). O carbono tem a química mais importante do grupo. Todos os elementos do grupo 14 apresentam o Nox +4, mas o Nox +2 aumenta em estabilidade a medida que descemos no grupo. © 2005 by Pearson Education Capítulo 22

OS ELEMENTOS DO GRUPO 14 ELEMENTO SÍMBOLO CONFIGURAÇÃO ELETRÔNICA ESTADOS DE OXIDAÇÃO Carbono C [He]2 s 22 p 2 IV Silício Si [Ne]3 s 23 p 2 II IV Germânio Ge [Ar]3 d 104 s 24 p 2 II IV Estanho Sn [Kr]4 d 105 s 25 p 2 II IV Chumbo Pb [Xe]4 f 145 d 106 s 26 p 2 II Capítulo 22 IV © 2005 by Pearson Education

OS ELEMENTOS DO GRUPO 14: SOBRE O FLERÓVIO Desse grupo o fleróvio foi o último elemento a ser descoberto. O elemento foi reconhecido pela IUPAC em junho de 2011. O nome do elemento é uma homenagem ao físico russo Georgy Flyorov. © 2005 by Pearson Education Capítulo 22

OS ELEMENTOS DO GRUPO 14: SOBRE O FLERÓVIO O elemento tem Z=114 e está no 7° Período. A configuração eletrônica é : [Rn]5 f 146 d 107 s 27 p 2 Trata-se de um elemento transurânico e radioativo. Provavelmente metálico, sólido e de aspecto prateado. Alguns isótopos mais estáveis 114 Fl 285 ; 114 Fl 286 114 Fl 287 114 Fl 288 289 A meia vida do último isótopo é 2, 6 s. Fl 114 © 2005 by Pearson Education Capítulo 22

OS ELEMENTOS DO GRUPO 14: • Configuração eletrônica externa: ns 2 np 2. • As eletronegatividades são baixas. • Os carbetos (C 4 -) são raros. • O carbono é polimorfo. • Todos os elementos do grupo, exceto o chumbo, possuem no mínimo uma fase sólida com uma estrutura do diamante. © 2005 by Pearson Education Capítulo 22

Tendências Gerais do Grupo 14: C, Si, Ge, Sn, Pb e Fl • EFEITO DO PAR INERTE • O EFEITO DO PAR INERTE CRESCE DE CIMA PARA BAIXO NO GRUPO. • OBSERVA-SE UMA DIMINUIÇÃO NA ESTABILIDADE DO Nox +4 E UM AUMENTO DA ESTABILIDADE DO Nox +2 AO PERCORRERMOS O GRUPO DE CIMA PARA BAIXO • O CÁTION Pb(II) É IÔNICO E ESTÁVEL ENQUANTO QUE O Pb (IV) É OXIDANTE. © 2005 by Pearson Education Capítulo 22

Tendências Gerais do Grupo 14: C, Si, Ge, Sn, e Pb DIFERENÇAS ENTRE O CARBONO, O SILÍCIO E OS DEMAIS ELEMENTOS DO GRUPO Em geral o primeiro elemento difere do restante do grupo, por causa de seu menor tamanho e maior eletronegatividade. Como resultado desses fatores, o primeiro elemento do grupo apresenta maior energia de ionização, sendo mais covalente e menos metálico. © 2005 by Pearson Education Capítulo 22

Tendências Gerais do Grupo 14: C, Si, Ge, Sn, e Pb • O carbono tem número de coordenação 4, os outros membros têm números de coordenação mais altos. • O estado de oxidação dominante para Ge, Sn e Pb é +2. • As ligações sigma C-C são muito fortes, logo, o C tende a formar longas cadeias. © 2005 by Pearson Education Capítulo 22

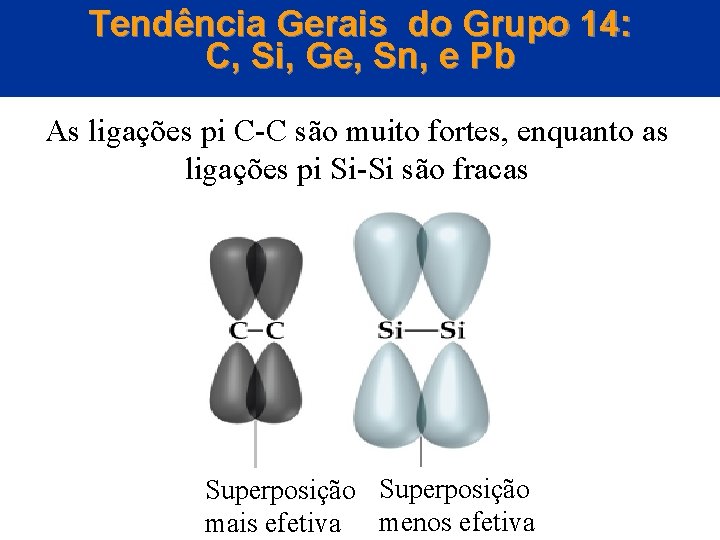
Tendências Gerais do Grupo 14: C, Si, Ge, Sn, e Pb • O primeiro membro de um grupo pode formar ligações mais facilmente do que os membros subsequentes. • O Si é bem maior do que o C e o orbital 3 p é bem maior do que o orbital 2 p, logo, a superposição entre orbitais 3 p para formar uma ligação 3 p (Si-Si) é significativamente pior do que a superposicão (C-C) para formar uma ligação 2 p. © 2005 by Pearson Education Capítulo 22

Tendência Gerais do Grupo 14: C, Si, Ge, Sn, e Pb As ligações pi C-C são muito fortes, enquanto as ligações pi Si-Si são fracas Superposição © 2005 by Pearson Education mais efetiva menos efetiva Capítulo 22

Tendências Gerais do Grupo 14: C, Si, Ge, Sn, e Pb • Como a ligação Si-Si é bem mais fraca do que a ligação C-C, o Si tende a formar ligações . Ex. o dióxido de silício é um sólido e o dióxido de carbono é um gás. © 2005 by Pearson Education Capítulo 22

TENDÊNCIAS GERAIS – GRUPO 14 • Tendo em vista que a ligação sigma Si-O é mais forte do que a ligação sigma Si-Si, o Si tende a formar óxidos (silicatos). © 2005 by Pearson Education Capítulo 22

PROPRIEDADES DOS ELEMENTOS DO GRUPO 14 1 © 2005 by Pearson Education 14 Capítulo 22

PROPRIEDADES DOS ELEMENTOS DO GRUPO 14 Raio Atômico O raio atômico aumenta de cima para baixo no grupo. A diferença de tamanho entre o Si e o Ge é menor do que seria de se esperar, porque o Ge possui uma camada 3 d cheia, e a blindagem da carga nuclear é menos eficiente. De modo análogo a pequena diferença de tamanho entre Sn e Pb deve-se ao preenchimento dos orbitais 4 f 4 f Capítulo 22 © 2005 by Pearson Education

PROPRIEDADES GERAIS DOS ELEMENTOS DO GRUPO 14 Energia de Ionização As energias de ionização diminuem do carbono para o silício, e a seguir variam de forma irregular devido aos efeitos do preenchimento dos níveis “d” e “f”. © 2005 by Pearson Education Capítulo 22

PROPRIEDADES GERAIS DOS ELEMENTOS DO GRUPO 14 ENTALPIA DE LIGAÇÃO A força particular da ligação C-C contribui para o fato de a catenação ser comum em compostos de carbono. No entanto, deve-se enfatizar que podem estar envolvidos tanto fatores cinéticos como termodinâmicos, e qualquer discussão minuciosa de fatores cinéticos está sujeita a complicações. © 2005 by Pearson Education Capítulo 22

CARBONO: FORMAS CRISTALINAS ELEMENTARES • O carbono constitui aproximadamente 0, 027 % da crosta terrestre. • É o principal constituinte da matéria viva • Existem duas formas cristalinas elementares do carbono: – diamante (claro, duro e forma uma rede covalente, é um isolante elétrico, apresenta grande dispersão) – grafita (macia, preta, mole, brilho semimetálico e © 2005 by Pearson – Education A alta condutividade elétrica) Capítulo 22

FORMAS CRISTALINAS DO CARBONO ELEMENTAR – DIAMANTE E GRAFITE © 2005 by Pearson Education Capítulo 22

FORMAS CRISTALINAS DO CARBONO ELEMENTAR – DIAMANTE E GRAFITE ESTRUTURA CÚBICA DO DIAMANTE © 2005 by Pearson Education Capítulo 22

DIAMANTE O DIAMANTE É UM SÓLIDO COVALENTE QUE TEM LIGAÇÕES σ C-C , MAS NÃO APRESENTA LIGAÇÕES π. NO DIAMANTE CADA CARBONO USA TODOS OS 4 ELÉTRONS DE VALÊNCIA FORMANDO 4 3 3 LIGAÇÕES COVALENTES SIGMA sp - sp COM 4 ÁTOMOS DE CARBONO ADJACENTES © 2005 by Pearson Education Capítulo 22

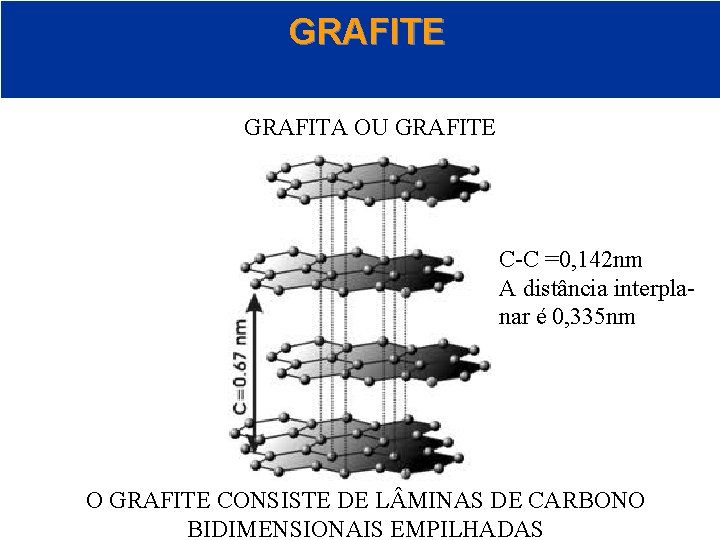
GRAFITE OU GRAFITA © 2005 by Pearson Education Capítulo 22

GRAFITE GRAFITA OU GRAFITE C-C =0, 142 nm A distância interplanar é 0, 335 nm O GRAFITE CONSISTE DE L MINAS DE CARBONO Capítulo 22 BIDIMENSIONAIS EMPILHADAS © 2005 by Pearson Education

GRAFITE NAS L MINAS OU CAMADAS DA GRAFITE CADA CARBONO ESTÁ LIGADO A TRÊS OUTROS. A DIST NCIA DA LIGAÇÃO C-C NO DIAMANTE É 0, 154 nm. A DIST NCIA DA LIGAÇÃO C-C NA GRAFITA 0, 142 nm. A GRAFITA FORMA LIGAÇÕES σ E π © 2005 by Pearson Education Capítulo 22

GRAFITE DENTRO DAS CAMADAS CADA ÁTOMO DE CARBONO FORMA 3 LIGAÇÕES 2 2 COVALENTES σ sp - sp COM OS 3 ÁTOMOS DE CARBONOS ADJACENTES. O QUARTO ELÉTRON DO CARBONO VIA SUPERPOSIÇÃO LATERAL DOS ORBITAIS “p” FORMA AS LIGAÇÕES π © 2005 by Pearson Education Capítulo 22

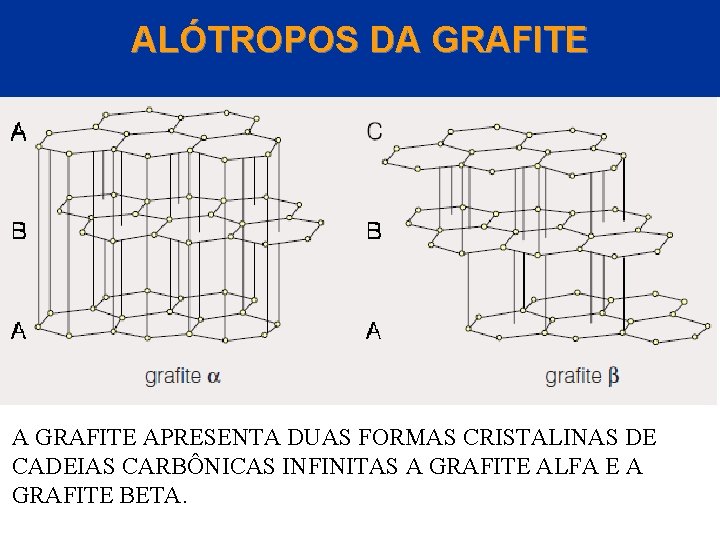
ALÓTROPOS DA GRAFITE APRESENTA DUAS FORMAS CRISTALINAS DE CADEIAS CARBÔNICAS INFINITAS A GRAFITE ALFA E A Aaaaa GRAFITE BETA. © 2005 by Pearson Education Capítulo 22

AGREGADOS DE CARBONO – Buckminsterfulereno ou simplesmente fulerenos (forma molecular do carbono, C 60, ) – nanotubos de carbono (NTC, morfologia tubular com dimensões nanométricas) - Grafenos (uma única folha plana de anéis hexagonais) © 2005 by Pearson Education Capítulo 22

FULERENOS - DESCOBERTA OS FULERENOS FORAM DESCOBERTOS EM 1985 POR UM GRUPO DE PESQUISADORES LIDERADOS POR RICHARD SMALLEY E ROBERT CURL DA UNIVERSIDADE DE RICE, EM HOUSTON, E HARRY KROTO DA UNIVERSIDADE DE SUSSEX, NA INGLATERRA. OS 3 PESQUISADORES GANHARAM O PREMIO NOBEL EM QUÍMICA DE 1996. © 2005 by Pearson Education Capítulo 22

FULERENOS OS FULERENOS SÃO ALÓTROPOS MOLECULARES DO CARBONO. O NÚMERO DE ÁTOMOS DE CARBONO NUMA MOLÉCULA FULERÊNICA PODE VARIAR DE 60 A MILHARES FORMANDO HEXÁGONOS E EXATAMENTE 12 PENTÁGONOS. OS FULERENOS SÃO SÓLIDOS PRETOS E DISSOLVEM-SE EM SOLVENTES APOLARES © 2005 by Pearson Education Capítulo 22

AGREGADOS DE CARBONO Kroto e colaboradores, sintetizaram em 1985 os fulerenos. Quando uma descarga elétrica gera faíscas entre eletrodos de aa grafite, em atmosfera inerte, forma-se uma grande quantidade de negro de fumo junto com uma quantidade significativa de C 60. A molécula consiste de anéis de carbono de cinco e seis Capítulo 22 © 2005 by Pearson Education membros, e a simetria global é icosaédrica na fase gasosa.

FULERENOS NO CASO DO C 60 CADA PENTÁGONO ESTÁ RODEADO POR UM COLAR DE 5 HEXÁGONOS DIFERENTEMENTE DO DIAMANTE E DA GRAFITE OS FULERENOS PODEM SER DISSOLVIDOS EM SOLVENTES ORG NICOS. EX. O C 60 DISSOLVE-SE EM N -HEXANO PRODUZINDO UMA SOLUÇÃO DE COR MAGENTA. © 2005 by Pearson Education Capítulo 22

ESTRUTURA DE UM FULERENO – C 60 Buckminsterfullereno © 2005 by Pearson Education Capítulo 22

ESTRUTURA DE UM FULERENO – C 60 © 2005 by Pearson Education Capítulo 22

ORBITAL MOLECULAR DE UM FULERENO – C 60 Buckminsterfullereno © 2005 by Pearson Education Capítulo 22

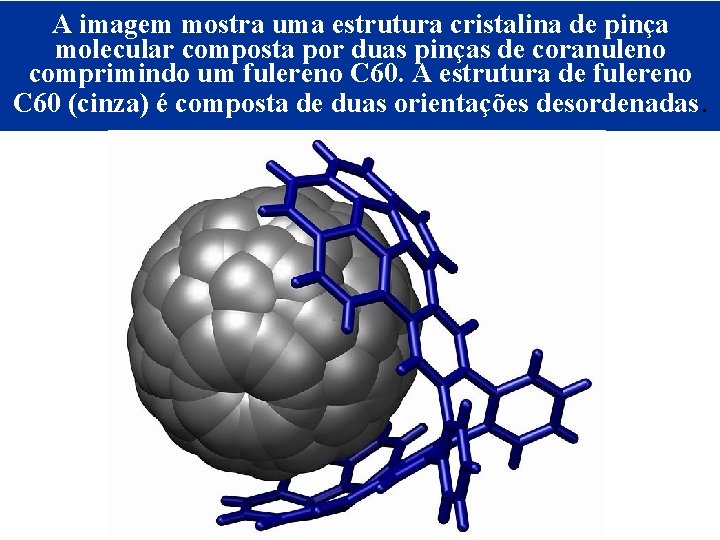
A imagem mostra uma estrutura cristalina de pinça molecular composta por duas pinças de coranuleno comprimindo um fulereno C 60. A estrutura de fulereno C 60 (cinza) é composta de duas orientações desordenadas. © 2005 by Pearson Education Capítulo 22

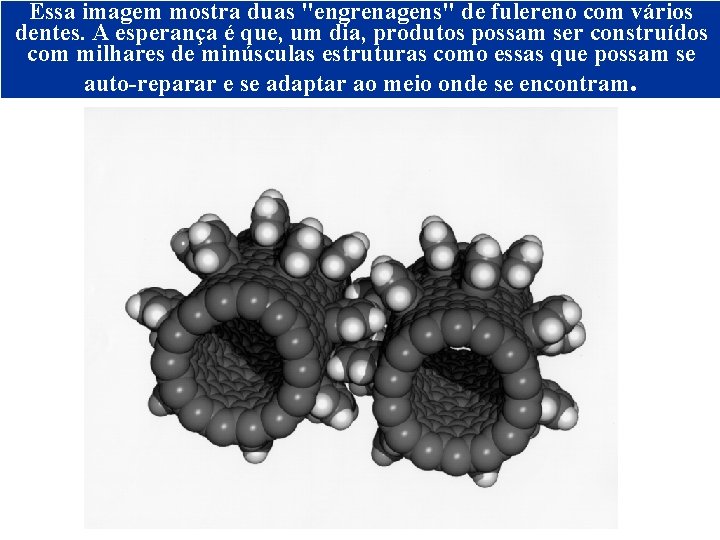
Essa imagem mostra duas "engrenagens" de fulereno com vários dentes. A esperança é que, um dia, produtos possam ser construídos com milhares de minúsculas estruturas como essas que possam se auto-reparar e se adaptar ao meio onde se encontram. NANOTUBO DE CARBONO © 2005 by Pearson Education Capítulo 22

NANOTUBOS DE CARBONO A NANOTECNOLOGIA É O DESENVOLVIMENTO DE MATERIAIS EM ESCALA DE TAMANHO NANOMÉTRICO. MATERIAIS EM ESCALA NANOMÉTRICA EXIBEM PROPRIEDADES QUÍMICAS E FÍSICAS DIFERENTES DE MATERIAIS VOLUMOSOS. QUANDO OS NANOTUBOS SÃO FORMADOS COM PERFEIÇÃO, CONDUZEM CORRENTE ELÉTRICA COMO UM METAL © 2005 by Pearson Education Capítulo 22

NANOTUBOS DE CARBONO Descobertos em 1991 por Sumio Iijima © 2005 by Pearson Education Capítulo 22

NANOTUBOS DE CARBONO Os nanotubos são essencialmente tiras pequenas de folhas de grafite, enroladas na forma de tubos e fechadas com meio fulereno em cada extremidade. Podem ser produzidos pelos aquecimento da grafite em uma atmosfera inerte sob condições patenteadas. Nesse caso aquece-se a grafite até cerca de 1200°C © 2005 by Pearson Education Capítulo 22

NANOTUBO DE CARBONO © 2005 by Pearson Education Capítulo 22

NANOTUBO DE CARBONO VISÃO INTERNA DE UM NANOTUBO DE CARBONO © 2005 by Pearson Education Capítulo 22

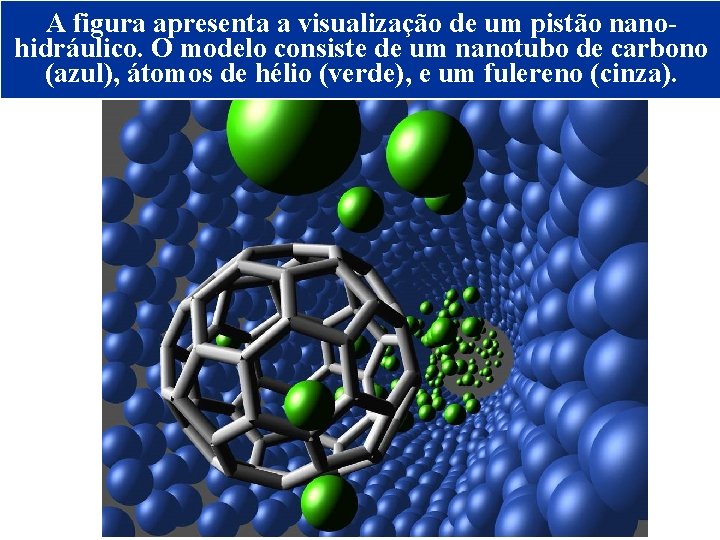
A figura apresenta a visualização de um pistão nanohidráulico. O modelo consiste de um nanotubo de carbono (azul), átomos de hélio (verde), e um fulereno (cinza). NANOTUBOS DE CARBONO © 2005 by Pearson Education Capítulo 22

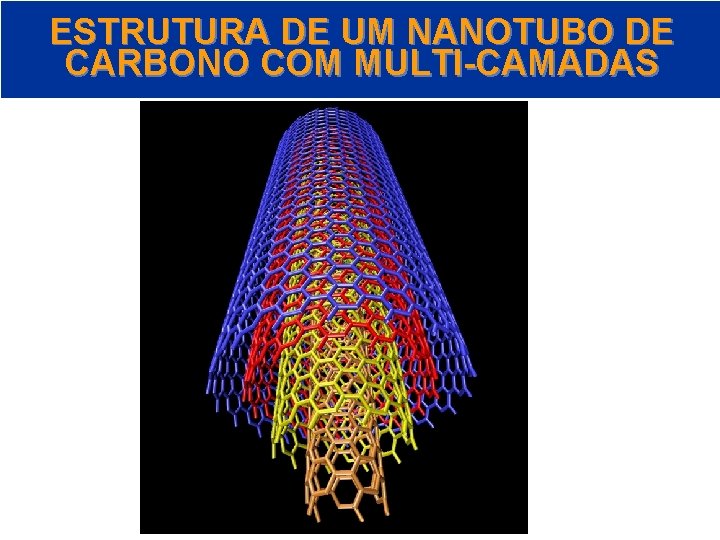
ESTRUTURA DE UM NANOTUBO DE CARBONO COM MULTI-CAMADAS © 2005 by Pearson Education Capítulo 22

GRAFENO NANOFITA OU FOLHA DE GRAFENO Formada por uma única folha plana de anéis hexagonais a nanofita é mantida por um sistema sigma e um sistema pi conjugado. © 2005 by Pearson Education Capítulo 22

O grafeno pode ser descrito como um nanotubo de carbono desenrolado. Sua folha bidimensional é composta de uma única camada de átomos de carbono arranjados em um padrão hexagonal, como um favo de mel. Elétrons podem se mover através dessas folhas mesmo à temperatura ambiente, fazendo do grafeno um dos principais alvos da indústria eletrônica. © 2005 by Pearson Education Capítulo 22

GRAFENOS O grafeno se comporta como um semimetal, com propriedades elétricas e magnéticas incomuns. É também muito resistente. Os grafenos são os condutores mais finos que se conhece e terão muito provavelmente ampla aplicação na eletrônica do futuro. © 2005 by Pearson Education Capítulo 22

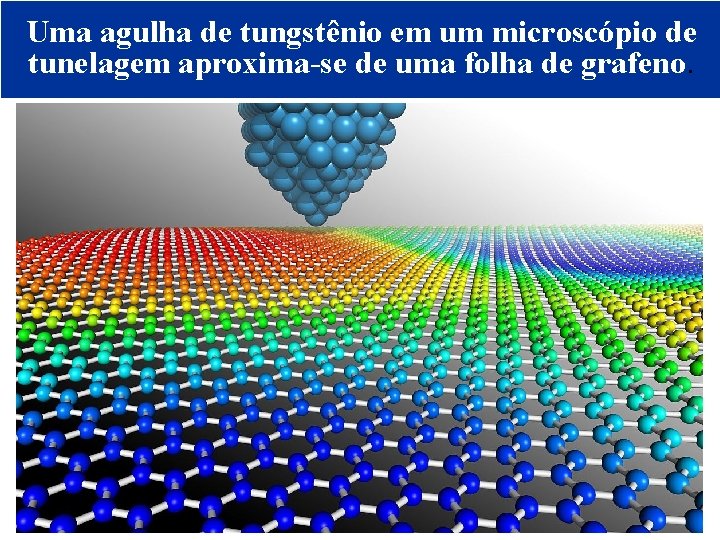
Uma agulha de tungstênio em um microscópio de tunelagem aproxima-se de uma folha de grafeno. © 2005 by Pearson Education Capítulo 22

FORMAS MICROCRISTALINAS E AMORFAS DE CARBONO Negro de Fumo – CH 4(g) + O 2(g) C(s) + 2 H 2 O(g): – usado como um pigmento em tintas pretas e pneus de automóveis; o negro de fumo corresponde a fuligem formada pela combustão incompleta de hidrocarbonetos utilizando pouco oxigênio © 2005 by Pearson Education Capítulo 22

FORMAS MICROCRISTALINAS E AMORFAS DE CARBONO Carvão vegetal (formado pelo aquecimento da madeira na ausência de ar): Carvão ativado é usado para a remoção de odores e impurezas do ar e da água, obtido pela desidratação química de pó de madeira com H 3 PO 4. Coque (formado pelo aquecimento de carvão na ausência de ar): usado como um agente de redução. Capítulo 22 © 2005 by Pearson Education

FORMAS MICROCRISTALINAS E AMORFAS DE CARBONO Fibras de Carbono As fibras de carbono podem ser preparadas pela pirólise controlada de fibras asfálticas ou fibras sintéticas. As fibras de carbono garantem resistência aos materiais poliméricos. © 2005 by Pearson Education Capítulo 22

FORMAS MICROCRISTALINAS E AMORFAS DE CARBONO FIBRAS DE CARBONO Obtidas por degradação térmica de polímeros, que não fundem, como a celulose por aquecimento a 300 e depois a 1000ºC, na ausência de ar. © 2005 by Pearson Education Capítulo 22

Carbono Óxidos de Carbono • O carbono forma os óxidos CO , CO 2 e um óxido raro C 3 O 2 • CO é muito tóxico (se liga irreversivelmente ao Fe na hemoglobina, provocando parada respiratória). • O CO também tem um par solitário no C, o que não é comum. © 2005 by Pearson Education Capítulo 22

Carbono Óxidos de Carbono • O CO é uma boa base de Lewis (por exemplo, o Ni(CO)4 forma-se facilmente quando o Ni é aquecido em CO). • O CO pode ser usado como um combustível , por exemplo, 2 CO(g) + O 2(g) 2 CO 2(g) H = -566 k. J © 2005 by Pearson Education Capítulo 22

Carbono • • Óxidos de Carbono O CO é um bom agente redutor (por exemplo, Fe 3 O 4(s) + 4 CO(g) 3 Fe(s) + 4 CO 2(g)). O CO 2 é produzido quando compostos orgânicos são queimados em oxigênio: C(s) + O 2(g) CO 2(g) CH 4(g) + 2 O 2(g) CO 2(g) + 2 H 2 O(l) C 2 H 5 OH(l) + 3 O 2(g) 2 CO 2(g) + 3 H 2 O(l) O CO 2 é produzido pelo tratamento de carbonatos com ácido. © 2005 by Pearson Education Capítulo 22

Carbono Óxidos de Carbono • A fermentação do açúcar para produzir álcool também produz CO 2: C 6 H 12 O 6(aq) 2 C 2 H 5 OH(aq) + 2 CO 2(g) • Sob pressão atmosférica, o CO 2 condensa-se para formar CO 2(s) ou gelo seco. © 2005 by Pearson Education Capítulo 22

Carbono Óxidos de Carbono • O CO 2 é usado como gelo seco (refrigeração), carbonação de bebidas, soda (Na 2 CO 3. 10 H 2 O) e bicarbonato de sódio (Na. HCO 3. 10 H 2 O). • Um emprego importante do dióxido de carbono na atualidade é como fluido supercrítico. © 2005 by Pearson Education Capítulo 22

Óxidos de Carbono Fluido Supercrítico. Acima de sua temperatura crítica e pressão crítica, um elemento ou composto está em seu estado de fluido supercrítico. O CO 2 sc é uma alternativa “limpa” para solvente orgânico em uma variedade de processos de extração. © 2005 by Pearson Education Capítulo 22

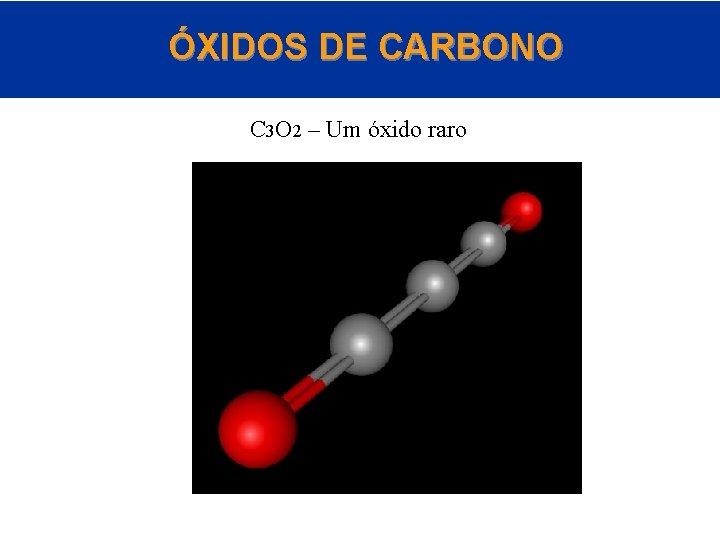
ÓXIDOS DE CARBONO C 3 O 2 – Um óxido raro © 2005 by Pearson Education Capítulo 22
![OXOCARBONOS Oxocarbonos Compostos de fórmula geral Cn On 2 Onde n varia de 3 OXOCARBONOS Oxocarbonos: Compostos de fórmula geral [Cn. On] 2 Onde n varia de 3](https://slidetodoc.com/presentation_image_h/a084d5d876f63d0aa2c8d13742d16531/image-58.jpg)
OXOCARBONOS Oxocarbonos: Compostos de fórmula geral [Cn. On] 2 Onde n varia de 3 a 6 © 2005 by Pearson Education Capítulo 22

ÁCIDO CARBÔNICO E CARBONATOS • Quando o CO 2 se dissolve em água (moderadamente solúvel), forma-se ácido carbônico: CO 2(aq) + H 2 O(l) H 2 CO 3(aq) • O ácido carbônico é responsável por fornecer às bebidas carbonadas um acentuado gosto ácido. © 2005 by Pearson Education Capítulo 22

ÁCIDO CARBÔNICO E CARBONATOS • A neutralização parcial do H 2 CO 3 produz hidrogeno carbonatos (bicarbonatos), e a neutralização completa produz carbonatos. • Muitos minerais contêm CO 32 -. © 2005 by Pearson Education Capítulo 22

ÁCIDO CARBÔNICO E CARBONATOS • A temperaturas elevadas o Ca. CO 3 decompõe-se: Ca. CO 3(s) Ca. O(s) + 2 CO 2(g) • Essa reação é a fonte comercial de cal, Ca. O. • O Ca. O reage com água e com o CO 2 para formar o Ca. CO 3, que liga a areia na argamassa: Ca. O(s) + H 2 O(l) Ca 2+(aq) + 2 OH-(aq) + CO 2(aq) Ca. CO 3(s) + H 2 O(l) © 2005 by Pearson Education Capítulo 22

CARBETOS • Os carbetos são compostos binários de C com metais, semimetais e determinados não-metais. • Três tipos de carbetos: – Iônico (formado por metais ativos, por exemplo, Ca. C 2), – Intersticial ou metálico (formado por metais de transição, por exemplo, carbeto de tungstênio) – Covalente(formado por B e Si, por exemplo, Si. C). © 2005 by Pearson Education Capítulo 22

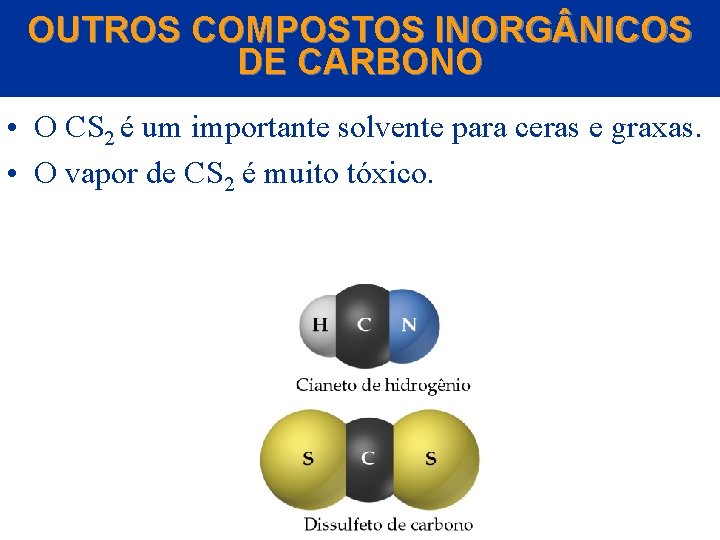
OUTROS COMPOSTOS INORG NICOS DE CARBONO • A química inorgânica é o estudo dos compostos dos elementos diferentes do Carbono. • Dois compostos inorgânicos de carbono interessantes são HCN e CS 2. • O HCN (cianeto de hidrogênio) é um gás extremamente tóxico. • O HCN é produzido pela reação de um sal, por exemplo, Na. CN, com ácido. • Os cianetos são usados na fabricação de plásticos como o náilon e o Orlon. © 2005 by Pearson Education Capítulo 22

OUTROS COMPOSTOS INORG NICOS DE CARBONO • O CS 2 é um importante solvente para ceras e graxas. • O vapor de CS 2 é muito tóxico. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Ocorrência e Preparação do Silício • Toróides de Si são cortadas de cristais cilíndricos de Si. • O silício tem muitos usos importantes na indústria eletrônica. • O Si é o segundo elemento mais abundante na crosta • © terrestre. Capítulo 22 2005 by Pearson Education

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Ocorrência e Preparação do Silício • O Si elementar é preparado pela redução do Si. O 2: Si. O 2(l) + 2 C(s) Si(l) + 2 CO(g) • O Si é um semicondutor e, deste modo, deve ser extremamente puro. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Ocorrência e Preparação do Silício • Para purificar, converte-se o Si impuro em Si. Cl 4 (com Cl 2). A seguir destila-se. Depois reduz-se o Si. Cl 4 (com H 2) em Si puro: Si. Cl 4(g) + 2 H 2(g) Si(s) + 4 HCl(g) • O Si é então adicionalmente purificado pelo processo de refino por zona. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Ocorrência e Preparação do Silício • O refino por zona é usado para produzir Si ultrapuro. • O cristal de silício é colocado dentro de um tubo sob atmosfera inerte. • Uma espiral de aquecimento é lentamente movida para baixo. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Ocorrência e Preparação do Silício • À medida que a espiral derrete o Si, quaisquer impurezas se dissolvem e descem com a movimentação da espiral de aquecimento. • No final do processo, a porção de Si contendo todas as impurezas é arrancada e descartada. • O cristal restante é ultrapuro. © 2005 by Pearson Education Capítulo 22

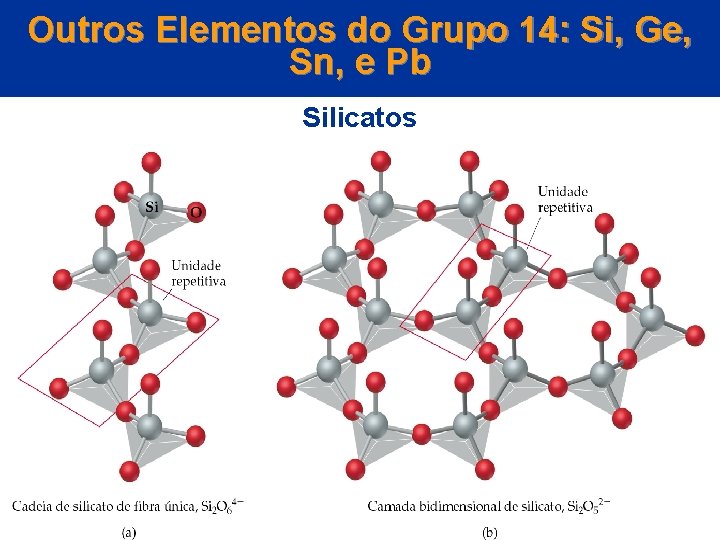
Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Silicatos • 90 % da crosta terrestre é constituída de compostos de Si e O. • Os silicatos são compostos onde o Si tem quatro átomos de O circundados em um arranjo tetraédrico. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Silicatos • O estado de oxidação do Si é +4. • Outros minerais, como o zircônio, Zr. O 4, têm uma estrutura similar. • O tetraedro de silicato são unidades básicas para estruturas mais complicadas. © 2005 by Pearson Education Capítulo 22

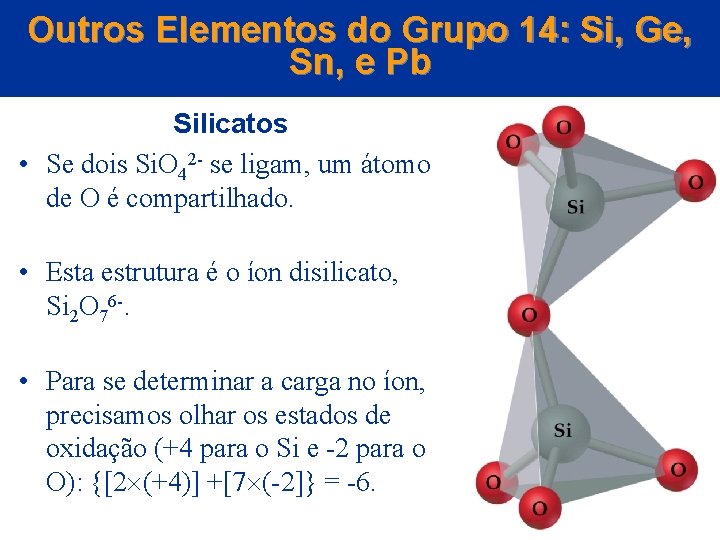
Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Silicatos • Se dois Si. O 42 - se ligam, um átomo de O é compartilhado. • Esta estrutura é o íon disilicato, Si 2 O 76 -. • Para se determinar a carga no íon, precisamos olhar os estados de oxidação (+4 para o Si e -2 para o O): {[2 (+4)] +[7 (-2]} = -6. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Silicatos • Tanto a thorveitita (Sc 2 Si 2 O 7) como a hardistonita Ca 2 Zn(Si 2 O 7) contêm íons dissilicato. • Muitos tetraedros de silicato podem se ligar para formar chapas, cadeias ou estruturas em 3 D. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Silicatos • Considere uma estrutura com dois vértices ligados a dois outros tetraedros: – uma cadeia simples de fios de silicato pode se formar com uma unidade de Si 2 O 64 - que se repete. Exemplo: enstatito (Mg. Si. O 3). © 2005 by Pearson Education Capítulo 22

Outros elementos do grupo 14: Si, Ge, Sn, e Pb Silicatos • Considere uma estrutura com dois vértices ligados a outros três tetraedros: – resulta em uma chapa bidimensional. – resulta em talco mineral. – (talco, Mg 3(Si 2 O 5)2(OH)2). – os asbestos formam cadeias ou chapas de silicatos. © 2005 by Pearson Education Capítulo 22

Outros elementos do grupo 14: Si, Ge, Sn, e Pb Silicatos – as chapas em asbestos são formadas em rolos. – os rolos tornam os asbestos fibrosos. – as fibras podem ser tecidas em pano (roupas à prova de fogo). • O silicato tridimensional forma o quartzo. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Silicatos © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Vidro • Vidros são o resultado que se obtém quando silicatos são aquecidos (as ligações Si-O são quebradas) e depois resfriados rapidamente (as ligações Si-O são formadas outra vez antes que os átomos sejam capazes de se organizarem em um arranjo ordenado). • São usados aditivos para reduzir o ponto de fusão do Si. O 2. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Vidro • O vidro em janelas e garrafas é chamado vidro de soda-cal (Ca. O e Na 2 O são usados como aditivos). • O Ca. O e o Na 2 O formam calcário (Ca. CO 3) e cinza de soda (Na 2 CO 3) quando aquecidos. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Vidro • As propriedades dos vidros são alteradas por aditivos: Co. O produz vidro de cobalto azul, K 2 O produz um vidro mais resistente do que Na 2 O, Pb. O produz vidro de cristal de chumbo (alto índice de refração) B 2 O 3 é usado em vidros como Pyrex e Kimax. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Siloxanos e Polissiloxanos (Silicones) • Os silicones consistem em cadeias de ligações OSi-O nas quais as posições restantes em cada silício são ocupadas por grupos orgânicos como CH 3 • Os silicones podem ser materiais parecidos com óleo ou borracha, dependendo do comprimento da cadeia e do grau de ligação cruzadas entre as cadeias. © 2005 by Pearson Education Capítulo 22

Outros Elementos do Grupo 14: Si, Ge, Sn, e Pb Siloxanos e Polissiloxanos (Silicones) • Os silicones são usados em lubrificantes, ceras de polimento de carros, lacradores, calafetagem e para a fabricação de tecidos à prova d’água. Capítulo 22 © 2005 by Pearson Education Estrutura Geral de um Polímero de Siloxano (Silicone)

OBTENÇÃO O CARBONO ELEMENTAR SOB A FORMA DE GRAFITE E DIAMANTE É ENCONTRADO EM MINAS. O COQUE É FORMADO PELA PIRÓLISE DO CARVÃO. NEGRO DE FUMO É PRODUTO DA COMBUSTÃO INCOMPLETA DE HIDROCARBONETOS. CH 4(g) + O 2(g) C(s) + 2 H 2 O(g) © 2005 by Pearson Education Capítulo 22

OBTENÇÃO SILÍCIO ELEMENTAR É RECUPERADO DE Si. O 2 PELA REDUÇÃO EM ARCO DE CARBONO Si. O 2 + 2 C → Si + 2 CO GERM NIO É OBTIDO NO PROCESSAMENTO DE MINÉRIOS DE ZINCO. © 2005 by Pearson Education Capítulo 22

OBTENÇÃO O ESTANHO É OBTIDO POR REDUÇÃO DO MINERAL CASSITERITA Sn. O 2 COM COQUE EM UM FORNO ELÉTRICO. Sn. O 2(s) + 2 C(s) → Sn (l) + 2 CO(g) O CHUMBO É OBTIDO A PARTIR DE SEUS MINÉRIOS DE SULFETOS, QUE SÃO CONVERTIDOS A ÓXIDO SEGUIDO DE UMA AUTO-REDUÇÃO DA MISTURA © 2005 by Pearson Education Capítulo 22

OBTENÇÃO 2 Pb. S(s) + 3 O 2 (g) → 2 Pb. O(s) + 2 SO 2(g) PARTE DO Pb. S É CONVERTIDO A SULFATO DE CHUMBO NESSE PROCESSO Pb. S(s) + 2 O 2 (g) → Pb. SO 4(s) A mistura de produtos (Pb. O e Pb. SO 4) é então adicionado mais Pb. S e novamente aquecida na ausência de ar Pb. S(s) + 2 Pb. O(s) → 3 Pb(l) + SO 2 (g) Pb. S(s) + Pb. SO 4(s) → 2 Pb(l) + 2 SO 2 (g) © 2005 by Pearson Education Capítulo 22

OBTENÇÃO O fleróvio pode ser obtido em aceleradores de partículas bombardeando-se o plutônio 244 com íons cálcio. 244 + Ca 48 Fl 289 + 3 n 1 Pu 94 20 114 0 244 + Ca 48 Fl 288 + 4 n 1 Pu 94 20 114 0 © 2005 by Pearson Education Capítulo 22

USOS O DIAMANTE É O MELHOR ABRASIVO O DIAMANTE É UMA DAS PEDRAS PRECIOSAS MAIS APRECIADAS O GRAFITE É USADO COMO LUBRIFICANTE SÓLIDO O NEGRO DE FUMO É USADO EM GRANDE ESCALA COMO PIGMENTO EM TINTA DE IMPRESSORA E COMO ENCHIMENTO EM ARTIGOS DE BORRACHA INCLUINDO PNEUS DE AUTOMÓVEIS © 2005 by Pearson Education Capítulo 22

USOS O CARBONO ATIVADO É UM ADSORVENTE PARA MOLÉCULAS MUITO EFICIENTE. ELE REMOVE POLUENTES ORG NICOS DA ÁGUA POTÁVEL, GASES NOCIVOS NO AR E IMPUREZAS DE MISTURAS DE REAÇÕES. AS FIBRAS DE CARBONO SÃO INCORPORADAS EM DIVERSOS PRODUTOS PLÁSTICOS DE ALTA RESISTÊNCIA, COMO RAQUETE DE TÊNIS E COMPONENTES DE AERONAVES. © 2005 by Pearson Education Capítulo 22

USOS Além da purificação de gases o carvão ativado é empregado na recuperação de solventes orgânicos voláteis (por exemplo, acetona, etanol, tolueno, hidrocarbonetos clorados) e em pigmentos, tintas, fibras sintéticas, borrachas e indústrias de adesivos. Vários filtros de gás, inclusive aqueles em coifas de fogões e capelas móveis ou de bancada de laboratório, contêm filtros de carvão ativado. © 2005 by Pearson Education Capítulo 22

USOS Cerca de 20% do carvão ativado que é produzido é consumido na indústria do açúcar, onde é empregado como agente descolorante. O carvão é utilizado na purificação da água. O carvão ativado é utilizado como catalizador heterogênio. carvão ativado CO + Cl 2 COCl 2 © 2005 by Pearson Education Capítulo 22

USOS O ESTANHO É USADO COMO FOLHA DE FLANDRES- CHAPAS DE AÇO COBERTAS DE ESTANHO – O Sn É TAMBÉM UTILIZADO COM OUTROS METAIS PARA CONSTRUÇÃO DE MANCAIS EM DISPOSITIVOS MEC NICOS E EM LIGAS POR EXEMPLO COM O COBRE (BRONZE) O EMPREGO PRINCIPAL DO CHUMBO CONSISTE NA FABRICAÇÃO DE BATERIAS DE CHUMBO O CHUMBO É APROVEITÁVEL EM VÁRIAS LIGAS E NUMA TINTA RESISTENTE À CORROSÃO, O ZARCÃO QUE CONTÉM Pb 3 O 4. Capítulo 22 © 2005 by Pearson Education

USOS A maioria das células solares é fabricada com o uso do silício. Trata-se da conversão de energia solar em energia térmica e elétrica. O silício encontra as suas principais aplicações na indústria de aço e nas indústrias eletrônicas e de semicondutores. A sílica é um material comercial de extrema importância. Trata-se do principal componente do vidro, e grande quantidade de areia são consumidas Capítulo 22 © 2005 by Pearson Education nna construção civil.