origen del universo Jos Agera Soriano 2012 1



































































































- Slides: 136

origen del universo? José Agüera Soriano 2012 1

PRIMER PRINCIPIO • ENERGÍA INTERNA Y CALOR • SISTEMAS CERRADOS • SISTEMAS ABIERTOS • IRREVERSIBILIDAD MECÁNICA • PROCESOS EQUIVALENTES • LEY DE JOULE • CAPACIDADES CALORÍFICAS José Agüera Soriano 2012 2

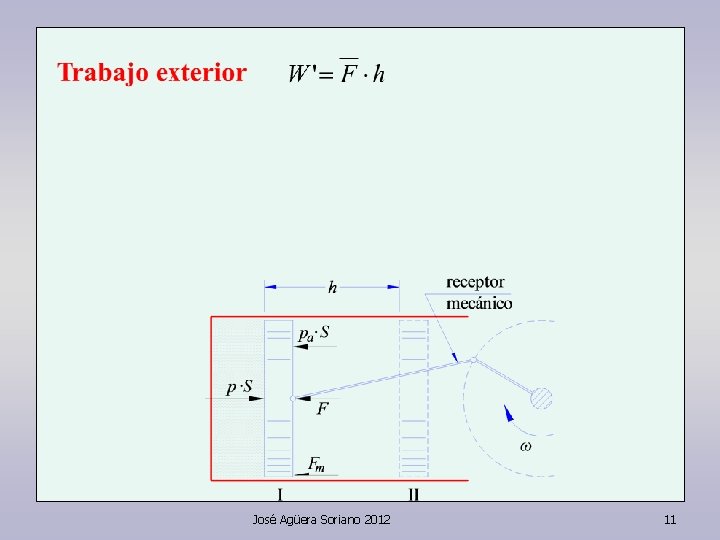
Como se indicó en la introducción del libro, el primer principio de la Termodinámica no es otra cosa que la ley de la conservación de la energía, aplicada a un proceso en el que intervengan o puedan intervenir calor y/o energía interna, que son las energías que la Termodinámica aporta a la Física. José Agüera Soriano 2012 3

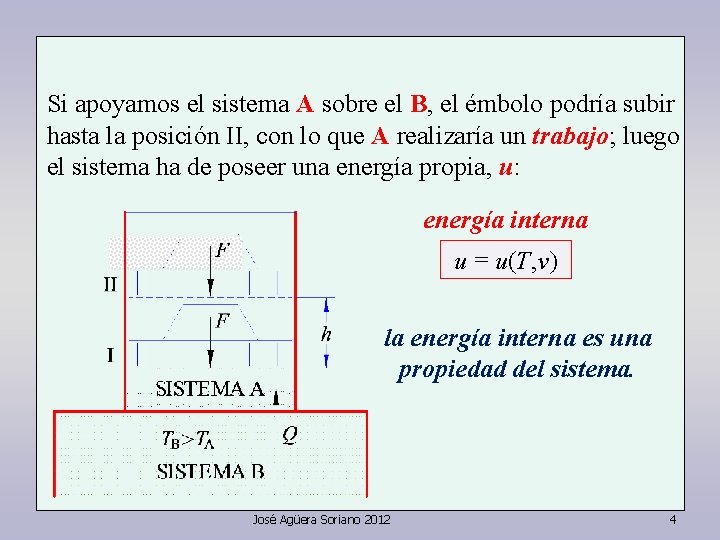
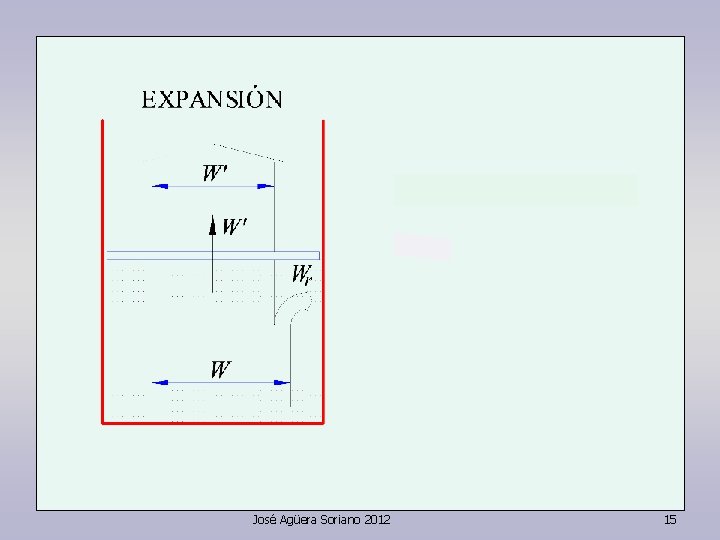
Si apoyamos el sistema A sobre el B, el émbolo podría subir hasta la posición II, con lo que A realizaría un trabajo; luego el sistema ha de poseer una energía propia, u: energía interna u = u(T, v) la energía interna es una propiedad del sistema. José Agüera Soriano 2012 4

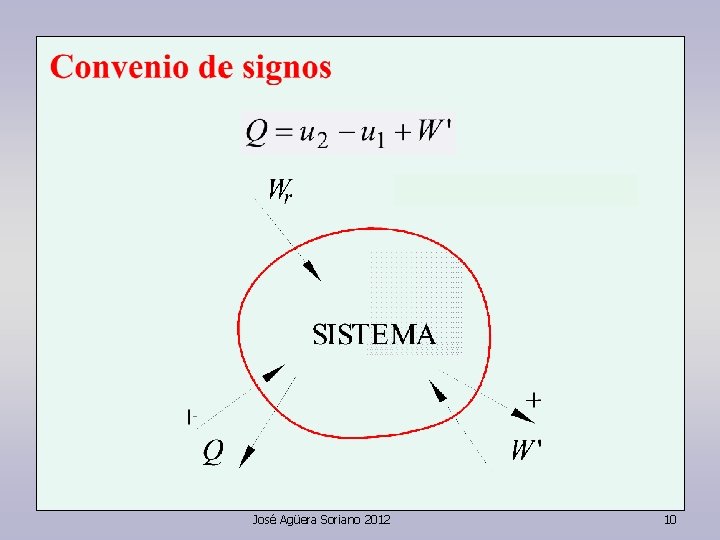
No se nos escapa el hecho de que el sistema A recibió, mientras tanto, energía del sistema B; es una nueva energía a la que llamaremos calor, Q. El calor es una energía de paso que cruza la frontera entre dos sistemas, como consecuencia exclusivamente de una diferencia de temperatura entre los mismos José Agüera Soriano 2012 5

La experiencia anterior podemos hacerla también calentando el sistema con un ventilador por ejemplo, en lugar de con calor. Llamaremos a esta energía trabajo de rozamiento y/o rozamiento interno Wr. Conviene separar conceptualmente ambas energías: Wr sólo puede ser recibido por el sistema. José Agüera Soriano 2012 6

La experiencia anterior podemos hacerla también calentando el sistema con un ventilador por ejemplo, en lugar de con calor. Llamaremos a esta energía trabajo de rozamiento y/o rozamiento interno Wr. Conviene separar conceptualmente ambas energías: Wr sólo puede ser recibido por el sistema. José Agüera Soriano 2012 7

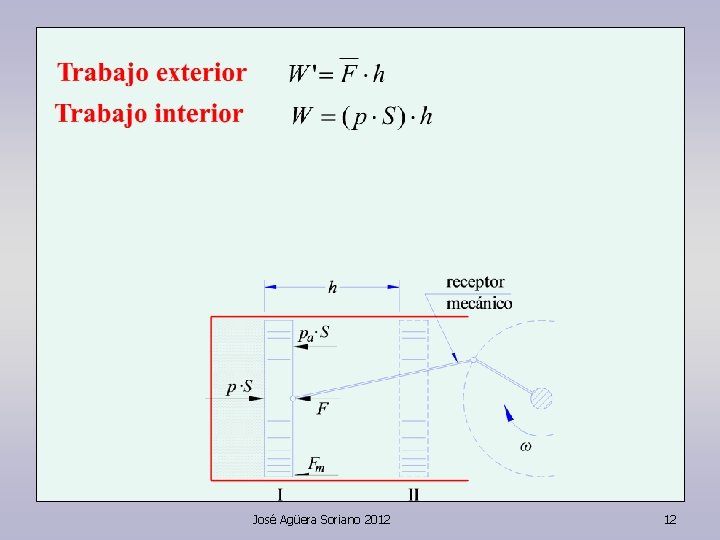
Al pasar el émbolo de I a II: José Agüera Soriano 2012 8

Al pasar el émbolo de I a II: El calor y el trabajo son energías de paso que cruzan los límites del sistema: ambas energías modifican el estado del mismo y con ello su energía interna; pero una vez que pasaron, dejan de ser calor y trabajo. José Agüera Soriano 2012 9

José Agüera Soriano 2012 10

José Agüera Soriano 2012 11

José Agüera Soriano 2012 12

José Agüera Soriano 2012 13

José Agüera Soriano 2012 14

José Agüera Soriano 2012 15

José Agüera Soriano 2012 16

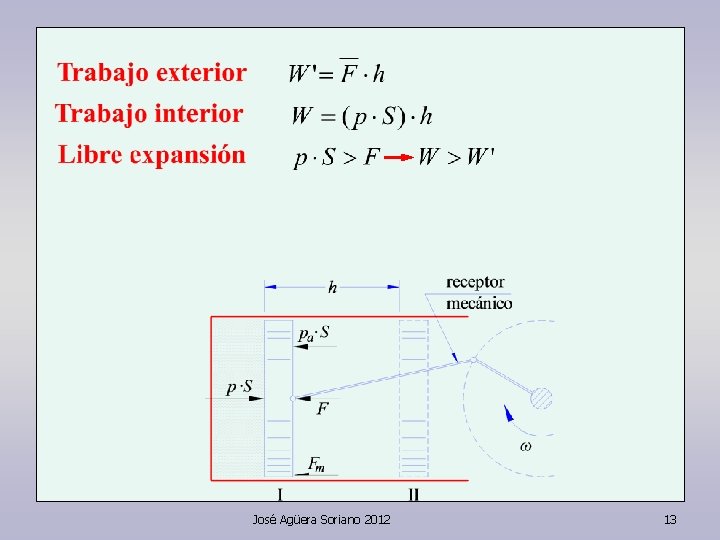
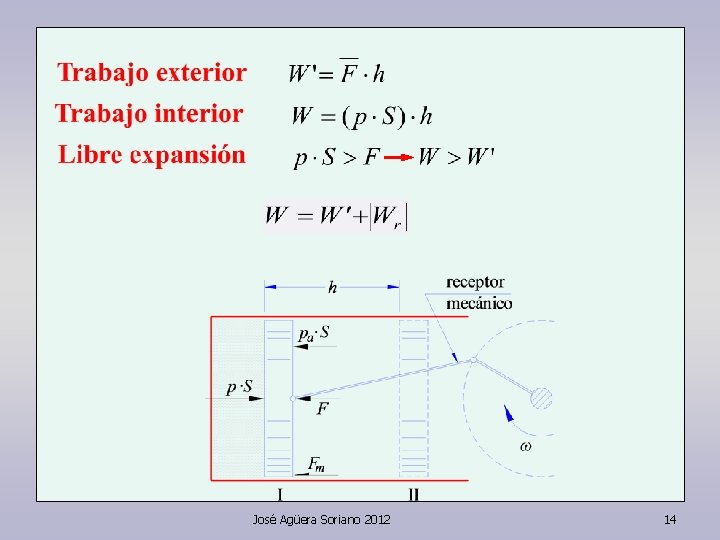
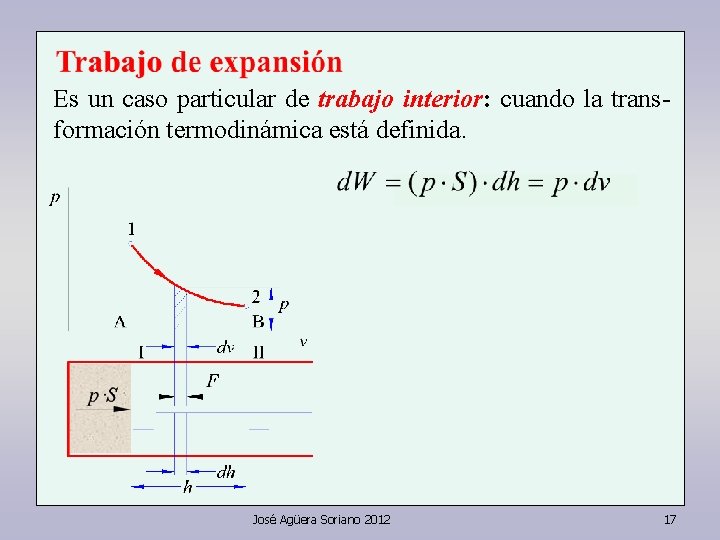
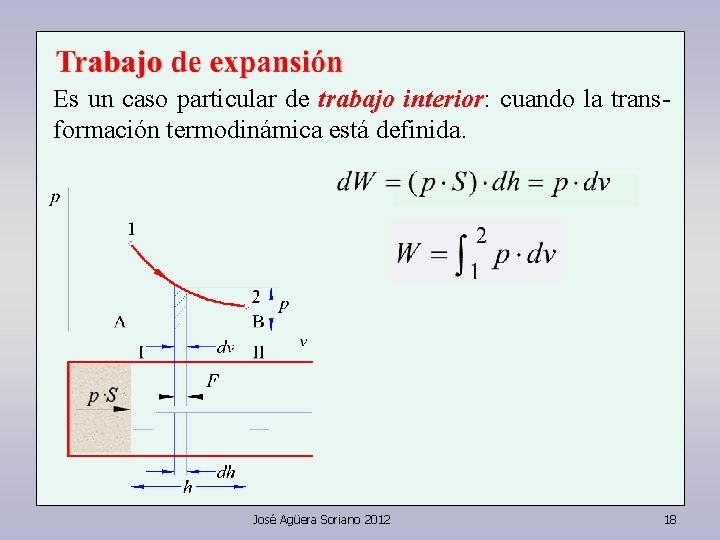
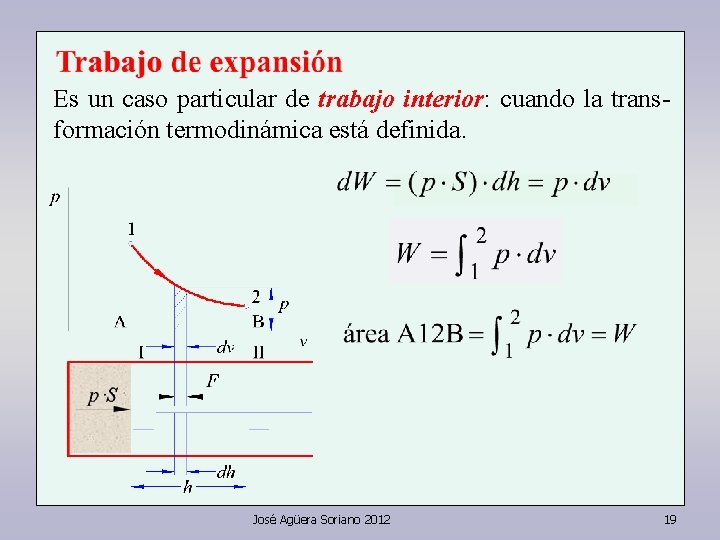
Es un caso particular de trabajo interior: cuando la transformación termodinámica está definida. José Agüera Soriano 2012 17

Es un caso particular de trabajo interior: cuando la transformación termodinámica está definida. José Agüera Soriano 2012 18

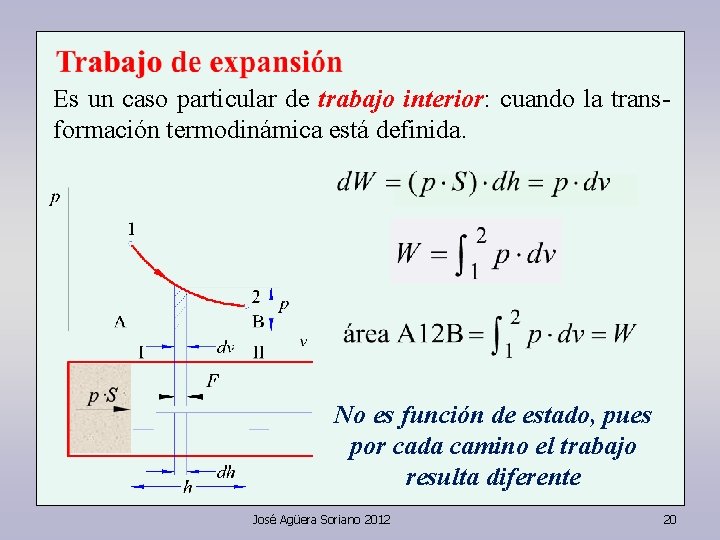
Es un caso particular de trabajo interior: cuando la transformación termodinámica está definida. José Agüera Soriano 2012 19

Es un caso particular de trabajo interior: cuando la transformación termodinámica está definida. No es función de estado, pues por cada camino el trabajo resulta diferente José Agüera Soriano 2012 20

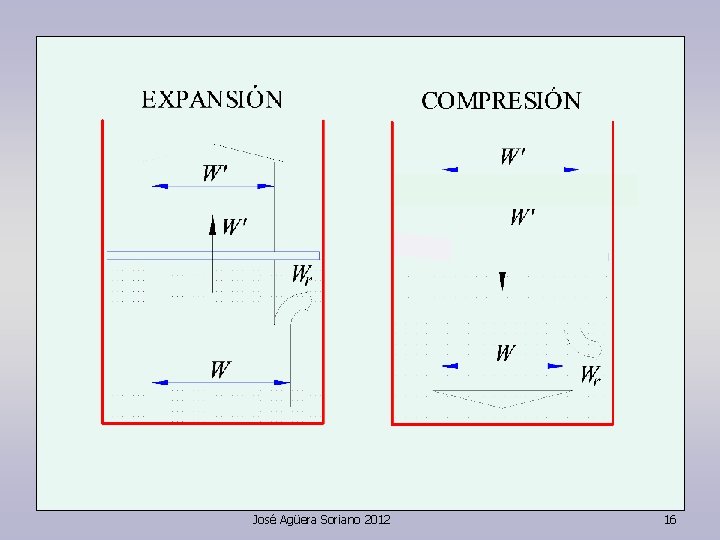
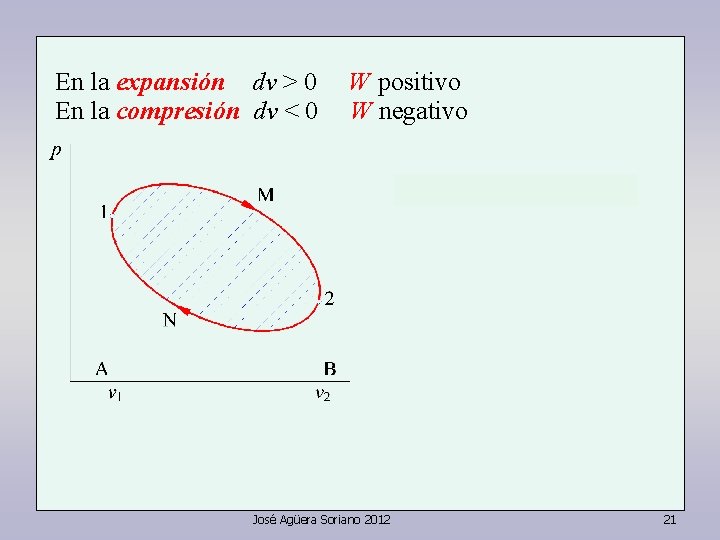
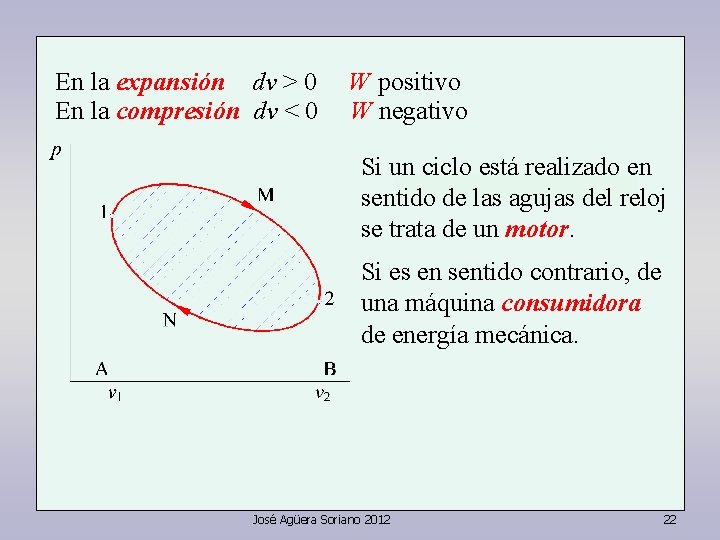
En la expansión dv > 0 En la compresión dv < 0 W positivo W negativo José Agüera Soriano 2012 21

En la expansión dv > 0 En la compresión dv < 0 W positivo W negativo Si un ciclo está realizado en sentido de las agujas del reloj se trata de un motor. Si es en sentido contrario, de una máquina consumidora de energía mecánica. José Agüera Soriano 2012 22

En la expansión dv > 0 En la compresión dv < 0 W positivo W negativo Si un ciclo está realizado en sentido de las agujas del reloj se trata de un motor. Si es en sentido contrario, de una máquina consumidora de energía mecánica. W = área A 1 M 2 B - área A 1 N 2 B José Agüera Soriano 2012 23

Primer principio En función del trabajo exterior José Agüera Soriano 2012 24

Primer principio En función del trabajo exterior En función del trabajo interior José Agüera Soriano 2012 25

Primer principio En función del trabajo exterior En función del trabajo interior En función del trabajo de expansión José Agüera Soriano 2012 26

Primer principio En función del trabajo exterior En función del trabajo interior En función del trabajo de expansión Wr lo hemos pasado al primer miembro porque ejerce sobre el sistema el mismo efecto que una recepción de calor. José Agüera Soriano 2012 27

Trabajo de expansión en las transformaciones teóricas • Isócoras, o a volumen constante 28

Trabajo de expansión en las transformaciones teóricas • Isócoras, o a volumen constante • Isobaras, o a presión constante 29

Trabajo de expansión en las transformaciones teóricas • Isócoras, o a volumen constante • Isobaras, o a presión constante 30

Trabajo de expansión en las transformaciones teóricas • Isócoras, o a volumen constante • Isobaras, o a presión constante gas perfecto (p v = R T) 31

• Isotermas gas perfecto (p v = R T) José Agüera Soriano 2012 32

• Isotermas gas perfecto (p v = R T) José Agüera Soriano 2012 33

• Isotermas gas perfecto (p v = R T) José Agüera Soriano 2012 34

• Adiabáticas José Agüera Soriano 2012 35

• Adiabáticas José Agüera Soriano 2012 36

• Adiabáticas José Agüera Soriano 2012 37

• Adiabáticas gas perfecto (p v = R T) José Agüera Soriano 2012 38

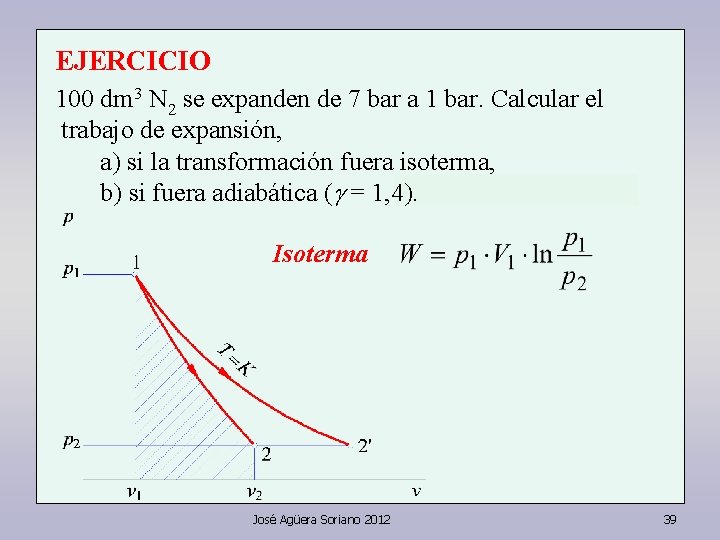
EJERCICIO 100 dm 3 N 2 se expanden de 7 bar a 1 bar. Calcular el trabajo de expansión, a) si la transformación fuera isoterma, b) si fuera adiabática ( = 1, 4). Isoterma José Agüera Soriano 2012 39

EJERCICIO 100 dm 3 N 2 se expanden de 7 bar a 1 bar. Calcular el trabajo de expansión, a) si la transformación fuera isoterma, b) si fuera adiabática ( = 1, 4). Isoterma José Agüera Soriano 2012 40

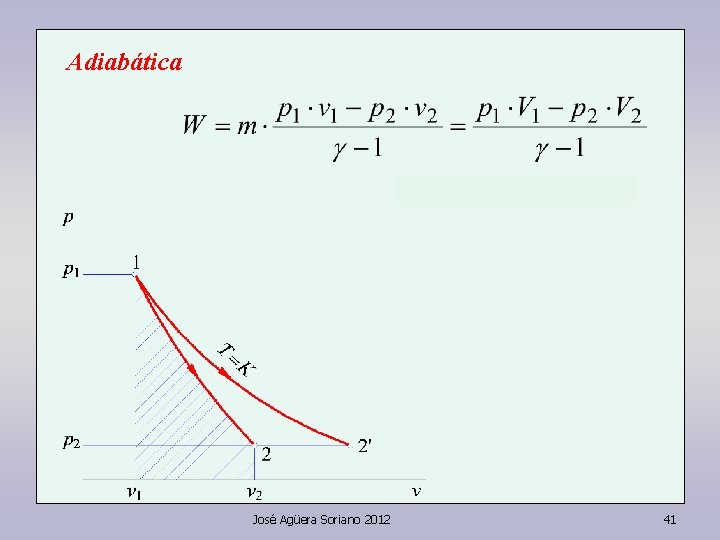
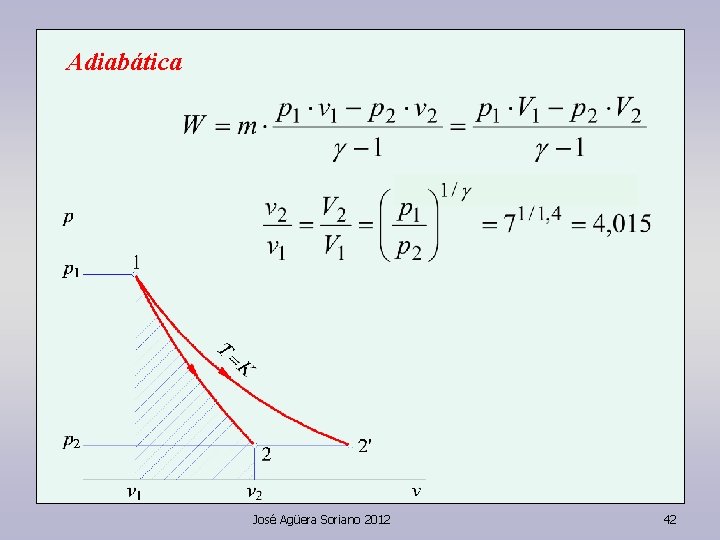
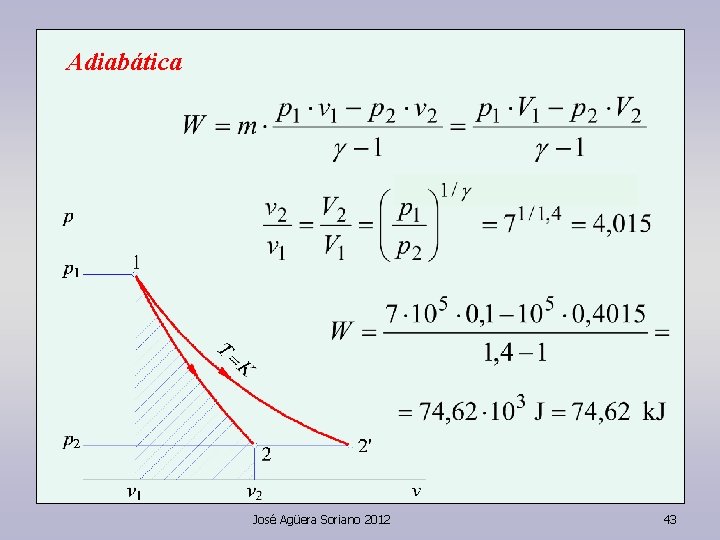
Adiabática José Agüera Soriano 2012 41

Adiabática José Agüera Soriano 2012 42

Adiabática José Agüera Soriano 2012 43

Como las p que aparecen en la ecuación de estado son absolutas, en el trabajo de expansión hay que pasarlas a relativas retándole la presión atmosférica pa para obtener el trabajo útil: José Agüera Soriano 2012 44

Como las p que aparecen en la ecuación de estado son absolutas, en el trabajo de expansión hay que pasarlas a relativas retándole la presión atmosférica pa para obtener el trabajo útil: José Agüera Soriano 2012 45

Como las p que aparecen en la ecuación de estado son absolutas, en el trabajo de expansión hay que pasarlas a relativas retándole la presión atmosférica pa para obtener el trabajo útil: En transformaciones cerradas, o ciclos, la presión atmosférica queda compensada. El área del ciclo no se ve afectada. José Agüera Soriano 2012 46

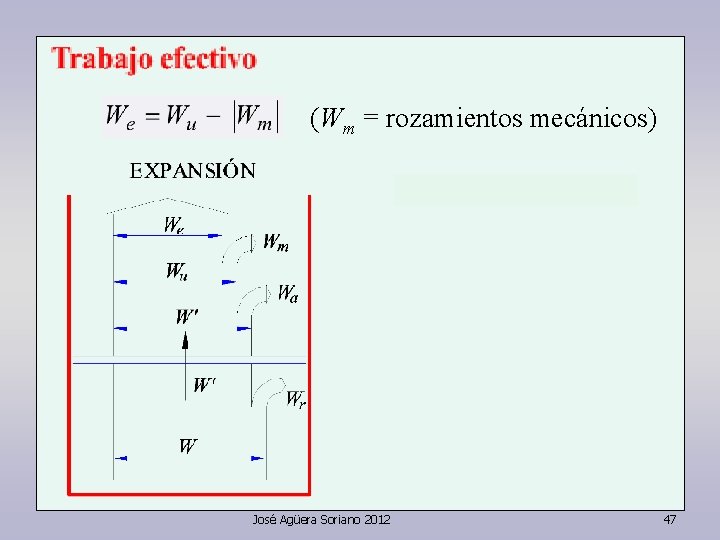
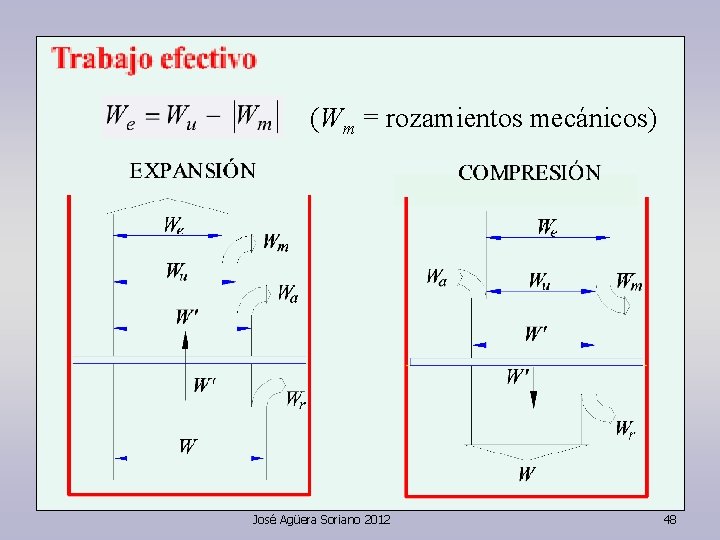
(Wm = rozamientos mecánicos) José Agüera Soriano 2012 47

(Wm = rozamientos mecánicos) José Agüera Soriano 2012 48

SISTEMAS ABIERTOS Energía de un flujo. interna (u), presión (p/ = p v) cinética (c 2/2), posición (g z) José Agüera Soriano 2012 49

SISTEMAS ABIERTOS Energía de un flujo. interna (u), presión (p/ = p v) cinética (c 2/2), posición (g z) José Agüera Soriano 2012 50

SISTEMAS ABIERTOS Energía de un flujo. interna (u), presión (p/ = p v) cinética (c 2/2), posición (g z) Entalpía José Agüera Soriano 2012 51

Primer principio en función de la entalpía José Agüera Soriano 2012 52

Primer principio en función de la entalpía Sustituyendo en, José Agüera Soriano 2012 53

Primer principio en función de la entalpía Sustituyendo en, se obtiene: José Agüera Soriano 2012 54

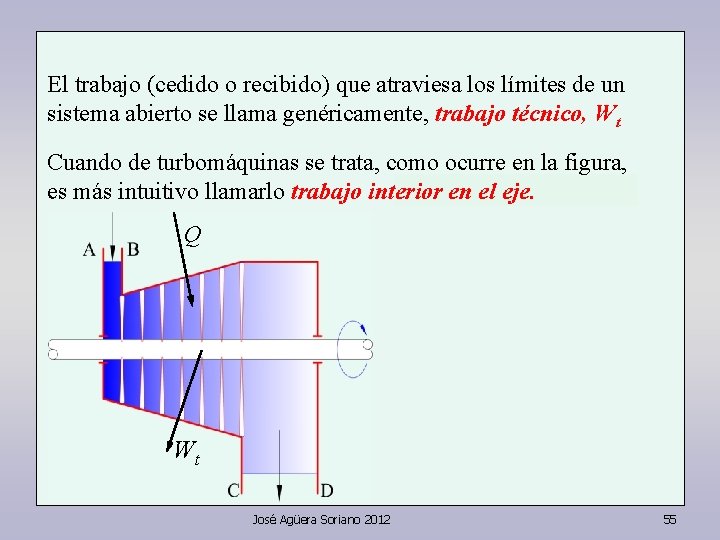
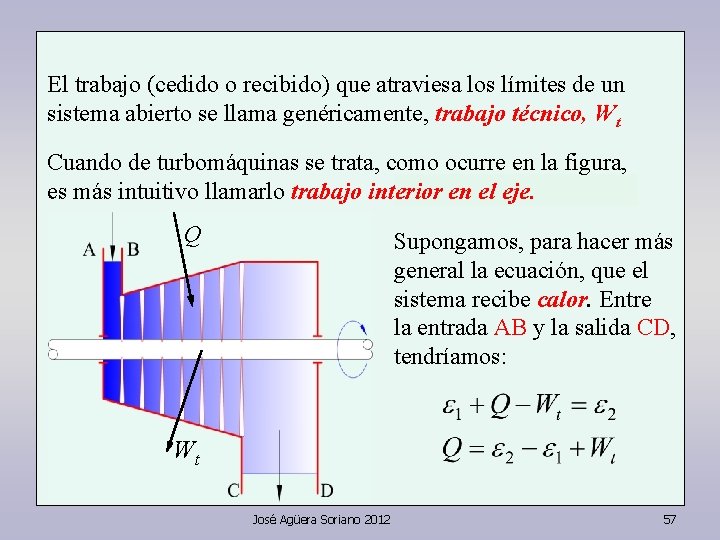
El trabajo (cedido o recibido) que atraviesa los límites de un sistema abierto se llama genéricamente, trabajo técnico, Wt Cuando de turbomáquinas se trata, como ocurre en la figura, es más intuitivo llamarlo trabajo interior en el eje. Q Wt José Agüera Soriano 2012 55

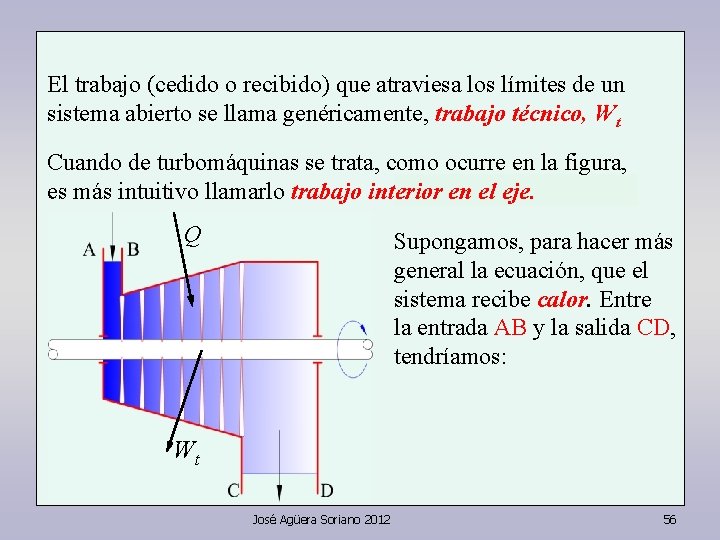
El trabajo (cedido o recibido) que atraviesa los límites de un sistema abierto se llama genéricamente, trabajo técnico, Wt Cuando de turbomáquinas se trata, como ocurre en la figura, es más intuitivo llamarlo trabajo interior en el eje. Q Supongamos, para hacer más general la ecuación, que el sistema recibe calor. Entre la entrada AB y la salida CD, tendríamos: Wt José Agüera Soriano 2012 56

El trabajo (cedido o recibido) que atraviesa los límites de un sistema abierto se llama genéricamente, trabajo técnico, Wt Cuando de turbomáquinas se trata, como ocurre en la figura, es más intuitivo llamarlo trabajo interior en el eje. Q Supongamos, para hacer más general la ecuación, que el sistema recibe calor. Entre la entrada AB y la salida CD, tendríamos: Wt José Agüera Soriano 2012 57

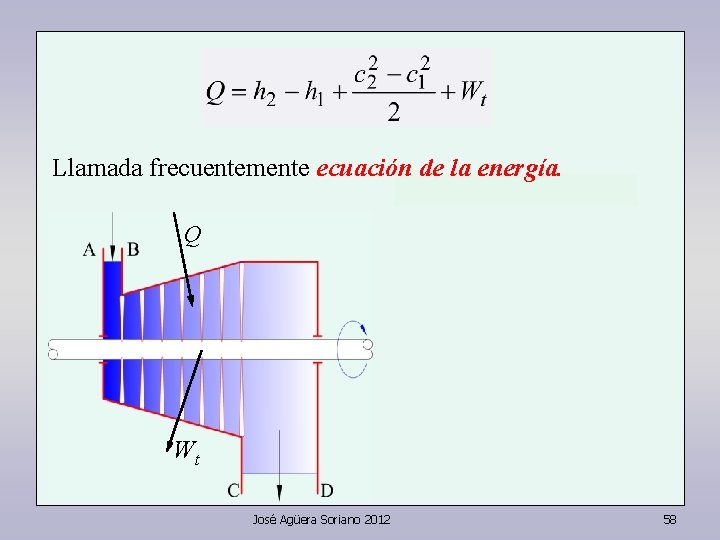
Llamada frecuentemente ecuación de la energía. Q Wt José Agüera Soriano 2012 58

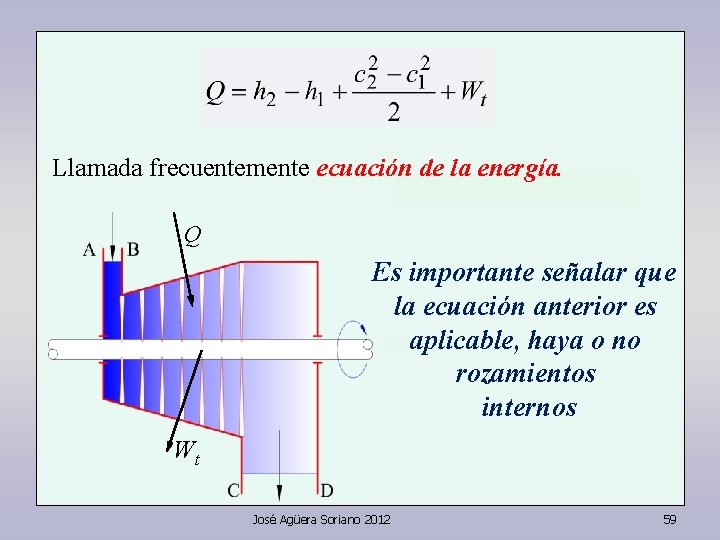
Llamada frecuentemente ecuación de la energía. Q Es importante señalar que la ecuación anterior es aaaplicable, haya o no rozamientos internos Wt José Agüera Soriano 2012 59

Primer principio en función de la entalpía: José Agüera Soriano 2012 60

Primer principio en función de la entalpía: Ecuación de la energía: José Agüera Soriano 2012 61

Primer principio en función de la entalpía: Ecuación de la energía: Restando ambas miembro a miembro: José Agüera Soriano 2012 62

José Agüera Soriano 2012 63

José Agüera Soriano 2012 64

Cualquier cuestión que se nos presente de sistemas abiertos, podrá resolverse partiendo de una de estas dos expresiones. José Agüera Soriano 2012 65

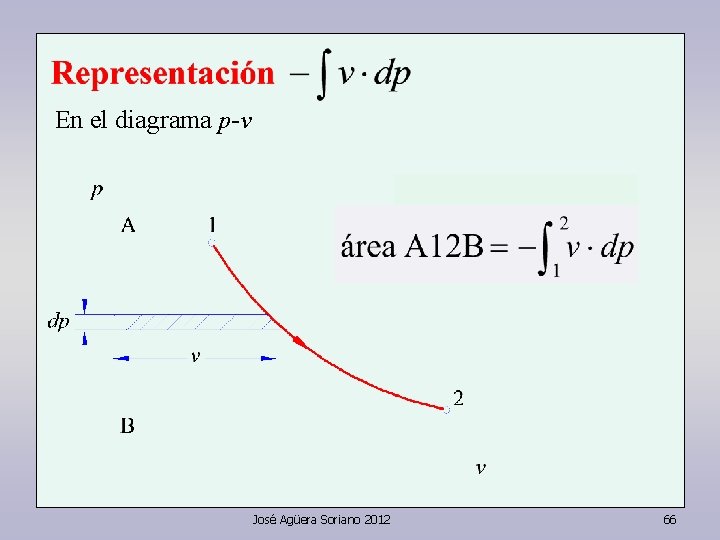
En el diagrama p-v José Agüera Soriano 2012 66

Valoración de la integral • Isobaras José Agüera Soriano 2012 67

Valoración de la integral • Isobaras • Isócoras José Agüera Soriano 2012 68

Valoración de la integral • Isobaras • Isócoras gas perfecto (p v = R T) José Agüera Soriano 2012 69

• Isotermas: gas perfecto (p v = R T) José Agüera Soriano 2012 70

• Isotermas: gas perfecto (p v = R T) José Agüera Soriano 2012 71

• Isotermas: gas perfecto (p v = R T) José Agüera Soriano 2012 72

• Adiabáticas José Agüera Soriano 2012 73

• Adiabáticas José Agüera Soriano 2012 74

• Adiabáticas José Agüera Soriano 2012 75

• Adiabáticas gas perfecto (p v = R T) José Agüera Soriano 2012 76

IRREVERSIBILIDAD En Termodinámica es usual hablar de irreversibilidad cuando hay destrucción de exergía. Así pues, • proceso irreversible • destrucción de exergía • generación de anergía • transformación de exergía en anergía son denominaciones indistintas José Agüera Soriano 2012 77

IRREVERSIBILIDAD MECÁNICA José Agüera Soriano 2012 78

IRREVERSIBILIDAD MECÁNICA José Agüera Soriano 2012 79

IRREVERSIBILIDAD MECÁNICA José Agüera Soriano 2012 80

IRREVERSIBILIDAD MECÁNICA Este último sería el único proceso realmente reversible José Agüera Soriano 2012 81

En dos de los cuatro casos anteriores, Wr = 0: Cuando no hay rozamientos internos (Wr = 0), hablaremos de la transformación reversible José Agüera Soriano 2012 82

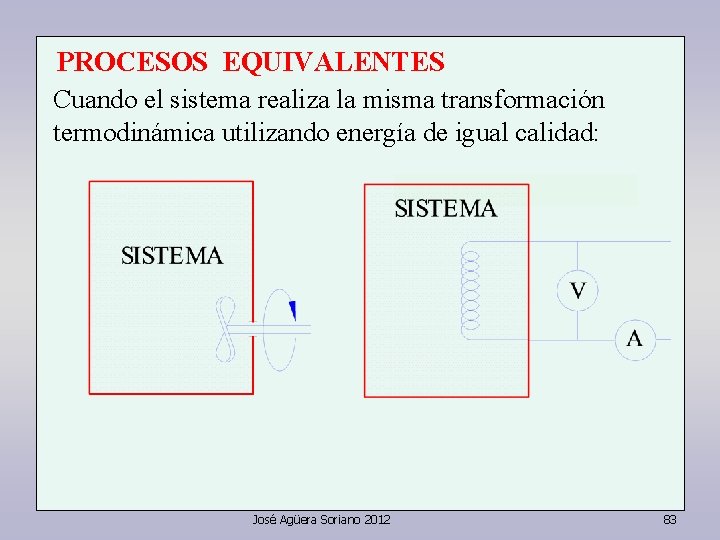
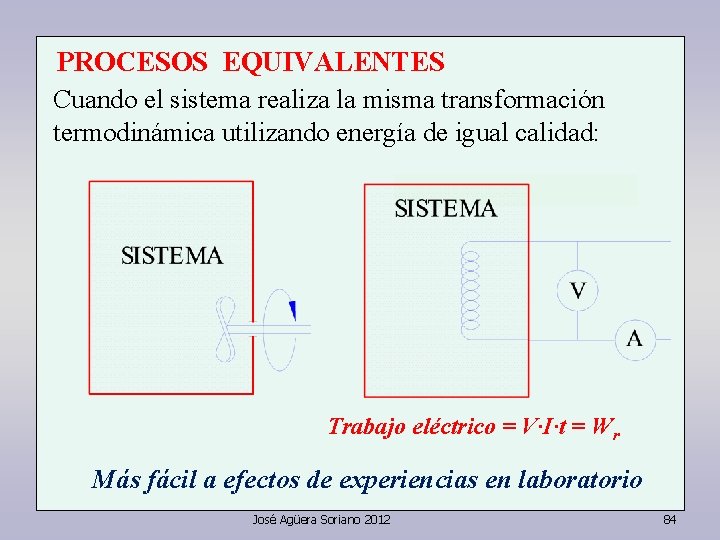
PROCESOS EQUIVALENTES Cuando el sistema realiza la misma transformación termodinámica utilizando energía de igual calidad: José Agüera Soriano 2012 83

PROCESOS EQUIVALENTES Cuando el sistema realiza la misma transformación termodinámica utilizando energía de igual calidad: Trabajo eléctrico = V·I·t = Wr Más fácil a efectos de experiencias en laboratorio José Agüera Soriano 2012 84

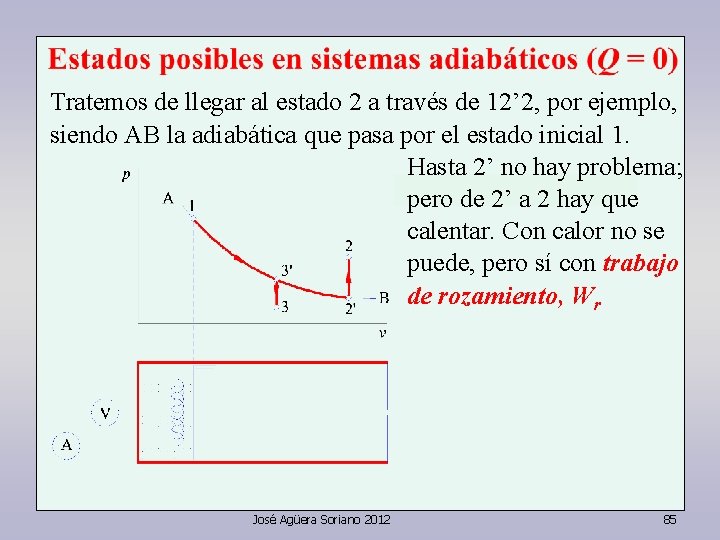
Tratemos de llegar al estado 2 a través de 12’ 2, por ejemplo, siendo AB la adiabática que pasa por el estado inicial 1. Hasta 2’ no hay problema; pero de 2’ a 2 hay que calentar. Con calor no se puede, pero sí con trabajo de rozamiento, Wr José Agüera Soriano 2012 85

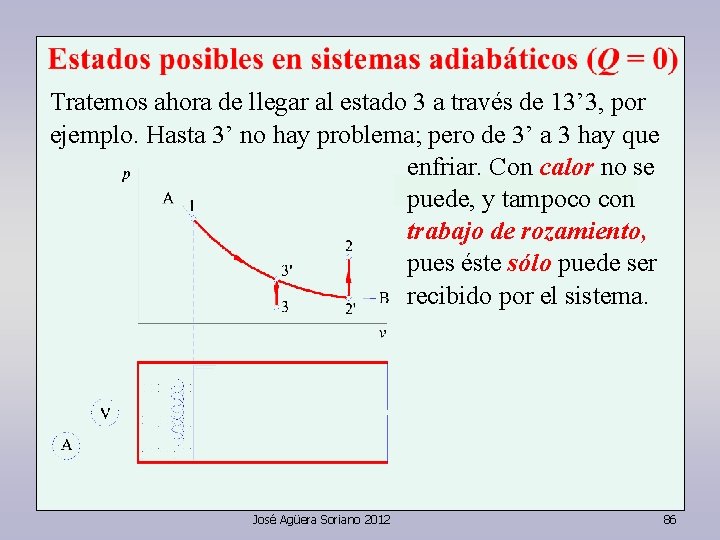
Tratemos ahora de llegar al estado 3 a través de 13’ 3, por ejemplo. Hasta 3’ no hay problema; pero de 3’ a 3 hay que enfriar. Con calor no se puede, y tampoco con trabajo de rozamiento, pues éste sólo puede ser recibido por el sistema. José Agüera Soriano 2012 86

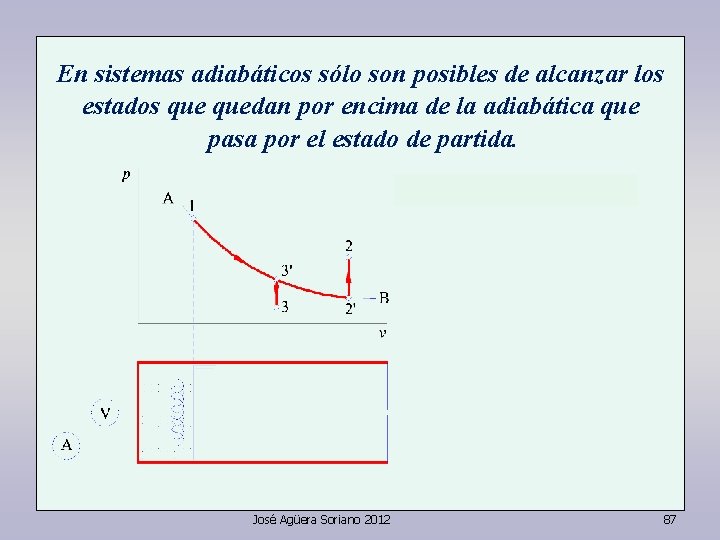
En sistemas adiabáticos sólo son posibles de alcanzar los estados quedan por encima de la adiabática que pasa por el estado de partida. José Agüera Soriano 2012 87

Sólo pueden realizarse aquellas cuyo estado conseguido esté por encima de la adiabática que pasa por el estado anterior, en cuyo caso podrían realizarse todas pero un solo sentido; a excepción de la adiabática que puede realizarse en ambos sentidos. T=K José Agüera Soriano 2012 88

Se puede pasar de 1 a 2 por infinitos caminos, 1 M 2 por ejemplo, pero no por todos; sólo por aquellos en los que cada estado conseguido esté por encima de la adiabática que pasa por el estado anterior. Por ejemplo, por el camino 134562, sólo se podría llegar hasta el estado 6. José Agüera Soriano 2012 89

(Wr = 0) Q=0 +Q -Q -Q Las que antes sí podían realizar con trabajo de rozamiento, ahora se realizarían recibiendo calor. Las que no podían realizarse, ahora sí: cediendo calor el sistema. Q=0 José Agüera Soriano 2012 90

a) Si Q = 0 ¿Se pueden realizar las transformaciones de la figura? José Agüera Soriano 2012 91

a) Si Q = 0 ¿Se pueden realizar las transformaciones de la figura? 1 -2. Si (irreversible) José Agüera Soriano 2012 92

a) Si Q = 0 ¿Se pueden realizar las transformaciones de la figura? 1 -2. Si (irreversible) 2 -3. Si (irreversible) José Agüera Soriano 2012 93

a) Si Q = 0 ¿Se pueden realizar las transformaciones de la figura? 1 -2. Si (irreversible) 2 -3. Si (irreversible) 3 -4. Si (reversible) José Agüera Soriano 2012 94

a) Si Q = 0 ¿Se pueden realizar las transformaciones de la figura? 1 -2. Si (irreversible) 2 -3. Si (irreversible) 3 -4. Si (reversible) 4 -1. No José Agüera Soriano 2012 95

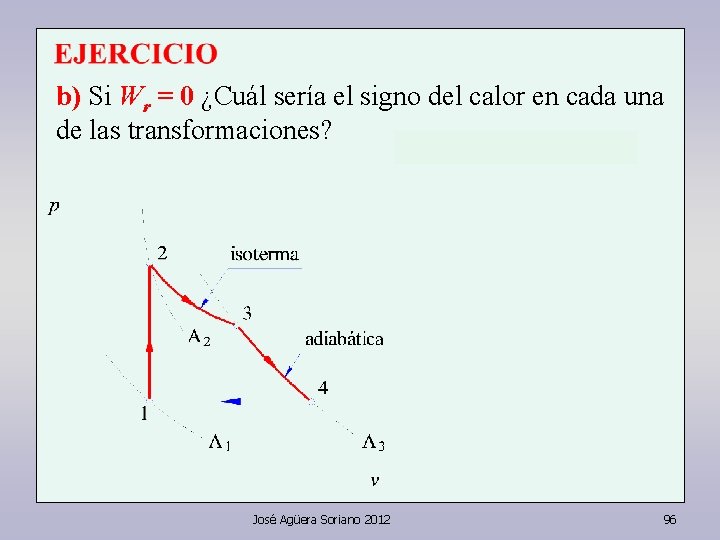
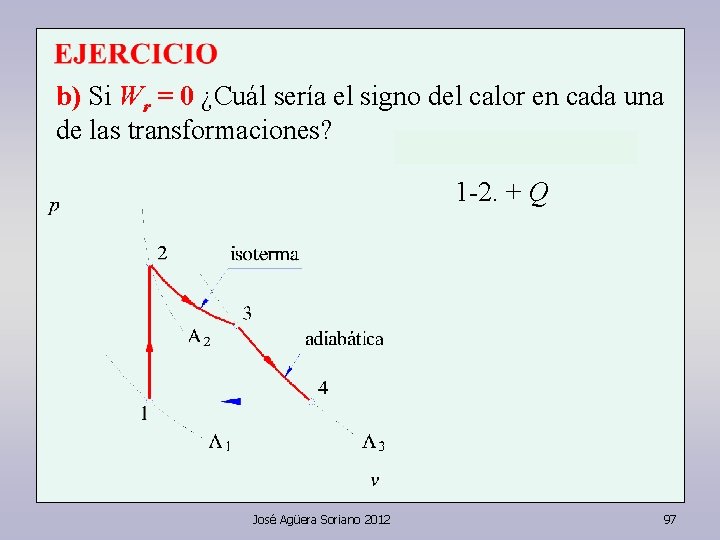
b) Si Wr = 0 ¿Cuál sería el signo del calor en cada una de las transformaciones? José Agüera Soriano 2012 96

b) Si Wr = 0 ¿Cuál sería el signo del calor en cada una de las transformaciones? 1 -2. + Q José Agüera Soriano 2012 97

b) Si Wr = 0 ¿Cuál sería el signo del calor en cada una de las transformaciones? 1 -2. + Q 2 -3. + Q José Agüera Soriano 2012 98

b) Si Wr = 0 ¿Cuál sería el signo del calor en cada una de las transformaciones? 1 -2. + Q 2 -3. + Q 3 -4. Q = 0 José Agüera Soriano 2012 99

b) Si Wr = 0 ¿Cuál sería el signo del calor en cada una de las transformaciones? 1 -2. + Q 2 -3. + Q 3 -4. Q = 0 4 -1. - Q José Agüera Soriano 2012 100

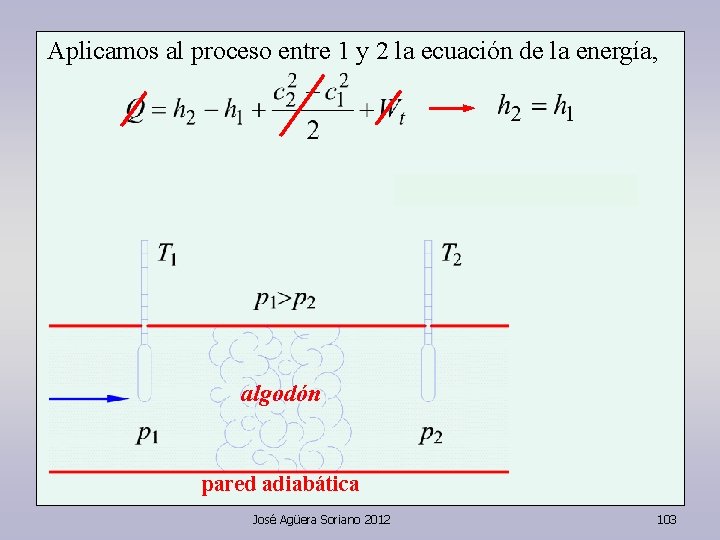
LEY DE JOULE Abramos la válvula V del dispositivo adiabático de la figura. En el proceso que tiene lugar, no interviene calor ni trabajo: pared adiabática A Joule se encontró con que la temperatura del gas no había variado; por tanto su energía interna depende sólo de la temperatura: José Agüera Soriano 2012 101

Joule obtuvo el mismo resultado con todos los gases ensayados. No quedó muy satisfecho, pues pensó que pequeñas absorciones de calor por las paredes, habrían podido falsear los resultados. Entonces, en unión de Lord Kelvin, decidieron hacer la la experiencia con un sistema abierto. La ventaja de éste es que, midiendo las temperaturas una vez que las paredes hayan adquirido su temperatura de régimen, las mediciones no quedarían falseadas por cesiones de calor a la pared. Ahora encontraron pequeñas diferencias de temperatura, aunque tanto menores cuando más se acercaba el gas a un gas perfecto. Con hidrógeno no hubo diferencia. José Agüera Soriano 2012 102

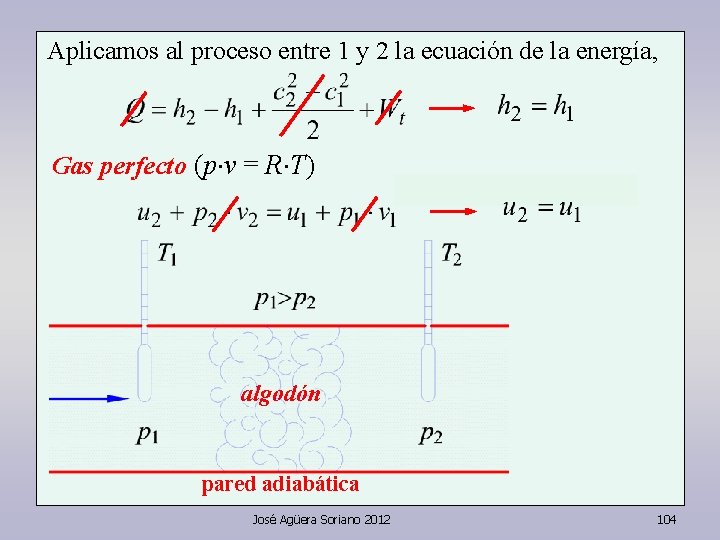
Aplicamos al proceso entre 1 y 2 la ecuación de la energía, algodón pared adiabática José Agüera Soriano 2012 103

Aplicamos al proceso entre 1 y 2 la ecuación de la energía, Gas perfecto (p v = R T) algodón pared adiabática José Agüera Soriano 2012 104

Aplicamos al proceso entre 1 y 2 la ecuación de la energía, Gas perfecto (p v = R T) algodón u = u(T) h = h(T) pared adiabática José Agüera Soriano 2012 105

José Agüera Soriano 2012 106

José Agüera Soriano 2012 107

Se llama capacidad calorífica al cociente entre la energía térmica recibida por el sistema y la variación de temperatura que como consecuencia sufre: José Agüera Soriano 2012 108

Se llama capacidad calorífica al cociente entre la energía térmica recibida por el sistema y la variación de temperatura que como consecuencia sufre: Por unidad de masa: José Agüera Soriano 2012 109

Se llama capacidad calorífica al cociente entre la energía térmica recibida por el sistema y la variación de temperatura que como consecuencia sufre: Por unidad de masa: El primer principio podría expresarse: José Agüera Soriano 2012 110

Capacidad calorífica a volumen constante José Agüera Soriano 2012 111

Capacidad calorífica a volumen constante Capacidad calorífica a presión constante José Agüera Soriano 2012 112

Capacidad calorífica a volumen constante Capacidad calorífica a presión constante Capacidad calorífica de las adiabáticas José Agüera Soriano 2012 113

Capacidad calorífica a volumen constante Capacidad calorífica a presión constante Capacidad calorífica de las adiabáticas Capacidad calorífica de la isotermas José Agüera Soriano 2012 114

• transformación 1 -2: c = +/+ = + • transformación 1 -3: c = -/- = + • transformación 1 -4: c = +/- = • transformación 1 -5: c = -/+ = - José Agüera Soriano 2012 115

• transformación 1 -2: c = +/+ = + • transformación 1 -3: c = -/- = + • transformación 1 -4: c = +/- = • transformación 1 -5: c = -/+ = La capacidad calorífica resulta negativa en las politrópicas entre la isoterma y la adiabática José Agüera Soriano 2012 116

Capacidades caloríficas de los gases perfectos: u = u(T) José Agüera Soriano 2012 117

Capacidades caloríficas de los gases perfectos: u = u(T) Derivando la entalpía: José Agüera Soriano 2012 118

Capacidades caloríficas de los gases perfectos: u = u(T) Derivando la entalpía: igualdad de Mayer José Agüera Soriano 2012 119

Según la teoría cinética de gases: gases monoatómicos, cv = 3·R/2 gases biatómicos, cv = 5·R/2 gases triatómicos, cv = 3 R José Agüera Soriano 2012 cp = 5·R/2 cp = 7·R/2 cp = 4 R 120

Según la teoría cinética de gases: gases monoatómicos, cv = 3·R/2 gases biatómicos, cv = 5·R/2 gases triatómicos, cv = 3 R cp = 5·R/2 cp = 7·R/2 cp = 4 R Es decir, ni siquiera dependen de la temperatura. Esto sólo es verdad para los monoatómicos. Para los demás gases, sus valores aumentan con la temperatura, como veremos en el capítulo IV. Los problemas de los capítulos II y III los resolveremos con estos valores constantes. José Agüera Soriano 2012 121

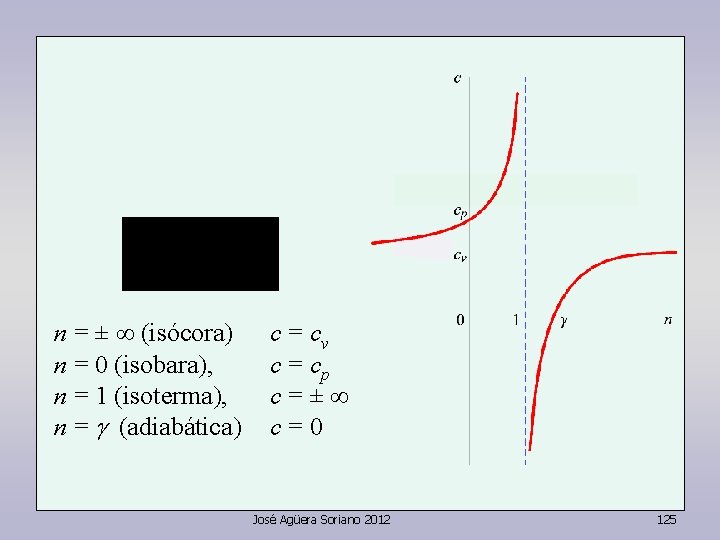
EJERCICIO Analizar cómo varía la capacidad calorífica en función del exponente politrópico n. Solución Para las politrópicas, José Agüera Soriano 2012 122

EJERCICIO Analizar cómo varía la capacidad calorífica en función del exponente politrópico n. Solución Para las politrópicas, José Agüera Soriano 2012 123

EJERCICIO Analizar cómo varía la capacidad calorífica en función del exponente politrópico n. Solución Para las politrópicas, José Agüera Soriano 2012 124

n = ± (isócora) n = 0 (isobara), n = 1 (isoterma), n = (adiabática) c = cv c = cp c=± c=0 José Agüera Soriano 2012 125

José Agüera Soriano 2012 126

Igualando y dividiendo miembro a miembro: José Agüera Soriano 2012 127

Igualando y dividiendo miembro a miembro: José Agüera Soriano 2012 128

Ecuación que ya habíamos establecido; pero sin conocer que el exponente adiabático era el cociente entre la capacidad calorífica a presión constante y la calorífica a volumen constante. José Agüera Soriano 2012 129

Ecuación que ya habíamos establecido; pero sin conocer que el exponente adiabático era el cociente entre la capacidad calorífica a presión constante y la calorífica a volumen constante. Según la teoría cinética de gases: gases monoatómicos: = 5/3 = 1, 66 gases biatómicos: = 7/5 = 1, 40 gases triatómicos: = 4/3 = 1, 33 José Agüera Soriano 2012 130

Ecuación que ya habíamos establecido; pero sin conocer que el exponente adiabático era el cociente entre la capacidad calorífica a presión constante y la calorífica a volumen constante. Según la teoría cinética de gases: gases monoatómicos: = 5/3 = 1, 66 gases biatómicos: = 7/5 = 1, 40 gases triatómicos: = 4/3 = 1, 33 Esto sólo es verdad para los monoatómicos. Para los demás gases, su valor es menor con temperaturas mayores, como veremos en el capítulo IV. Los problemas de los capítulos II y III los resolveremos con estos valores constantes. José Agüera Soriano 2012 131

origen del universo? José Agüera Soriano 2012 132

Figuras no incluidas en las diapositivas Problema 2. 3 Problema 2. 4 Problema 2. 6 Problema 2. 5 José Agüera Soriano 2012 133

Problema 2. 8 Problema 2. 9 Problema 2. 10 José Agüera Soriano 2012 134

Problema 2. 11 Problema 2. 12 José Agüera Soriano 2012 135

Problema 2. 13 Problema 2. 14 José Agüera Soriano 2012 136
 Altos del perdido soriano
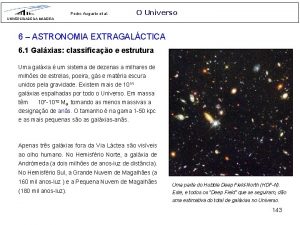
Altos del perdido soriano Mapa conceptual de las galaxias
Mapa conceptual de las galaxias Nervio trigemino origen real y aparente
Nervio trigemino origen real y aparente Laura soriano dieste
Laura soriano dieste Dr jaime soriano
Dr jaime soriano Juan soriano la niña muerta; the dead girl; dead infant
Juan soriano la niña muerta; the dead girl; dead infant Dr jaime soriano
Dr jaime soriano Laura soriano dieste
Laura soriano dieste Jesus soriano nsf
Jesus soriano nsf Tipos de contusiones
Tipos de contusiones Laura soriano dieste
Laura soriano dieste Jose aguera soriano
Jose aguera soriano Rafael molina soriano
Rafael molina soriano Soriano company is preparing its master
Soriano company is preparing its master Jose aguera soriano
Jose aguera soriano Poesia la mejor mama del universo
Poesia la mejor mama del universo Consagracion a cristo rey del universo
Consagracion a cristo rey del universo Que bello es ver a dios en cada cosa del universo
Que bello es ver a dios en cada cosa del universo Sol adivinanza del sistema solar
Sol adivinanza del sistema solar Creo en dios padre todopoderoso
Creo en dios padre todopoderoso La poesia es el eco de la melodia del universo
La poesia es el eco de la melodia del universo Objetivo del universo
Objetivo del universo Bendito seas padre dios del universo
Bendito seas padre dios del universo Expansion del universo
Expansion del universo Agradecido del universo
Agradecido del universo Elementos del universo
Elementos del universo Prraga
Prraga Universo medina del campo
Universo medina del campo Sistema solar
Sistema solar El origen del petroleo
El origen del petroleo Tesla universo
Tesla universo Aula 1 um universo de conflitos
Aula 1 um universo de conflitos Hay dos cosas infinitas el universo y la estupidez humana
Hay dos cosas infinitas el universo y la estupidez humana La via lactea y el sistema solar
La via lactea y el sistema solar El cosmo y el universo
El cosmo y el universo Zeus ocupa o trono do universo uel 2003
Zeus ocupa o trono do universo uel 2003 Adorai o rei do universo harpa cristã
Adorai o rei do universo harpa cristã Não me abandones senhor vem socorrer vem socorrer
Não me abandones senhor vem socorrer vem socorrer Muestra no representativa
Muestra no representativa Sistema ticonico
Sistema ticonico Orvoton
Orvoton Teoria geocentrica
Teoria geocentrica Rotacion y traslacion de marte
Rotacion y traslacion de marte Universo central de havona
Universo central de havona Helecho de barnsley
Helecho de barnsley Universo y muestra
Universo y muestra Universo e amostra
Universo e amostra Van gogh universo
Van gogh universo Ide batizai em nome do pai
Ide batizai em nome do pai El universo segun los griegos
El universo segun los griegos Miguel de nebadon
Miguel de nebadon De qué está formado el universo
De qué está formado el universo Localização da terra no universo
Localização da terra no universo Mercurio pluton
Mercurio pluton Salvington
Salvington Universo
Universo Universo
Universo Universo
Universo Autor
Autor Subtração de conjuntos
Subtração de conjuntos Conjunto universo
Conjunto universo Imagenes de cosmos y el universo
Imagenes de cosmos y el universo Universobit
Universobit Engenharia de produção universo
Engenharia de produção universo Ejemplo de muestreo aleatorio simple
Ejemplo de muestreo aleatorio simple University of galati
University of galati Corectează greșelile din propozițiile următoare
Corectează greșelile din propozițiile următoare Että, jotta, koska, kun, jos, vaikka kuin, kunnes
Että, jotta, koska, kun, jos, vaikka kuin, kunnes Jos oostveen
Jos oostveen Kas yra bendruomenė ir kodėl mums jos reikia
Kas yra bendruomenė ir kodėl mums jos reikia Jos van berkum
Jos van berkum Jos kuilboer
Jos kuilboer Bahs jos
Bahs jos Nandram
Nandram Još hrvatska ni propala note
Još hrvatska ni propala note Pliu palmar unic
Pliu palmar unic Figdge
Figdge Completează propoziţiile cu predicate potrivite
Completează propoziţiile cu predicate potrivite Budnica još hrvatska ni propala
Budnica još hrvatska ni propala Wayfaring stranger 1917 scene
Wayfaring stranger 1917 scene Drafbalken
Drafbalken Jos operating system
Jos operating system Jos jaspars
Jos jaspars U smrti se sniva
U smrti se sniva Shell process safety fundamentals
Shell process safety fundamentals Scrie aproximarea prin adaos a numărului
Scrie aproximarea prin adaos a numărului Portuguese speakers in macau
Portuguese speakers in macau Jos l.
Jos l. L calvo
L calvo Još hrvatska ni propala tekst
Još hrvatska ni propala tekst Confidental costa rica
Confidental costa rica Još hrvatska ni propala tekst
Još hrvatska ni propala tekst Vođa hrvatskog narodnog preporoda
Vođa hrvatskog narodnog preporoda Tumor de wilms
Tumor de wilms Josua 1 9 sei mutig und stark
Josua 1 9 sei mutig und stark Jos verlinden
Jos verlinden Stalin vs trotsky
Stalin vs trotsky Jos 1:9
Jos 1:9 Jos t
Jos t Jos t
Jos t La jos
La jos Jos van den enden
Jos van den enden Anomalie cromozomiala
Anomalie cromozomiala Suprafata olanda
Suprafata olanda Jos r
Jos r Jos r
Jos r Aria triunghiului formula
Aria triunghiului formula Organizarea datelor in tabele si reprezentarea lor grafica
Organizarea datelor in tabele si reprezentarea lor grafica Olanda monarhie
Olanda monarhie Jos i
Jos i Jos dobber
Jos dobber Koje životinje žive uz more
Koje životinje žive uz more Tipos de jos
Tipos de jos Citiți cu atenție textul de mai jos
Citiți cu atenție textul de mai jos Jostabes confituur
Jostabes confituur The valley foundation school of nursing
The valley foundation school of nursing Hello purr app inventor 2
Hello purr app inventor 2 Luis jos
Luis jos Dunarea de jos university of galati
Dunarea de jos university of galati Luis jos gallego
Luis jos gallego Maria jos
Maria jos Elevador de la escapula
Elevador de la escapula Relieve costero
Relieve costero Definicion sexting
Definicion sexting Origen del termino romanticismo
Origen del termino romanticismo Fosa craneal anterior media y posterior
Fosa craneal anterior media y posterior Origen del dua
Origen del dua Origen del derecho
Origen del derecho Musculo semitendinoso insercion
Musculo semitendinoso insercion Musculos cervicales
Musculos cervicales Musculos corrugador de la ceja
Musculos corrugador de la ceja Origen del musculo elevador de la escapula
Origen del musculo elevador de la escapula El capishca origen
El capishca origen El origen del pecado menu
El origen del pecado menu Que significa la palabra teatro en griego
Que significa la palabra teatro en griego Grooming concepto
Grooming concepto Origen del teatro barroco
Origen del teatro barroco