Organick sloueniny obsahujc kyslk Jana Novotn Elektronov konfigurace

Organické sloučeniny obsahující kyslík Jana Novotná

Elektronová konfigurace atomu kyslíku 1 s 2 2 p 4 Z elektronové konfigurace kyslíku vyplývá, že v molekule organické sloučeniny může být kovalentně vázán jako dvojvazný. O dvě s vazby O jedna vazba s a jedna p

Sloučeniny obsahující kyslík l l Komplexní molekuly - cukry, tuky, bílkoviny, nukleové kyseliny. Jednodušší sloučeniny: ¡ alkoholy, fenoly, ethery, aldehydy, ketony, karboxylové kyseliny, estery.
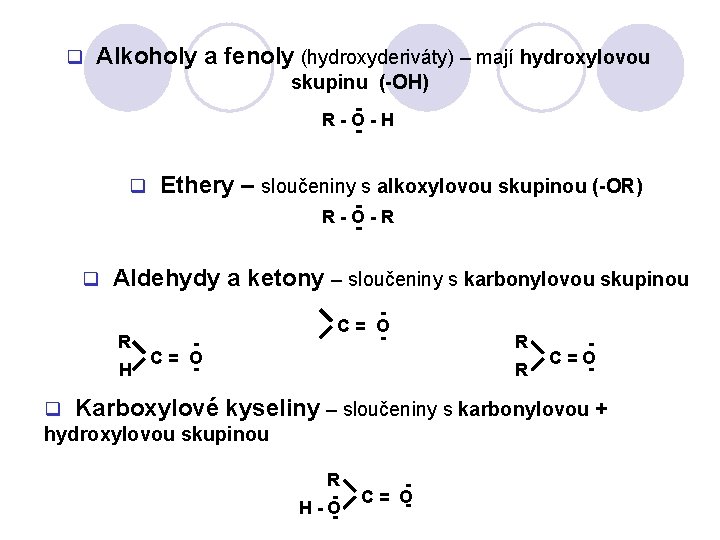
q Alkoholy a fenoly (hydroxyderiváty) – mají hydroxylovou skupinu (-OH) R-O-H q Ethery – sloučeniny s alkoxylovou skupinou (-OR) R-O-R q Aldehydy a ketony – sloučeniny s karbonylovou skupinou R C= O H C= O - R R C=O - q Karboxylové kyseliny – sloučeniny s karbonylovou + hydroxylovou skupinou R H -O - - C = O-

Alkoholy
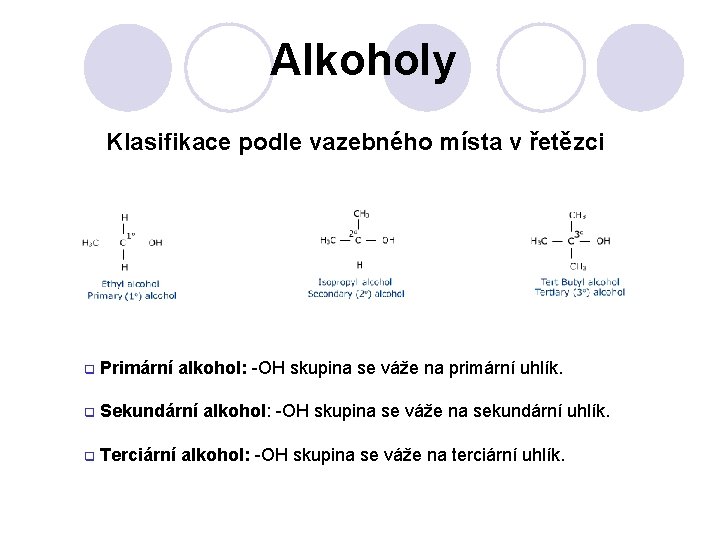
Alkoholy Klasifikace podle vazebného místa v řetězci q Primární alkohol: -OH skupina se váže na primární uhlík. q Sekundární alkohol: -OH skupina se váže na sekundární uhlík. q Terciární alkohol: -OH skupina se váže na terciární uhlík.

Alkoholy Podle počtu –OH skupin rozlišujeme: q Monohydroxyderiváty, jednosytné alkoholy Polyhydroxyderiváty q Dioly, dvojsytné (dihydroxyderiváty) q Trioly, trojsytné (trihydroxyderiváty) q Polyoly, vícesytné, patří do skupiny sacharidů Fenoly - skupina -OH se přímo váže na aromatické jádro q

Klasifikace alkoholů Alkoholy s nižší molekulovou váhou - kromě běžných názvů se slovo alkohol přidává za jméno alkylové skupiny, na kterou se váže hydroxylová skupina: q methanol – methylalkohol ethanol – ethylalkohol 1 -propanol – propylalkohol 2 -propanol – isopropylalkohol 1 -butanol – n-butylalkohol CH 3 -OH CH 3 -CH 2 -CH 2 -OH CH 3 -CH-CH 3 OH CH 3 -CH 2 -CH 2 -OH

Vlastnosti alkoholů Nižší alkoholy – bezbarvé tekutiny, charakteristický zápach (od C 4 nepříjemný), narkotický účinek, toxické. q Polyhydroxyalkoholy - sladká chuť. q Vyšší alkoholy (od C 12) – pevné látky. q Prodlužováním uhlovodíkového řetězce se snižuje rozpustnost alkoholů ve vodě. q H-můstky → rozpustnost ve vodě, vyšší bod varu než alkany. q
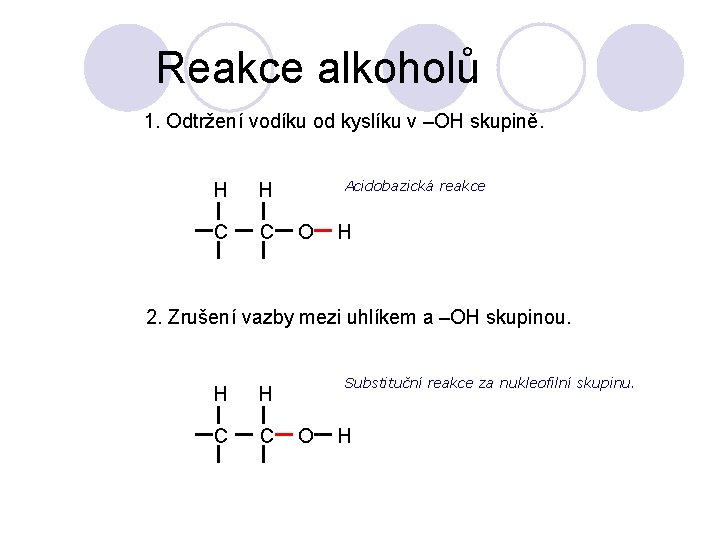
Reakce alkoholů 1. Odtržení vodíku od kyslíku v –OH skupině. H H C C Acidobazická reakce O H 2. Zrušení vazby mezi uhlíkem a –OH skupinou. H H C C Substituční reakce za nukleofilní skupinu. O H
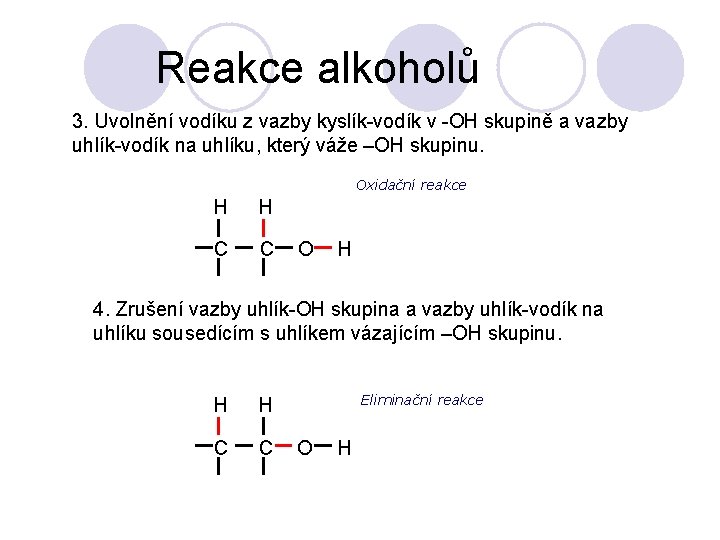
Reakce alkoholů 3. Uvolnění vodíku z vazby kyslík-vodík v -OH skupině a vazby uhlík-vodík na uhlíku, který váže –OH skupinu. Oxidační reakce H H C C O H 4. Zrušení vazby uhlík-OH skupina a vazby uhlík-vodík na uhlíku sousedícím s uhlíkem vázajícím –OH skupinu. H H C C Eliminační reakce O H

Vlastnosti alkoholů Polarita vazby mezi kyslíkem a vodíkem v OH skupině vyvolává slabě kyselý charakter. q Chovají se jako kyselina i jako zásada, stejně jako voda. q q Schopnost tvořit soli – alkoholáty. http: //en. wikipedia. org/wiki/Alcohol#Physical_and_chemical_properties
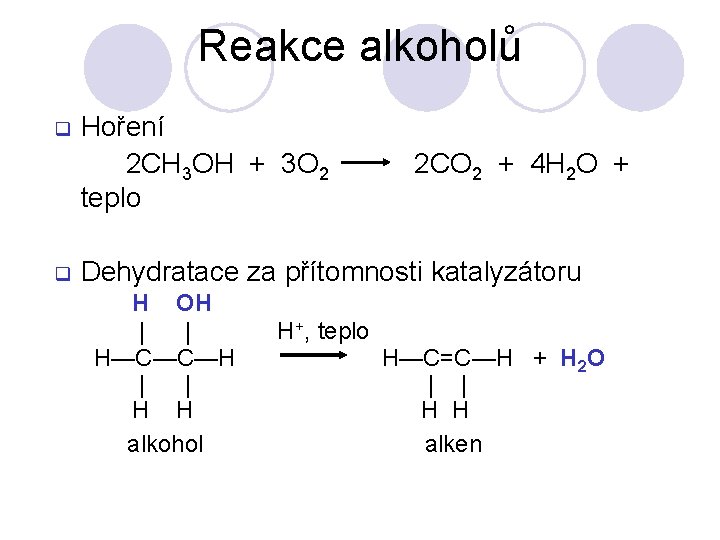
Reakce alkoholů q q Hoření 2 CH 3 OH + 3 O 2 teplo 2 CO 2 + 4 H 2 O + Dehydratace za přítomnosti katalyzátoru H OH | | H—C—C—H | | H H alkohol H+, teplo H—C=C—H + H 2 O | | H H alken
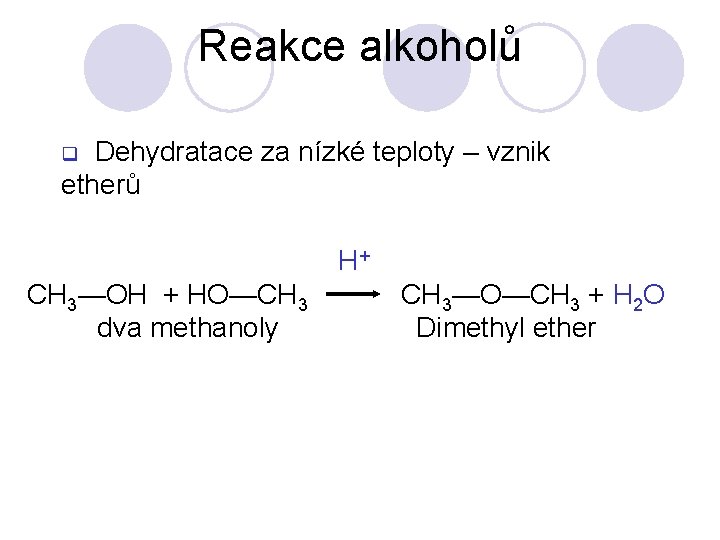
Reakce alkoholů Dehydratace za nízké teploty – vznik etherů q H+ CH 3—OH + HO—CH 3 dva methanoly CH 3—O—CH 3 + H 2 O Dimethyl ether
![Oxidace primárních alkoholů q Při oxidaci primárních alkoholů [O] dochází ke ztrátě H z Oxidace primárních alkoholů q Při oxidaci primárních alkoholů [O] dochází ke ztrátě H z](http://slidetodoc.com/presentation_image_h/8f3a32485e29fe603a5d67b81d31f280/image-15.jpg)
Oxidace primárních alkoholů q Při oxidaci primárních alkoholů [O] dochází ke ztrátě H z –OH skupiny a druhého H, který je vázán na primární C. [O] Primární alkohol OH | CH 3—C—H | H Ethanol (ethyl alkohol) Aldehyd [O] O || CH 3—C—H + H 2 O Ethanal (acetaldehyd)
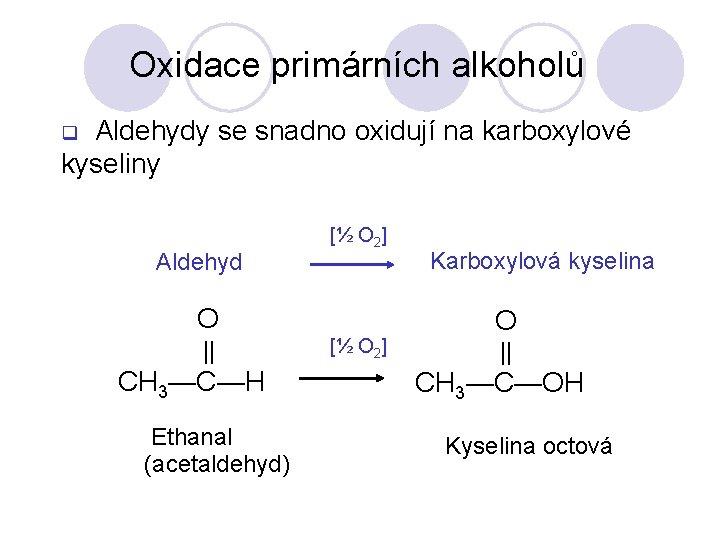
Oxidace primárních alkoholů Aldehydy se snadno oxidují na karboxylové kyseliny q Aldehyd [½ O 2] O || CH 3—C—H Ethanal (acetaldehyd) [½ O 2] Karboxylová kyselina O || CH 3—C—OH Kyselina octová
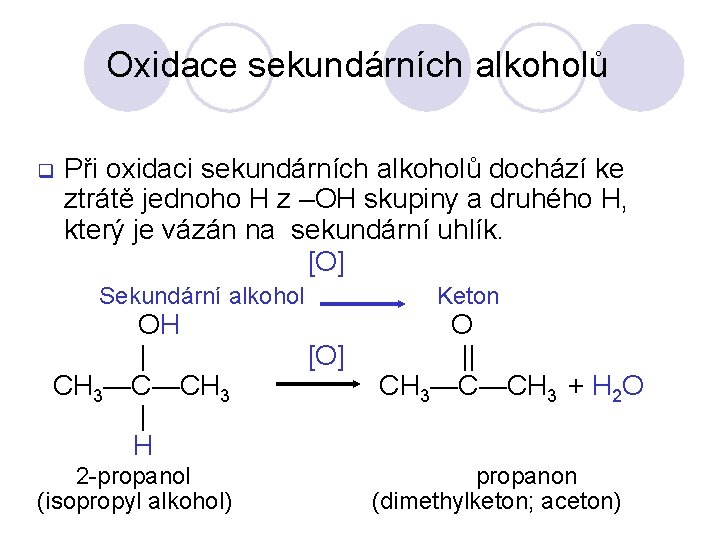
Oxidace sekundárních alkoholů q Při oxidaci sekundárních alkoholů dochází ke ztrátě jednoho H z –OH skupiny a druhého H, který je vázán na sekundární uhlík. [O] Sekundární alkohol OH | CH 3—C—CH 3 | H 2 -propanol (isopropyl alkohol) Keton [O] O || CH 3—C—CH 3 + H 2 O propanon (dimethylketon; aceton)
![Oxidace terciárních alkoholů q Terciární alkoholy se neoxidují. [O] Terciární alkohol není reakce OH Oxidace terciárních alkoholů q Terciární alkoholy se neoxidují. [O] Terciární alkohol není reakce OH](http://slidetodoc.com/presentation_image_h/8f3a32485e29fe603a5d67b81d31f280/image-18.jpg)
Oxidace terciárních alkoholů q Terciární alkoholy se neoxidují. [O] Terciární alkohol není reakce OH | [O] CH 3—C—CH 3 žádný produkt | CH 3 není žádný další H na C-OH pro oxidaci 2 -methyl-2 -propanol

Vznik a příprava některých alkoholů Methanol Vzniká při rozkladné destilaci dřeva. q Průmyslově se vyrábí redukcí CO vodíkem za vysokého tlaku a teploty, bez přítomnosti vzduchu CO + 2 H 2 CH 3 -OH q Toxická látka, poškozuje zrakový nerv. q Dočasná slepota (15 ml), trvalá slepota nebo smrt (30 ml). q

Vznik a příprava některých alkoholů Ethanol (spiritus, líh) Kvasné procesy cukerných šťáv rostlin za přítomnosti kvasinek při teplotě nižší než 37°C. q Výroba ve velkém hydrolýzou škrobu na jednoduché cukry q C 6 H 12 O 6 (hexosa) 2 CH 3 CH 2 OH + 2 CO 2 Nejprve excitační účinky, posléze narkotické účinky, působí jako sedativum. q Letální dávka je 6 -8 g/kg ( 1 l vodky). q
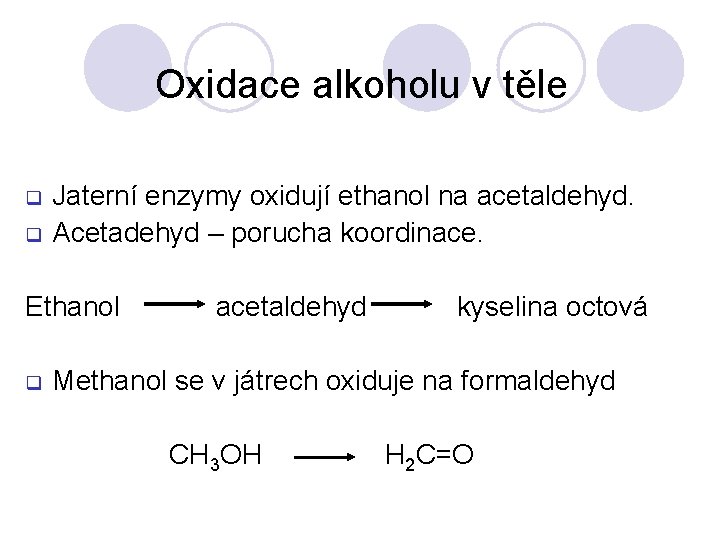
Oxidace alkoholu v těle q q Jaterní enzymy oxidují ethanol na acetaldehyd. Acetadehyd – porucha koordinace. Ethanol q acetaldehyd kyselina octová Methanol se v játrech oxiduje na formaldehyd CH 3 OH H 2 C=O

Ethanol – protijed proti otravě methanolem Formaldehyd reaguje velice rychle s proteiny, enzymy ztrácejí svou funkci. q Ethanol soutěží s methanolem o oxidační enzymy a to zabraňuje oxidaci formaldehydu. q

Vícesytné alkoholy Ethylenglykol - ethan-1, 2 -diol HO–CH 2–OH q Používá se do nemrznoucích směsí (radiátory, automobily) q Toxický: 50 ml, letální: 100 ml Glycerol - propan-1, 2, 3 -triol (glycerin) CH 2 - OH Uhlíková kostra glycerolu je součástí biologicky významných látek v organismu q
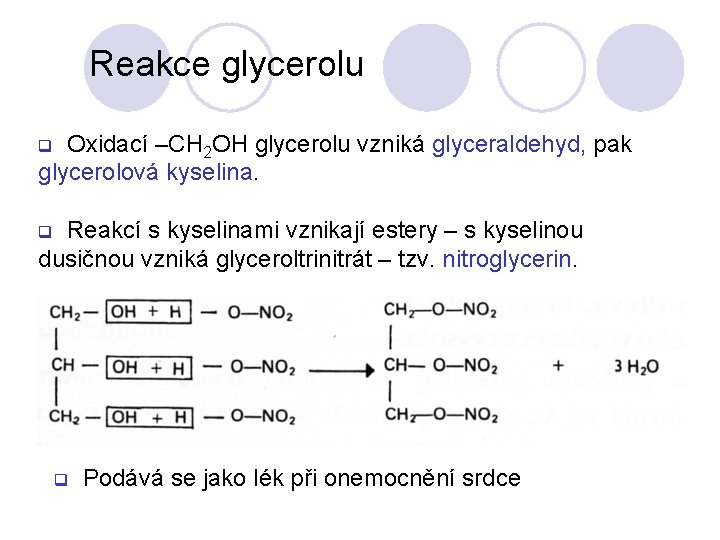
Reakce glycerolu Oxidací –CH 2 OH glycerolu vzniká glyceraldehyd, pak glycerolová kyselina. q Reakcí s kyselinami vznikají estery – s kyselinou dusičnou vzniká glyceroltrinitrát – tzv. nitroglycerin. q q Podává se jako lék při onemocnění srdce
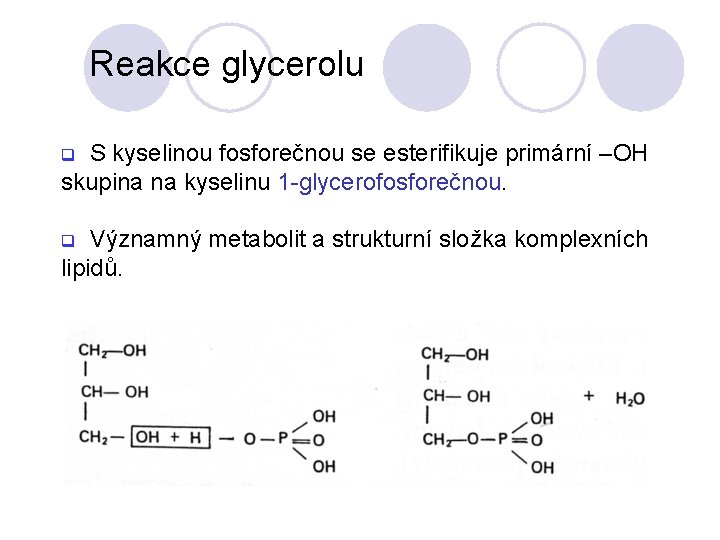
Reakce glycerolu S kyselinou fosforečnou se esterifikuje primární –OH skupina na kyselinu 1 -glycerofosforečnou. q Významný metabolit a strukturní složka komplexních lipidů. q
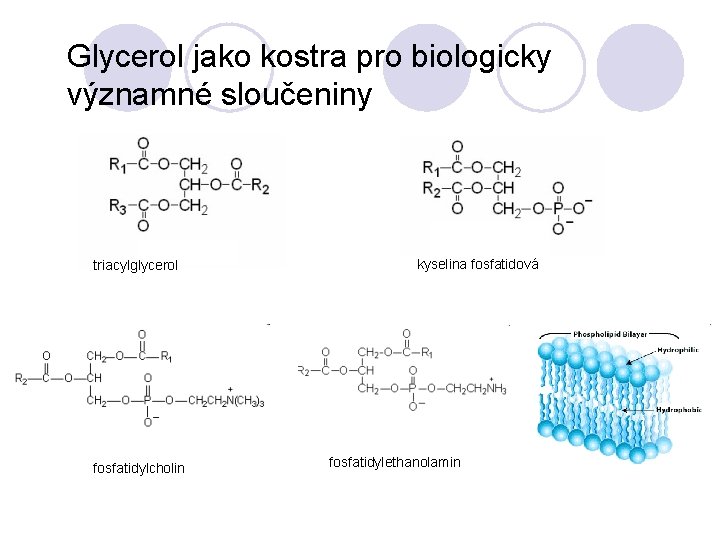
Glycerol jako kostra pro biologicky významné sloučeniny triacylglycerol fosfatidylcholin kyselina fosfatidová fosfatidylethanolamin
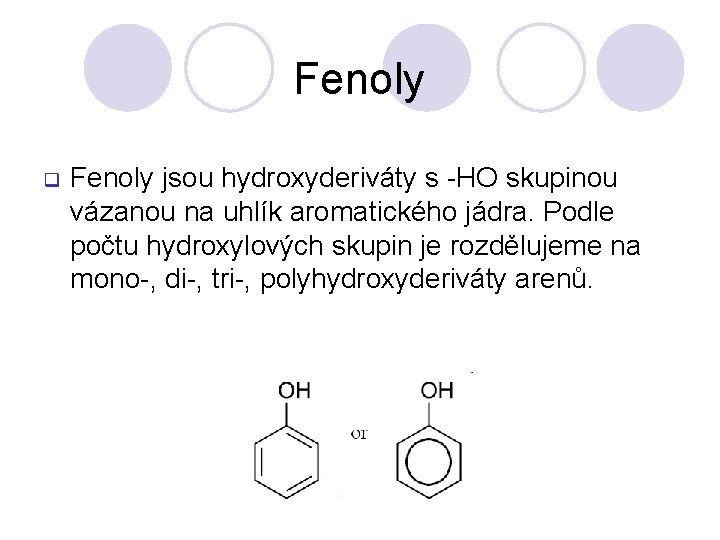
Fenoly q Fenoly jsou hydroxyderiváty s -HO skupinou vázanou na uhlík aromatického jádra. Podle počtu hydroxylových skupin je rozdělujeme na mono-, di-, tri-, polyhydroxyderiváty arenů.
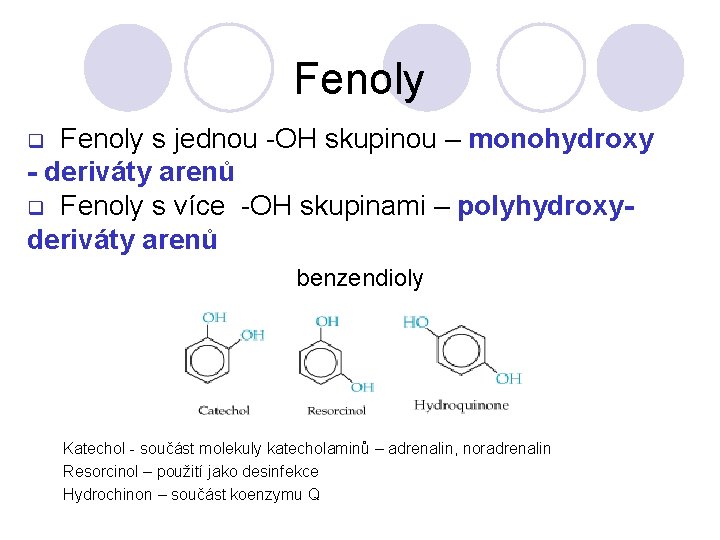
Fenoly s jednou -OH skupinou – monohydroxy - deriváty arenů q Fenoly s více -OH skupinami – polyhydroxyderiváty arenů q benzendioly Katechol - součást molekuly katecholaminů – adrenalin, noradrenalin Resorcinol – použití jako desinfekce Hydrochinon – součást koenzymu Q

Využití fenolů q q Fenoly se získávají z kamenouhelného dehtu. Používají se jako dezinfekční prostředky (lyzol). Přidávají se do zubních past, vyrábějí se z nich plasty (polymerací fenolu a formaldehydu vzniká bakelit). Redukční vlastnosti se využívají při přípravě fotografických vývojek (pyrokatechol).

Vlastnosti a reakce fenolů Polární sloučeniny, mohou tvořit vodíkové můstky. q q q Ve vodě špatně rozpustné. Acidita je ve srovnání s alkoholy vyšší. Soli – fenoláty, vznik s roztoky alkalických hydroxydů q Methylderiváty - kresoly se používají jako rozpouštědla, jako insekticidy proti škůdcům, k desinfekci.
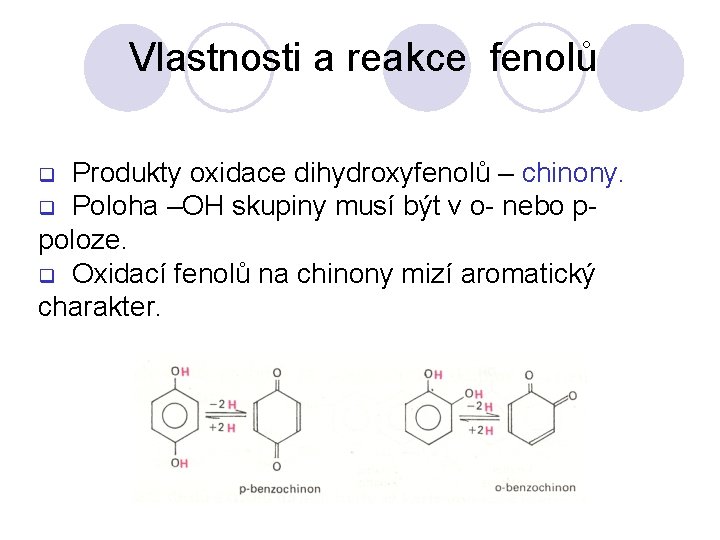
Vlastnosti a reakce fenolů Produkty oxidace dihydroxyfenolů – chinony. q Poloha –OH skupiny musí být v o- nebo ppoloze. q Oxidací fenolů na chinony mizí aromatický charakter. q

Vlastnosti a reakce fenolů Esterifikace fenolů Alkoholy a fenoly reagují s karboxylovými kyselinami na estery (reakce probíhá za přítomnosti malého množství H 2 SO 4 (donor protonu a dehydratační činidlo). q Vazba acetylové skupiny (CH 3 CO-) na molekulu alkoholu nebo fenol se nazývá acetylace. q

Ethery
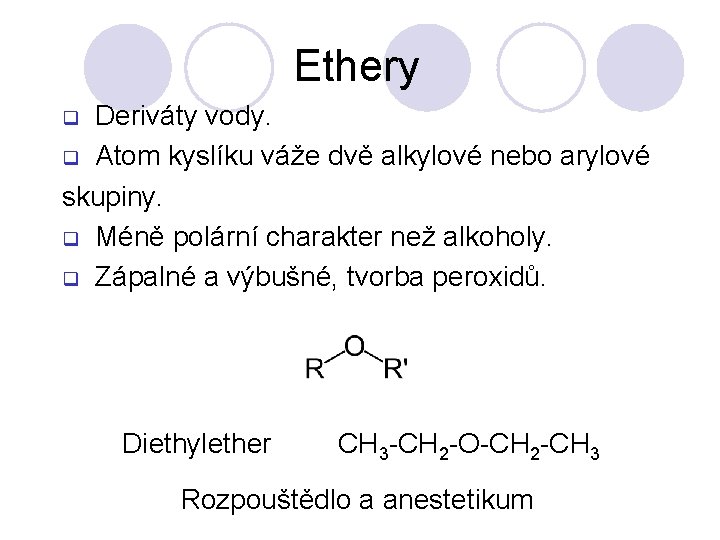
Ethery Deriváty vody. q Atom kyslíku váže dvě alkylové nebo arylové skupiny. q Méně polární charakter než alkoholy. q Zápalné a výbušné, tvorba peroxidů. q Diethylether CH 3 -CH 2 -O-CH 2 -CH 3 Rozpouštědlo a anestetikum

Aldehydy a ketony

Aldehydy a ketony (oxosloučeniny) Aldehydy a ketony jsou kyslíkaté analogy alkenů. q Společná je pro ně karbonylová skupina (C=O) q q Aldehydy - karbonylový uhlík váže nejméně jeden atom vodíku q Ketony - karbonylový uhlík váže dva další uhlíkové atomy.

Vlastnosti aldehydů a ketonů q Skupenství je kapalné nebo tuhé, formaldehyd je plyn. q Díky nerovnoměrnému rozložení elektronové hustoty na C=O skupině a sousedních atomech jsou aldehydy a ketony velmi reaktivní. q Rozpustnost ve vodě závisí na počtu atomů C. S rostoucím počtem těchto atomů rozpustnost značně klesá.
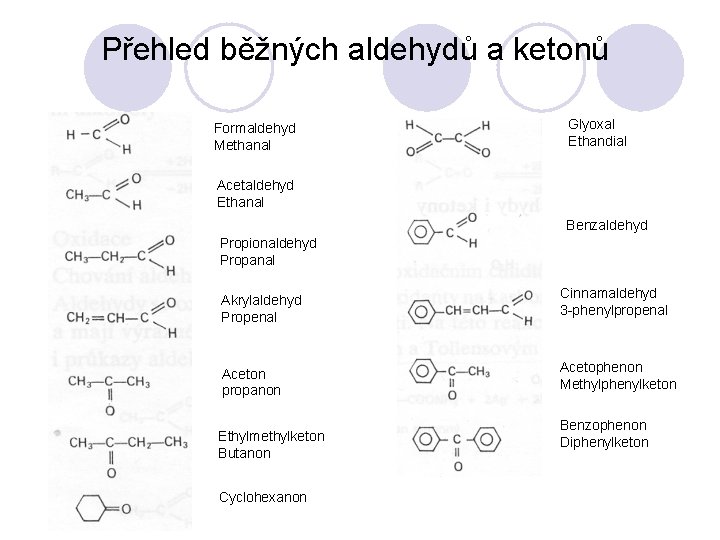
Přehled běžných aldehydů a ketonů Formaldehyd Methanal Glyoxal Ethandial Acetaldehyd Ethanal Benzaldehyd Propionaldehyd Propanal Akrylaldehyd Propenal Cinnamaldehyd 3 -phenylpropenal Aceton propanon Acetophenon Methylphenylketon Ethylmethylketon Butanon Cyclohexanon Benzophenon Diphenylketon

Tvorba poloacetálů (hemiacetálů) Reakce alkoholu s aldehydem nebo s ketonem. q -OH skupina akoholu se váže na karbonylovou skupinu aldehydu nebo ketonu. q polocetálový hydroxyl Poloacetály jsou nestabilní. q Sacharidy mají jak–OH skupinu, tak C=O skupinu a vytvářejí poloacetály. q

Cyklická struktura glukosy 1. Kyslík (červeně) –OH skupiny na uhlíku 5 tvoří vazbu s uhlíkem 1 a vznikne ether. 2. Vodík (zeleně) z -OH skupiny na uhlíku 5 se přenese na karbonylový kyslík (zeleně) a vznikne nová alkoholová skupina (zeleně). http: //www. elmhurst. edu/~chm/vchembook/700 carbonyls. html
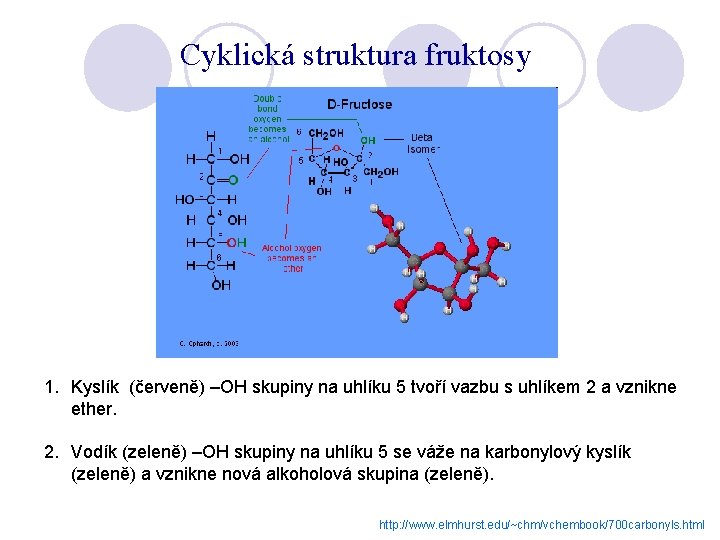
Cyklická struktura fruktosy 1. Kyslík (červeně) –OH skupiny na uhlíku 5 tvoří vazbu s uhlíkem 2 a vznikne ether. 2. Vodík (zeleně) –OH skupiny na uhlíku 5 se váže na karbonylový kyslík (zeleně) a vznikne nová alkoholová skupina (zeleně). http: //www. elmhurst. edu/~chm/vchembook/700 carbonyls. html

Cyklické poloacetaly jsou stabilnější, než necyklické poloacetaly. q Vznik poloacetalu je zejména významný u sacharidů a je příčinou vzniku jejich cyklické struktury, která má zásadní biologický význam. q
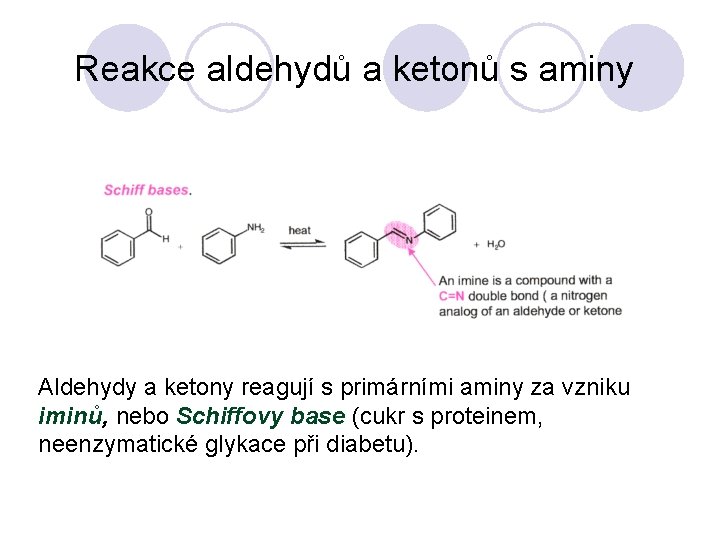
Reakce aldehydů a ketonů s aminy Aldehydy a ketony reagují s primárními aminy za vzniku iminů, nebo Schiffovy base (cukr s proteinem, neenzymatické glykace při diabetu).

Benedictův test u diabetu Benedictův roztok obsahuje Cu 2+ iont. q Aldehydy se oxidují na kyselinu a Cu 2+ se redukuje na Cu+, vznikne sraženina Cu 2 O (červená sraženina). q Glukosa obsahuje aldehydickou skupinu. q

Karboxylové kyseliny
Karboxylové kyseliny q Funkční skupina je -COOH q Organické kyseliny, které společně se svými solemi tvoří nezbytnou součást všech živých organismů. q Substráty klíčových metabolických dějů (glykolýza, Krebsův cyklus).

Karboxylové kyseliny alifatické (mastné), alicyklické a aromatické. q Podle počtu –COOH skupin rozlišujeme: mono-, di-, tri- až polykarboxylové kyseliny. q Karboxylové kyseliny nasycené a nenasycené. q
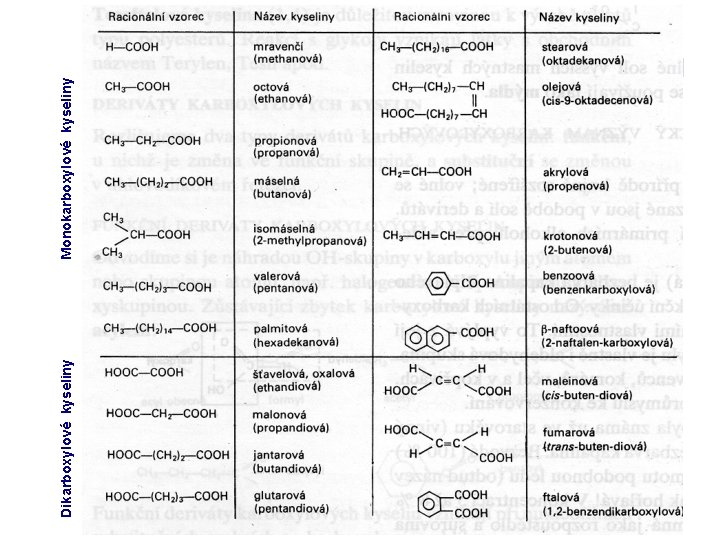
Dikarboxylové kyseliny Monokarboxylové kyseliny
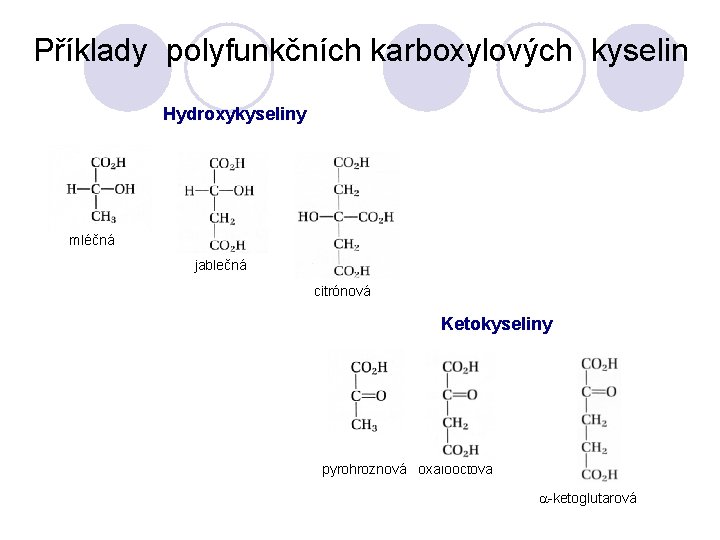
Příklady polyfunkčních karboxylových kyselin Hydroxykyseliny mléčná jablečná citrónová Ketokyseliny pyrohroznová oxalooctová a-ketoglutarová

Vlastnosti Kyseliny s nižší molekulovou hmotností jsou kapalné, mají štiplavý a nepříjemný zápach (kyselina máselná vzniká q žluknutím másla ). q Kyseliny střední jsou olejovité kapaliny. Kyseliny s vyšší molekulovou hmotností (myristová, palmytová, stearová) jsou známé jako mastné kyseliny. q q Vyšší mastné kyseliny jsou pevné látky.
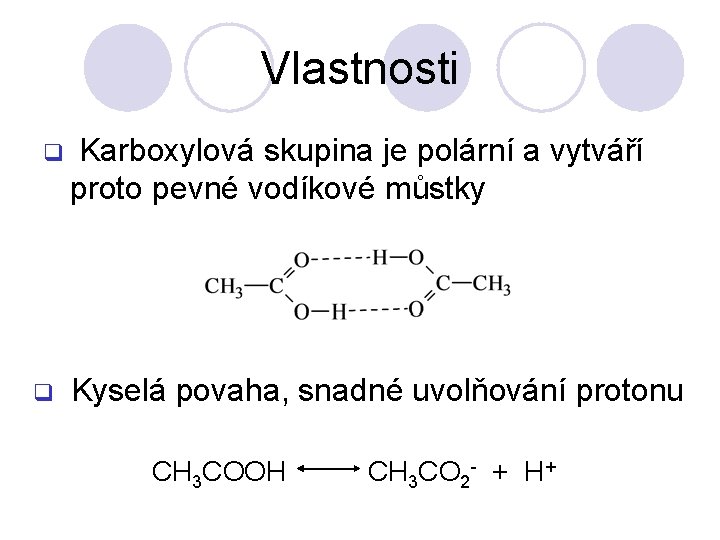
Vlastnosti q q Karboxylová skupina je polární a vytváří proto pevné vodíkové můstky Kyselá povaha, snadné uvolňování protonu CH 3 COOH CH 3 CO 2 - + H+
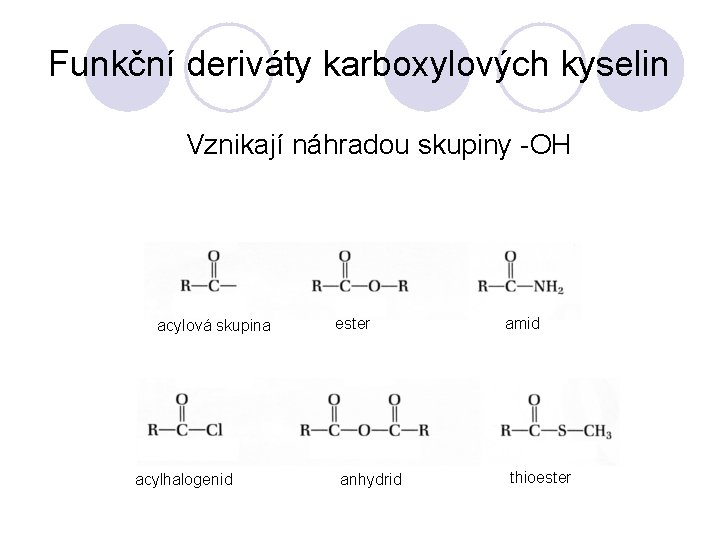
Funkční deriváty karboxylových kyselin Vznikají náhradou skupiny -OH acylová skupina acylhalogenid ester anhydrid amid thioester

Soli karboxylových kyselin Karboxylové kyseliny reagují s hydroxydy nebo uhličitany. q Význam mají sodné a draselné soli vyšších mastných kyselin (stearová, palmitová) – používají se jako mýdla q Kyselina octová Octan sodný
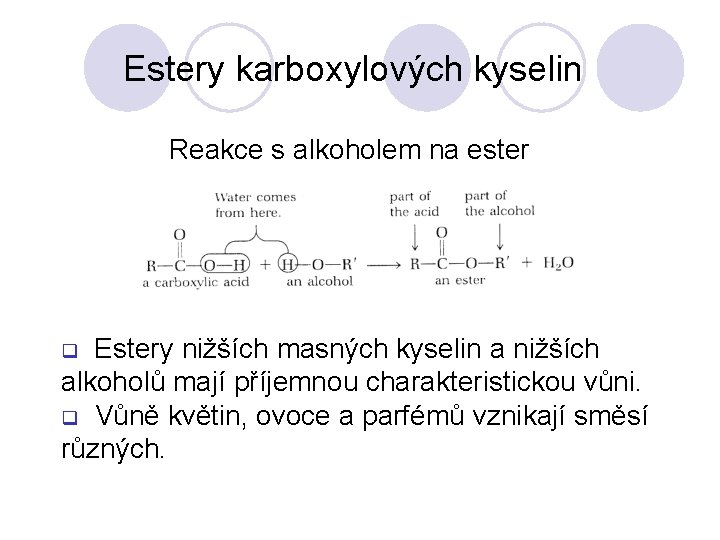
Estery karboxylových kyselin Reakce s alkoholem na ester Estery nižších masných kyselin a nižších alkoholů mají příjemnou charakteristickou vůni. q Vůně květin, ovoce a parfémů vznikají směsí různých. q
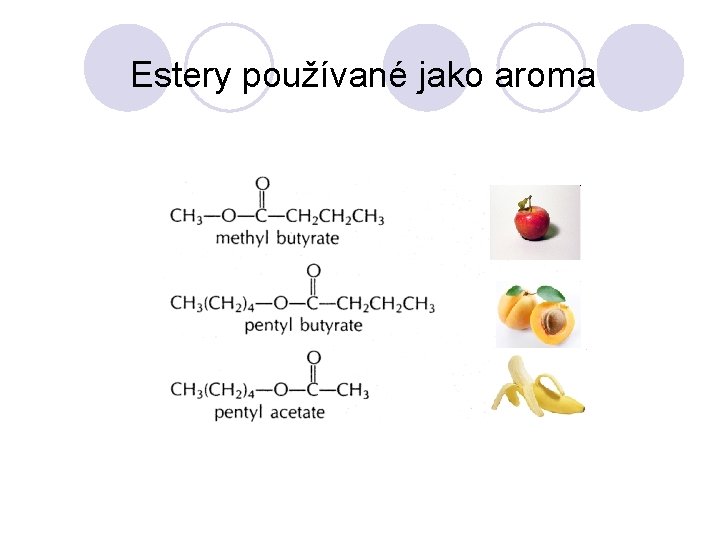
Estery používané jako aroma

Děkuji za pozornost jana. novotna@lfmotol. cuni. cz
- Slides: 56