Organic Chemistry Second Edition Janice Gorzynski Smith University







![Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila [2] La scissione del Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila [2] La scissione del](https://slidetodoc.com/presentation_image/20009669a68a8a54f233e0c9f6c1e85c/image-29.jpg)
![Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione [1]: Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione [1]:](https://slidetodoc.com/presentation_image/20009669a68a8a54f233e0c9f6c1e85c/image-30.jpg)
![Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione [2]: Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione [2]:](https://slidetodoc.com/presentation_image/20009669a68a8a54f233e0c9f6c1e85c/image-31.jpg)









- Slides: 61

Organic Chemistry, Second Edition Janice Gorzynski Smith University of Hawai’i Chapter 7 Lecture Outline Prepared by Rabi Ann Musah State University of New York at Albany Copyright © The Mc. Graw-Hill Companies, Inc. Permission required for reproduction or display. 1

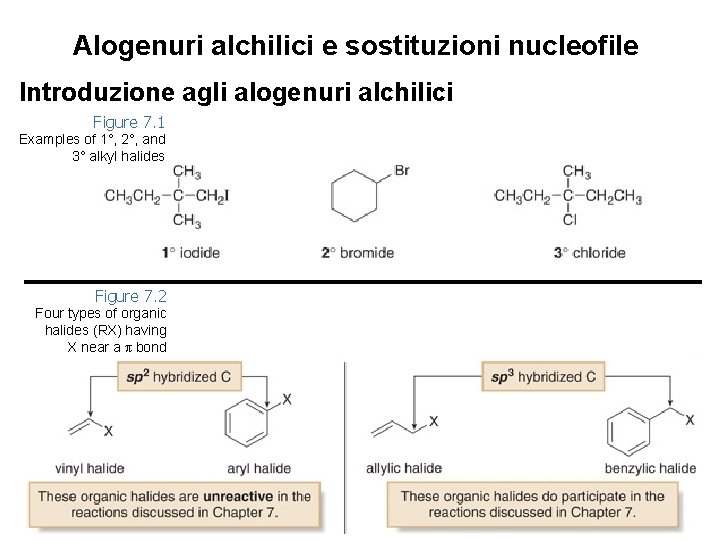
Alogenuri alchilici e sostituzioni nucleofile Introduzione agli alogenuri alchilici • Gli alogenuri alchilici sono molecole organiche contenenti un atomo di alogeno legato ad un carbonio ibridato sp 3. • Gli alogenuri organici sono classificati come primari (1°), secondari (2°), o terziari (3°), a seconda del numero di atomi di carbonio legati al carbonio alogenato. • L’atomo di alogeno negli alogenuri è spesso indicato dal simbolo “X”. 2

Alogenuri alchilici e sostituzioni nucleofile Introduzione agli alogenuri alchilici • Ci sono altri tipi di alogenuri organici. Tra questi gli alogenuri vinilici, alogenuri arilici, alogenuri allilici e alogenuri benzilici. • Gli alogenuri vinilici sono caratterizzati da un atomo di alogeno (X) legato ad un doppio legame C—C. • Gli alogenuri arilici sono caratterizzati da un atomo di alogeno legato ad un anello benzenico. • Gli alogenuri allilici sono caratterizzati da un atomo di alogeno legato ad un carbonio adiacente ad un doppio legame C—C. • Gli alogenuri benzilici sono caratterizzati da un atomo di alogeno legato ad un carbonio adiacente ad un anello 3 benzenico.

Alogenuri alchilici e sostituzioni nucleofile Introduzione agli alogenuri alchilici Figure 7. 1 Examples of 1°, 2°, and 3° alkyl halides Figure 7. 2 Four types of organic halides (RX) having X near a π bond 4

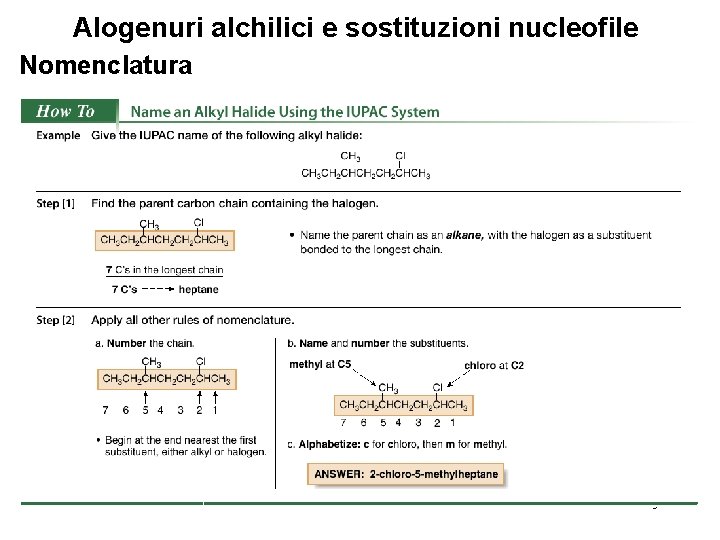
Alogenuri alchilici e sostituzioni nucleofile Nomenclatura 5

Alogenuri alchilici e sostituzioni nucleofile Nomenclatura § I nomi comuni sono usati spesso per gli alogenuri alchilici semplici. Per assegnare il nome comune: Nominare tutti gli atomi di carbonio di una molecola come un singolo gruppo alchilico. Nominare l’alogeno legato al gruppo alchilico. Combinare insieme i nomi del gruppo alchilico e dell’alogenuro, separando le parole con uno spazio. 6

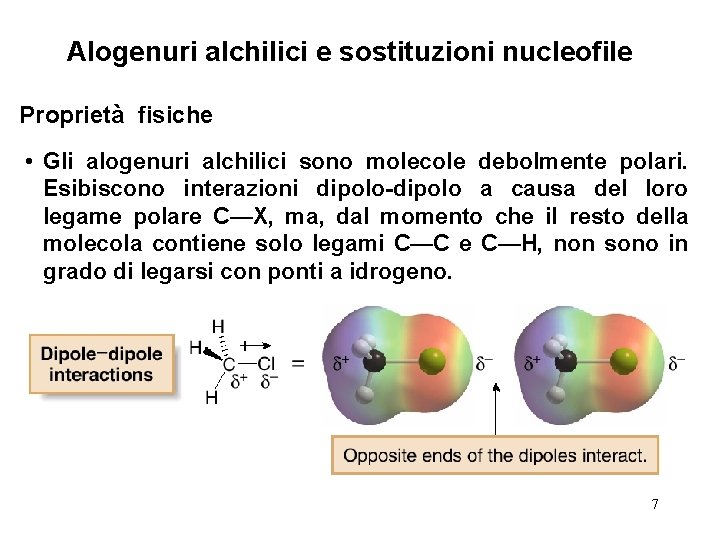
Alogenuri alchilici e sostituzioni nucleofile Proprietà fisiche • Gli alogenuri alchilici sono molecole debolmente polari. Esibiscono interazioni dipolo-dipolo a causa del loro legame polare C—X, ma, dal momento che il resto della molecola contiene solo legami C—C e C—H, non sono in grado di legarsi con ponti a idrogeno. 7

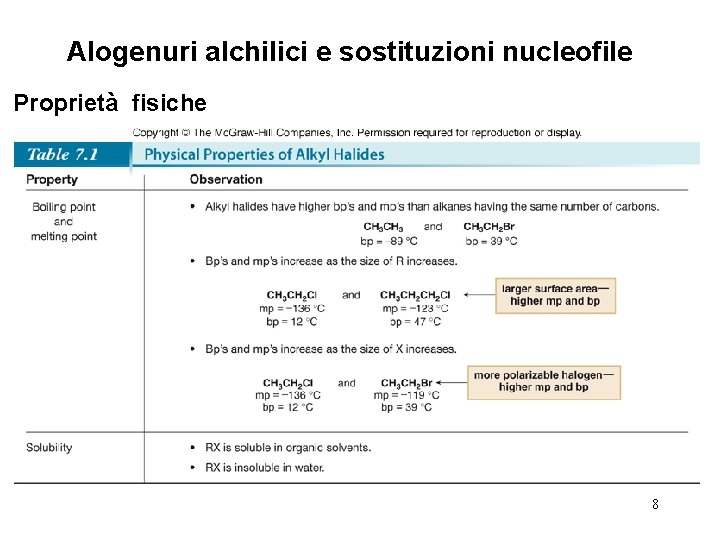
Alogenuri alchilici e sostituzioni nucleofile Proprietà fisiche 8

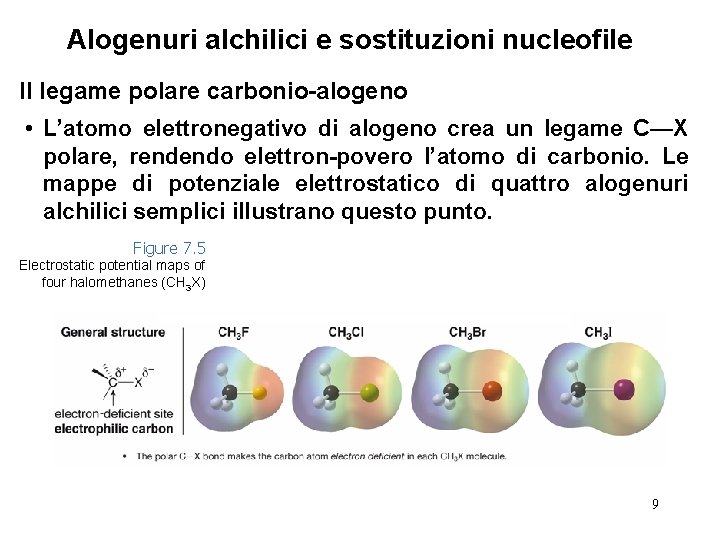
Alogenuri alchilici e sostituzioni nucleofile Il legame polare carbonio-alogeno • L’atomo elettronegativo di alogeno crea un legame C—X polare, rendendo elettron-povero l’atomo di carbonio. Le mappe di potenziale elettrostatico di quattro alogenuri alchilici semplici illustrano questo punto. Figure 7. 5 Electrostatic potential maps of four halomethanes (CH 3 X) 9

Alogenuri alchilici e sostituzioni nucleofile Il legame polare carbonio-alogeno 10

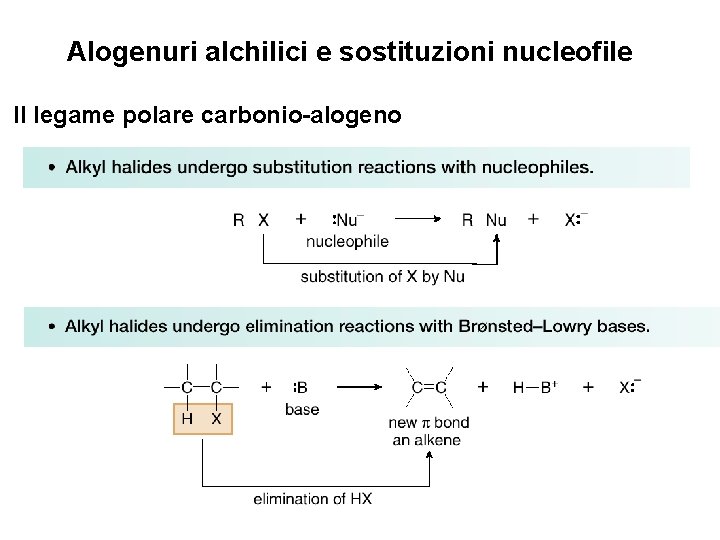
Alogenuri alchilici e sostituzioni nucleofile Caratteristiche generali della sostituzione nucleofila • In ogni reazione di sostituzione sono sempre presenti tre componenti. 11

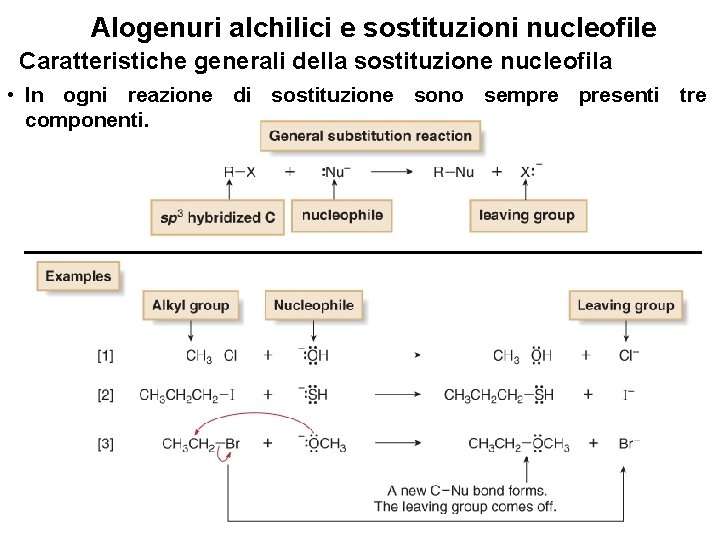
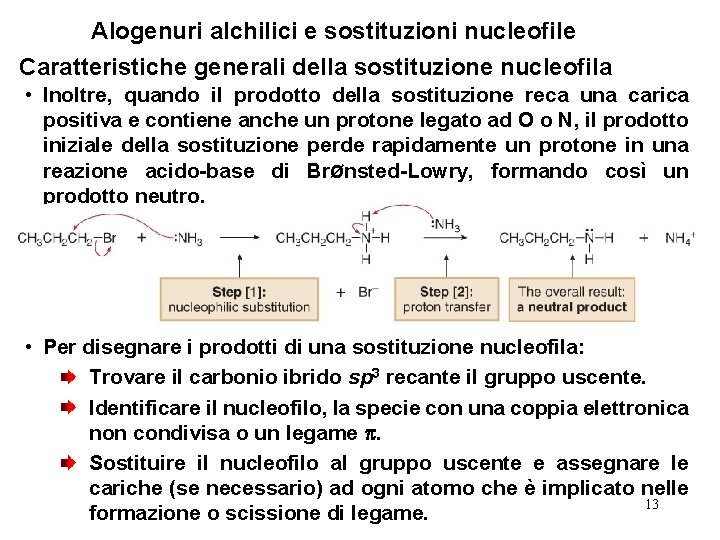
Alogenuri alchilici e sostituzioni nucleofile Caratteristiche generali della sostituzione nucleofila • I nucleofili carichi negativamente come HO¯ e HS¯ sono usati come sali controione Li+, Na+, o K+ per bilanciare la carica. L’identità del catione è normalmente ininfluente, pertanto essa è spesso omessa nella equazione chimica. • Quando si utilizza un nucleofilo neutro, il prodotto di sostituzione reca una carica positiva. 12

Alogenuri alchilici e sostituzioni nucleofile Caratteristiche generali della sostituzione nucleofila • Inoltre, quando il prodotto della sostituzione reca una carica positiva e contiene anche un protone legato ad O o N, il prodotto iniziale della sostituzione perde rapidamente un protone in una reazione acido-base di BrØnsted-Lowry, formando così un prodotto neutro. • Per disegnare i prodotti di una sostituzione nucleofila: Trovare il carbonio ibrido sp 3 recante il gruppo uscente. Identificare il nucleofilo, la specie con una coppia elettronica non condivisa o un legame . Sostituire il nucleofilo al gruppo uscente e assegnare le cariche (se necessario) ad ogni atomo che è implicato nelle 13 formazione o scissione di legame.

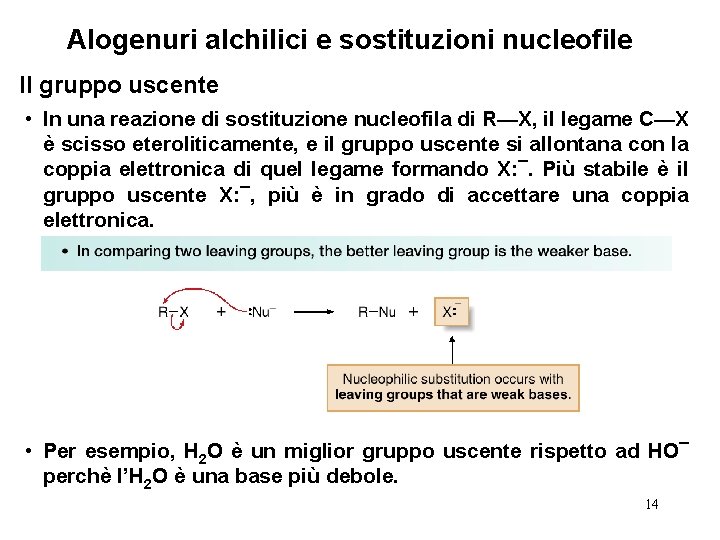
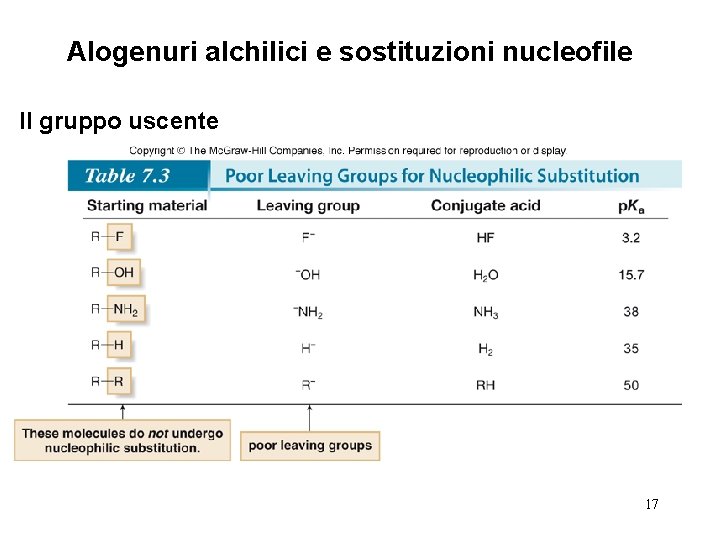
Alogenuri alchilici e sostituzioni nucleofile Il gruppo uscente • In una reazione di sostituzione nucleofila di R—X, il legame C—X è scisso eteroliticamente, e il gruppo uscente si allontana con la coppia elettronica di quel legame formando X: ¯. Più stabile è il gruppo uscente X: ¯, più è in grado di accettare una coppia elettronica. • Per esempio, H 2 O è un miglior gruppo uscente rispetto ad HO¯ perchè l’H 2 O è una base più debole. 14

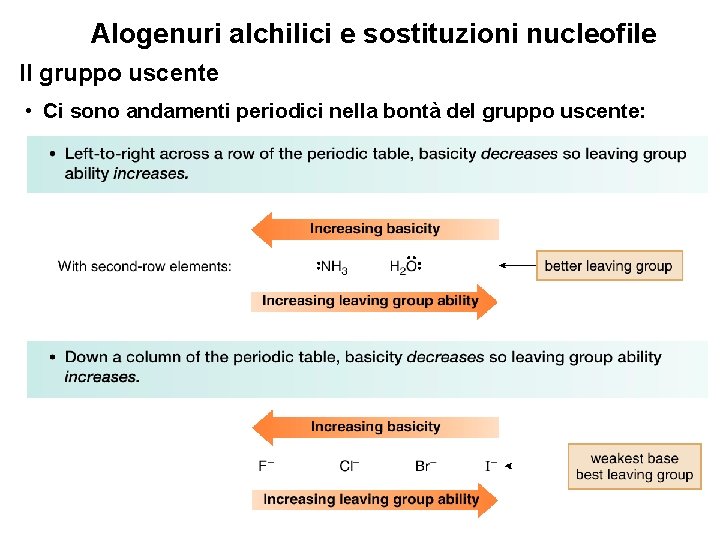
Alogenuri alchilici e sostituzioni nucleofile Il gruppo uscente • Ci sono andamenti periodici nella bontà del gruppo uscente: 15

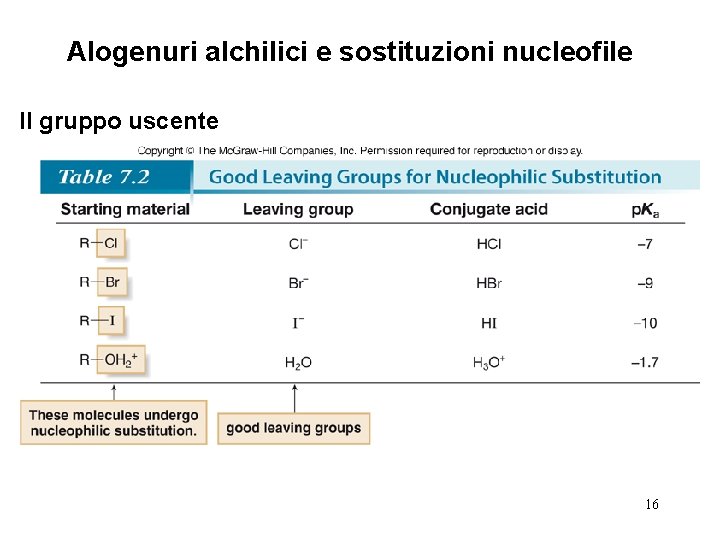
Alogenuri alchilici e sostituzioni nucleofile Il gruppo uscente 16

Alogenuri alchilici e sostituzioni nucleofile Il gruppo uscente 17

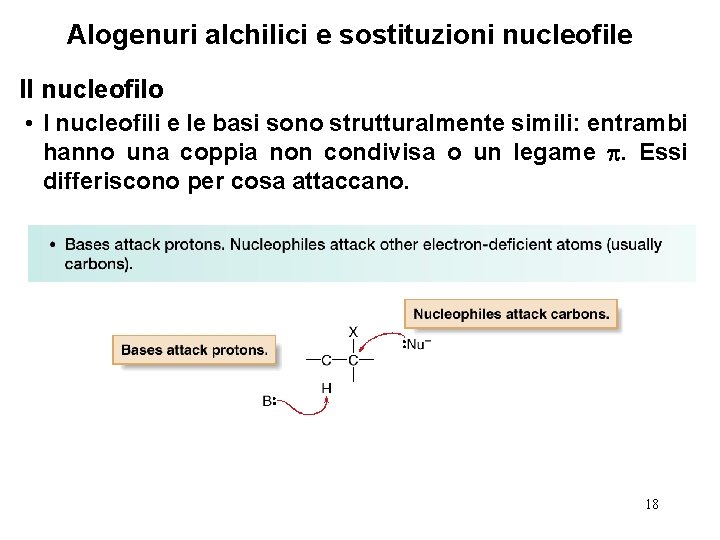
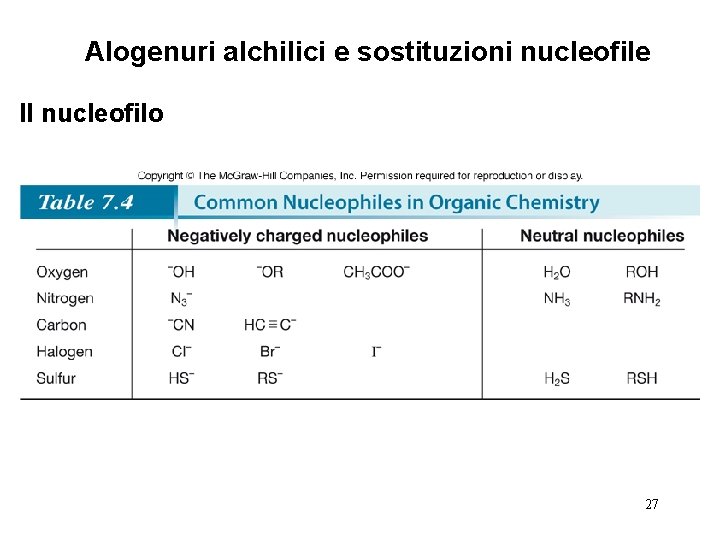
Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • I nucleofili e le basi sono strutturalmente simili: entrambi hanno una coppia non condivisa o un legame . Essi differiscono per cosa attaccano. 18

Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • Benchè la nucleofilicità e la basicità siano correlate, esse sono fondamentalmente diverse. La basicità è una misura di quanto prontamente un atomo dona la sua coppia elettronica al protone. Essa è caratterizzata dalla costante di equilibrio Ka di una reazione acido-base, che la rende una proprietà termodinamica. La nucleofilicità è invece una misura di quanto prontamente un atomo dona la sua coppia elettronica ad altri atomi. Essa è caratterizzata dalla costante di velocità k, che la rende una proprietà cinetica. 19

Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • La nucleofilicità è parallela alla basicità in tre casi: 1. Per due nucleofili con lo stesso atomo nucleofilo, più forte è la base più forte è il nucleofilo. La nucleofilicità relativa di HO¯ e CH 3 COO¯, due nucleofili ossigenati, si può determinare paragonando i valori di p. Ka dei loro acidi coniugati (H 2 O = 15. 7, e CH 3 COOH = 4. 8). HO¯ è una base più forte e un nucleofilo migliore rispetto a CH 3 COO¯. 2. Un nucleofilo carico negativmente è sempre più forte del suo acido coniugato. HO¯ è una base più forte e nucleofilo migliore rispetto ad H 2 O. 3. Muovendosi da destra a sinistra lungo una riga della tavola periodica, la nucleofilicità aumenta parallelamente all’aumentare della basicità: 20

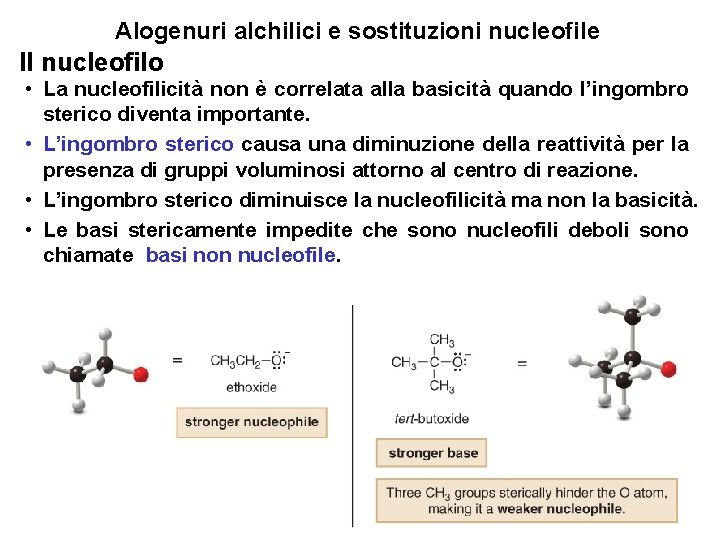
Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • La nucleofilicità non è correlata alla basicità quando l’ingombro sterico diventa importante. • L’ingombro sterico causa una diminuzione della reattività per la presenza di gruppi voluminosi attorno al centro di reazione. • L’ingombro sterico diminuisce la nucleofilicità ma non la basicità. • Le basi stericamente impedite che sono nucleofili deboli sono chiamate basi non nucleofile. 21

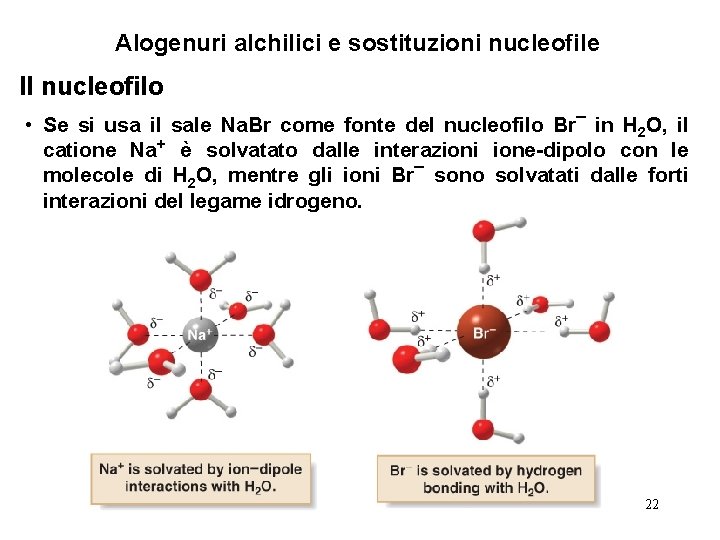
Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • Se si usa il sale Na. Br come fonte del nucleofilo Br¯ in H 2 O, il catione Na+ è solvatato dalle interazioni ione-dipolo con le molecole di H 2 O, mentre gli ioni Br¯ sono solvatati dalle forti interazioni del legame idrogeno. 22

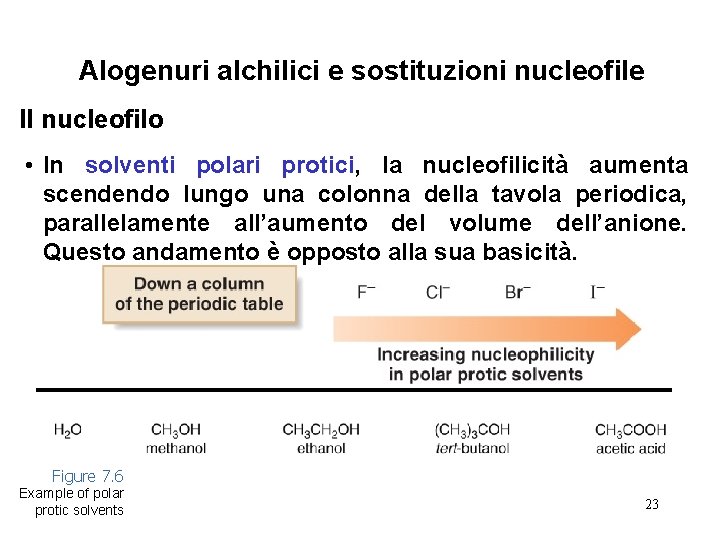
Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • In solventi polari protici, la nucleofilicità aumenta scendendo lungo una colonna della tavola periodica, parallelamente all’aumento del volume dell’anione. Questo andamento è opposto alla sua basicità. Figure 7. 6 Example of polar protic solvents 23

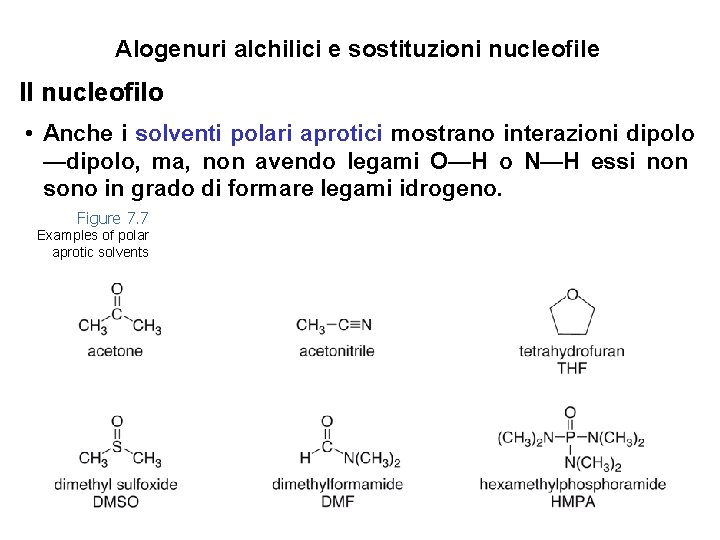
Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • Anche i solventi polari aprotici mostrano interazioni dipolo —dipolo, ma, non avendo legami O—H o N—H essi non sono in grado di formare legami idrogeno. Figure 7. 7 Examples of polar aprotic solvents 24

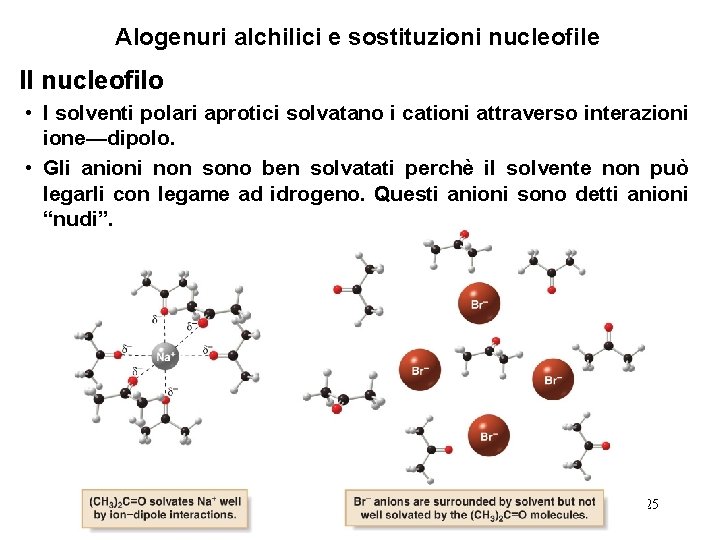
Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • I solventi polari aprotici solvatano i cationi attraverso interazioni ione—dipolo. • Gli anioni non sono ben solvatati perchè il solvente non può legarli con legame ad idrogeno. Questi anioni sono detti anioni “nudi”. 25

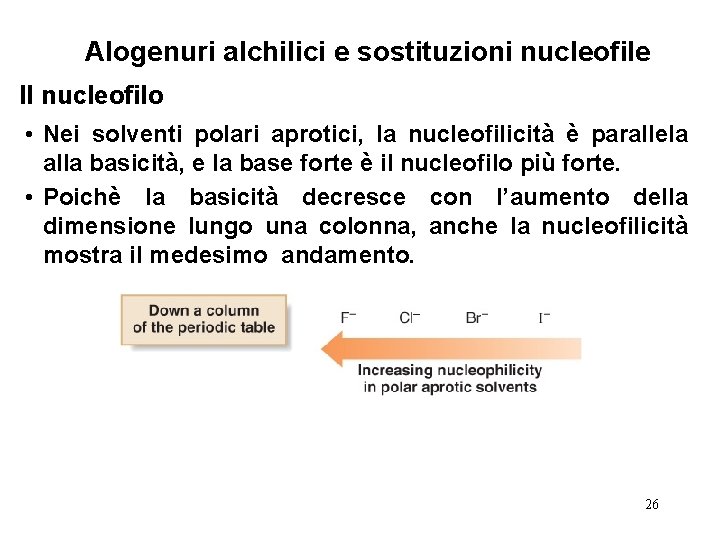
Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo • Nei solventi polari aprotici, la nucleofilicità è parallela alla basicità, e la base forte è il nucleofilo più forte. • Poichè la basicità decresce con l’aumento della dimensione lungo una colonna, anche la nucleofilicità mostra il medesimo andamento. 26

Alogenuri alchilici e sostituzioni nucleofile Il nucleofilo 27

Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila In una sostituzione nucleofila: Ma qual’è l’ordine in cui i legami si scindono e si formano? In teoria, ci sono due possibilità. [1] La scissione e la formazione dei legami avvengono nello stesso tempo. In questo scenario, il meccanismo è composto di un singolo stadio. In questa reazione bimolecolare, la velocità dipende dalla concentrazione di entrambi i reagenti, cioè, la reazione è 28 del secondo ordine.
![Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila 2 La scissione del Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila [2] La scissione del](https://slidetodoc.com/presentation_image/20009669a68a8a54f233e0c9f6c1e85c/image-29.jpg)
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila [2] La scissione del legame avviene prima della formazione del nuovo legame. In questo scenario, il meccanismo presenta due stadi e si forma un carbocatione come intermedio. Dal momento che il primo stadio è quello cineticamente determinante, la velocità dipende dalla concentrazione solamente di RX; cioè, l’equazione della velocità è del primo ordine. 29
![Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione 1 Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione [1]:](https://slidetodoc.com/presentation_image/20009669a68a8a54f233e0c9f6c1e85c/image-30.jpg)
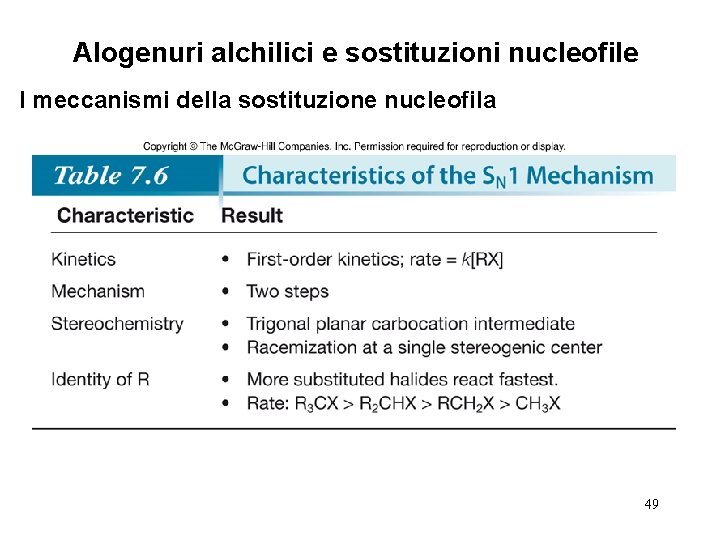
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione [1]: I dati cinetici mostrano che la velocità della reazione [1] dipende dalla concentrazione di entrambi i reagenti, e questo suggerisce una reazione bimolecolare con un meccanismo a singolo stadio. Questo è un esempio di una meccanismo SN 2 (sostituzione nucleofila bimoleculare). 30
![Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione 2 Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione [2]:](https://slidetodoc.com/presentation_image/20009669a68a8a54f233e0c9f6c1e85c/image-31.jpg)
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Considerare la reazione [2]: I dati cinetici mostrano che la velocità della reazione [2] dipende dalla concentrazione del solo alogenuro alchilico. Questo suggerisce un meccanismo a due stadi, in cui lo stadio cineticamente determinante coinvolge il solo alogenuro alchilico. Questo è un esempio di un meccanismo SN 1 (sostituzione nucleofila monomolecolare). 31

Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Il meccanismo di una reazione SN 2 dovrebbe essere disegnato secondo l’esempio. Notare la notazione della freccia curva che è usata per mostrare lo spostamento degli elettroni. 32

Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Figure 7. 8 An energy diagram for the SN 2 reaction: 33

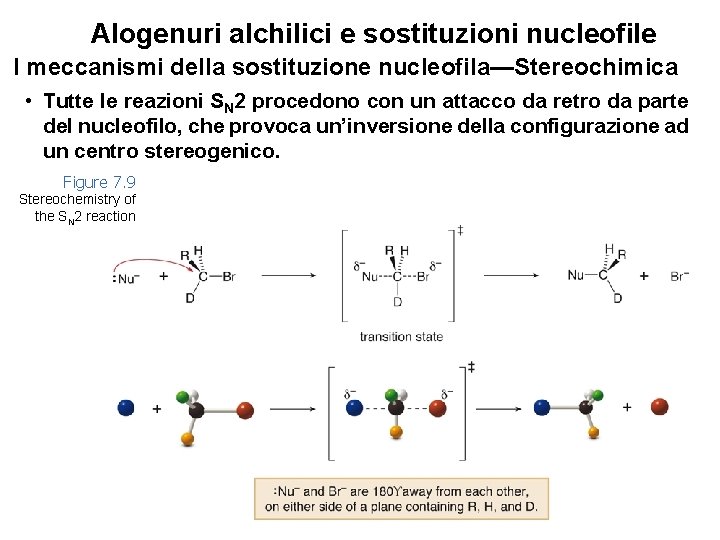
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila—Stereochimica • Tutte le reazioni SN 2 procedono con un attacco da retro da parte del nucleofilo, che provoca un’inversione della configurazione ad un centro stereogenico. Figure 7. 9 Stereochemistry of the SN 2 reaction 34

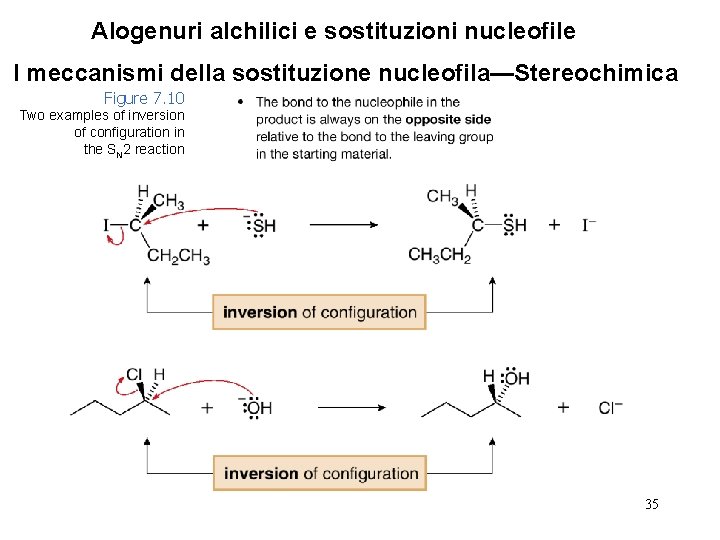
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila—Stereochimica Figure 7. 10 Two examples of inversion of configuration in the SN 2 reaction 35

Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila • Gli alogenuri metilici e 1° danno le reazioni SN 2 con facilità. • Gli alognuri 2° reagiscono più lentamente. • Gli alogenuri 3° non danno reazioni SN 2. Questo ordine di reattività può essere spiegato con effetti sterici. L’ingombro sterico causato dai voluminosi gruppi R rende più difficoltoso l’attacco nucleofilo da retro, 36 rallentando la velocità.

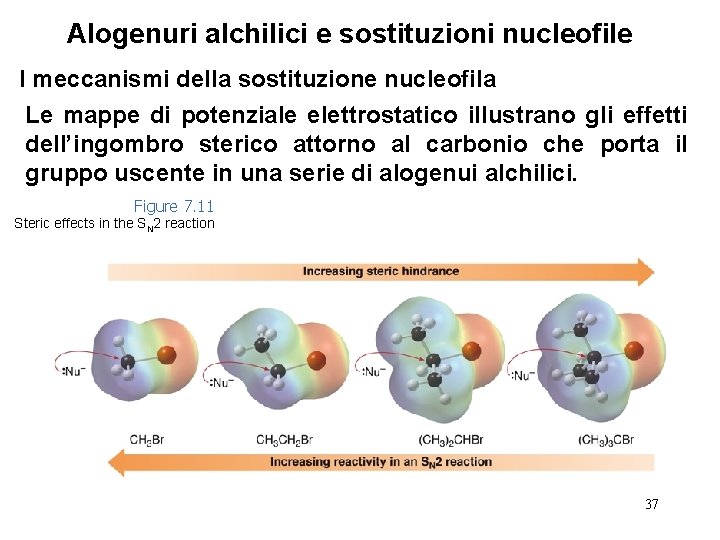
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Le mappe di potenziale elettrostatico illustrano gli effetti dell’ingombro sterico attorno al carbonio che porta il gruppo uscente in una serie di alogenui alchilici. Figure 7. 11 Steric effects in the SN 2 reaction 37

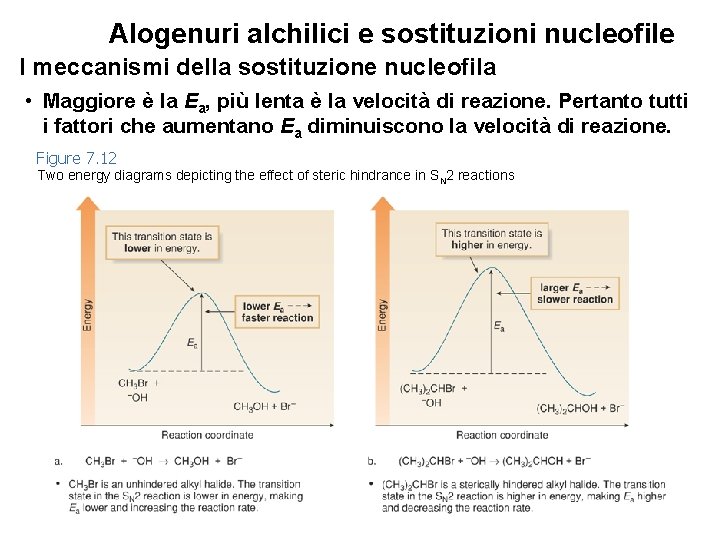
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila • Maggiore è la Ea, più lenta è la velocità di reazione. Pertanto tutti i fattori che aumentano Ea diminuiscono la velocità di reazione. Figure 7. 12 Two energy diagrams depicting the effect of steric hindrance in SN 2 reactions 38

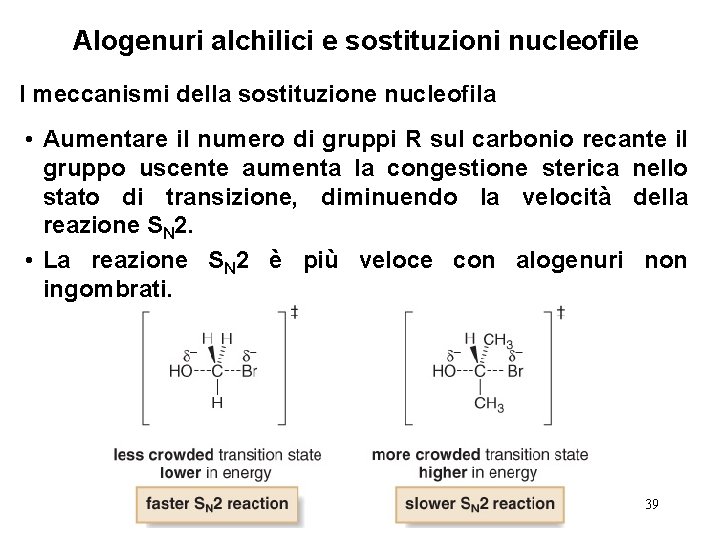
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila • Aumentare il numero di gruppi R sul carbonio recante il gruppo uscente aumenta la congestione sterica nello stato di transizione, diminuendo la velocità della reazione SN 2. • La reazione SN 2 è più veloce con alogenuri non ingombrati. 39

Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila 40

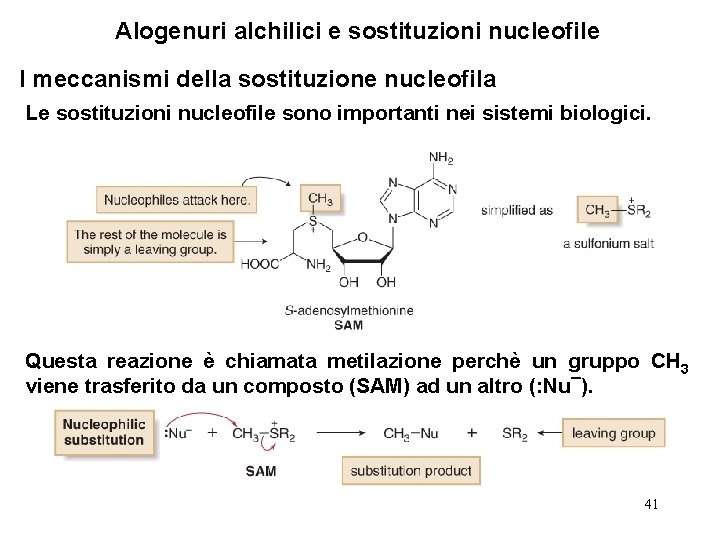
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Le sostituzioni nucleofile sono importanti nei sistemi biologici. Questa reazione è chiamata metilazione perchè un gruppo CH 3 viene trasferito da un composto (SAM) ad un altro (: Nu¯). 41

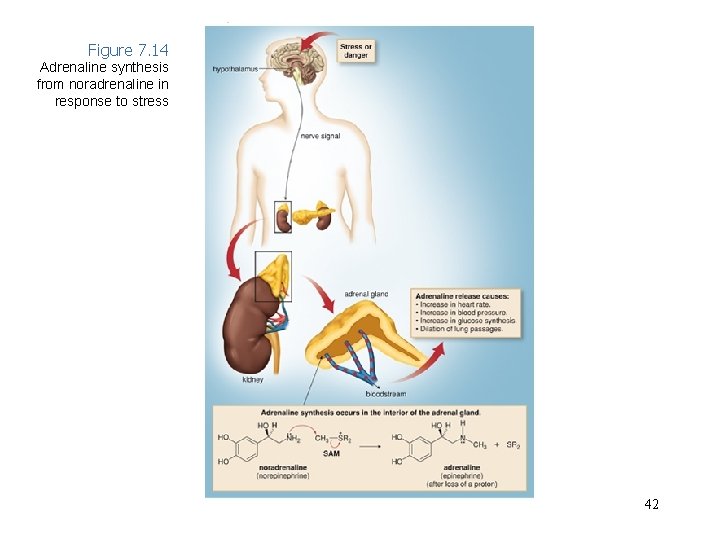
Figure 7. 14 Adrenaline synthesis from noradrenaline in response to stress 42

Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Il meccanismo di una reazione SN 1 dovrebbe essere disegnato come nell’esempio: Notare il formalismo della freccia curva che è usato per mostrare il movimento degli elettroni. Le caratteristiche chiave del meccanismo SN 1 sono che presenta due stadi, e come intermedi reattivi si formano 43 carbocationi.

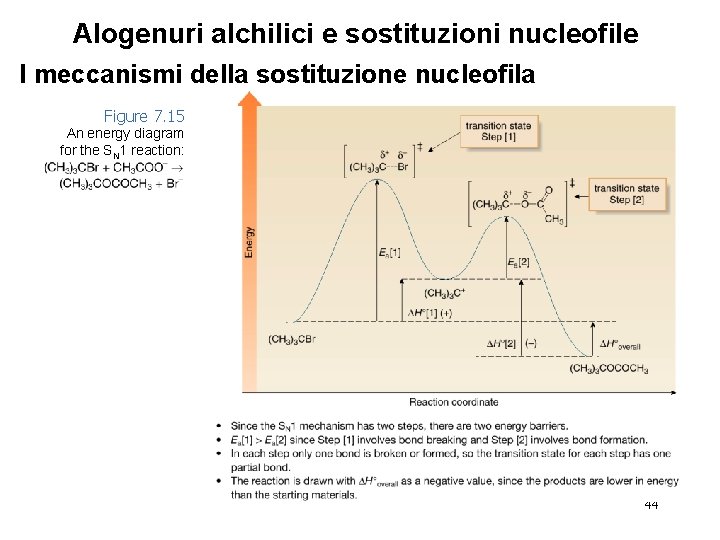
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Figure 7. 15 An energy diagram for the SN 1 reaction: 44

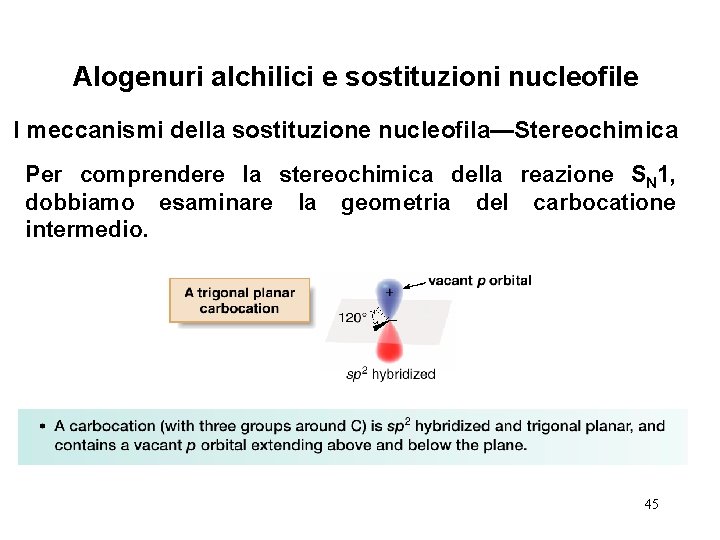
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila—Stereochimica Per comprendere la stereochimica della reazione SN 1, dobbiamo esaminare la geometria del carbocatione intermedio. 45

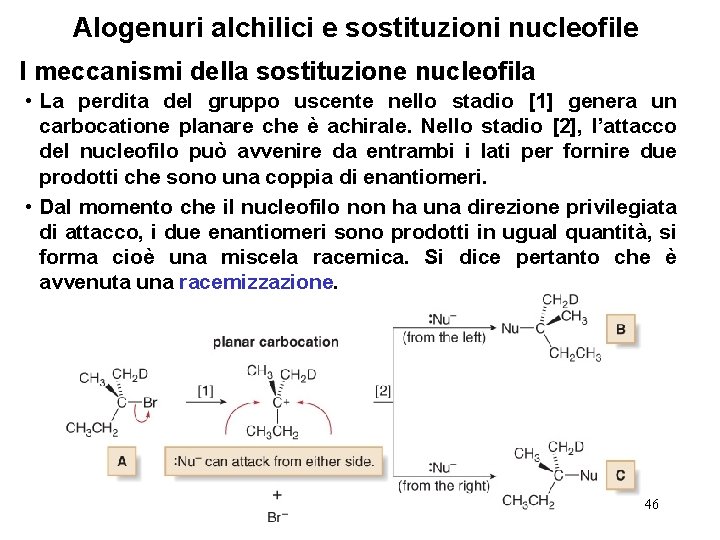
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila • La perdita del gruppo uscente nello stadio [1] genera un carbocatione planare che è achirale. Nello stadio [2], l’attacco del nucleofilo può avvenire da entrambi i lati per fornire due prodotti che sono una coppia di enantiomeri. • Dal momento che il nucleofilo non ha una direzione privilegiata di attacco, i due enantiomeri sono prodotti in ugual quantità, si forma cioè una miscela racemica. Si dice pertanto che è avvenuta una racemizzazione. 46

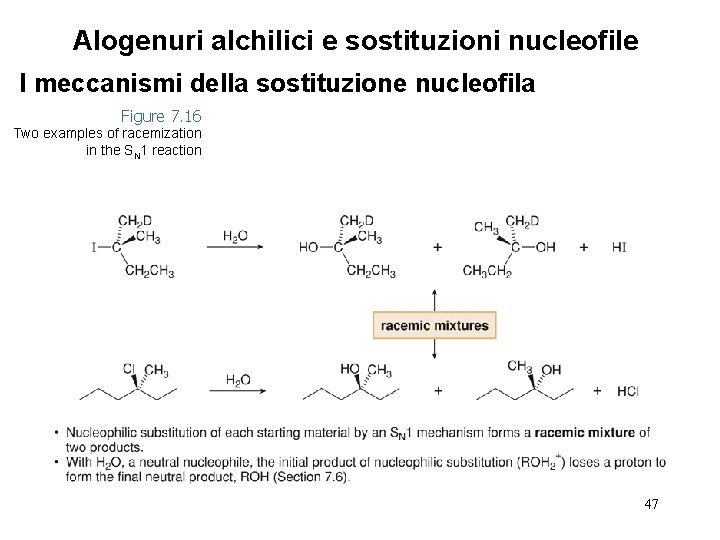
Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila Figure 7. 16 Two examples of racemization in the SN 1 reaction 47

Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila • La velocità di una reazione SN 1 è influenzata dal tipo di alogenuro coinvolto. • Questo andamento è esattamente opposto a quello osservato nel meccanismo SN 2. 48

Alogenuri alchilici e sostituzioni nucleofile I meccanismi della sostituzione nucleofila 49

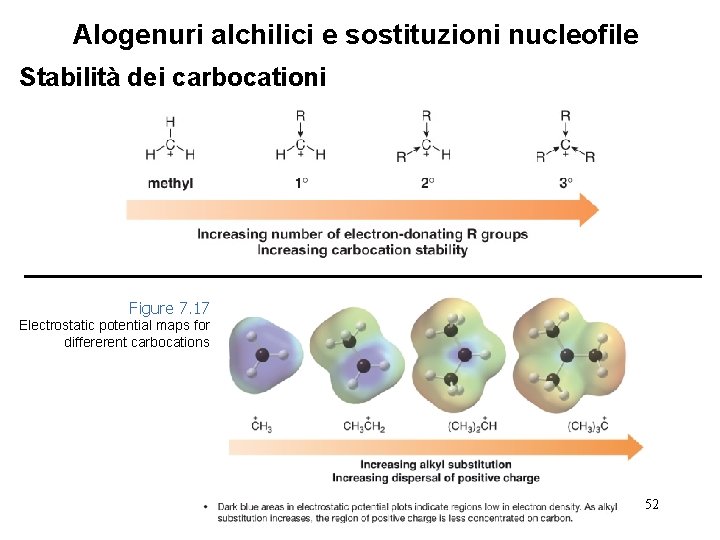
Alogenuri alchilici e sostituzioni nucleofile Stabilità dei carbocationi • L’effetto del tipo di alogenuro alchilico sulla velocità di una reazione SN 1 può essere spiegato considerando la stabilità dei carbocationi. • I carbocationi sono classificati come primari (1°), secondari (2°), o terziari (3°), a seconda del numero dei gruppi R legati all’atomo di carbonio carico positivamente. Al crescere del numero di gruppi R, la stabilità del carbocatione aumenta. 50

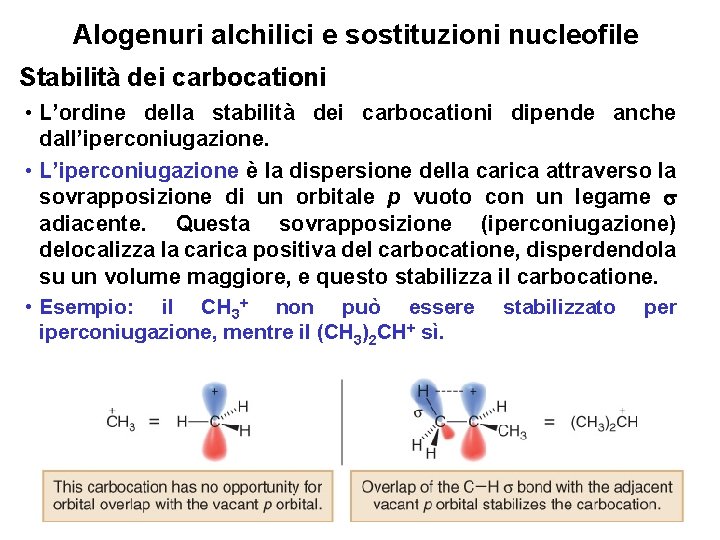
Alogenuri alchilici e sostituzioni nucleofile Stabilità dei carbocationi • L’ordine della stabilità dei carbocationi può essere razionalizzata attraverso gli effetti induttivi e l’iperconiugazione. • Gli effetti induttivi sono effetti elettronici che si trasmettono attraverso i legami . In particolare, l’effetto induttivo è lo spostamento di densità elettronica attraverso legami causata dalle differenze di elettronegatività tra gli atomi. • I gruppi alchilici sono gruppi elettron donatori che stabilizzano una carica positiva. Poichè un guppo alchilico ha molti legami , ciascuno contenente densità elettronica, è più polarizzabile di un atomo di idrogeno, e più capace di donare densità elettronica. • In generale, maggiore il numero di gruppi alchilici legati ad un carbonio con una carica positiva, maggiore 51 la stabilità del catione.

Alogenuri alchilici e sostituzioni nucleofile Stabilità dei carbocationi Figure 7. 17 Electrostatic potential maps for differerent carbocations 52

Alogenuri alchilici e sostituzioni nucleofile Stabilità dei carbocationi • L’ordine della stabilità dei carbocationi dipende anche dall’iperconiugazione. • L’iperconiugazione è la dispersione della carica attraverso la sovrapposizione di un orbitale p vuoto con un legame adiacente. Questa sovrapposizione (iperconiugazione) delocalizza la carica positiva del carbocatione, disperdendola su un volume maggiore, e questo stabilizza il carbocatione. • Esempio: il CH 3+ non può essere stabilizzato per iperconiugazione, mentre il (CH 3)2 CH+ sì. 53

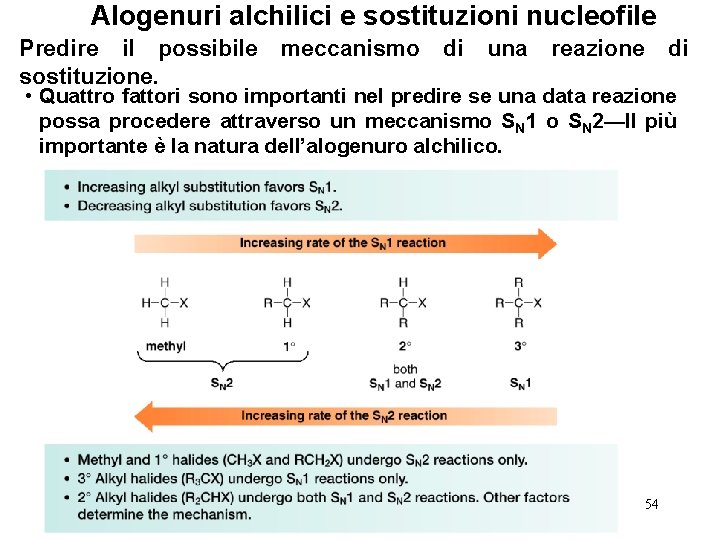
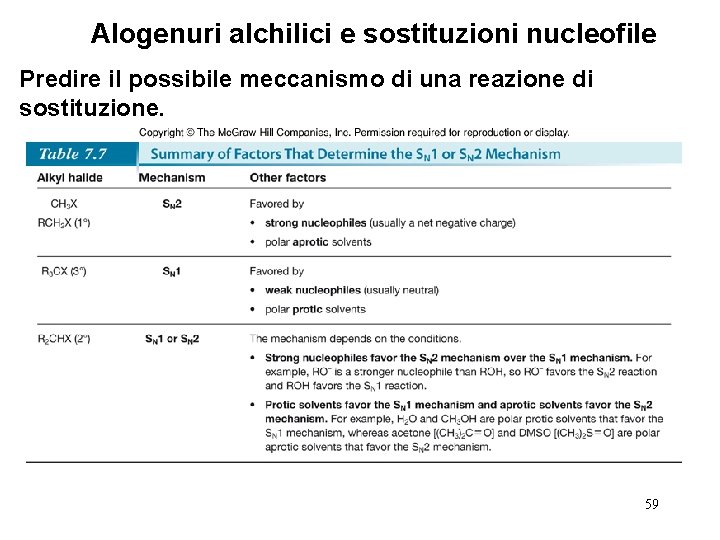
Alogenuri alchilici e sostituzioni nucleofile Predire il possibile sostituzione. meccanismo di una reazione di • Quattro fattori sono importanti nel predire se una data reazione possa procedere attraverso un meccanismo SN 1 o SN 2—Il più importante è la natura dell’alogenuro alchilico. 54

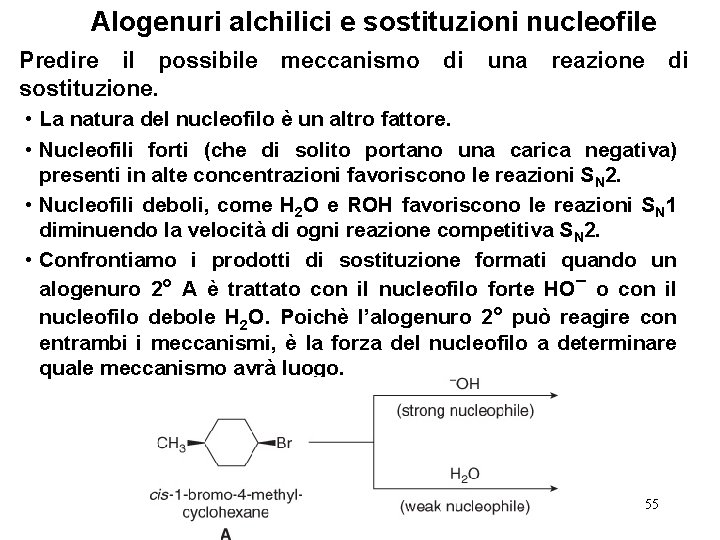
Alogenuri alchilici e sostituzioni nucleofile Predire il possibile sostituzione. meccanismo di una reazione di • La natura del nucleofilo è un altro fattore. • Nucleofili forti (che di solito portano una carica negativa) presenti in alte concentrazioni favoriscono le reazioni SN 2. • Nucleofili deboli, come H 2 O e ROH favoriscono le reazioni SN 1 diminuendo la velocità di ogni reazione competitiva S N 2. • Confrontiamo i prodotti di sostituzione formati quando un alogenuro 2° A è trattato con il nucleofilo forte HO¯ o con il nucleofilo debole H 2 O. Poichè l’alogenuro 2° può reagire con entrambi i meccanismi, è la forza del nucleofilo a determinare quale meccanismo avrà luogo. 55

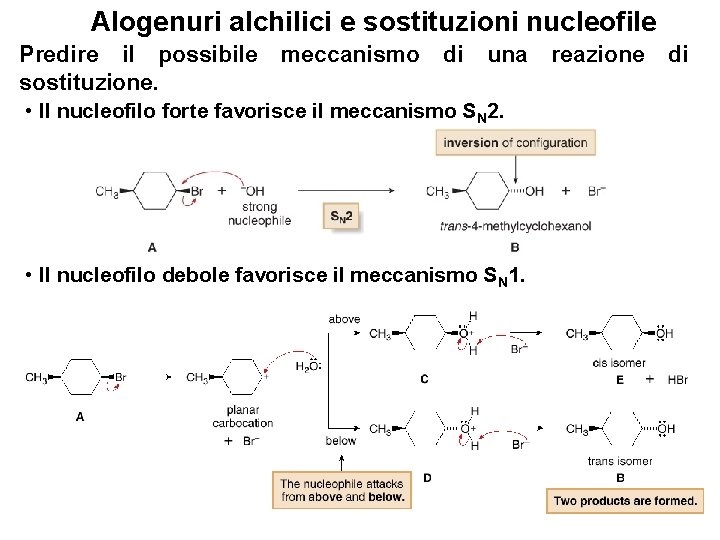
Alogenuri alchilici e sostituzioni nucleofile Predire il possibile sostituzione. meccanismo di una reazione di • Il nucleofilo forte favorisce il meccanismo SN 2. • Il nucleofilo debole favorisce il meccanismo SN 1. 56

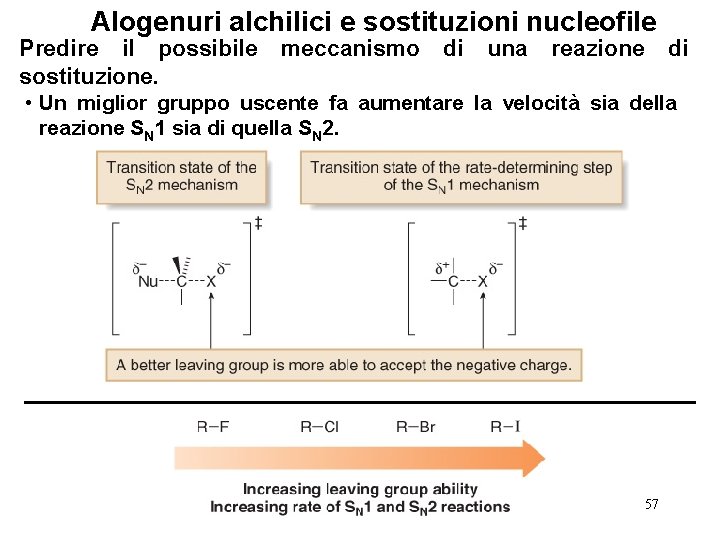
Alogenuri alchilici e sostituzioni nucleofile Predire il possibile sostituzione. meccanismo di una reazione di • Un miglior gruppo uscente fa aumentare la velocità sia della reazione SN 1 sia di quella SN 2. 57

Alogenuri alchilici e sostituzioni nucleofile Predire il possibile meccanismo di una reazione di sostituzione. • La natura del solvente è il quarto fattore. • I solventi polari protici come H 2 O e ROH favoriscono le reazioni SN 1 poichè gli intermedi ionici (sia cationi che anioni) sono stabilizzati per solvatazione. • I solventi polari aprotici favoriscono le reazioni SN 2 poichè i nucleofili non sono ben solvatati, e di conseguenza, sono più nucleofili. 58

Alogenuri alchilici e sostituzioni nucleofile Predire il possibile meccanismo di una reazione di sostituzione. 59

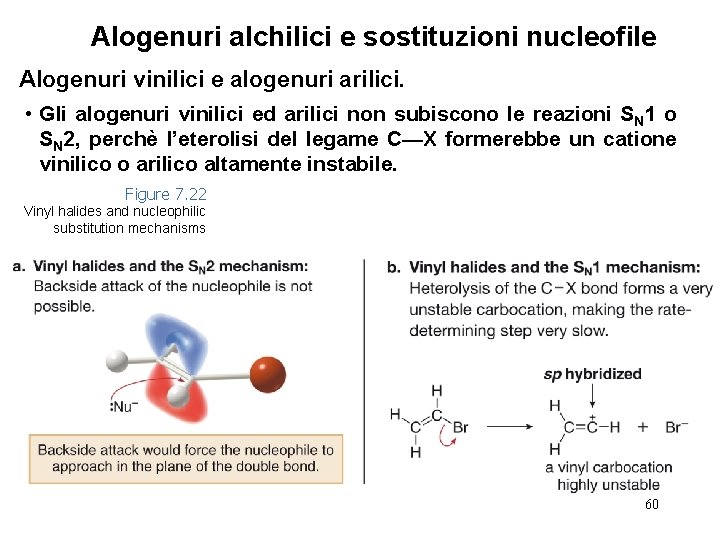
Alogenuri alchilici e sostituzioni nucleofile Alogenuri vinilici e alogenuri arilici. • Gli alogenuri vinilici ed arilici non subiscono le reazioni SN 1 o SN 2, perchè l’eterolisi del legame C—X formerebbe un catione vinilico o arilico altamente instabile. Figure 7. 22 Vinyl halides and nucleophilic substitution mechanisms 60

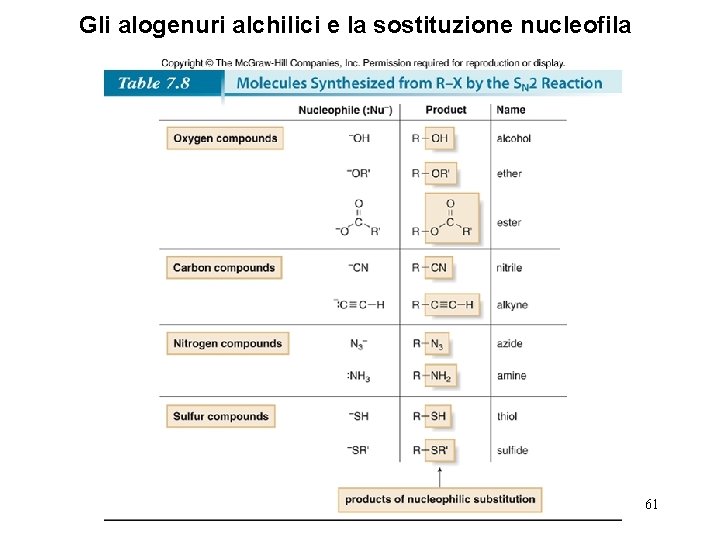
Gli alogenuri alchilici e la sostituzione nucleofila 61