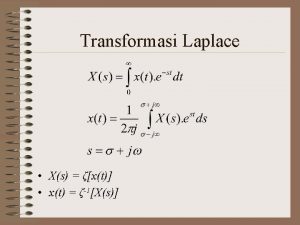Open Course Mengenal Sifat Material 1 oleh Sudaryatno




























![Persamaan Schrödinger, Dalam Koordinat Bola Pe Pe 1 r 0 r [Å] probabilitas maksimum Persamaan Schrödinger, Dalam Koordinat Bola Pe Pe 1 r 0 r [Å] probabilitas maksimum](https://slidetodoc.com/presentation_image_h2/8924342dcae9f86025f4c7f9e6302e5a/image-42.jpg)









![Ionisasi dan Energi Ionisasi [e. V] 1 H 13, 6 2 He 24, 5 Ionisasi dan Energi Ionisasi [e. V] 1 H 13, 6 2 He 24, 5](https://slidetodoc.com/presentation_image_h2/8924342dcae9f86025f4c7f9e6302e5a/image-56.jpg)







![Ikatan Atom Contoh : O 1 H: 1 s 1 8 O: [He] 2 Ikatan Atom Contoh : O 1 H: 1 s 1 8 O: [He] 2](https://slidetodoc.com/presentation_image_h2/8924342dcae9f86025f4c7f9e6302e5a/image-66.jpg)
![Ikatan Atom Hibrida dari fungsi gelombang s dan p 6 C: [He] 2 s Ikatan Atom Hibrida dari fungsi gelombang s dan p 6 C: [He] 2 s](https://slidetodoc.com/presentation_image_h2/8924342dcae9f86025f4c7f9e6302e5a/image-67.jpg)







- Slides: 81


Open Course Mengenal Sifat Material (1) oleh: Sudaryatno Sudirham

Cakupan Bahasan Ø Perkembangan Konsep Atom Ø Elektron Sebagai Partikel dan Gelombang Ø Persamaan Gelombang Schrödinger Ø Aplikasi Persamaan Schrödinger Ø Konfigurasi Elektron Dalam Atom Ø Ikatan Atom dan Susunan Atom


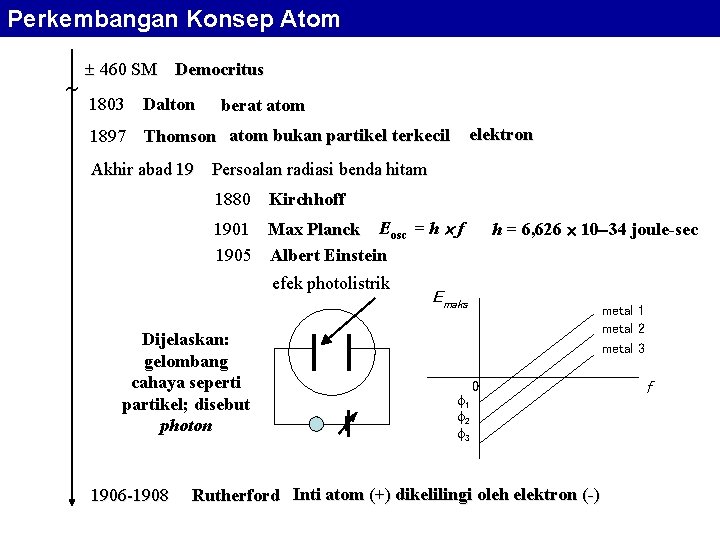
Perkembangan Konsep Atom Perkembangan pengetahuan tentang material dilandasi oleh konsep atom yang tumbuh semakin rumit dibandingkan dengan konsep awalnya yang sangat sederhana.

Perkembangan Konsep Atom 460 SM Democritus 1803 Dalton berat atom elektron 1897 Thomson atom bukan partikel terkecil Akhir abad 19 Persoalan radiasi benda hitam 1880 Kirchhoff 1901 Max Planck Eosc = h f 1905 Albert Einstein efek photolistrik Dijelaskan: gelombang cahaya seperti partikel; disebut photon 1906 -1908 h = 6, 626 10 34 joule-sec Emaks 1 2 3 metal 1 metal 2 metal 3 0 Rutherford Inti atom (+) dikelilingi oleh elektron (-) f

Perkembangan Konsep Atom Niels Bohr 5 4 3 tingkat energi 1913 PASCHEN 2 BALMER 1 LYMAN 1923 Compton photon dari sinar-X mengalami perubahan momentum saat berbenturan dengan elektron valensi. 1924 Louis de Broglie partikel sub-atom dapat dipandang sebagai gelombang 1926 Erwin Schrödinger mekanika kuantum 1927 Davisson dan Germer berkas elektron didefraksi oleh sebuah kristal 1927 Heisenberg 1930 Born uncertainty Principle intensitas gelombang

Model Atom Bohr

Perkembangan Konsep Atom, Model Atom Bohr Model atom Bohr dikemukakan dengan menggunakan pendekatan mekanika klasik. Model atom Bohr berbasis pada model yang diberikan oleh Rutherford: Partikel bermuatan positif terkonsentrasi di inti atom, dan elektron berada di sekeliling inti atom. Perbedaan penting antara kedua model atom: Model atom Rutherford: elektron berada di sekeliling inti atom dengan cara yang tidak menentu Model atom Bohr: elektron-elektron berada pada lingkaran-lingkaran orbit yang diskrit; energi elektron adalah diskrit.

Perkembangan Konsep Atom, Model Atom Bohr r Ze Fc Gagasan Bohr : orbit elektron adalah diskrit; ada hubungan linier antara energi dan frekuensi seperti halnya apa yang dikemukakan oleh Planck dan Einstein

Perkembangan Konsep Atom, Model Atom Bohr Dalam model atom Bohr : energi dan momentum sudut elektron dalam orbit terkuantisasi Setiap orbit ditandai dengan dua macam bilangan kuantum: bilangan kuantum prinsipal, n bilangan kuantum sekunder, l

Perkembangan Konsep Atom, Model Atom Bohr Jari-Jari Atom Bohr Untuk atom hidrogen pada ground state, di mana n = 1 dan Z = 1, maka r = 0, 528 Å

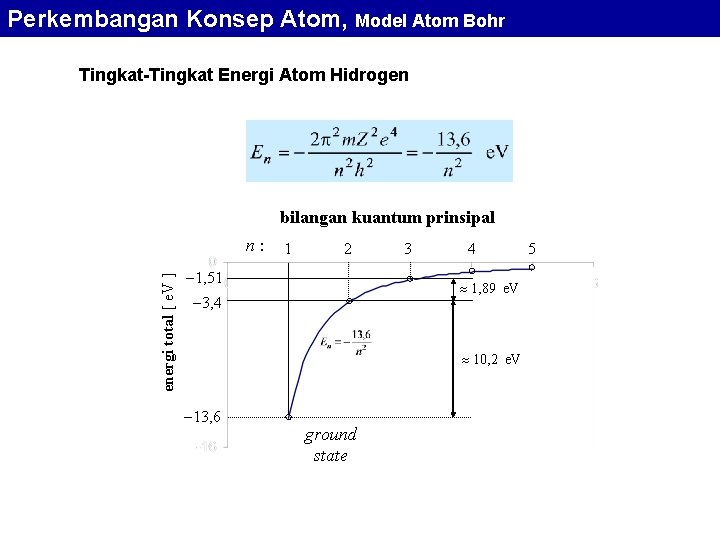
Perkembangan Konsep Atom, Model Atom Bohr Tingkat-Tingkat Energi Atom Hidrogen bilangan kuantum prinsipal energi total [ e. V ] n: 1 2 1, 51 3 4 1, 89 e. V 3, 4 10, 2 e. V 13, 6 ground state 5

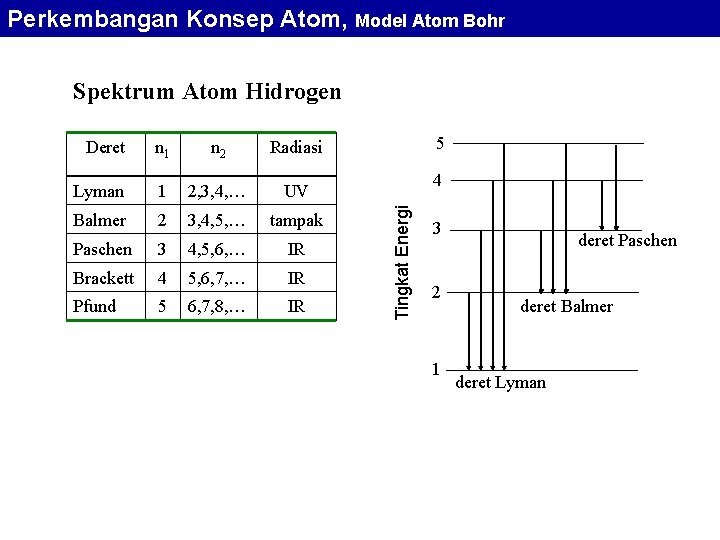
Perkembangan Konsep Atom, Model Atom Bohr Spektrum Atom Hidrogen n 1 n 2 Radiasi Lyman 1 2, 3, 4, … UV Balmer 2 3, 4, 5, … tampak Paschen 3 4, 5, 6, … IR Brackett 4 5, 6, 7, … IR Pfund 5 6, 7, 8, … IR 5 4 Tingkat Energi Deret 3 2 1 deret Paschen deret Balmer deret Lyman


Elektron Sebagai Gelombang Tunggal bilangan gelombang Kecepatan rambat gelombang dicari dengan melihat perubahan posisi amplitudo Kecepatan ini disebut kecepatan fasa

Elektron Sebagai Gelombang Paket gelombang adalah gelombang komposit yang merupakan jumlah dari n gelombang sinus dengan k 0 , 0, A 0, berturut-turut adalah nilai tengah dari bilangan gelombang, frekuensi dan amplitudo

Elektron Sebagai Gelombang Bilangan gelombang: k variasi k sempit Perbedaan nilai k antara gelombang-gelombang yang membentuk paket gelombang tersebut sangat kecil dianggap kontinyu demikian juga selang k sempit sehingga An / A 0 ≈ 1. Dengan demikian maka Pada suatu t tertentu, misalnya pada t = 0 persamaan bentuk amplitudo gelombang menjadi Karena perubahan nilai k dianggap kontinyu maka

Elektron Sebagai Gelombang Persamaan gelombang komposit untuk t = 0 menjadi Persamaan ini menunjukkan bahwa amplitudo gelombang komposit ini terselubung oleh fungsi lebar paket gelombang x selubung

Elektron Sebagai Gelombang Kecepatan Gelombang kecepatan fasa: kecepatan group: Amplitudo gelombang akan mempunyai bentuk yang sama bila S(x, t) = konstan. Hal ini terjadi jika ( )t = ( k)x untuk setiap n Kecepatan group ini merupakan kecepatan rambat paket gelombang

Elektron Sebagai Gelombang Panjang gelombang de Broglie, Momentum, Kecepatan Einstein : energi photon de Broglie: energi elektron Panjang gelombang Momentum Kecepatan konstanta Planck momentum elektron

Elektron Sebagai Gelombang Elektron Sebagai Partikel dan Elektron Sebagai Gelombang Elektron dapat dipandang sebagai gelombang tidaklah berarti bahwa elektron adalah gelombang; akan tetapi kita dapat mempelajari gerakan elektron dengan menggunakan persamaan diferensial yang sama bentuknya dengan persamaan diferensial untuk gelombang. Elektron sebagai partikel: massa tertentu, m. Elektron sebagai gelombang massa nol, tetapi = h/mve. Elektron sebagai partikel: Etotal = Ep+ Ek= Ep+ mve 2/2. Elektron sebagai gelombang: Etotal = hf = ħ. Elektron sebagai partikel: p = mve 2 Elektron sebagai gelombang: p = ħk = h/. Dalam memandang elektron sebagai gelombang, kita tidak dapat menentukan momentum dan posisi elektron secara simultan dengan masing-masing mempunyai tingkat ketelitian yang kita inginkan secara bebas. Kita dibatasi oleh prinsip ketidakpastian Heisenberg: p x h. Demikian pula halnya dengan energi dan waktu: E t h.


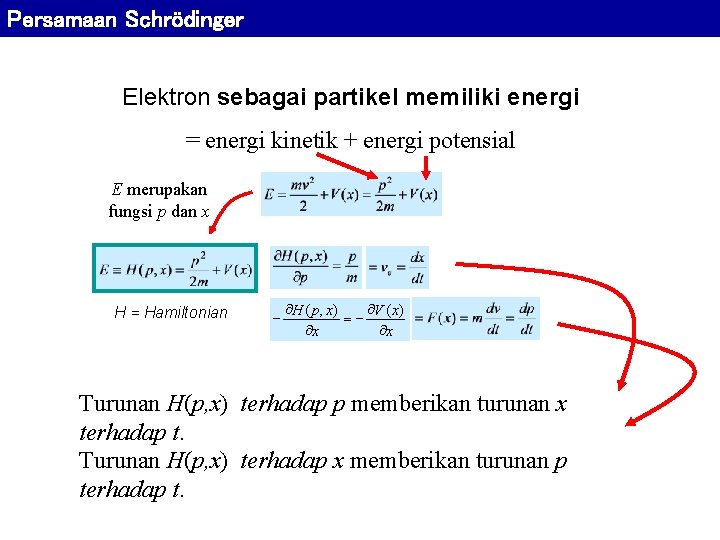
Persamaan Schrödinger Elektron sebagai partikel memiliki energi = energi kinetik + energi potensial E merupakan fungsi p dan x H = Hamiltonian ¶H ( p, x) ¶V ( x) ¶x ¶x Turunan H(p, x) terhadap p memberikan turunan x terhadap t. Turunan H(p, x) terhadap x memberikan turunan p terhadap t.

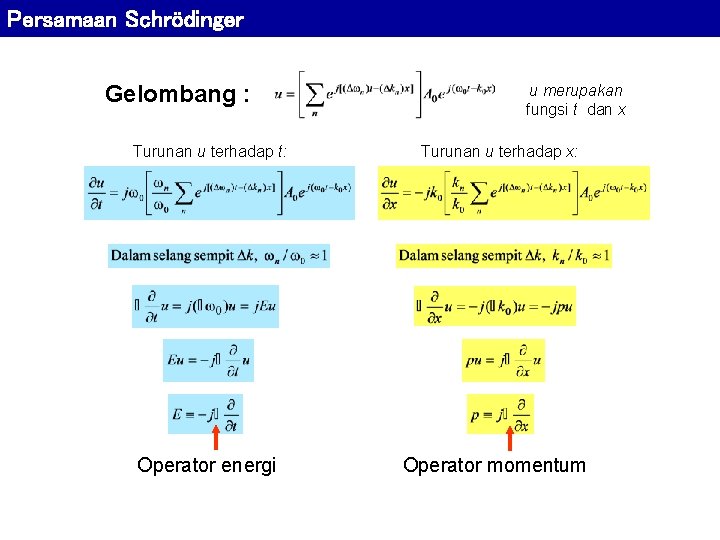
Persamaan Schrödinger Gelombang : Turunan u terhadap t: Operator energi u merupakan fungsi t dan x Turunan u terhadap x: Operator momentum

Persamaan Schrödinger Hamiltonian: Operator: Jika H(p, x) dan E dioperasikan pada fungsi gelombang maka diperoleh Inilah persamaan Schrödinger satu dimensi tiga dimensi

Persamaan Schrödinger Bebas Waktu Aplikasi persamaan Schrödinger dalam banyak hal hanya berkaitan dengan energi potensial, yaitu besaran yang hanya merupakan fungsi posisi Oleh karena itu jika persamaan tersebut diupayakan tidak merupakan fungsi yang bebas waktu agar penanganannya menjadi lebih sederhana Jika kita nyatakan: sehingga maka dapat diperoleh Satu dimensi Tiga dimensi

Persamaan Schrödinger Fungsi Gelombang Persamaan Schrödinger adalah persamaan diferensial parsial dengan adalah fungsi gelombang dengan pengertian bahwa adalah probabilitas keberadaan elektron pada waktu tertentu dalam volume dx dy dz di sekitar titik (x, y, z) Jadi persamaan Schrödinger tidak menentukan posisi elektron melainkan memberikan probabilitas bahwa ia akan ditemukan di sekitar posisi tertentu. Kita juga tidak dapat mengatakan secara pasti bagaimana elektron bergerak sebagai fungsi waktu karena posisi dan momentum elektron dibatasi oleh prinsip ketidakpastian Heisenberg Contoh kasus satu dimensi pada suatu t = 0

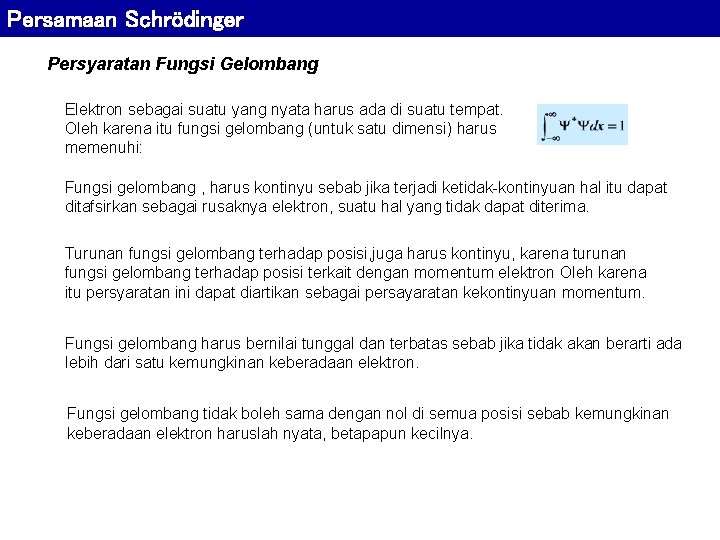
Persamaan Schrödinger Persyaratan Fungsi Gelombang Elektron sebagai suatu yang nyata harus ada di suatu tempat. Oleh karena itu fungsi gelombang (untuk satu dimensi) harus memenuhi: Fungsi gelombang , harus kontinyu sebab jika terjadi ketidak-kontinyuan hal itu dapat ditafsirkan sebagai rusaknya elektron, suatu hal yang tidak dapat diterima. Turunan fungsi gelombang terhadap posisi, juga harus kontinyu, karena turunan fungsi gelombang terhadap posisi terkait dengan momentum elektron Oleh karena itu persyaratan ini dapat diartikan sebagai persayaratan kekontinyuan momentum. Fungsi gelombang harus bernilai tunggal dan terbatas sebab jika tidak akan berarti ada lebih dari satu kemungkinan keberadaan elektron. Fungsi gelombang tidak boleh sama dengan nol di semua posisi sebab kemungkinan keberadaan elektron haruslah nyata, betapapun kecilnya.


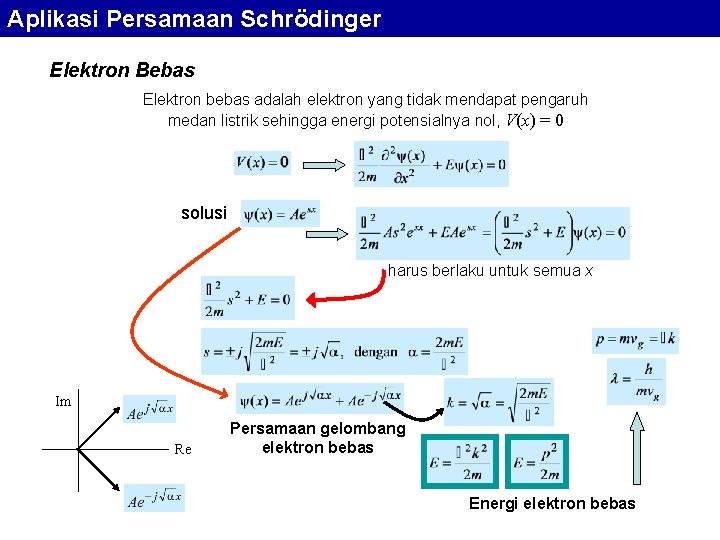
Aplikasi Persamaan Schrödinger Elektron Bebas Elektron bebas adalah elektron yang tidak mendapat pengaruh medan listrik sehingga energi potensialnya nol, V(x) = 0 solusi harus berlaku untuk semua x Im Re Persamaan gelombang elektron bebas Energi elektron bebas

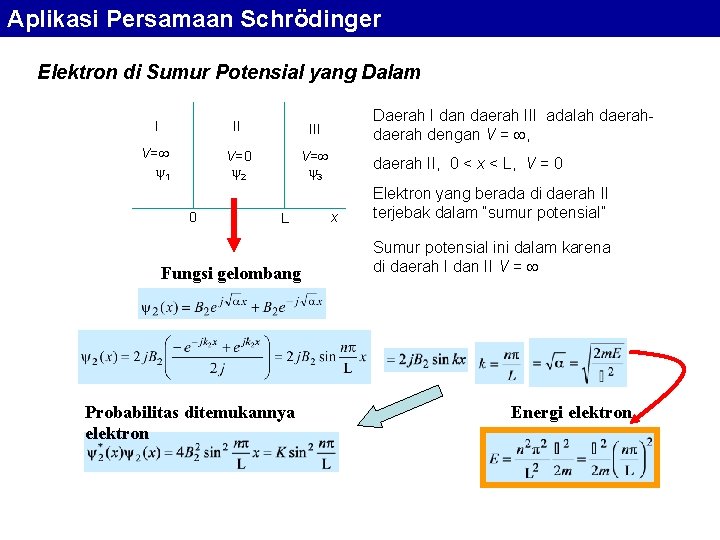
Aplikasi Persamaan Schrödinger Elektron di Sumur Potensial yang Dalam I II III V= 1 V=0 2 V= 3 0 L Fungsi gelombang Probabilitas ditemukannya elektron Daerah I dan daerah III adalah daerah dengan V = , daerah II, 0 < x < L, V = 0 x Elektron yang berada di daerah II terjebak dalam “sumur potensial” Sumur potensial ini dalam karena di daerah I dan II V = Energi elektron

Aplikasi Persamaan Schrödinger Fungsi gelombang, probabilitas ditemukannya elektron, dan energi elektron, tergantung dari lebar sumur, L Fungsi gelombang Probabilitas ditemukan elektron * * 0 x a). n = 1 Energi elektron * L 0 L b). n = 2 0 L c). n = 3

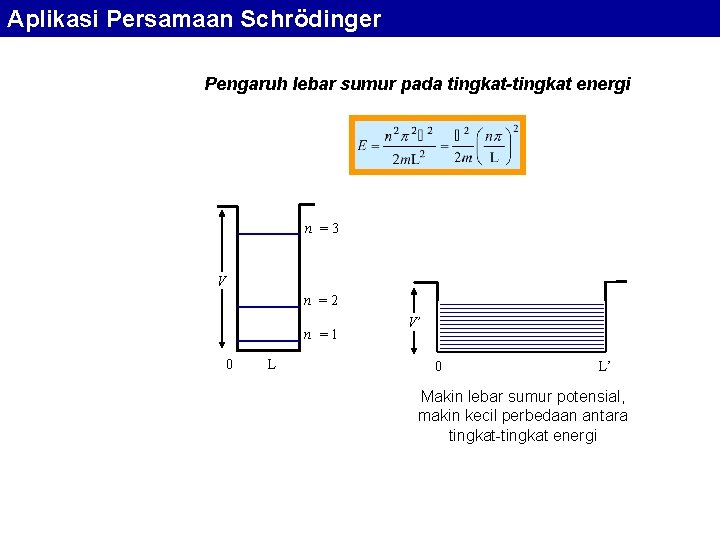
Aplikasi Persamaan Schrödinger Pengaruh lebar sumur pada tingkat-tingkat energi n =3 V n =2 n =1 0 L V’ 0 L’ Makin lebar sumur potensial, makin kecil perbedaan antara tingkat-tingkat energi

Aplikasi Persamaan Schrödinger Elektron di Sumur Potensial yang Dangkal Probabilitas keberadaan elektron tergantung dari kedalaman sumur V * E 0 L a) * * E E 0 L b) 0 a L c) Makin dangkal sumur, kemungkinan keberadaan elektron di luar sumur makin besar * 0 L d) Jika diding sumur tipis, elektron bisa “menembus” dinding potensial

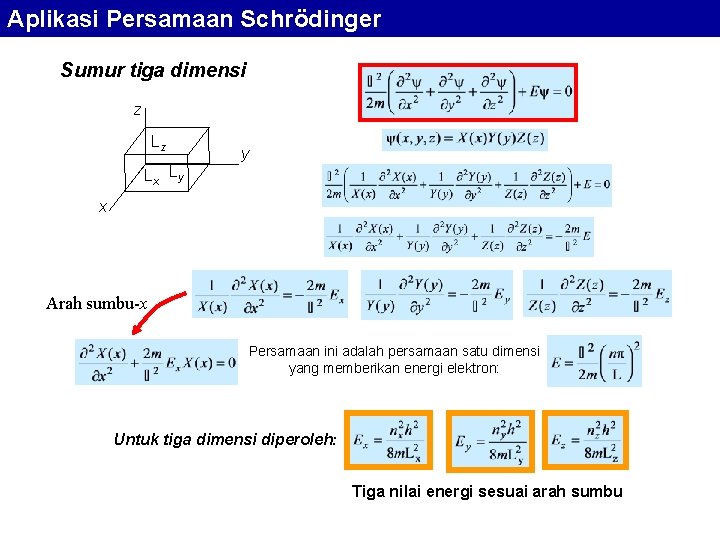
Aplikasi Persamaan Schrödinger Sumur tiga dimensi z Lz Lx Ly y x Arah sumbu-x Persamaan ini adalah persamaan satu dimensi yang memberikan energi elektron: Untuk tiga dimensi diperoleh: Tiga nilai energi sesuai arah sumbu


Persamaan Schrödinger dalam Koordinat Bola

Persamaan Schrödinger, Dalam Koordinat Bola Persamaan Schrödinger dalam Koordinat Bola z elektron inti atom berimpit dengan titik awal koordinat r inti atom y persamaan Schrödinger dalam koordinat bola x Jika kita nyatakan: mengandung r kita peroleh persamaan yang berbentuk tidak mengandung r salah satu kondisi yang akan memenuhi persamaan ini adalah jika keduanya = 0

Persamaan Schrödinger, Dalam Koordinat Bola Persamaan yang mengandung r saja fungsi gelombang R hanya merupakan fungsi r simetri bola kalikan dengan dan kelompokkan suku-suku yang berkoefisien konstan Ini harus berlaku untuk semua nilai r Salah satu kemungkinan:

Persamaan Schrödinger, Dalam Koordinat Bola salah satu solusi: Inilah nilai E yang harus dipenuhi agar R 1 merupakan solusi dari kedua persamaan Energi elektron pada status ini diperoleh dengan masukkan nilai-nilai e, m, dan h Probabilitas keberadaan elektron dapat dicari dengan menghitung probabilitas keberadaan elektron dalam suatu “volume dinding” bola yang mempunyai jari-jari r dan tebal dinding r.
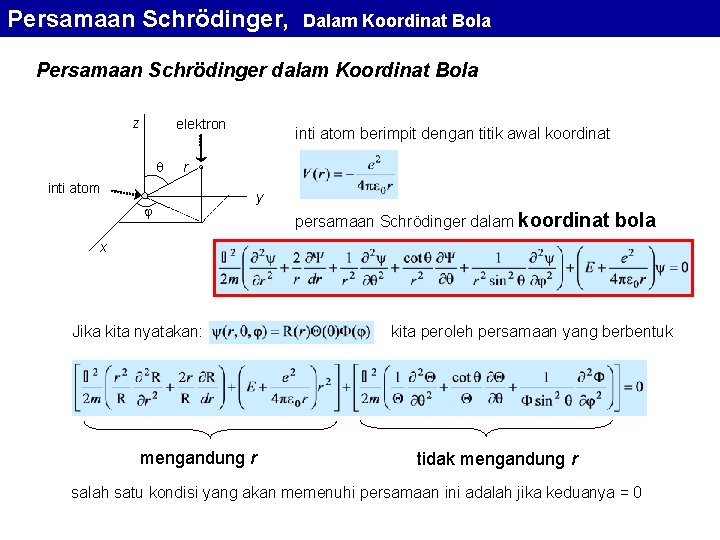
![Persamaan Schrödinger Dalam Koordinat Bola Pe Pe 1 r 0 r Å probabilitas maksimum Persamaan Schrödinger, Dalam Koordinat Bola Pe Pe 1 r 0 r [Å] probabilitas maksimum](https://slidetodoc.com/presentation_image_h2/8924342dcae9f86025f4c7f9e6302e5a/image-42.jpg)
Persamaan Schrödinger, Dalam Koordinat Bola Pe Pe 1 r 0 r [Å] probabilitas maksimum ada di sekitar suatu nilai r 0 sedangkan di luar r 0 probabilitas ditemukannya elektron dengan cepat menurun keberadaan elektron terkonsentrasi di sekitar jari-jari r 0 saja Inilah struktur atom hidrogen yang memiliki hanya satu elektron di sekitar inti atomnya dan inilah yang disebut status dasar atau ground state

Persamaan Schrödinger, Dalam Koordinat Bola Adakah Solusi Yang Lain? * * Kita ingat: 0 * x L 0 0 L c). n = 3 b). n = 2 a). n = 1 L Energi Elektron terkait jumlah titik simpul fungsi gelombang solusi yang lain: bertitik simpul dua R R 1 bertitik simpul tiga Solusi secara umum: R 3 R 2 r[Å] polinom

Persamaan Schrödinger, Dalam Koordinat Bola probabilitas keberadaan elektron Pe Pe 1 Pe 2 Pe 3 r[Å] bilangan kuantum prinsipal 1 2 3 4 energi total [ e. V ] Tingkat-Tingkat Energi Atom Hidrogen 1, 51 3, 4 1, 89 e. V 10, 2 e. V 13, 6 5 ground state n

Persamaan Schrödinger, Dalam Koordinat Bola Momentum Sudut Momentum sudut juga terkuantisasi bilangan bulat positif Momentum sudut ditentukan oleh dua macam bilangan bulat: l : menentukan besar momentum sudut, dan ml : menentukan komponen z atau arah momentum sudut Nilai l dan ml yang mungkin : dst.

Persamaan Schrödinger, Dalam Koordinat Bola l disebut bilangan kuantum momentum sudut, atau bilangan kuantum azimuthal bilangan kuantum l 0 1 2 3 4 5 simbol s p d f g h degenerasi 1 3 5 7 9 11 ml adalah bilangan kuantum magnetik

Persamaan Schrödinger, Dalam Koordinat Bola Bilangan Kuantum Ada tiga bilangan kuantum. (1) bilangan kuantum utama, n, yang menentukan tingkat energi; (2) bilangan kuantum momentum sudut, atau bilangan kuantum azimuthal, l; (3) bilangan kuantum magnetik, ml. kuantum utama bilangan n: 1 2 3 4 5 2 s, 2 p 1, 5 0 1 energi 3, 4 total [ e. V ] 13, 6 1 s Bohr lebih cermat (4) Spin Elektron: ½ dikemukakan oleh Uhlenbeck 3 s, 3 p, 3 d

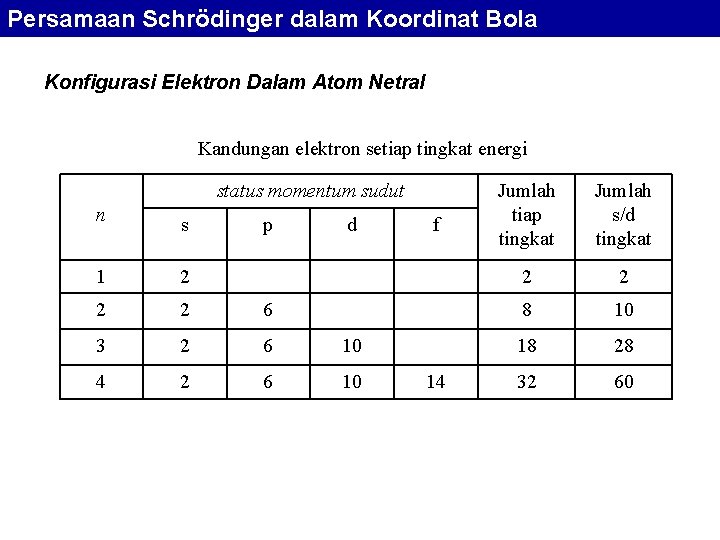
Persamaan Schrödinger dalam Koordinat Bola Konfigurasi Elektron Dalam Atom Netral Kandungan elektron setiap tingkat energi status momentum sudut n s 1 2 2 2 6 3 2 6 10 4 2 6 10 p d f 14 Jumlah tiap tingkat Jumlah s/d tingkat 2 2 8 10 18 28 32 60

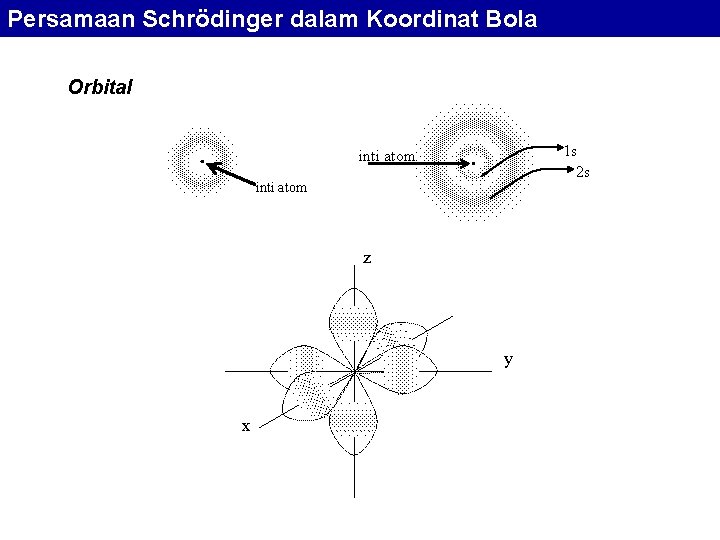
Persamaan Schrödinger dalam Koordinat Bola Orbital 1 s 2 s inti atom z y x

Persamaan Schrödinger dalam Koordinat Bola Penulisan konfigurasi elektron unsur-unsur H: 1 s 1; He: 1 s 2 Li: 1 s 2 2 s 1; Be: 1 s 2 2 s 2; B: 1 s 2 2 p 1; C: 1 s 2 2 p 2; N: 1 s 2 2 p 3; O: 1 s 2 2 p 4; F: 1 s 2 2 p 5; Ne: 1 s 2 2 p 6. . dst

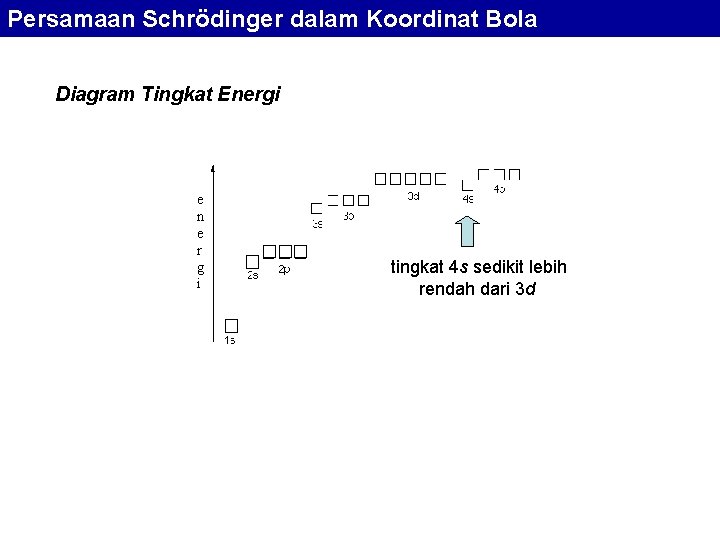
Persamaan Schrödinger dalam Koordinat Bola Diagram Tingkat Energi e n e r g i tingkat 4 s sedikit lebih rendah dari 3 d

Persamaan Schrödinger dalam Koordinat Bola Pengisian Elektron Pada Orbital H: He: Li: Be: B: C: N: O: F: Ne: pengisian 1 s; pemenuhan 1 s; pengisian 2 s; pemenuhan 2 s; pengisian 2 px dengan 1 elektron; pengisian 2 py dengan 1 elektron; pengisian 2 pz dengan 1 elektron; pemenuhan 2 px; pemenuhan 2 py; pemenuhan 2 pz.

Konfigurasi Elektron Dalam Atom Tingkat energi 4 s lebih rendah dari 3 d. Hal ini terlihat pada perubahan konfigurasi dari Ar (argon) ke K (kalium). Ar: 1 s 2 2 p 6 3 s 2 3 p 6 K: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 (bukan 3 d 1) Ca: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 (bukan 3 d 2) Sc: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 1 4 s 2 (orbital 3 d baru mulai terisi setelah 4 s penuh) Y: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 2 4 s 2 (dan unsur selanjutnya pengisian 3 d sampai penuh)

Konfigurasi Elektron Dalam Atom Blok-Blok Unsur 1 H 1 s 1 2 He 1 s 2 3 Li [He] 2 s 1 4 Be [He] 2 s 2 5 B [He] 2 s 2 2 p 1 6 C [He] 2 s 2 2 p 2 7 N [He] 2 s 2 2 p 3 8 O [He] 2 s 2 2 p 4 9 F [He] 2 s 2 2 p 5 10 Ne [He] 2 s 2 2 p 6 11 Na [Ne] 3 s 1 12 Mg [Ne] 3 s 2 13 Al [Ne] 3 s 2 3 p 1 14 Si [Ne] 3 s 2 3 p 2 15 P [Ne] 3 s 2 3 p 3 16 S [Ne] 3 s 2 3 p 4 17 Cl [Ne] 3 s 2 3 p 5 18 Ar [Ne] 3 s 2 3 p 6 19 K [Ar] 4 s 1 20 Ca [Ar] 4 s 2 31 Ga [Ar] 3 d 10 4 s 2 4 p 1 32 Ge [Ar] 3 d 10 4 s 2 4 p 2 33 As [Ar] 3 d 10 4 s 2 4 p 3 34 Se [Ar] 3 d 10 4 s 2 4 p 4 35 Br [Ar] 3 d 10 4 s 2 4 p 5 36 Kr [Ar] 3 d 10 4 s 2 4 p 6 21 Sc [Ar] 3 d 1 4 s 2 Blok s pengisian orbital s 22 Ti [Ar] 3 d 2 4 s 2 23 V [Ar] 3 d 3 4 s 2 24 Cr [Ar] 3 d 5 4 s 1 25 Mn [Ar] 3 d 5 4 s 2 26 Fe [Ar] 3 d 6 4 s 2 27 Co [Ar] 3 d 7 4 s 2 Blok d pengisian orbital d 28 Ni [Ar] 3 d 8 4 s 2 29 Cu [Ar] 3 d 10 4 s 1 30 Zn [Ar] 3 d 10 4 s 2 Blok p pengisian orbital p

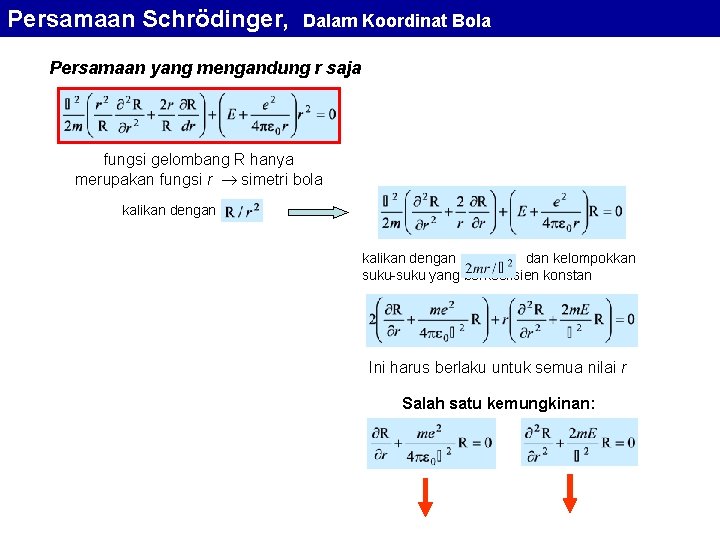
Ionisasi dan Energi Ionisasi ionisasi Energi ionisasi adalah jumlah energi yang diperlukan untuk melepaskan elektron terluar suatu unsur guna membentuk ion positif bermuatan +1. Energi ionisasi dalam satuan e. V disebut juga potensial ionisasi. Potensial ionisasi didefinisikan sebagai energi yang diperlukan untuk melepaskan elektron yang paling lemah terikat pada atom. Pada atom dengan banyak elektron, pengertian ini sering disebut sebagai potensial ionisasi yang pertama, karena sesudah ionisasi yang pertama ini bisa terjadi ionisasi lebih lanjut dengan terlepasnya elektron yang lebih dekat ke inti atom.
![Ionisasi dan Energi Ionisasi e V 1 H 13 6 2 He 24 5 Ionisasi dan Energi Ionisasi [e. V] 1 H 13, 6 2 He 24, 5](https://slidetodoc.com/presentation_image_h2/8924342dcae9f86025f4c7f9e6302e5a/image-56.jpg)
Ionisasi dan Energi Ionisasi [e. V] 1 H 13, 6 2 He 24, 5 3 Li 5, 39 4 Be 9, 32 5 B 8, 29 6 C 11, 2 7 N 14, 6 8 O 13, 6 9 F 17, 4 10 Ne 21, 6 11 Na 5, 14 12 Mg 7, 64 13 Al 5, 98 14 Si 8, 15 15 P 10, 4 16 S 10, 4 17 Cl 13, 0 18 Ar 15, 8 19 K 4, 34 20 Ca 6, 11 31 Ga 6, 00 32 Ge 7, 88 33 As 9, 81 34 Se 9, 75 35 Br 11, 8 36 Kr 14 21 Sc 6, 54 22 Ti 6, 83 23 V 6, 74 24 Cr 6, 76 25 Mn 7, 43 26 Fe 7, 87 27 Co 7, 86 28 Ni 7, 63 29 Cu 7, 72 30 Zn 9, 39

Ionisasi dan Energi Ionisasi p p s s p d s Di setiap blok unsur, energi ionisasi cenderung meningkat jika nomer atom makin besar Energi ionisasi turun setiap kali pergantian blok unsur

Afinitas Elektron Afinitas elektron adalah energi yang dilepaskan jika atom netral menerima satu elektron membentuk ion negatif bermuatan 1. Afinitas elektron dinyatakan dengan bilangan negatif, yang berarti pelepasan energi. Afinitas elektron merupakan ukuran kemampuan suatu unsur untuk menarik elektron, bergabung dengan unsur untuk membentuk ion negatif. Makin kuat gaya tarik ini, berarti makin besar energi yang dilepaskan. Gaya tarik ini dipengaruhi oleh jumlah muatan inti atom, jarak orbital ke inti, dan screening (tabir elektron).


Konfigurasi Unsur Bilangan Kuantum : Bilangan kuantum : prinsipal: n = 1, 2, 3, dst azimuthal: l = 0, 1, 2, 3 : s, p, d, f magnetik: ml = l sampai +l spin elektron: ms = +1/2 dan 1/2 Pauli Exclusion Prinsiple : setiap status hanya dapat ditempati tidak lebih dari satu elektron

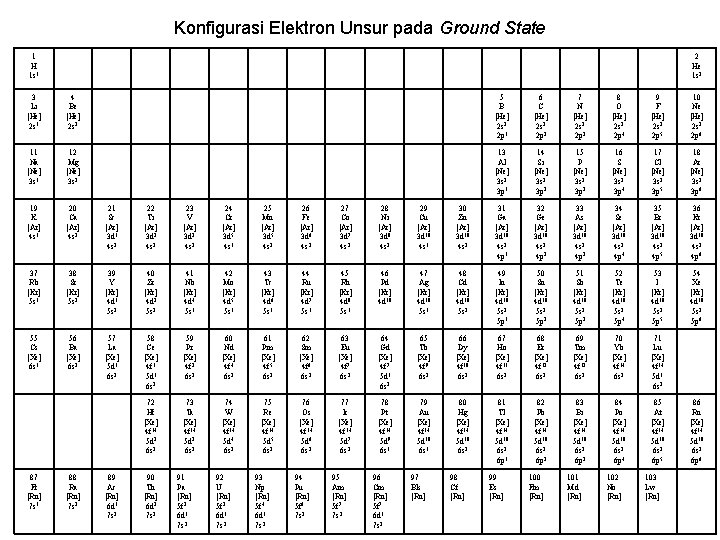
Konfigurasi Elektron Unsur pada Ground State 1 H 1 s 1 2 He 1 s 2 3 Li [He] 2 s 1 4 Be [He] 2 s 2 5 B [He] 2 s 2 2 p 1 6 C [He] 2 s 2 2 p 2 7 N [He] 2 s 2 2 p 3 8 O [He] 2 s 2 2 p 4 9 F [He] 2 s 2 2 p 5 10 Ne [He] 2 s 2 2 p 6 11 Na [Ne] 3 s 1 12 Mg [Ne] 3 s 2 13 Al [Ne] 3 s 2 3 p 1 14 Si [Ne] 3 s 2 3 p 2 15 P [Ne] 3 s 2 3 p 3 16 S [Ne] 3 s 2 3 p 4 17 Cl [Ne] 3 s 2 3 p 5 18 Ar [Ne] 3 s 2 3 p 6 19 K [Ar] 4 s 1 20 Ca [Ar] 4 s 2 21 Sc [Ar] 3 d 1 4 s 2 22 Ti [Ar] 3 d 2 4 s 2 23 V [Ar] 3 d 3 4 s 2 24 Cr [Ar] 3 d 5 4 s 1 25 Mn [Ar] 3 d 5 4 s 2 26 Fe [Ar] 3 d 6 4 s 2 27 Co [Ar] 3 d 7 4 s 2 28 Ni [Ar] 3 d 8 4 s 2 29 Cu [Ar] 3 d 10 4 s 1 30 Zn [Ar] 3 d 10 4 s 2 31 Ga [Ar] 3 d 10 4 s 2 4 p 1 32 Ge [Ar] 3 d 10 4 s 2 4 p 2 33 As [Ar] 3 d 10 4 s 2 4 p 3 34 Se [Ar] 3 d 10 4 s 2 4 p 4 35 Br [Ar] 3 d 10 4 s 2 4 p 5 36 Kr [Ar] 3 d 10 4 s 2 4 p 6 37 Rb [Kr] 5 s 1 38 Sr [Kr] 5 s 2 39 Y [Kr] 4 d 1 5 s 2 40 Zr [Kr] 4 d 2 5 s 2 41 Nb [Kr] 4 d 4 5 s 1 42 Mo [Kr] 4 d 5 5 s 1 43 Tc [Kr] 4 d 6 5 s 1 44 Ru [Kr] 4 d 7 5 s 1 45 Rh [Kr] 4 d 8 5 s 1 46 Pd [Kr] 4 d 10 47 Ag [Kr] 4 d 10 5 s 1 48 Cd [Kr] 4 d 10 5 s 2 49 In [Kr] 4 d 10 5 s 2 5 p 1 50 Sn [Kr] 4 d 10 5 s 2 5 p 2 51 Sb [Kr] 4 d 10 5 s 2 5 p 3 52 Te [Kr] 4 d 10 5 s 2 5 p 4 53 I [Kr] 4 d 10 5 s 2 5 p 5 54 Xe [Kr] 4 d 10 5 s 2 5 p 6 55 Cs [Xe] 6 s 1 56 Ba [Xe] 6 s 2 57 La [Xe] 5 d 1 6 s 2 58 Ce [Xe] 4 f 1 5 d 1 6 s 2 59 Pr [Xe] 4 f 3 6 s 2 60 Nd [Xe] 4 f 4 6 s 2 61 Pm [Xe] 4 f 5 6 s 2 62 Sm [Xe] 4 f 6 6 s 2 63 Eu [Xe] 4 f 7 6 s 2 64 Gd [Xe] 4 f 7 5 d 1 6 s 2 65 Tb [Xe] 4 f 9 6 s 2 66 Dy [Xe] 4 f 10 6 s 2 67 Ho [Xe] 4 f 11 6 s 2 68 Er [Xe] 4 f 12 6 s 2 69 Tm [Xe] 4 f 13 6 s 2 70 Yb [Xe] 4 f 14 6 s 2 71 Lu [Xe] 4 f 14 5 d 1 6 s 2 72 Hf [Xe] 4 f 14 5 d 2 6 s 2 73 Ta [Xe] 4 f 14 5 d 3 6 s 2 74 W [Xe] 4 f 14 5 d 4 6 s 2 75 Re [Xe] 4 f 14 5 d 5 6 s 2 76 Os [Xe] 4 f 14 5 d 6 6 s 2 77 Ir [Xe] 4 f 14 5 d 7 6 s 2 78 Pt [Xe] 4 f 14 5 d 9 6 s 1 79 Au [Xe] 4 f 14 5 d 10 6 s 1 80 Hg [Xe] 4 f 14 5 d 10 6 s 2 81 Tl [Xe] 4 f 14 5 d 10 6 s 2 6 p 1 82 Pb [Xe] 4 f 14 5 d 10 6 s 2 6 p 2 83 Bi [Xe] 4 f 14 5 d 10 6 s 2 6 p 3 84 Po [Xe] 4 f 14 5 d 10 6 s 2 6 p 4 85 At [Xe] 4 f 14 5 d 10 6 s 2 6 p 5 87 Fr [Rn] 7 s 1 88 Ra [Rn] 7 s 2 89 Ac [Rn] 6 d 1 7 s 2 90 Th [Rn] 6 d 2 7 s 2 91 Pa [Rn] 5 f 2 6 d 1 7 s 2 92 U [Rn] 5 f 3 6 d 1 7 s 2 93 Np [Rn] 5 f 4 6 d 1 7 s 2 94 Pu [Rn] 5 f 6 7 s 2 95 Am [Rn] 5 f 7 7 s 2 96 Cm [Rn] 5 f 7 6 d 1 7 s 2 97 Bk [Rn] 98 Cf [Rn] 99 Es [Rn] 100 Fm [Rn] 101 Md [Rn] 102 No [Rn] 103 Lw [Rn] 86 Rn [Xe] 4 f 14 5 d 10 6 s 2 6 p 6

Ikatan Atom Gaya Ikat : gaya yang menyebabkan dua atom menjadi terikat; gaya ini terbentuk jika terjadi penurunan energi ketika dua atom saling mendekat Ikatan Primer : Kuat Ikatan Kovalen Ikatan Metal Ikatan Ion Ikatan Sekunder : Lemah Ikatan Hidrogen Ikatan van der Waals

Ikatan Atom Ikatan Berarah dan Tak Berarah Ikatan berarah: kovalen dipole permanen terutama terjadi pada ikatan kovalen antara unsur non metal: Nitrogen; Oksigen; Carbon; Fluor; Chlor atom dengan ikatan berarah akan terkumpul sedemikian rupa sehingga terpenuhi sudut ikatan Ikatan tak berarah: metal ion van der Waals terutama pada Ikatan metal yang terjadi antara sejumlah besar atom dengan ikatan tak berarah pada umumnya terkumpul secara rapat (kompak) dan mengikuti aturan geometris yang ditentukan oleh perbedaan ukuran atom walaupun kita bedakan ikatan atom berarah dan ikatan tak berarah, namum dalam kenyataan material bisa terbentuk dari campuran dua macam ikatan tersebut

Ikatan Atom dengan ikatan tak berarah Sifat ikatan : Jumlah diskrit Arah tidak diskrit Contoh : H 2 atom H memiliki 1 elektron di orbital 1 s simetri bola namun ikatan 2 atom H tetap diskrit : setiap atom H hanya akan terikat dengan satu atom H yang lain

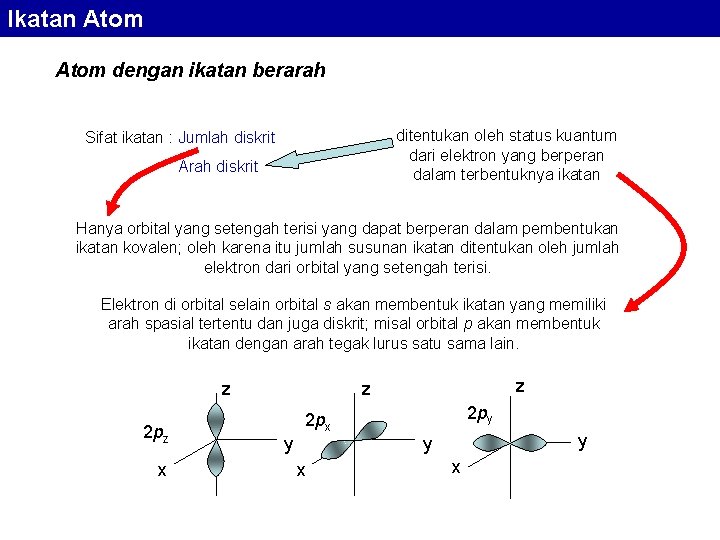
Ikatan Atom dengan ikatan berarah ditentukan oleh status kuantum dari elektron yang berperan dalam terbentuknya ikatan Sifat ikatan : Jumlah diskrit Arah diskrit Hanya orbital yang setengah terisi yang dapat berperan dalam pembentukan ikatan kovalen; oleh karena itu jumlah susunan ikatan ditentukan oleh jumlah elektron dari orbital yang setengah terisi. Elektron di orbital selain orbital s akan membentuk ikatan yang memiliki arah spasial tertentu dan juga diskrit; misal orbital p akan membentuk ikatan dengan arah tegak lurus satu sama lain. z 2 pz x z z 2 py 2 px y y y x x
![Ikatan Atom Contoh O 1 H 1 s 1 8 O He 2 Ikatan Atom Contoh : O 1 H: 1 s 1 8 O: [He] 2](https://slidetodoc.com/presentation_image_h2/8924342dcae9f86025f4c7f9e6302e5a/image-66.jpg)
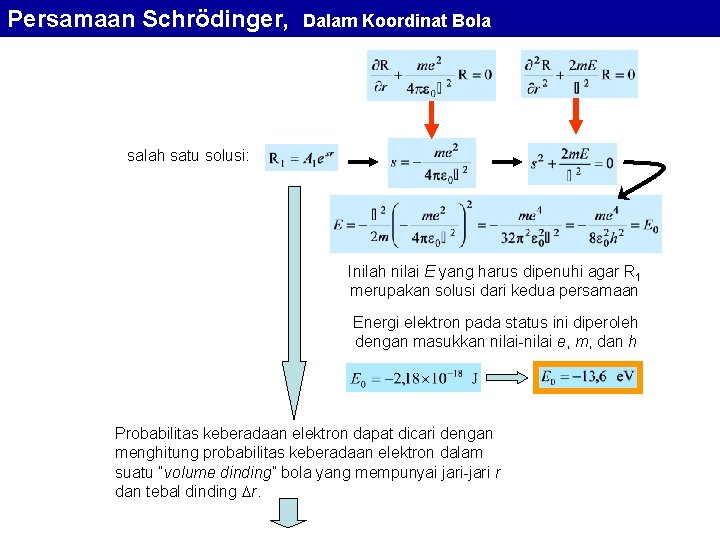
Ikatan Atom Contoh : O 1 H: 1 s 1 8 O: [He] 2 s 2 2 p 4 H H 104 o H 1 H: 1 s 1 + dipole + 9 F: [He] 2 s 2 2 p 5 F dipole
![Ikatan Atom Hibrida dari fungsi gelombang s dan p 6 C He 2 s Ikatan Atom Hibrida dari fungsi gelombang s dan p 6 C: [He] 2 s](https://slidetodoc.com/presentation_image_h2/8924342dcae9f86025f4c7f9e6302e5a/image-67.jpg)
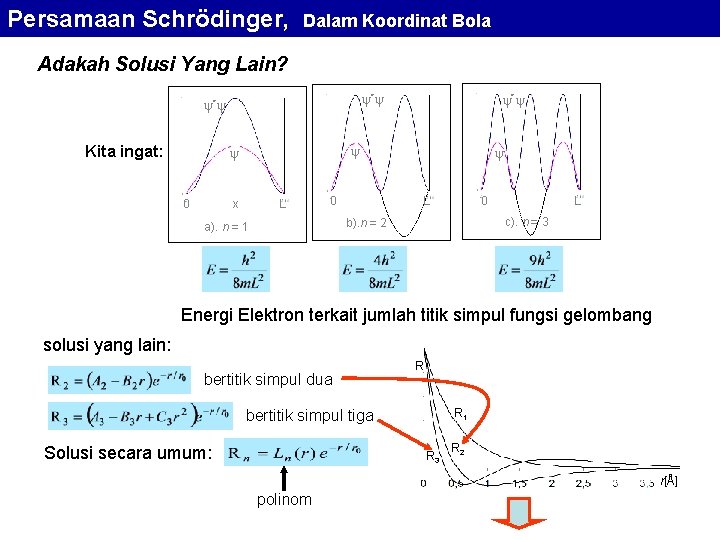
Ikatan Atom Hibrida dari fungsi gelombang s dan p 6 C: [He] 2 s 2 2 p 2 Hibrida dari fungsi gelombang s dan p pada karbon membuat karbon memiliki 4 ikatan yang kuat mengarah ke susut-sudut tetrahedron Intan dan methane (CH 4) terbentuk dari ikatan hibrida ini. 14 Si [Ne] 3 s 2 3 p 2 32 Ge [Ar] 3 d 10 4 s 2 4 p 2 50 Sn [Kr] 4 d 10 5 s 2 5 p 2 juga membentuk orbital tetrahedral seperti karbon karena hibrida 3 s-sp, 4 s-4 p, dan 5 s -5 p, sama dengan 2 s-2 p.

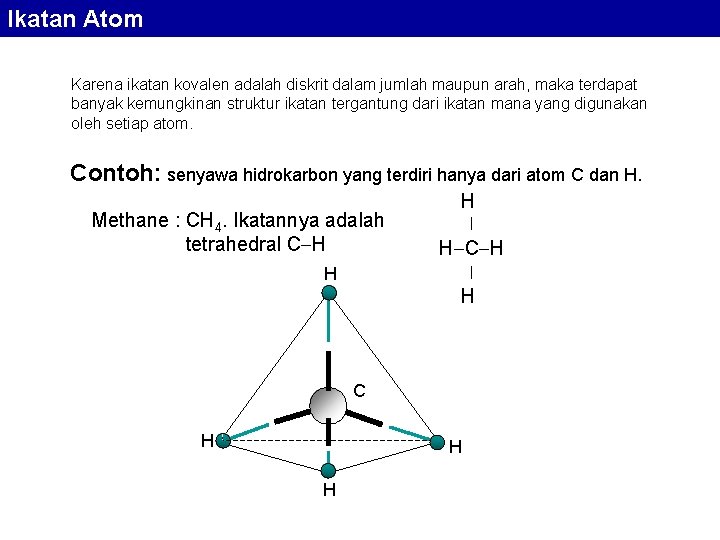
Ikatan Atom Karena ikatan kovalen adalah diskrit dalam jumlah maupun arah, maka terdapat banyak kemungkinan struktur ikatan tergantung dari ikatan mana yang digunakan oleh setiap atom. Contoh: senyawa hidrokarbon yang terdiri hanya dari atom C dan H. Methane : CH 4. Ikatannya adalah tetrahedral C H H | H C H | H H C H H H

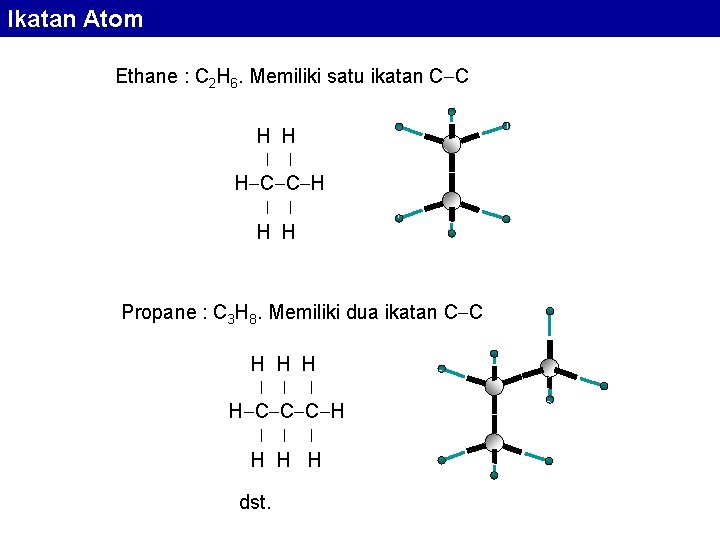
Ikatan Atom Ethane : C 2 H 6. Memiliki satu ikatan C C H H | | H C C H | | H H Propane : C 3 H 8. Memiliki dua ikatan C C H H H | | | H C C C H | | | H H H dst.

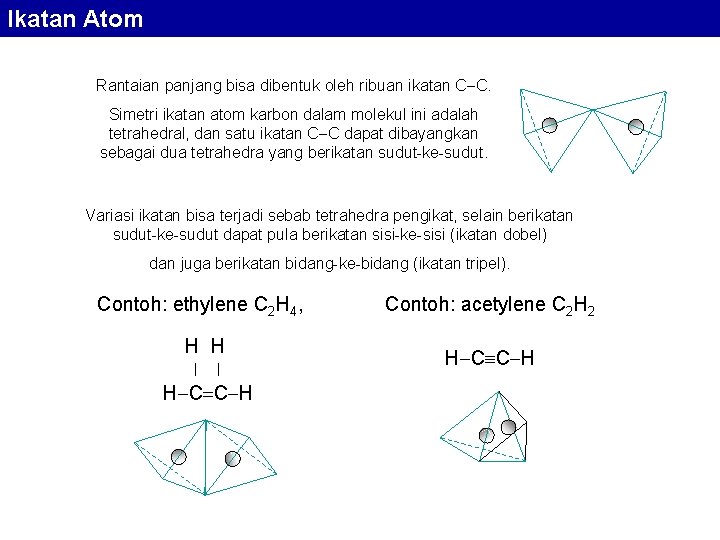
Ikatan Atom Rantaian panjang bisa dibentuk oleh ribuan ikatan C C. Simetri ikatan atom karbon dalam molekul ini adalah tetrahedral, dan satu ikatan C C dapat dibayangkan sebagai dua tetrahedra yang berikatan sudut-ke-sudut. Variasi ikatan bisa terjadi sebab tetrahedra pengikat, selain berikatan sudut-ke-sudut dapat pula berikatan sisi-ke-sisi (ikatan dobel) dan juga berikatan bidang-ke-bidang (ikatan tripel). Contoh: ethylene C 2 H 4, H H | | H C C H Contoh: acetylene C 2 H 2 H C C H

Ikatan Atom Peningkatan kekuatan ikatan sebagai hasil dari terjadinya ikatan multiple disertai penurunan jarak antar atom karbon. 1, 54 Ä pada ikatan tunggal, 1, 33 Ä pada ikatan dobel, 1, 20 Ä pada ikatan tripel. Ikatan C C juga bisa digabung dari ikatan tunggal dan ikatan dobel, seperti yang terjadi pada benzena.

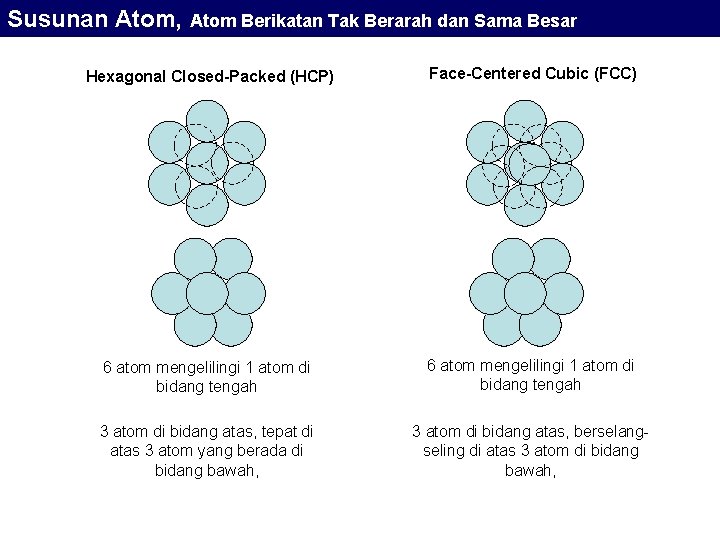
Susunan Atom, Atom Berikatan Tak Berarah dan Sama Besar Susunan Atom-atom yang Berikatan Tak Berarah Atom berukuran sama Atom-atom material padat akan terkumpul secara ringkas / kompak menempati ruang sekecil mungkin. Dengan cara ini jumlah ikatan per satuan volume menjadi maksimum yang berarti energi ikatan per satuan volume menjadi minimum. Sebagai pendekatan pertama kita memandang atom sebagai kelereng keras. Secara geometris, ada 12 kelereng yang dapat berposisi mengelilingi 1 kelereng (terletak di pusat) dan mereka saling menyentuh satu sama lain. Ada 2 macam susunan kompak yang teramati pada banyak struktur metal dan elemen mulia, yaitu hexagonal close-packed (HCP) dan face-centered cubic (FCC).

Susunan Atom, Atom Berikatan Tak Berarah dan Sama Besar Hexagonal Closed-Packed (HCP) Face-Centered Cubic (FCC) 6 atom mengelilingi 1 atom di bidang tengah 3 atom di bidang atas, tepat di atas 3 atom yang berada di bidang bawah, 3 atom di bidang atas, berselangseling di atas 3 atom di bidang bawah,

Susunan Atom, Atom Berikatan Tak Berarah dan Sama Besar Semua elemen mulia membentuk struktur kompak jika membeku pada temperatur sangat rendah, Sekitar 2/3 dari jenis metal membentuk struktur HCP atau FCC pada temperatur kamar. 1/3 dari jenis metal yang tidak membentuk struktur kompak pada temperatur kamar adalah metal alkali (Na, K, dll) dan metal transisi (Fe, Cr, W, dsb). Mereka cenderung membentuk struktur body-centered cubic (BCC). Walaupun kurang kompak, susunan ini memiliki energi total relatif rendah. Kebanyakan metal alkali berubah dari BCC ke FCC atau HCP pada temperatur yang sangat rendah. Hal ini menunjukkan bahwa susunan kurang kompak yang terjadi pada temperatur kamar adalah akibat dari pengaruh energi thermal Susunan BCC pada metal transisi diduga sebagai akibat dari ikatan metal ini yang sebagian berupa ikatan kovalen (yang merupakan ikatan berarah).

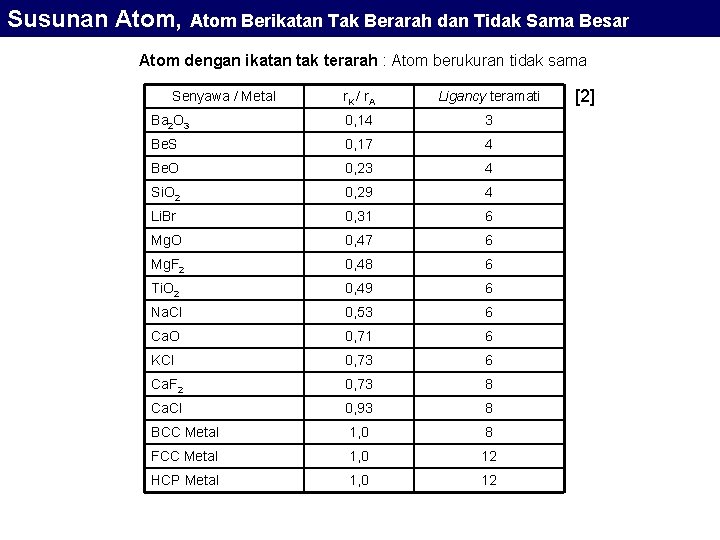
Susunan Atom, Atom Berikatan Tak Berarah dan Tidak Sama Besar Susunan Atom-atom yang Berikatan Tak Berarah Atom berukuran tidak sama Ikatan ion membentuk struktur yang terdiri dari atom-atom yang berbeda ukuran karena anion dan kation pada umumnya sangat berbeda ukuran. Perbedaan ini terjadi karena transfer elektron dari atom yang elektro-positif ke atom yang elektronegatif Membuat ukuran anion > kation. Anion : Kation : ion negatif sebagai hasil dari atom elektronegatif yang memperoleh tambahan elektron. ion positif sebagai hasil dari atom elektropositif yang kehilangan satu atau lebih elektron. Ikatan ini tak berarah dan juga tidak diskrit, namun pada skala besar kenetralan harus tetap terjaga.

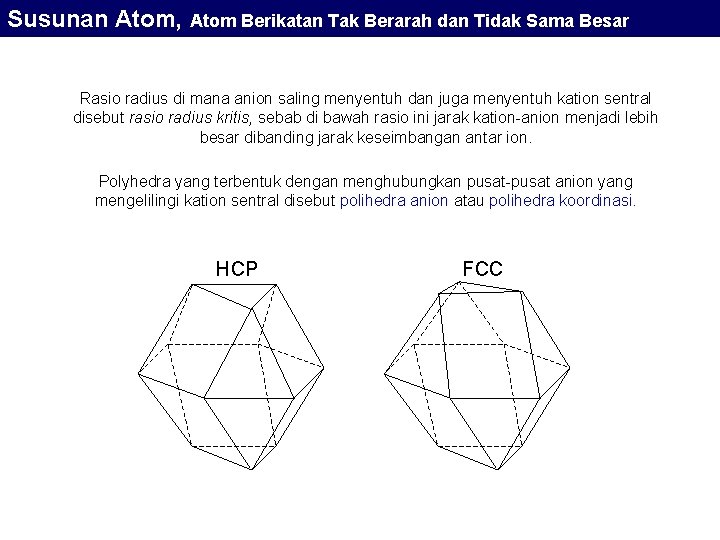
Susunan Atom, Atom Berikatan Tak Berarah dan Tidak Sama Besar Bilangan Koordinasi Bilangan yang menunjukkan perbandingan jumlah ion elemen A yang mengelilingi ion elemen K yang lebih kecil disebut bilangan koordinasi (Ligancy). Bilangan Koordinasi tergantung dari perbedaan radius antara Kation dan Anion makin besar perbedaannya, ligancy akan semakin kecil. Bilangan Koordinasi Rasio Radius Kation / Anion 2 0 – 0, 155 3 Polyhedron Koordinasi Packing garis linier 0, 155 – 0, 225 segitiga triangular 4 0, 225 – 0, 414 tetrahedron Tetrahedral 6 0, 414 – 0, 732 oktahedron Octahedral 8 0, 732 – 1, 0 kubus cubic 12 1, 0 HCP 12 1, 0 FCC [2]

Susunan Atom, Atom Berikatan Tak Berarah dan Tidak Sama Besar Atom dengan ikatan tak terarah : Atom berukuran tidak sama Senyawa / Metal r. K / r A Ligancy teramati Ba 2 O 3 0, 14 3 Be. S 0, 17 4 Be. O 0, 23 4 Si. O 2 0, 29 4 Li. Br 0, 31 6 Mg. O 0, 47 6 Mg. F 2 0, 48 6 Ti. O 2 0, 49 6 Na. Cl 0, 53 6 Ca. O 0, 71 6 KCl 0, 73 6 Ca. F 2 0, 73 8 Ca. Cl 0, 93 8 BCC Metal 1, 0 8 FCC Metal 1, 0 12 HCP Metal 1, 0 12 [2]

Susunan Atom, Atom Berikatan Tak Berarah dan Tidak Sama Besar Rasio radius di mana anion saling menyentuh dan juga menyentuh kation sentral disebut rasio radius kritis, sebab di bawah rasio ini jarak kation-anion menjadi lebih besar dibanding jarak keseimbangan antar ion. Polyhedra yang terbentuk dengan menghubungkan pusat-pusat anion yang mengelilingi kation sentral disebut polihedra anion atau polihedra koordinasi. HCP FCC

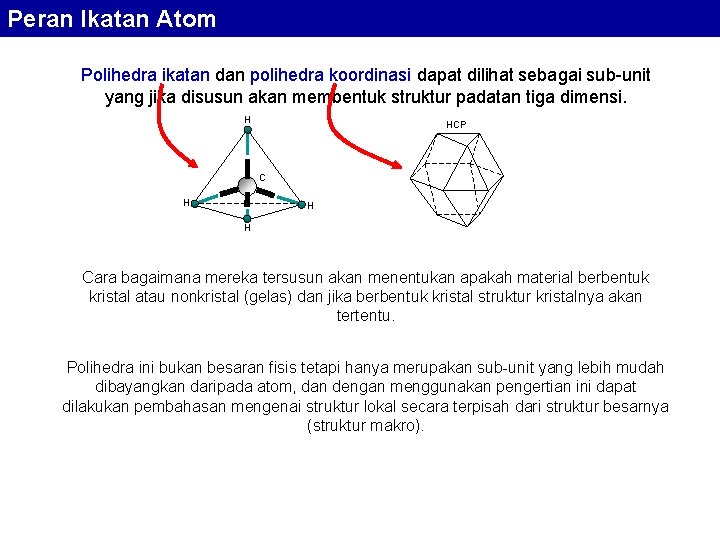
Peran Ikatan Atom Polihedra ikatan dan polihedra koordinasi dapat dilihat sebagai sub-unit yang jika disusun akan membentuk struktur padatan tiga dimensi. H HCP C H H H Cara bagaimana mereka tersusun akan menentukan apakah material berbentuk kristal atau nonkristal (gelas) dan jika berbentuk kristal struktur kristalnya akan tertentu. Polihedra ini bukan besaran fisis tetapi hanya merupakan sub-unit yang lebih mudah dibayangkan daripada atom, dan dengan menggunakan pengertian ini dapat dilakukan pembahasan mengenai struktur lokal secara terpisah dari struktur besarnya (struktur makro).

Peran Ikatan Atom Polihedra koordinasi berperilaku sebagai suatu unit yang erat terikat jika valensi atom sentral lebih dari setengah dari total valensi atom yang terikat dengannya. Jika valensi atom sentral sama dengan valensi total atom yang mengelilinginya maka sub-unit itu adalah molekul. Titik leleh suatu material bergantung dari kekuatan ikatan atom. Ia makin rendah jika polihedra sub-unit terbangun dari kelompok atom yang diskrit, yang terikat satu sama lain dengqan ikatan sekunder dibandingkan dengan bila ikatannya primer. Contoh: methane, CH 4, titik leleh 184 o. C; ethane, C 2 H 6, titik leleh 172 o. C; polyethylene, titik leleh 125 o. C; polyethylene saling terikat dengan ikatan C-C dapat stabil sampai 300 o. C.

Courseware Mengenal Sifat Material (1) Sudaryatno Sudirham
 Barang siapa mengenal dirinya maka dia mengenal tuhannya
Barang siapa mengenal dirinya maka dia mengenal tuhannya Peta konsep sifat allah
Peta konsep sifat allah Sifat - sifat -sifat pemerintah reformasi di indonesia
Sifat - sifat -sifat pemerintah reformasi di indonesia Open innovation open science open to the world
Open innovation open science open to the world Panjang dari penjumlahan vektor a 6 4 5
Panjang dari penjumlahan vektor a 6 4 5 Sifat sifat unsur dan senyawa periode 3
Sifat sifat unsur dan senyawa periode 3 Ekspektasi satu peubah acak
Ekspektasi satu peubah acak Koloid liofil
Koloid liofil Sifat fisik warna
Sifat fisik warna Sifat sifat kemasan
Sifat sifat kemasan Sifat dasar regresi
Sifat dasar regresi Sudut segitiga
Sudut segitiga Jika 27 log 5 = p maka 25 log 3 + 243 log akar 5
Jika 27 log 5 = p maka 25 log 3 + 243 log akar 5 Nilai harapan peluang
Nilai harapan peluang Contoh asam konjugasi
Contoh asam konjugasi Kemasan inert
Kemasan inert Hasil kali titik vektor
Hasil kali titik vektor Hasil skalar
Hasil skalar Sifat dasar analisis regresi
Sifat dasar analisis regresi Sifat-sifat determinan matriks
Sifat-sifat determinan matriks Peta konsep iman kepada rasul
Peta konsep iman kepada rasul Peta konsep nabi daud
Peta konsep nabi daud Sifat sifat senyawa hidrokarbon
Sifat sifat senyawa hidrokarbon Sifat rangkaian listrik paralel
Sifat rangkaian listrik paralel Sifat sifat komposisi fungsi
Sifat sifat komposisi fungsi Gelombang cahaya transversal
Gelombang cahaya transversal Sifat-sifat transformasi laplace
Sifat-sifat transformasi laplace Sifat dosa
Sifat dosa Tabel mutu beton
Tabel mutu beton Sifat yang dimiliki
Sifat yang dimiliki Sifat dinamis motivasi
Sifat dinamis motivasi Sifat pariwisata
Sifat pariwisata Pengertian determinan adalah
Pengertian determinan adalah Masyarakat arab hadhari
Masyarakat arab hadhari Setara kas adalah
Setara kas adalah Sifat sifat kas kecil
Sifat sifat kas kecil Ancase saka pawarta yaiku....
Ancase saka pawarta yaiku.... Kelompok sekunder dan primer
Kelompok sekunder dan primer Unsur-unsur bangun ruang kubus balok dan prisma segitiga
Unsur-unsur bangun ruang kubus balok dan prisma segitiga Sifat sifat baja
Sifat sifat baja Contoh matriks antisimetris
Contoh matriks antisimetris Koloid liofilik dan liofobik
Koloid liofilik dan liofobik Sifat-sifat kubus
Sifat-sifat kubus Peta konsep
Peta konsep Bahan penyusun jaket
Bahan penyusun jaket Sifat sudut
Sifat sudut Sifat salbiyah allah adalah...
Sifat salbiyah allah adalah... Kekal lawannya
Kekal lawannya Sifat-sifat baja
Sifat-sifat baja Sifat-sifat bahan serat alam mineral
Sifat-sifat bahan serat alam mineral Definisi persegi panjang
Definisi persegi panjang Cephalocaudal dan proximodistal
Cephalocaudal dan proximodistal Sifat sifat median
Sifat sifat median Sifat sifat struktur data tree
Sifat sifat struktur data tree Sifat karya ilmiah
Sifat karya ilmiah Sifat sifat persegi
Sifat sifat persegi Sifat-sifat tuhan
Sifat-sifat tuhan Psak konsolidasi
Psak konsolidasi Jenis sudut
Jenis sudut Diketahui beberapa sifat-sifat zat
Diketahui beberapa sifat-sifat zat Disagregasi dalam teori mikroekonomi
Disagregasi dalam teori mikroekonomi Sifat koligatif larutan adalah sifat yang bergantung pada
Sifat koligatif larutan adalah sifat yang bergantung pada Pemeriksaan kas dan setara kas
Pemeriksaan kas dan setara kas Rpp persamaan garis lurus
Rpp persamaan garis lurus Sifat sifat garis singgung lingkaran
Sifat sifat garis singgung lingkaran Pembawa sifat keturunan suatu makhluk hidup
Pembawa sifat keturunan suatu makhluk hidup Komposisi atmosfer
Komposisi atmosfer Rumus teori braak
Rumus teori braak Apa itu avl
Apa itu avl Slidetodoc
Slidetodoc Diagram class adalah
Diagram class adalah Uji mekanik adalah
Uji mekanik adalah Sifat thermal material
Sifat thermal material Sifat thermal material
Sifat thermal material T junction flemish bond
T junction flemish bond Course title and course number
Course title and course number Course interne course externe
Course interne course externe Gd and t symbols
Gd and t symbols Time variance
Time variance Example of pop culture
Example of pop culture Refers to the knowledge language values customs
Refers to the knowledge language values customs All groups create norms to enforce their cultural values.
All groups create norms to enforce their cultural values.