Oldds mint egyensly Szilrd A anyag olddsa K
![Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K= [A]oldott K∙[A]szilárd= [A]oldott [A]szilárd állandó S Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K= [A]oldott K∙[A]szilárd= [A]oldott [A]szilárd állandó S](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-1.jpg)
![Ionos vegyületek oldódása Szilárd (AB) anyag oldódása: AB → A+ + B– K∙[AB]szilárd = Ionos vegyületek oldódása Szilárd (AB) anyag oldódása: AB → A+ + B– K∙[AB]szilárd =](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-2.jpg)









![p. H - p. OH p. H= –log[H 3 O+] p. OH= –log[OH-] ha p. H - p. OH p. H= –log[H 3 O+] p. OH= –log[OH-] ha](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-14.jpg)
![A p. H skála p. H = -log[H 3 O+] = 10 Bázisos: p. A p. H skála p. H = -log[H 3 O+] = 10 Bázisos: p.](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-16.jpg)


![NH 3 + H 2 O ⇌ NH 4+ + OH– [NH 4+][OH–] 1. NH 3 + H 2 O ⇌ NH 4+ + OH– [NH 4+][OH–] 1.](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-21.jpg)

![[H+]= Ks p. H= p. Ks – 1 [HA]=10∙[A–] [HA] [A–] p. Ks [HA]=[A–] [H+]= Ks p. H= p. Ks – 1 [HA]=10∙[A–] [HA] [A–] p. Ks [HA]=[A–]](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-24.jpg)











- Slides: 43
![Oldódás mint egyensúly Szilárd A anyag oldódása K Aoldott KAszilárd Aoldott Aszilárd állandó S Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K= [A]oldott K∙[A]szilárd= [A]oldott [A]szilárd állandó S](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-1.jpg)
Oldódás, mint egyensúly Szilárd (A) anyag oldódása: K= [A]oldott K∙[A]szilárd= [A]oldott [A]szilárd állandó S = telített oldat conc. Folyadék oldódása: analóg módon ↑ Gázok oldódása: Kc = [gáz]oldott [gáz]gázfázis = [gáz]oldott= Kc ∙p gáz RT pgáz / RT Henry törvény: S = k. H·pgáz
![Ionos vegyületek oldódása Szilárd AB anyag oldódása AB A B KABszilárd Ionos vegyületek oldódása Szilárd (AB) anyag oldódása: AB → A+ + B– K∙[AB]szilárd =](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-2.jpg)
Ionos vegyületek oldódása Szilárd (AB) anyag oldódása: AB → A+ + B– K∙[AB]szilárd = [A+]oldott[B–]oldott L = oldhatósági szorzat

Oldhatóság és az oldhatósági szorzat Szilárd (AB) anyag oldódása: AB → A+ + B– LAB = [A+]oldott[B–]oldott oldhatósági szorzat S = [A+] = [B–] = √ LAB Mennyi a Ba. SO 4 oldhatósági szorzata 25 ºC-on, ha ezen a hőmérsékleten 50 cm 3 vízben 0, 12 mg anyag oldódik (ekkor az oldat telített) ? Ba. SO 4: 137+32+4(16)= 233 g/mol 233 g Ba. SO 4 0, 00012 g Ba. SO 4 1 mol x x= 0, 00012 ∙ 1 / 233 = 5, 15∙ 10 -7 mol c= 5, 15∙ 10 -7 mol 50∙ 10 -3 dm 3 = 1, 03∙ 10 -5 M [Ba 2+]=[SO 42 -] LBa. SO 4= [Ba 2+][SO 42 -] = (1, 03∙ 10 -5)2 = 1, 06∙ 10 -10

Ionos vegyületek oldódása Szilárd (An. Bm) anyag oldódása: Közös ion effektus An. Bm → n. Am+ + m. Bn– L = [Am+]n[Bn–]m Mennyi a Ba. SO 4 oldhatósága a. ) tiszta vízben ? b. ) 0, 1 M Na 2 SO 4 oldatban ? c. ) 0, 001 M Ba. Cl 2 oldatban ? oldhatóságot csökkenti


Savak és bázisok Svante Arrhenius Savak: hidrogén iont (H+) ad le vízben pl. sósav, HCl salétromsav, HNO 3 kénsav, H 2 SO 4 foszforsav, H 3 PO 4 ecetsav, HC 2 H 3 O 2 (CH 3 COOH) Bázisok: hidroxid iont (OH–) ad le vízben pl. nátrium-hidroxid, Na. OH kálium-hidroxid, KOH ? ? ? ? NH 3, R-NH 2, B(OH)3 [H 3 BO 3], BF 3 ? ? ? ?

Savak és bázisok 1923, Johannes Brønsted, Thomas Lowry Savak: protonleadás (H+) HCl + H 2 O → H 3 O+ + Cl– OH– + H 3 O+ → 2 H 2 O Bázisok: protonfelvétel NH 3 + H 2 O → NH 4+ + OH– bázis sav bázis ? ? ? ? B(OH)3 [H 3 BO 3], BF 3 ? ? ? ?

Savak és bázisok Gilbert Lewis sav: elektronpár akceptor H+ + H 2 O → H 3 O+ B(OH)3 + H 2 O ⇌ B(OH)4– + H+ Lewis bázis: elektronpár donor BF 3 + NH 3 → F 3 B-NH 3 sav bázis komplex

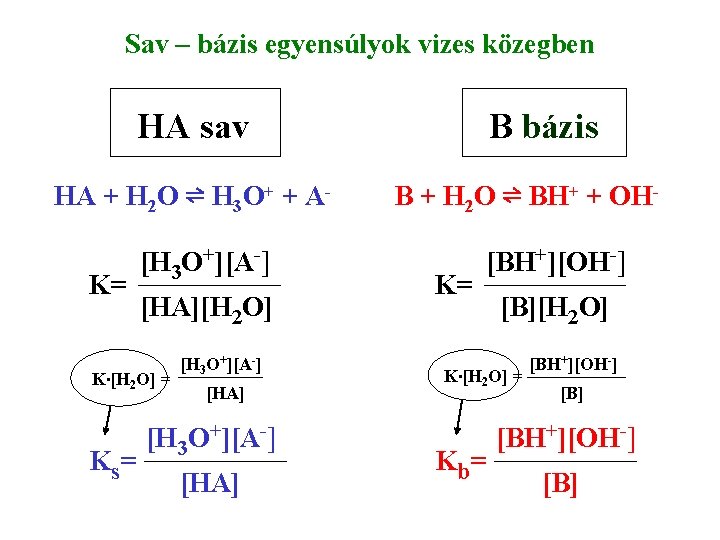
Sav – bázis egyensúlyok vizes közegben HA sav HA + H 2 O ⇌ H 3 O+ + AK= [H 3 O+][A-] [HA][H 2 O] K∙[H 2 O] = K s= [H 3 O+][A-] [HA] B bázis B + H 2 O ⇌ BH+ + OHK= [BH+][OH-] [B][H 2 O] K∙[H 2 O] = K b= [BH+][OH-] [B]

Erős és gyenge savak Ks < 10 -3 1 > Ks > 10 -3 Ks > 1 Perklórsav Sósav Salétromsav Kénsav Foszforsav Citromsav Ecetsav Szénsav gyenge sav középerős sav HCl. O 4 HCl HNO 3 H 2 SO 4 H 3 PO 4 H 3 C 6 H 5 O 7 HC 2 H 3 O 2 H 2 CO 3 Ks= nagy Ks 1= 7, 1∙ 10 -3 Ks 1= 7, 1∙ 10 -4 Ks= 1, 8∙ 10 -5 Ks 1= 4, 5∙ 10 -7

Savak, bázisok és sók Erős savak bázisok HA + H 2 O → H 3 O+ + A- Gyenge savak HA + H 2 O ⇌ H 3 O+ + AKs B + H 2 O → BH+ + OH- bázisok B + H 2 O ⇌ BH+ + OHKb sav + bázis → só

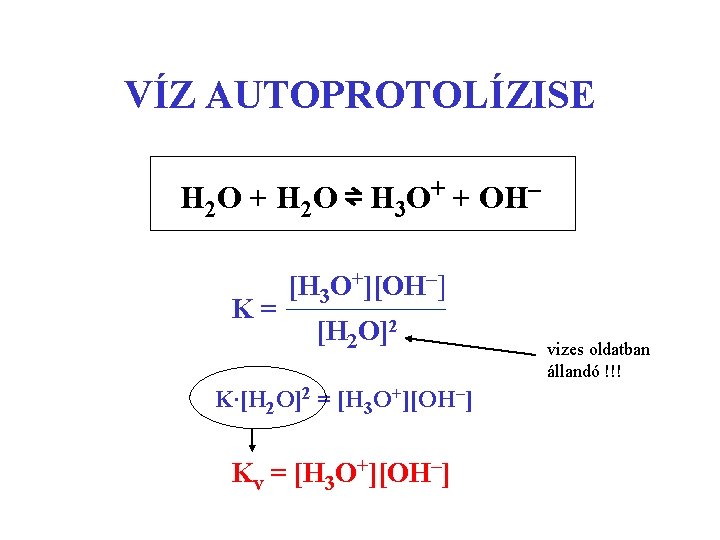
VÍZ AUTOPROTOLÍZISE H 2 O + H 2 O ⇌ H 3 O+ + OH– K= [H 3 O+][OH–] [H 2 O]2 K∙[H 2 O]2 = [H 3 O+][OH–] Kv = [H 3 O+][OH–] vizes oldatban állandó !!!

VÍZ AUTOPROTOLÍZISE pl. Coca Cola Ásványvíz Bor p. H≈2, 5 p. H≈5, 0 p. H≈3, 5 Dove kézmosó szappan Palmolive p. H≈7, 0 p. H≈10, 0
![p H p OH p H logH 3 O p OH logOH ha p. H - p. OH p. H= –log[H 3 O+] p. OH= –log[OH-] ha](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-14.jpg)
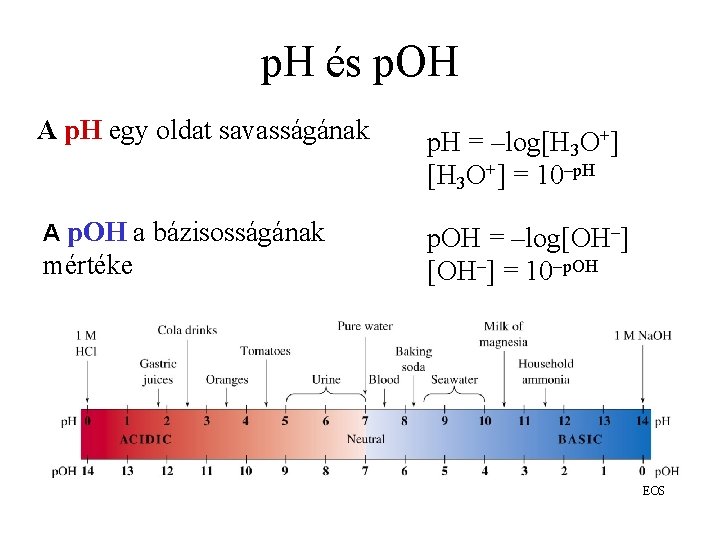
p. H - p. OH p. H= –log[H 3 O+] p. OH= –log[OH-] ha lusták vagyunk kiírni p. H= –log[H+] 25 ºC-on: p. H + p. OH = 14

p. H és p. OH A p. H egy oldat savasságának p. H = –log[H 3 O+] = 10–p. H A p. OH a bázisosságának p. OH = –log[OH–] = 10–p. OH mértéke EOS
![A p H skála p H logH 3 O 10 Bázisos p A p. H skála p. H = -log[H 3 O+] = 10 Bázisos: p.](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-16.jpg)
A p. H skála p. H = -log[H 3 O+] = 10 Bázisos: p. H > 7 Semleges: p. H = 7 Savas: p. H < 7 25 °C-on –p. H

p. H számítások 1. 2. 3. 4. Egyensúlyi állandó(k) Víz ionszorzata Anyagmérleg(ek) Töltésmérleg

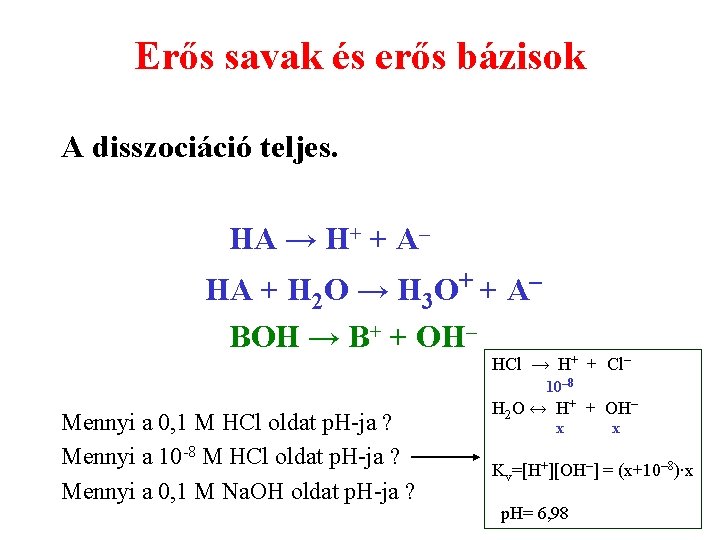
Erős savak és erős bázisok A disszociáció teljes. HA → H+ + A– HA + H 2 O → H 3 O+ + A– BOH → B+ + OH– HCl → H+ + Cl– 10– 8 Mennyi a 0, 1 M HCl oldat p. H-ja ? Mennyi a 10 -8 M HCl oldat p. H-ja ? Mennyi a 0, 1 M Na. OH oldat p. H-ja ? H 2 O ↔ H+ + OH– x x Kv=[H+][OH–] = (x+10– 8)∙x p. H= 6, 98

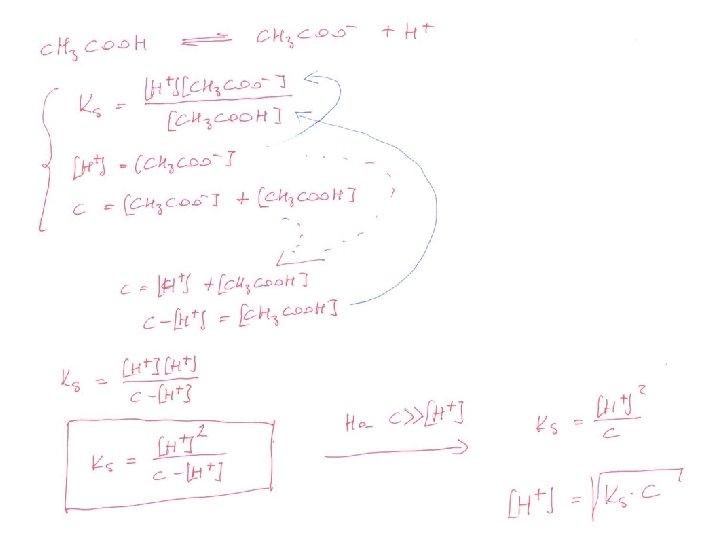
Gyenge savak és gyenge bázisok A disszociáció nem teljes. HA ⇄ H+ + A– Ks B + H 2 O ⇄ BH+ + OH– Kb Mennyi a 0, 1 M ecetsav oldat p. H-ja ? Mennyi a 0, 1 M ammónia oldat p. H-ja ?

![NH 3 H 2 O NH 4 OH NH 4OH 1 NH 3 + H 2 O ⇌ NH 4+ + OH– [NH 4+][OH–] 1.](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-21.jpg)
NH 3 + H 2 O ⇌ NH 4+ + OH– [NH 4+][OH–] 1. Kb= víz dissz. szárm. ionokat elhanyagoltuk !!!! p. H > 8 [NH 3] 2. [NH 4+] = [OH–] 3. c= [NH 4+] + [NH 3] 2→ 3. 2→ 1. c – [OH–] = [NH 3] K b= [OH–]2 [NH 3] [OH–]2 c – [OH–] –] [OH > > c a h !! K b= [OH–]2 c [OH–] = √ Kb∙c

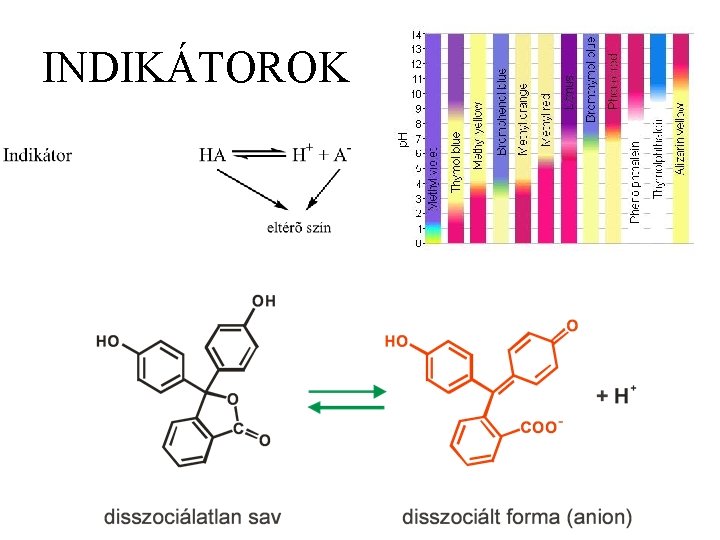
INDIKÁTOROK

![H Ks p H p Ks 1 HA10A HA A p Ks HAA [H+]= Ks p. H= p. Ks – 1 [HA]=10∙[A–] [HA] [A–] p. Ks [HA]=[A–]](https://slidetodoc.com/presentation_image/57c713d0f0db241b6b4d7c8f0b7f94bb/image-24.jpg)
[H+]= Ks p. H= p. Ks – 1 [HA]=10∙[A–] [HA] [A–] p. Ks [HA]=[A–] p. Ks + 1 10∙[HA]=[A–]

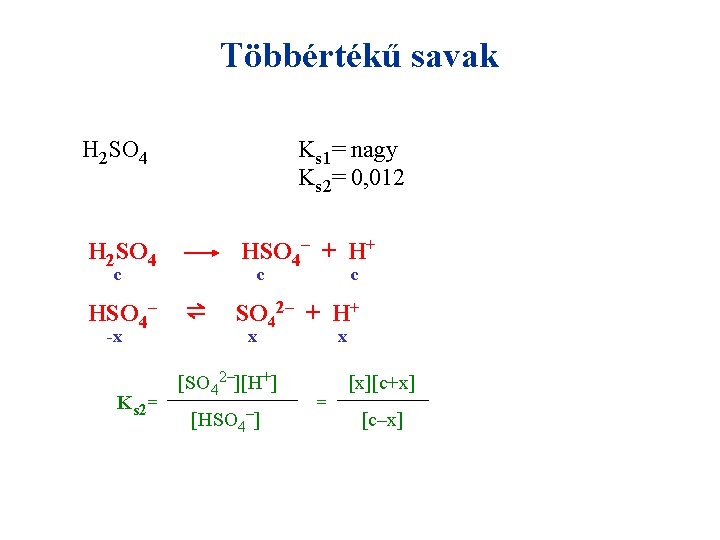
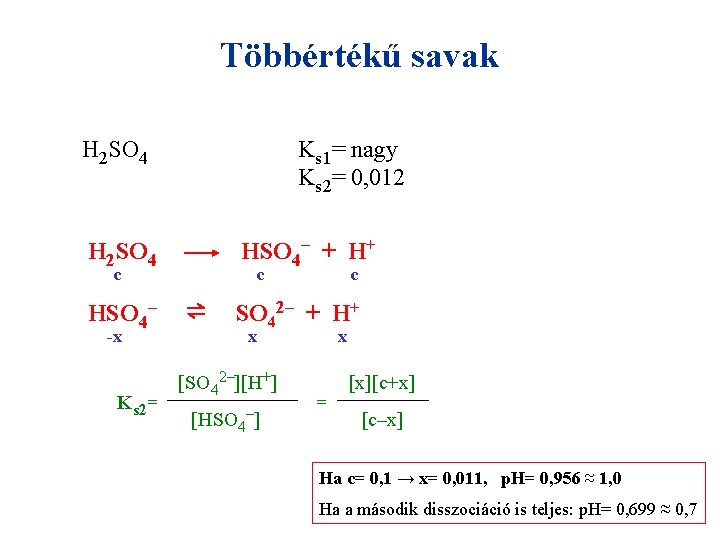
Többértékű savak H 2 SO 4 Ks 1= nagy Ks 2= 0, 012 HSO 4– + H+ H 2 SO 4 c HSO 4– -x Ks 2= c ⇌ c SO 42– + H+ x [SO 42–][H+] [HSO 4–] x = [x][c+x] [c–x]

Többértékű savak H 2 SO 4 Ks 1= nagy Ks 2= 0, 012 HSO 4– + H+ H 2 SO 4 c HSO 4– -x Ks 2= c ⇌ c SO 42– + H+ x [SO 42–][H+] [HSO 4–] x = [x][c+x] [c–x] Ha c= 0, 1 → x= 0, 011, p. H= 0, 956 ≈ 1, 0 Ha a második disszociáció is teljes: p. H= 0, 699 ≈ 0, 7

Többértékű savak H 3 PO 4 ⇌ H 2 PO 4– ⇌ c x -y HPO 42– -z H 2 PO 4– + H+ x HPO 42– + H+ y ⇌ Ks 2= 6, 2∙ 10 -8 y PO 43– + H+ z Ks 1= 7, 5∙ 10 -3 z Ks 3= 2, 2∙ 10 -13

Többértékű savak H 3 PO 4 ⇌ H 2 PO 4– ⇌ c H 2 PO 4– + H+ x HPO 42– + H+ -y HPO 42– y ⇌ Ks 2= Ks 3= [H 2 PO 4–][H+] [H 3 PO 4] [HPO 42–][H+] [H 2 PO 42–] [PO 43–][H+] [HPO 42–] Ks 2= 6, 2∙ 10 -8 y PO 43– + H+ -z Ks 1= x z = = = Ks 1= 7, 5∙ 10 -3 Ks 3= 2, 2∙ 10 -13 z [x–y][x+y+z] [c–x] [y–z][x+y+z] [x–y] [z][x+y+z] [y–z] ≈ ≈ ≈ [x][x] → x= 2, 4· 10– 2 [c–x] Tegyük fel: [y][x] [z][x] [y] >>6, 2· 10 y >> z– 8 → xy= → z= 5, 7· 10– 19

Hidrolízis, sók p. H-ja erős sav és erős bázis sója: pl. Na. Cl gyenge sav és erős bázis sója: pl. CH 3 COONa erős sav és gyenge bázis sója: pl. NH 4 Cl gyenge sav és gyenge bázis sója: pl. CH 3 COONH 4

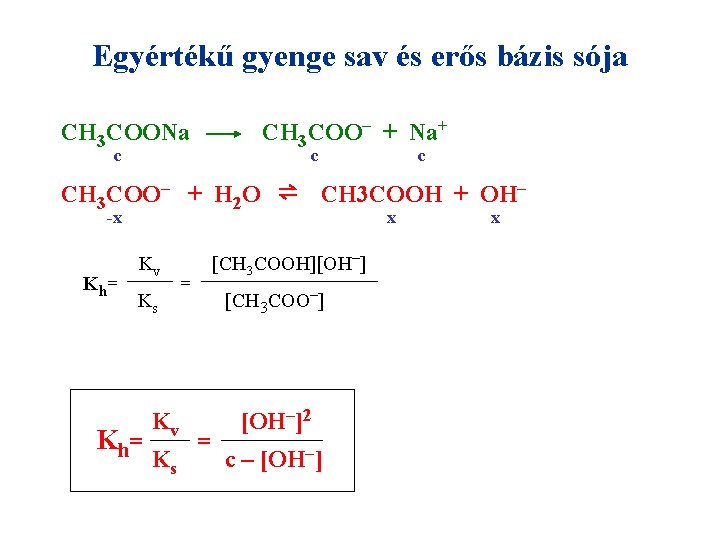
Egyértékű gyenge sav és erős bázis sója CH 3 COO– + Na+ CH 3 COONa c c CH 3 COO– + H 2 O ⇌ -x K h= Kv Ks c CH 3 COOH + OH– [CH 3 COOH][OH–] = [CH 3 COO–] = [OH–]2 c – [OH–] x x

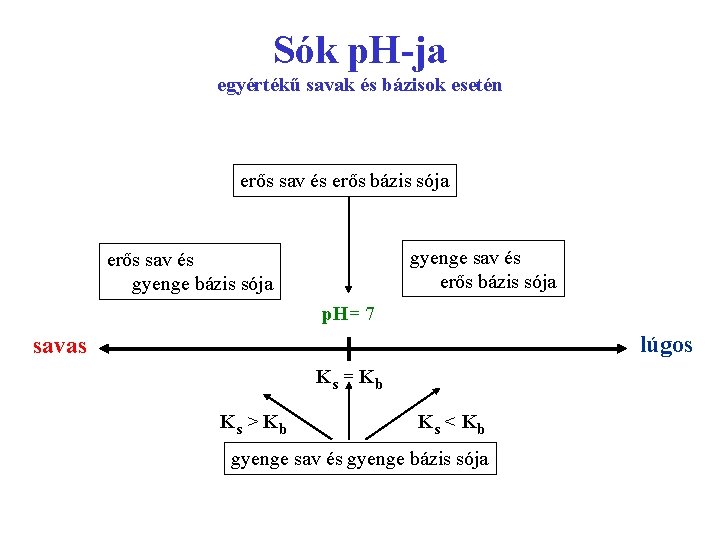
Sók p. H-ja egyértékű savak és bázisok esetén erős sav és erős bázis sója gyenge sav és erős bázis sója erős sav és gyenge bázis sója p. H= 7 lúgos savas Ks = Kb Ks > Kb Ks < Kb gyenge sav és gyenge bázis sója

Többértékű gyenge sav és erős bázis sója Na 3 PO 4 c PO 43– + 3 Na+ c PO 43– + H 2 O ⇌ HPO 42– + OH– -x x HPO 42– -y x – + H 2 O ⇌ H 2 PO 4 + y – H 2 PO 4 + H 2 O ⇌ H 3 PO 4 + -z z OH– y OH– z Kv Kh 1= K = 4, 55∙ 10 -2 s 3 Kv Kh 2= K = 1, 61∙ 10 -7 s 2 Kv Kh 3= K = 1, 33∙ 10 -12 s 1

Pufferek Olyan oldatok, melyek erős sav, vagy lúg hatását tompítják. Készíthetünk: 1. Gyenge sav + gyenge sav erős lúggal képzett sójából pl. CH 3 COOH + CH 3 COONa 2. Gyenge bázis + gyenge bázis erős savval képzett sójából pl. NH 3 + NH 4 Cl 3. Többértékű gyenge savak savanyú sóiból pl. Na. H 2 PO 4 + Na 2 HPO 4

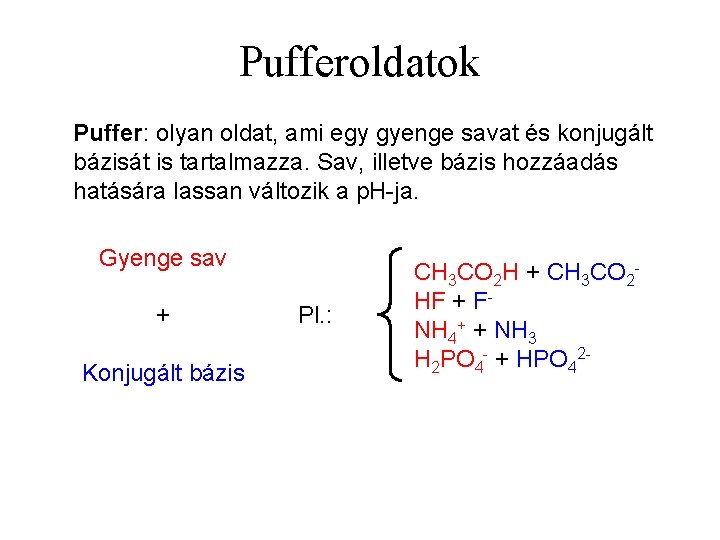
Pufferoldatok Puffer: olyan oldat, ami egy gyenge savat és konjugált bázisát is tartalmazza. Sav, illetve bázis hozzáadás hatására lassan változik a p. H-ja. Gyenge sav + Konjugált bázis Pl. : CH 3 CO 2 H + CH 3 CO 2 HF + FNH 4+ + NH 3 H 2 PO 4 - + HPO 42 -

Puffer Vízhez lúgot, vagy savat adunk Puffer oldathoz

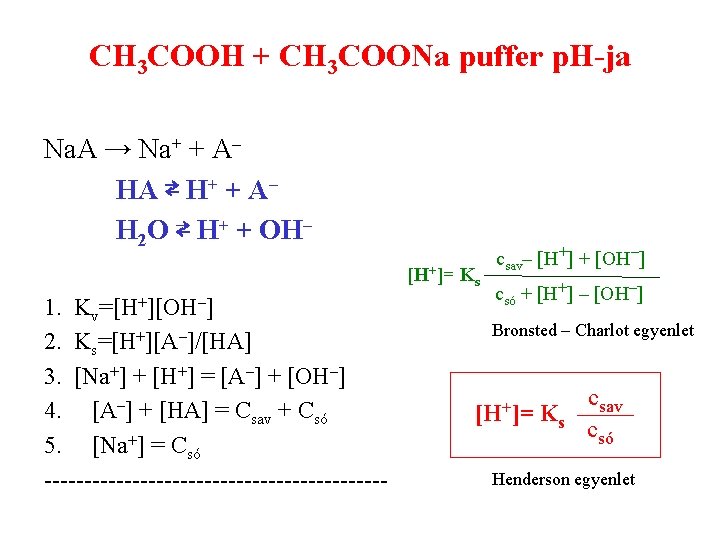
CH 3 COOH + CH 3 COONa puffer p. H-ja Na. A → Na+ + A– HA ⇄ H+ + A– H 2 O ⇄ H+ + OH– [H+]= Ks Kv=[H+][OH–] Ks=[H+][A–]/[HA] [Na+] + [H+] = [A–] 1. 2. 3. + [OH–] 4. [A–] + [HA] = Csav + Csó 5. [Na+] = Csó ---------------------- csav– [H+] + [OH–] csó + [H+] – [OH–] Bronsted – Charlot egyenlet [H+]= Ks csav csó Henderson egyenlet


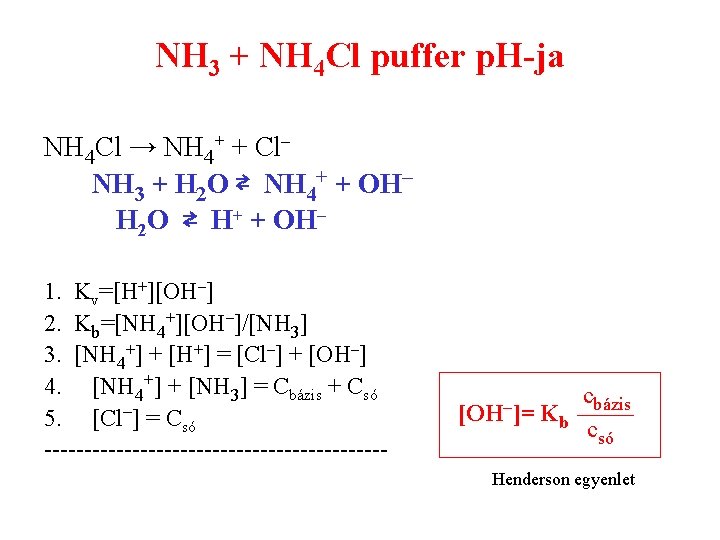
NH 3 + NH 4 Cl puffer p. H-ja NH 4 Cl → NH 4+ + Cl– NH 3 + H 2 O ⇄ NH 4+ + OH– H 2 O ⇄ H+ + OH– 1. Kv=[H+][OH–] 2. Kb=[NH 4+][OH–]/[NH 3] 3. [NH 4+] + [H+] = [Cl–] + [OH–] 4. [NH 4+] + [NH 3] = Cbázis + Csó 5. [Cl–] = Csó ---------------------- [OH–]= cbázis Kb csó Henderson egyenlet

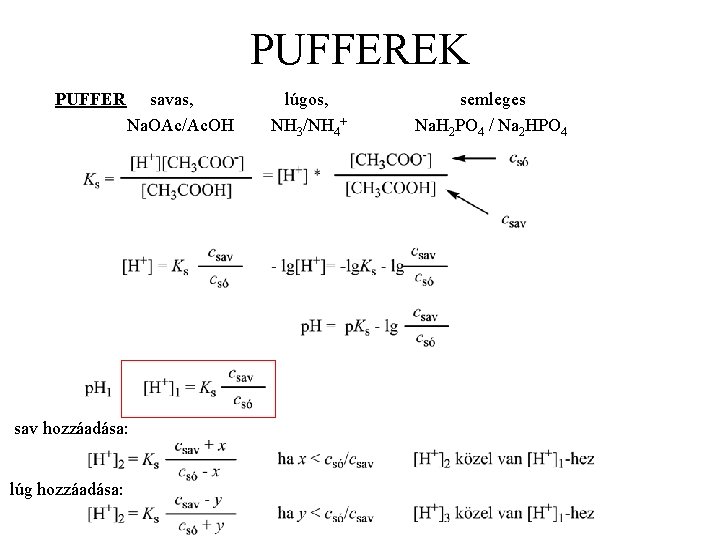
PUFFEREK PUFFER savas, Na. OAc/Ac. OH sav hozzáadása: lúg hozzáadása: lúgos, NH 3/NH 4+ semleges Na. H 2 PO 4 / Na 2 HPO 4

Az eső természetes savassága és a savas eső Természetes savasság: Savas eső: H 2 O + CO 2 H 2 CO 3 H 2 O + H 2 CO 3 HCO 3 + H 3 O+ p. H ≈ 5, mészkő, vízkő képződése: H 2 CO 3 + Ca. CO 3 2 HCO 3 + Ca 2+(aq) SO 2 + H 2 O = HSO 3– + H+ SO 2 + O 3 = SO 3 + O 2 SO 3 + H 2 O = H 2 SO 4 2 NO 2 + 2 H 2 O = HNO 2 + HNO 3


Ismétlő kérdések Milyen a p. H ? Savas, lúgos, vagy semleges ? Na. NO 3 NH 4 NO 3 Al. Cl 3 Na 2 CO 3 K 2 SO 4 NH 4 Br Na. HSO 4 Na 3 PO 4 → Na+ + NO 3– levezethető: Na. OH + HNO 3

Ismétlő kérdések 1. ) Mennyi a p. H-ja egy 0, 1 M KCl. O 4 oldatnak ? 2. ) Mennyi a p. H-ja egy 0, 1 M CH 3 COOH oldatnak ? 3. ) Mennyi a p. H-ja egy 0, 1 M NH 3 oldatban ? 4. ) Mennyi a p. H-ja egy 0, 1 M CH 3 COOK oldatnak ? 5. ) Mennyi a p. H-ja egy 0, 1 M NH 4 Br oldatnak ? 6. ) Mennyi a p. H-ja egy olyan oldatnak, amelyet úgy készítettünk, hogy 1 literében 0, 1 mol HCOOH és 0, 1 mol HCOONa legyen ? 7. ) Mennyi annak az oldatnak a p. H-ja amelyet úgy készítettünk, hogy 0, 5 liter 2 M CH 3 COOH és 0, 5 liter 2 M Na. OH oldatokat összeöntöttünk ? 8. ) Mennyi annak az oldatnak a p. H-ja amelyet úgy készítettünk, hogy 1 liter 2 M NH 3 és 0, 5 liter 2 M HCl oldatokat összeöntöttünk ?