Nzvoslov anorganick chemie VY32 INOVACECHE117 AUTOR Ing Ladislava


























- Slides: 28

Názvosloví anorganické chemie VY-32 -INOVACE-CHE-117 AUTOR: Ing. Ladislava Semerádová ANOTACE: Výukový materiál je určen pro studenty 1. ročníku SŠ. Může být použit při opakování názvosloví anorganické chemie KLÍČOVÁ SLOVA: oxidační čísla, názvosloví kyselin, solí, hydrogensolí, hydrátů, podvojných solí

Názvosloví anorganické chemie

• Základem názvosloví jsou oxidační čísla prvku Oxidační číslo: • bylo zavedeno jako formální pojem • umožňuje nám zařazovat prvky do určitého systému a určit název a vzorec sloučeniny

Pro oxidační čísla platí: • • V molekule prvku je rovno 0 Pbo, H 2 o, P 4 o Oxidační číslo vodíku I (s vyjímkou hydridů H-I) Oxidační číslo kyslíku je –II ( s vyjímkou peroxidů O-I • Součet všech oxidačních čísel v atomu je O • Součet oxidačních čísel v iontech = hodnotě náboje

• • Oxidační čísla se značí římskými číslicemi Nabývají hodnoty: Kladné : I až VIII Záporné : –I až -IV

Kladná oxidační čísla I -ný II -natý III - itý IV - ičitý V -ečný, ičný VI -ový VII -istý VIII - ičelý

Záporná oxidační čísla binárních sloučenin -I -III -IV - mají vždy koncovku id

Určení vzorce binární sloučeniny z jejího názvu • Vzorec : oxid sírový SVI O 3 -II • prvek, který tvoří pod. jméno napíšeme vpravo, • prvek tvořící příd. jméno vlevo • doplníme oxidační čísla pomocí koncovek • určíme indexy pomocí křížového pravidla • pokud lze zkrátit upravíme ne jednodušší tvar

Názvosloví kyselin

Názvosloví bezkyslíkatých kyselin • Tvoříme pomocí základu názvu příslušného prvku a koncovkou –vodíková • HCl – kyselina chlorovodíková • HBr- kyselina bromovodíková • HI – kyselina jodovodíková • HF- kyselina fluorovodíková

Názvosloví oxokyselin • Oxykyselina – obecný vzorec • H X O …. . X …kyselinotvorný prvek • 1. Napíšeme oxidační čísla vodíku (I) a kyslíku (-II) • 2. Rozdělíme pomyslně na kladnou a zápornou část • 3. Dopočítáme oxidační číslo kyselinotvorného prvku, tak, aby výsledný součet všech oxidačních čísel byl nulový • 4. Podle oxidačního čísla určíme koncovku přídavného jména, podstatné jméno je vždy slovo kyselina

Určete názvy příslušných kyselin • • • HCl. O 4 HCl. O 3 HCl. O 2 H 2 SO 3 H 2 Cr. O 4

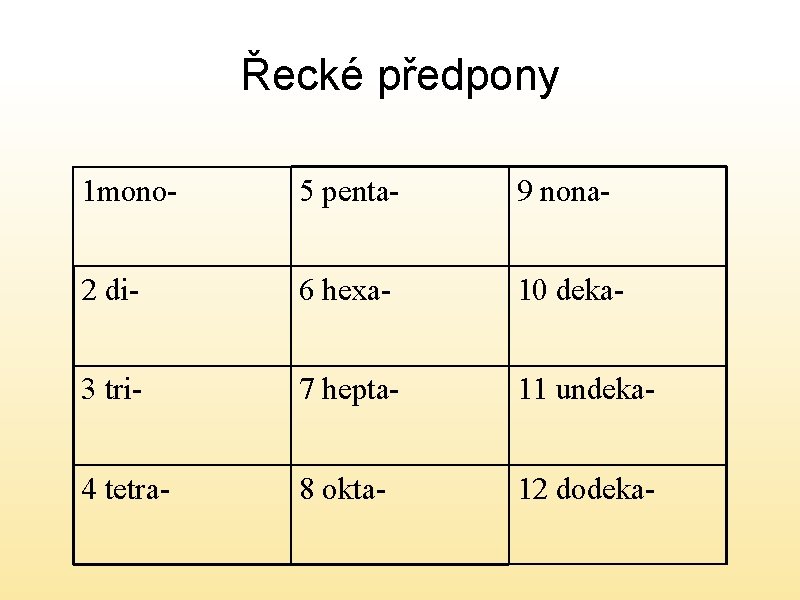
Hydrogenkyseliny • Pokud je přítomno více atomů vodíku než dva používáme řecké předpony a vsuvku – hydrogen • Předpony

Řecké předpony 1 mono- 5 penta- 9 nona- 2 di- 6 hexa- 10 deka- 3 tri- 7 hepta- 11 undeka- 4 tetra- 8 okta- 12 dodeka-

• Větší počet atomů kyslíku nebo kyselinotvorného prvku vyjadřujeme také řeckými předponami • H 2 S 2 O 7 kyselina disírová • H 4 V 2 O 7 kyselina tetrahydrogendivanadičná • H 4 P 2 O 6 kyselina tetrahydrogendifosforečná • H 2 Cr 3 O 10 kyselina trichromová

Určení vzorce kyseliny z jejího názvu 1. Napíšeme prvky v pořadí 2. H X O 3. Doplníme oxidační čísla vodíku a kyslíku automaticky u kyselinotvorného prvku podle koncovky přídavného jména 4. Pokud je koncovka sudá napíšeme k vodíku automaticky 2 5. Dopočítáme počet kyslíkových atomů tak, aby výsledný součet byl nulový

Napište vzorce následujících kyselin • • Kyselina jodistá Kyselina siřičitá Kyselina trihydrogenjodistá Kyselina tetrahydrogendifosforečná

Názvosloví solí Odvození vzorce z názvu 1. Napíšeme vzorec kyseliny od které sůl vznikla 2. Vytvoříme aniont odtržením atomů vodíku- celý aniont oddělíme závorkou – počet odtržených vodíků zapíšeme k závorce 3. Místo vodíku zapíšeme prvek, který tvoří přídavné jméno a uvedeme podle koncovky oxidační číslo 4. Podle křížového pravidla doplníme koeficienty

Napište vzorce následujících solí • Síran bárnatý • Uhličitan zinečnatý • Chlorečnan hlinitý

Odvození názvu ze vzorce 1)pomocí závorky si oddělíme aniont soli a doplníme náboje pomocí křížového pravidla POZOR! Vzorec může být zkrácen: Pomůcka : Oxidační číslo Na, K je vždy I Oxidační číslo Ca, Mg je vždy II 2) zapíšeme oxidační číslo u kyslíku 3) dopočítáme ox. číslo kyselinotvorného prvku tak, aby odpovídalo celkovému náboji

Utvořte názvy příslušných solí • • • Mg(Cl. O 4)2 Fe 2(SO 4)3 Ca SO 4 KCl. O 3 Na. NO 2

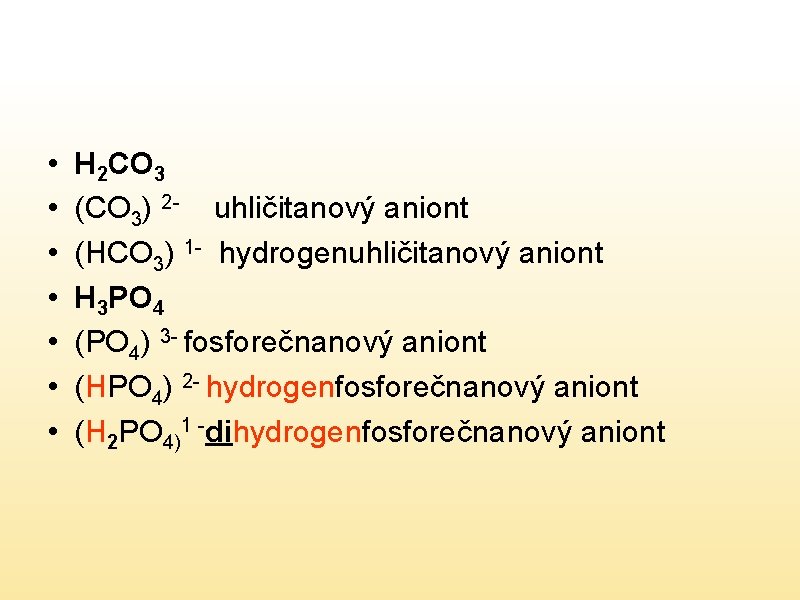
Hydrogensoli 1. Odvozují se od kyselin, které mají ve vzorci 2 a více vodíku 2. Kationtem kovu se nahradí pouze část vodíkových atomů a některé zůstávají součástí aniontu 3. Počet vodíkových atomů v aniontu soli vyjadřujeme předponou hydrogen a číselnou předponou di-, tri-……

• • H 2 CO 3 (CO 3) 2 - uhličitanový aniont (HCO 3) 1 - hydrogenuhličitanový aniont H 3 PO 4 (PO 4) 3 - fosforečnanový aniont (HPO 4) 2 - hydrogenfosforečnanový aniont (H 2 PO 4)1 -dihydrogenfosforečnanový aniont

Hydráty • Soli, které mají ve své struktuře vázány molekuly vody • Zahříváním lze tyto molekuly odstranit – projeví se změnou barvy • Modrá skalice Cu. SO 4. 5 H 2 O ( modrá barva ) zahříváním přechází na Cu. SO 4 ( bílá barva)

Název hydrátu soli • Sůl pojmenujeme klasickým způsobem název začíná slovem řecká předpona+hydrát 2. p. příslušné soli • Cu. SO 4. 5 H 2 O pentahydrát síranu měďnatého • Fe 2(SO 4)3. 7 H 2 O • Ca SO 4. 2 H 2 O

Podvojné a smíšené soli • Kationty v jejich vzorcích se uvádějí podle rostoucích oxidačních čísel • Při stejném oxidačním čísle se v abecedním pořádku značek prvků • V názvech se jednotlivé kationty oddělují pomlčkou

Doplňte názvy příslušných solí • • KNa. CO 3 Ca. Mg(CO 3)2 KAl(SO 4)2 NH 4 Mg. PO 4. 6 H 2 O

POUŽITÉ ZDROJE: DUŠEK, Bohuslav a Vratislav FLEMR. Obecná a anorganická chemie pro gymnázia. SPN, 2007. ISBN 80 -7235 -369 -1. Klouda P. Obecná a anorganická chemie. třetí. Ostrava: Pavel Klouda, Ostrava, 2004. ISBN 8086369 -10 -2. www. glassschool. cz