Nzev koly Z a M Verneice Autor vukovho










- Slides: 11

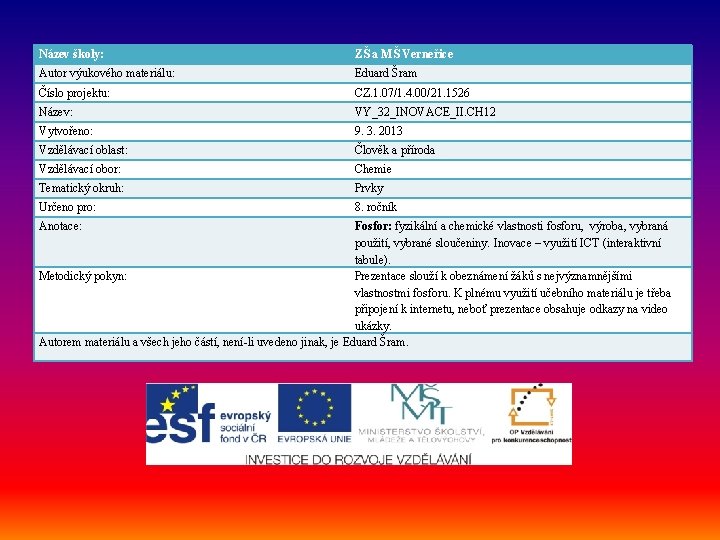
Název školy: ZŠ a MŠ Verneřice Autor výukového materiálu: Eduard Šram Číslo projektu: CZ. 1. 07/1. 4. 00/21. 1526 Název: VY_32_INOVACE_II. CH 12 Vytvořeno: 9. 3. 2013 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Tematický okruh: Prvky Určeno pro: 8. ročník Anotace: Fosfor: fyzikální a chemické vlastnosti fosforu, výroba, vybraná použití, vybrané sloučeniny. Inovace – využití ICT (interaktivní tabule). Metodický pokyn: Prezentace slouží k obeznámení žáků s nejvýznamnějšími vlastnostmi fosforu. K plnému využití učebního materiálu je třeba připojení k internetu, neboť prezentace obsahuje odkazy na video ukázky. Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Eduard Šram.

FOSFOR

FOSFOR • • • latinský název: Phosphorus značka: P protonové číslo: 15 V. A skupina, 3. perioda nekov tt = 44°C (bílý), tv = 280°C (bílý) skupenství (normální p, T): pevné výskyt: pouze ve sloučeninách (např. apatit) více modifikací – bílý (žlutý), červený, černý

BÍLÝ FOSFOR • Velmi reaktivní • Tvořen nestabilními molekulami P 4 (obrázek) • Uchováván pod vodou (na vzduchu možnost samovznícení) • Jedovatý • Rozpustný v sirouhlíku CS 2, ve vodě nerozpustný • Páry fosforeskují • Bílý až světle žlutý, měkký (obrázek)

BÍLÝ FOSFOR - použití • V minulosti výroba zápalek • Farmaceutický průmysl • Výroba zbraní (bílý fosfor působí velmi těžké popáleniny) • Výroba nástrah na hlodavce

ČERVENÝ FOSFOR • Méně reaktivní – s většinou prvků reaguje až při vyšších teplotách • Ve vodě i v sirouhlíku nerozpustný • Polymerní struktura – obrázek • Vzhled – obrázek • Není jedovatý • Použití: Výroba zápalek, surovina pro výrobu sloučenin fosforu

ČERNÝ FOSFOR • • • Nereaktivní, velmi stálý Připomíná kovy, elektricky vodivý Polymerní struktura – obrázek Není jedovatý Použití: Výroba polovodičových součástek (příměsové polovodiče typu N)

FOSFOR - výskyt • Nejvýznamnější minerál: apatit (základní surovina pro výrobu fosforu) • Významný biogenní prvek: součást zubů a kostí, DNA, RNA, tuků

FOSFOR - sloučeniny • H 3 PO 4 – kyselina fosforečná (trihydrogenfosforečná) – odrezovací lázně, zpracování ropy, nápoje • Fosforečnany – významná hnojiva (superfosfát), změkčování vody, potravinářství (např. výroba sýrů) • P 4 O 10 – oxid fosforečný – bílá silně hygroskopická látka, dimer

FOSFOR • http: //www. youtube. com/watch? v=LSYLUat 03 A 4 – obecné vlastnosti, bílý fosfor, 4 min • http: //www. youtube. com/watch? v=Oke 8 Gin. WDG 8 – vlastnosti bílého fosforu, 6, 5 min • http: //www. youtube. com/watch? v=Csv. SUAwq 0 u. M – hoření červeného fosforu, 1 min • http: //www. youtube. com/watch? v=m 4_tw. EXWjgg – hoření fosforu v kyslíku, 2 min • http: //www. youtube. com/watch? v=Qa. UIFZCCHi. E – příprava bílého fosforu z červeného, 1 min • http: //www. youtube. com/watch? v=2 m. U 2 Lc. Wl. Ww. M – „štěkající pes“ – bílý fosfor, 1 min

FOSFOR– jednoduché shrnutí: Symbol fosforu? P Latinský název? Phosphorus Výskyt v přírodě? Ve sloučeninách – např. apatit Skupenství, barva? Pevný, 3 modifikace – bílý, červený, černý Chemické vlastnosti? Bílý nejreaktivnější, červený podstatně méně, černý nereaktivní Rozpustnost? Bílý v sirouhlíku CS 2 Významné sloučeniny? např. H 3 PO 4, P 4 O 10, fosforečnany Použití? Např. výroba zápalek, jed na hlodavce, zbraně, polovodiče atd.





















