Nzev koly Nchod Zkladn kola a Matesk kola






![Zdroje a citace � Obr. 2 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. Zdroje a citace � Obr. 2 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-16.jpg)
![Zdroje a citace � Obr. 6 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. Zdroje a citace � Obr. 6 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-17.jpg)
![Zdroje a citace Obr. 9 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. Zdroje a citace Obr. 9 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-18.jpg)
![Zdroje a citace Obr. 11 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. Zdroje a citace Obr. 11 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-19.jpg)
![Zdroje a citace � Obr. 14 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. Zdroje a citace � Obr. 14 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-20.jpg)
- Slides: 20

Název školy: Náchod Základní škola a Mateřská škola, Police nad Metují, okres Autor: Stejskalová Hana Název : VY_32_INOVACE_11 C_07_Molekuly Téma: Chemie 8. ročník Číslo projektu: CZ. 1. 07/1. 4. 00/21. 1431

MOLEKULY

Anotace Prezentace je určena k výkladu a procvičování učiva Molekuly v 8. ročníku a opakování učiva v 9. ročníku. Žáci vysvětlí vznik chemické vazby mezi atomy, jak se tvoří vazebný elektronový pár, pojem vaznost. Vysvětlí rozdíl mezi atomem, molekulou, sloučeninou. Budou schopni určit, z kolika prvků a z kolika atomů je složena molekula. Pochopí význam chemického vzorce. Určeno pro interaktivní výuku.

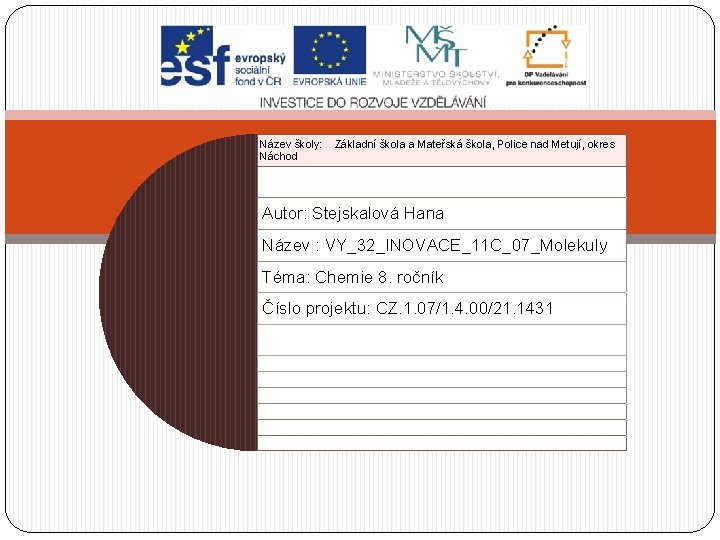
Molekuly � Částice – vzniknou spojením atomů: a) dvou stejných atomů obr. 1 obr. 2 kyslík O 2 molekula prvku kyslíku chlor Cl 2 molekula prvku chloru

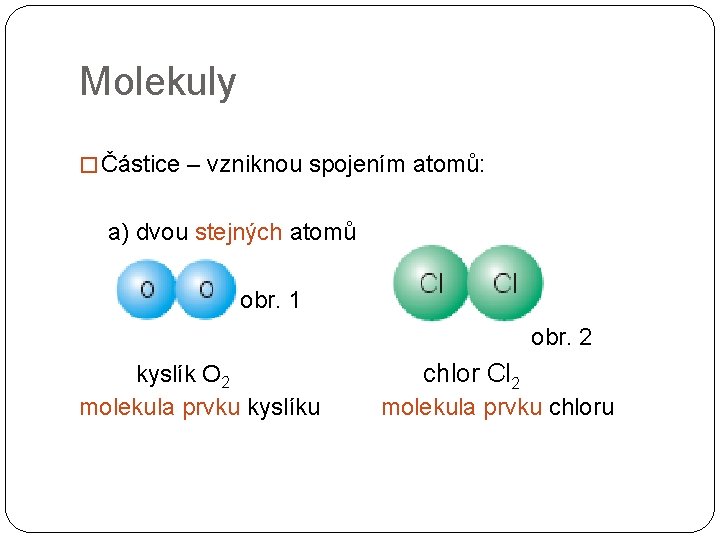
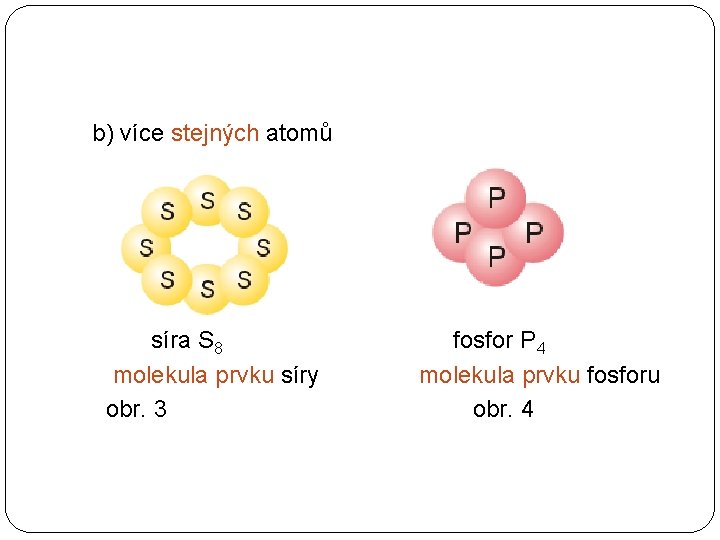
b) více stejných atomů síra S 8 molekula prvku síry obr. 3 fosfor P 4 molekula prvku fosforu obr. 4

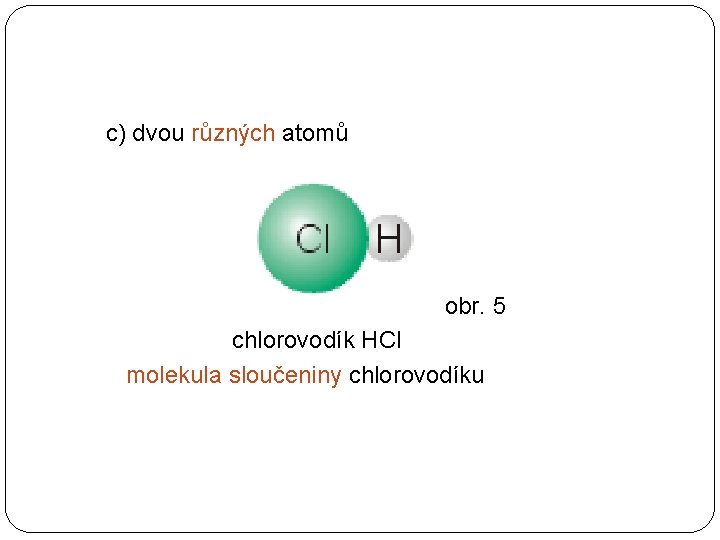
c) dvou různých atomů obr. 5 chlorovodík HCl molekula sloučeniny chlorovodíku

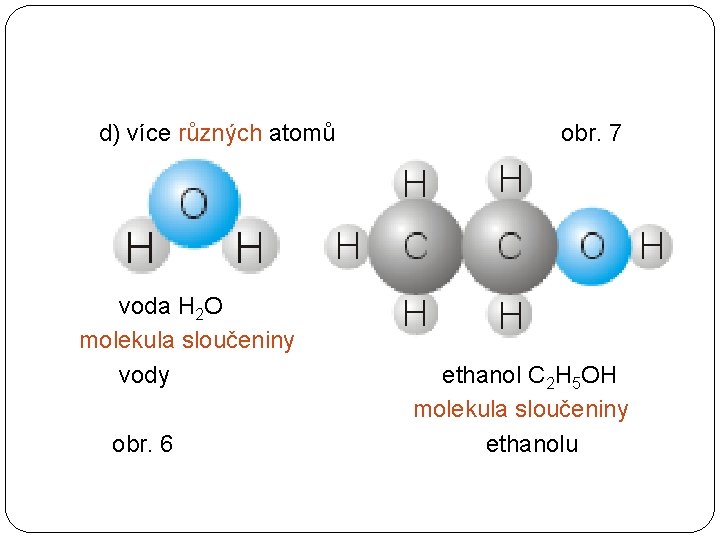
d) více různých atomů voda H 2 O molekula sloučeniny vody obr. 6 obr. 7 ethanol C 2 H 5 OH molekula sloučeniny ethanolu

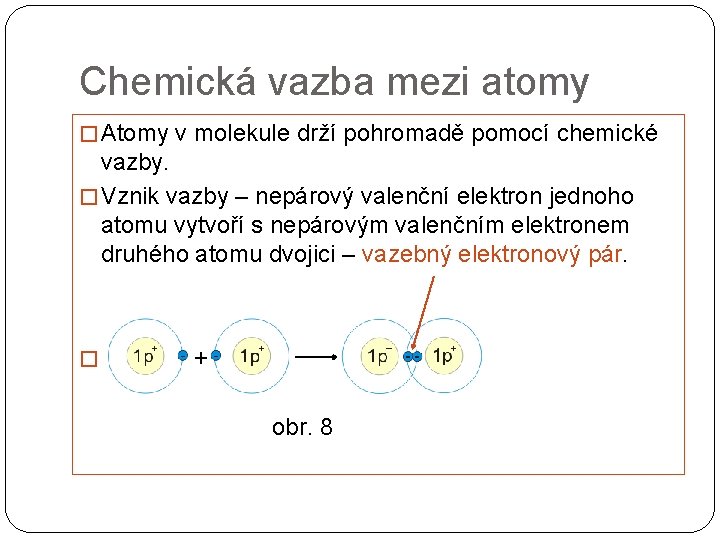
Chemická vazba mezi atomy � Atomy v molekule drží pohromadě pomocí chemické vazby. � Vznik vazby – nepárový valenční elektron jednoho atomu vytvoří s nepárovým valenčním elektronem druhého atomu dvojici – vazebný elektronový pár. � + obr. 8

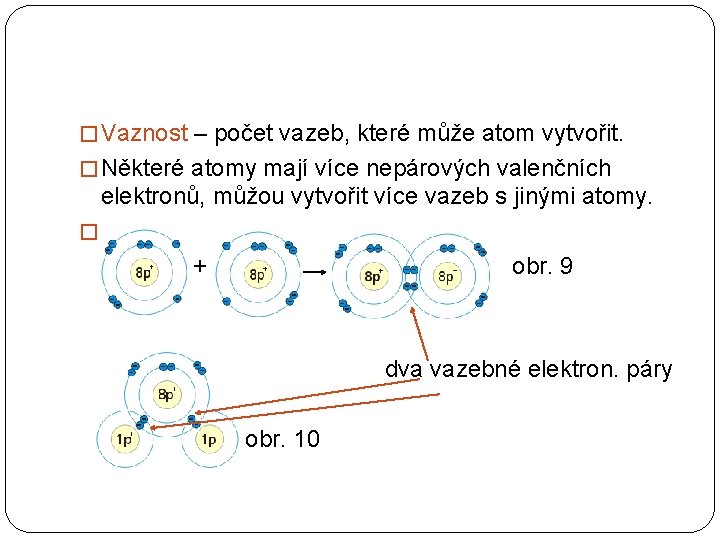
� Vaznost – počet vazeb, které může atom vytvořit. � Některé atomy mají více nepárových valenčních elektronů, můžou vytvořit více vazeb s jinými atomy. � ++ obr. 9 dva vazebné elektron. páry obr. 10

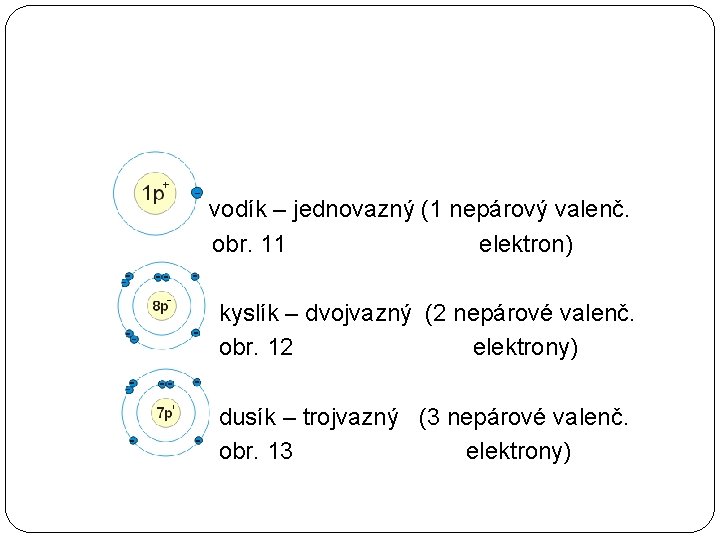
vodík – jednovazný (1 nepárový valenč. obr. 11 elektron) kyslík – dvojvazný (2 nepárové valenč. obr. 12 elektrony) dusík – trojvazný (3 nepárové valenč. obr. 13 elektrony)

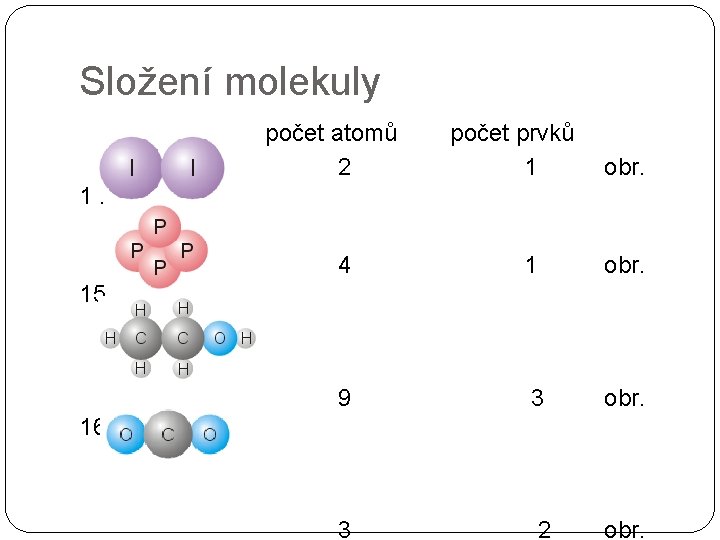
Složení molekuly počet atomů 2 počet prvků 1 obr. 14 4 1 obr. 9 3 obr. 3 2 obr. 15 16

Složení molekuly se zapisuje pomocí chemického vzorce. Vzorec – zápis pomocí značek a čísel, udává druh a počet atomů, ze kterých molekula vznikla: I 2 ze 2 atomů jodu P 4 ze 4 atomů fosforu C 2 H 5 OH ze 2 atomů uhlíku, 6 atomů vodíku a 1 atomu kyslíku CO 2 z 1 atomu uhlíku a 2 atomů kyslíku NH 3 z 1 atomu dusíku a 3 atomů vodíku

� Význam vzorce: CO 2 a) jedna molekula oxidu uhličitého b) sloučenina oxid uhličitý NH 3 a) jedna molekula amoniaku b) sloučenina amoniak H 2 SO 4 a) jedna molekula kyseliny sírové b) sloučenina kyselina sírová

ÚKOLY K OPAKOVÁNÍ � 1. Co je molekula? � Částice složená alespoň ze 2 atomů. � 2. Jak vzniká chemická vazba mezi atomy? � Pomocí nepárových valenčních elektronů, vznikají vazebné el. páry. � 3. Uveď, z kolika prvků a z kolika atomů je složena molekula HNO 3. � Ze 3 prvků a 5 atomů. � 4. Co je vaznost? Kolikavazný je vodík, kyslík? � Udává, kolik vazeb je atom schopen vytvořit. Jednovazný, dvojvazný.

Zdroje a citace � BENEŠ, Pavel; PUMPR, Václav; BANÝR, Jiří. Základy chemie 1 pro 2. stupeň základní školy, nižší ročníky víceletých gymnázií a střední školy. Praha: Fortuna, 1993, ISBN 80 -7168 -043 -5. � ŠKODA, Jiří; DOULÍK, Pavel. Chemie 8 učebnice pro základní školy a víceletá gymnázia. Plzeň: Fraus, 2006, ISBN 80 -7238 -442 -2. �Obr. 1 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/o 2. gif
![Zdroje a citace Obr 2 AUTOR NEUVEDEN zs chemie cz online cit 21 Zdroje a citace � Obr. 2 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-16.jpg)
Zdroje a citace � Obr. 2 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/cl 2. gif � Obr 3 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/s 8. gif � Obr. 4 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/p 4. gif � Obr. 5 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/hcl. gif
![Zdroje a citace Obr 6 AUTOR NEUVEDEN zs chemie cz online cit 21 Zdroje a citace � Obr. 6 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-17.jpg)
Zdroje a citace � Obr. 6 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/h 2 o. gif � Obr. 7 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/ethanol. gif � Obr. 8 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/atomh. gif AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/molekulah 2. gif
![Zdroje a citace Obr 9 AUTOR NEUVEDEN zs chemie cz online cit 21 1 Zdroje a citace Obr. 9 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-18.jpg)
Zdroje a citace Obr. 9 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/atomo 2. gif AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/molekulao 2. gif Obr. 10 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/molekulah 2 o. gif
![Zdroje a citace Obr 11 AUTOR NEUVEDEN zs chemie cz online cit 21 1 Zdroje a citace Obr. 11 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-19.jpg)
Zdroje a citace Obr. 11 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/atomh. gif Obr. 12 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/atomo. gif Obr. 13 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/atomn. gif
![Zdroje a citace Obr 14 AUTOR NEUVEDEN zs chemie cz online cit 21 Zdroje a citace � Obr. 14 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21.](https://slidetodoc.com/presentation_image_h/cf95d37659f031f66489d1a3d58c8893/image-20.jpg)
Zdroje a citace � Obr. 14 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/i 2. gif � Obr. 15 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/p 4. gif � Obr. 16 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/ethanol. gif � Obr. 17 AUTOR NEUVEDEN. zs chemie. cz [online]. [cit. 21. 1. 2013]. Dostupný na WWW: http: //www. zschemie. euweb. cz/molekuly/co 2. gif






































