NUMEROS CUANTICOS NUMEROS CUANTICOS Especifican las propiedades de












- Slides: 17

NUMEROS CUANTICOS

NUMEROS CUANTICOS • Especifican las propiedades de los orbítales atómicos y sus e-. • Ecuación de Schrödinger indican la región ocupada para cada orbital en terminos de: • • • Distancia desde el núcleo Forma del orbital Posición del orbital

NUMEROS CUANTICOS • Los números cuánticos se denominan con las letras n, m, l y s, nos indican la posición y la energía del e-. • Ningún e- de un mismo átomo puede tener los mismos números cuánticos.

SIGNIFICADO • n = número cuántico principal, que indica el nivel de energía donde se encuentra el e-, asume valores enteros positivos, del 1 al 7. • l = número cuántico secundario, que indica el orbital en el que se encuentra el electrón , puede ser s , p , d y f (0 , 1 , 2 y 3 ).

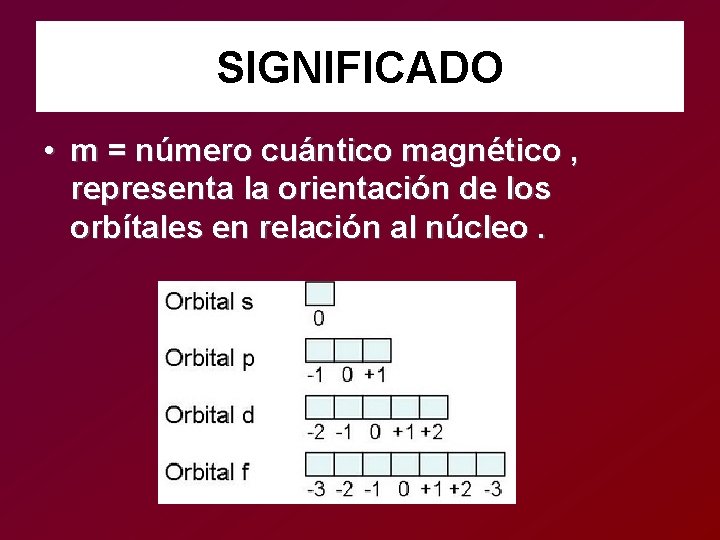
SIGNIFICADO • m = número cuántico magnético , representa la orientación de los orbítales en relación al núcleo.

SIGNIFICADO • s = Spin, únicamente tiene 2 valores posibles ½ y -1/2 indica los dos posibles estados de un e- en un orbital.


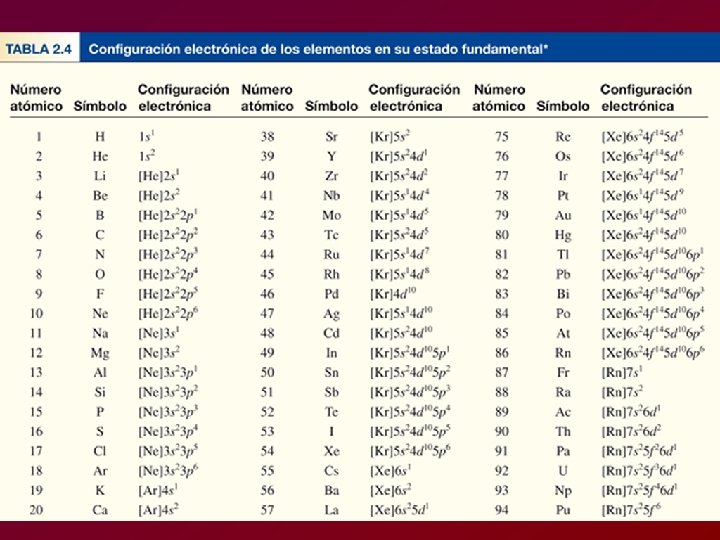
CONFIGURACION ELECTRONICA Es la descripción de la ubicación de los electrones en los distintos niveles (con subniveles y orbitales) de un determinado átomo.

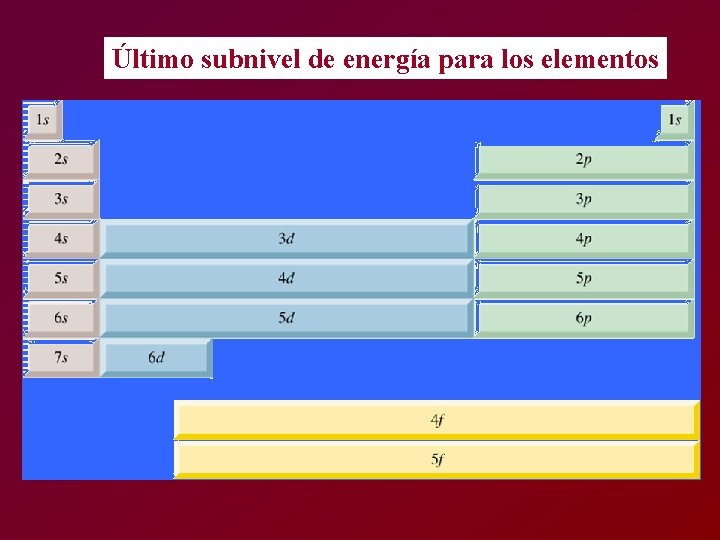
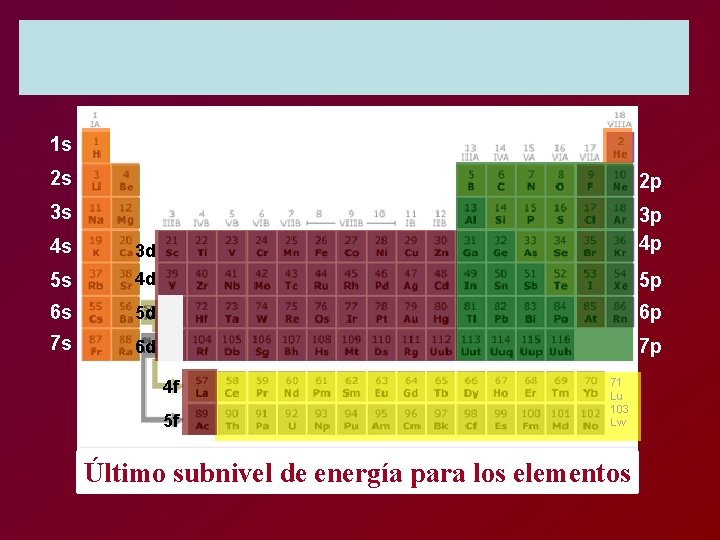
Último subnivel de energía para los elementos

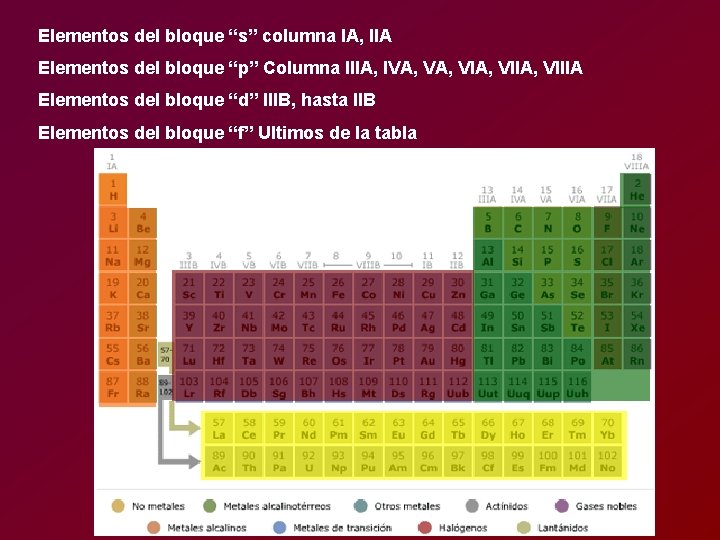
Elementos del bloque “s” columna IA, IIA Elementos del bloque “p” Columna IIIA, IVA, VIA, VIIIA Elementos del bloque “d” IIIB, hasta IIB Elementos del bloque “f” Ultimos de la tabla



EJEMPLO: • Desarrollada y gráfica de: • P: 1 s 2 2 p 6 3 s 2 3 p 3 1 s 2 s 2 px 2 py 2 pz 3 s 3 px 3 py 3 pz condensada P: [Ne] 3 s 2 3 p 3

1 s 2 s 2 p 3 s 4 s 3 d 3 p 4 p 5 s 4 d 5 p 6 s 5 d 6 p 7 s 6 d 7 p 4 f 5 f 71 Lu 103 Lw Último subnivel de energía para los elementos

Configuración electrónica desarrollada, condensada y gráfica de los siguientes elementos 1. Li 2. F 3. Na 4. Cl 5. K 6. Ga 7. Br 8. Sr 9. In 10. Xe

Para la plata (Z = 47) • Configuración electrónica de la plata: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 9 • Los electrones del nivel 4 d tendrán una disposición como se muestra en la figura: La flecha roja representa el electrón diferencial. Los 4 números cuánticos del electrón diferencial son: • Número cuántico principal (n) = 4 • Número cuántico secundario (l) = 2 • Número cuántico magnético (ml) = +1 • Número cuántico spin magnético (ms) = -1/2

Para el cloro (Z = 17) • Configuración electrónica del cloro: 1 s 22 p 63 s 23 p 5 Los electrones del nivel 3 p tendrán una disposición como se muestra en la figura: La flecha roja representa el electrón diferencial Los 4 números cuánticos del electrón diferencial son: • Número cuántico principal (n) = 3 • Número cuántico secundario (l) = 1 • Número cuántico magnético (ml) = 0 • Número cuántico spin magnético (ms) = -1/2