ns 0 2 n 1d VIII 1 VIII

![Общая электронная формула: […] ns 0 2 (n– 1)d VIII Б 1 VIII Б Общая электронная формула: […] ns 0 2 (n– 1)d VIII Б 1 VIII Б](https://slidetodoc.com/presentation_image/40845ac82a8a720b21166463ef0203bf/image-2.jpg)



![Комплексные соединения Fe. II КЧ Примеры 6 [Fe(H 2 O)6]2+ Ru. IV КЧ Примеры Комплексные соединения Fe. II КЧ Примеры 6 [Fe(H 2 O)6]2+ Ru. IV КЧ Примеры](https://slidetodoc.com/presentation_image/40845ac82a8a720b21166463ef0203bf/image-8.jpg)














- Slides: 26

![Общая электронная формула ns 0 2 n 1d VIII Б 1 VIII Б Общая электронная формула: […] ns 0 2 (n– 1)d VIII Б 1 VIII Б](https://slidetodoc.com/presentation_image/40845ac82a8a720b21166463ef0203bf/image-2.jpg)
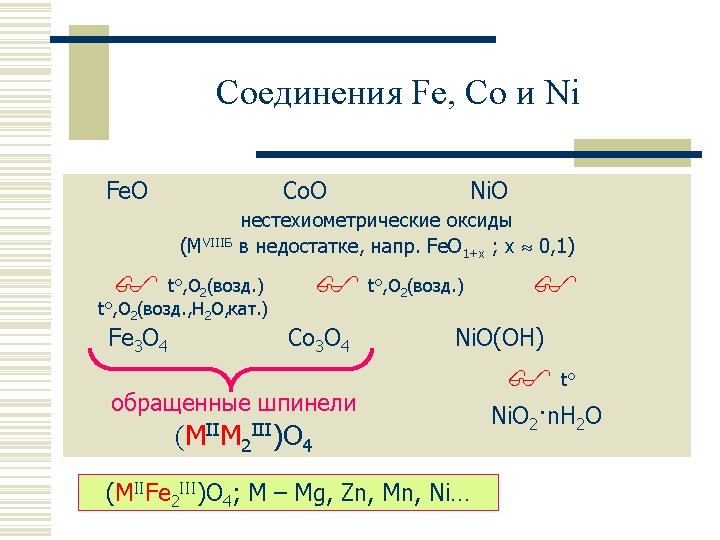
Общая электронная формула: […] ns 0 2 (n– 1)d VIII Б 1 VIII Б 0 VIII Б 2 Fe [Ar] 3 d 64 s 2 Co [Ar] 3 d 74 s 2 Ru [Kr] 4 d 75 s 1 Rh [Kr] 4 d 85 s 1 Os [Xe, 4 f 14] 5 d 66 s 2 Ir [Xe, 4 f 14] 5 d 76 s 2 6 10 Ni [Ar] 3 d 84 s Pd [Kr] 4 d 105 2 s 0 Pt [Xe, 4 f 14] 5 d 96 s 1

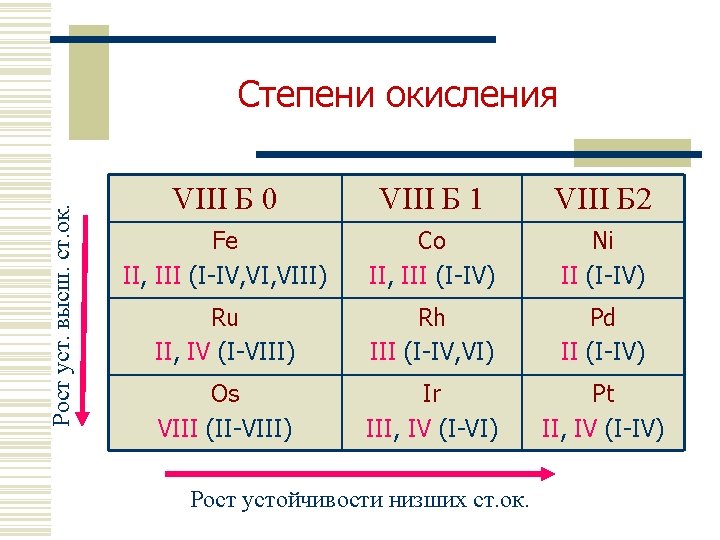
Рост уст. высш. ст. ок. Степени окисления VIII Б 0 VIII Б 1 VIII Б 2 Fe II, III (I-IV, VIII) Co II, III (I-IV) Ni II (I-IV) Ru II, IV (I-VIII) Rh III (I-IV, VI) Pd II (I-IV) Os VIII (II-VIII) Ir III, IV (I-VI) Pt II, IV (I-IV) Рост устойчивости низших ст. ок.

Электроотрицательность Zn 1, 66 Cd 1, 46 VIII Б 0 VIII Б 1 VIII Б 2 Fe 1, 64 Co 1, 70 Ni 1, 75 Ru 1, 42 Rh 1, 45 Pd 1, 35 Os 1, 52 Ir 1, 55 Pt 1, 44



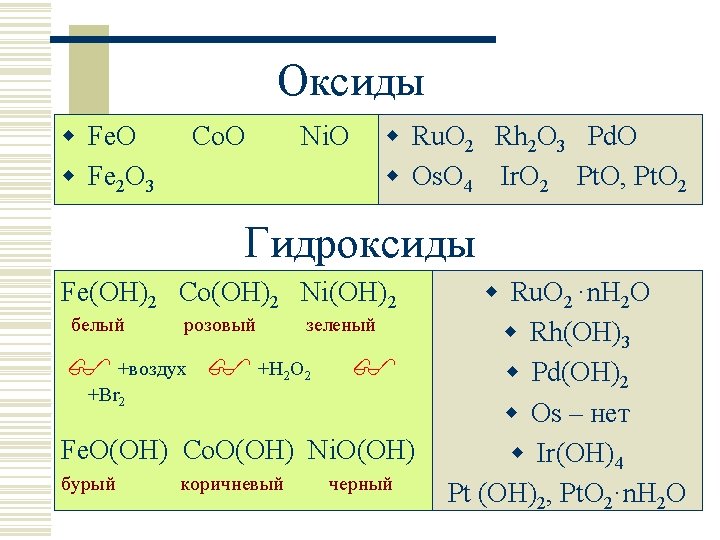
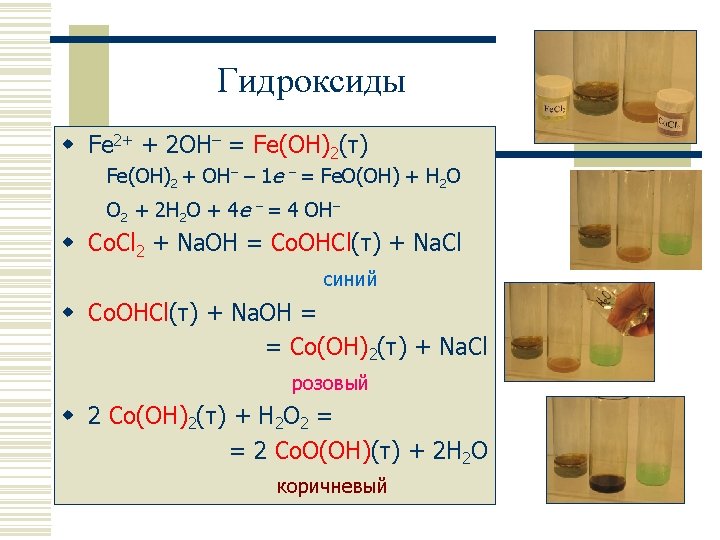
Оксиды w Fe. O w Fe 2 O 3 Co. O w Ru. O 2 Rh 2 O 3 Pd. O w Os. O 4 Ir. O 2 Pt. O, Pt. O 2 Ni. O Гидроксиды Fe(OH)2 Co(OH)2 Ni(OH)2 белый розовый зеленый +воздух +H 2 O 2 +Br 2 Fe. O(OH) Co. O(OH) Ni. O(OH) бурый коричневый черный w Ru. O 2 ·n. H 2 O w Rh(OH)3 w Pd(OH)2 w Os – нет w Ir(OH)4 Pt (OH)2, Pt. O 2·n. H 2 O
![Комплексные соединения Fe II КЧ Примеры 6 FeH 2 O62 Ru IV КЧ Примеры Комплексные соединения Fe. II КЧ Примеры 6 [Fe(H 2 O)6]2+ Ru. IV КЧ Примеры](https://slidetodoc.com/presentation_image/40845ac82a8a720b21166463ef0203bf/image-8.jpg)
Комплексные соединения Fe. II КЧ Примеры 6 [Fe(H 2 O)6]2+ Ru. IV КЧ Примеры 6 [Ru. Cl 6]2– Fe. III Co. III Ni. II 6 4 6 Rh. III Pd. II Os. VIII Ir. IV Pt. II Pt. IV 6 4 6 [Fe(H 2 O)6]3+ [Co. Cl 4]2– [Co(NH 3)6]2+ [Co(NH 3)6]3+ [Ni(CN)4]2– [Ni(NH 3)6]2+ [Rh. Cl 6]3– [Pd(H 2 O)4]2+ [Os. O 4(OH)2]2– [Ir. Cl 6]2– [Pt(NH 3)2 Cl 2]0 [Pt. Cl 6]2–









Гидроксиды никеля w Ni(OH)2 уст. на воздухе w 4 Ni(NO 3)2. 6 H 2 O = = 4 Ni. O(OH) + 8 NO 2 + 22 H 2 O w 4 Ni. O(OH) = 4 Ni. O + O 2 + 2 H 2 O w 2 Ni(OH)2(т) + Br 2 + 2 Na. OH = зеленый = 2 Ni. O(OH)(т) + 2 Na. Br + 2 H 2 O черный w Ni. O(OH)/Ni(OH)2 = 0, 78 В w Br 2/Br– = 1, 09 В

Окислительные свойства w 2 Ni. O(OH)(т) + 6 HCl = = 2 Ni. Cl 2 + 4 H 2 O Ni. O(OH) + 3 H+ + 1 e– = Ni 2+ + 2 H 2 O 2 Cl– – 2 e – = Cl 2 w Ni. O(OH)/Ni 2+ = +2, 25 В w Cl 2/Cl– = 1, 34 В w 4 Ni. IIIO(OH)(т) + 4 H 2 SO 4 = = O 2 + 4 Ni. SO 4 + 6 H 2 O Ni. O(OH) + 3 H+ + 1 e – = Ni 2+ + 2 H 2 O – 4 e – = O 2 + 4 H+ O 2/H 2 O= 1, 23 В







Комплексы кобальта и никеля • Co. IICl 2 + 7 KNO 2 + 2 CH 3 COOH = = K 3[Co. III(NO 2)6] + NO + 2 KCl + 2 CH 3 COOK + H 2 O Co 2+ + 6 NO 2– + 3 K+ – 1 e – = K 3[Co. III(NO 2)6] NO 2– + 2 CH 3 COOH + 1 e – = NO + 2 CH 3 COO– + H 2 O w Ni. Cl 2 + 6 NH 3·H 2 O = [Ni(NH 3)6]Cl 2 + 6 H 2 O β 6 109 w Ni. Cl 2 + 2 NH 3·H 2 O + 2 H 2 L = = [Ni(HL)2] + 2 NH 4 Cl + 2 H 2 O H 2 L – диметилглиоксим (CH 3)2 C 2(NOH)2 (см. «Компл. соединения. Хелаты» )
