Nomenklatura wybranych zwizkw nieorganicznych Nazwy jonw dodatnich kationy

Nomenklatura wybranych związków nieorganicznych

Nazwy jonów dodatnich – kationy nazwę kationu tworzy się od nazwy pierwiastka w dopełniaczu Li+ - jon litu Cu 2+ - jon miedzi II Hg 22+ - jon dirtęci I H+ - jon wodoru I lub hydron- (gdy liczba przyłączonych cząsteczek nie jest znana lub nieistotna) H 3 O+ - jon oksoniowy lub oksonium NH 4+ - jon amonu lub jon amonowy, amonium, azanium UO 22+ - jon uranylowy VI lub jon dioksouranu VI

Nazwy anionów tworzy się za pomocą końcówki „owy” dołączonej do nazwy grupy lub pierwiastka H- - jon wodorkowy OH- - anion wodorotlenowy F- - jon fluorkowy S 2 - - jon siarczkowy C 4 - - jon węglikowy O 2 - - jon ditlenkowy(-1) nazwa dopuszczalna- anion ponadtlenkowy O 22 - - jon ditlenkowy (-2) nazwa dopuszczalna- anion nadtlenkowy O 3 - - jon tritlenkowy (-1) nazwa dopuszczalna anion ozonkowy N 3 - - jon triazotkowy(1 -) NO 3 - - jon azotanowy V HSO 4 - - jon wodorosiarczanowy VI SCN- - jon tiocyjnianowy

Nazewnictwo tlenków Tlenki to związki o wzorze ogólnym En. Om E –jest symbolem dowolnego pierwiastka z wyjątkiem fluoru Nazwy tlenków prostych tworzy się łącząc słowo tlenek z nazwą pierwiastka w dopełniaczu a w nawiasie podaje się stopień utlenienia Cl 2 O 7 – tlenek chloru(VII) NO 2 – tlenek azotu(IV) Al 2 O 3 – tlenek glinu(III) Fe. O – tlenek żelaza(II) Cs 2 O tlenek cezu H 2 O 2 – nadtlenek wodoru

Nazewnictwo tlenków - doszczegółowienie Obecnie stosuje się dwa systemy nazewnictwa tlenków, przy czym pierwszy jest nazewnictwem systematycznym i zalecanym, natomiast drugi bardziej zwyczajowy, ale mimo to dozwolony. A. System Stocka (omówiony wcześniej) Nazwy tlenków tworzy się przez podanie w nazwie tlenku słowa „tlenek”, a w następnej kolejności nazwy pierwiastka z podaną w nawiasie wartościowością. Jeśli pierwiastek we wszystkich związkach wykazuje jedną wartościowość, wówczas nie ma konieczności jej podawania, np. Al 2 O 3 – tlenek glinu, ale N 2 O 5 – tlenek azotu(V); CO 2 – tlenek węgla (IV), CO – tlenek wegla(II) B. System przedrostków System ten opiera się na zapisie wzoru chemicznego danego związku, a dokładniej na indeksach stechiometrycznych. Jeżeli w danej cząsteczce występują dwa takie same atomu przed nazwą należy dodać przedrostek dwu- lub di- , jeżeli trzy - trój- lub tri- itd. Dla pojedynczo występujących atomów w cząsteczce nie dodaje się przedrostków.

Nazewnictwo tlenków wg Stocka Cl 2 O 7 – heptatlenek dichloru NO 2 – ditlenek azotu Al 2 O 3 – tritlenek diglinu Fe. O – tlenek żelaza Cs 2 O - tlenek dicezu H 2 O 2 – ditlenek diwodoru

Nazewnictwo związków z wodorem Związki z wodorem opisuje wzór ogólny En. Hm lub Hm. En. Wybór właściwego wzoru zależy od relacji elektroujemności danego pierwiastka i wodoru. Wzór Nazwa zwyczajowa (dopuszczalna) Nazwa systematyczna HF HCl HBr HI Fluorowodór Chlorowodór Bromowodór jodowodór Fluorek wodoru Chlorek wodoru Bromek wodoru Jodek wodoru

Wzór Nazwa zwyczajowa (dopuszczalna) B 2 H 6 Diborowodór (6) lub diboran (6) CH 4 Metan Si. H 4 Silan NH 3 Amoniak N 2 H 4 Hydrazyna PH 3 Fosfina H 2 O Woda H 2 S Siarkowodór H 2 Se Selenowodór H 2 Te tellurowodór Nazwa systematyczna Diborowodór (6) lub diboran (6) metan Silan Azan Diazan Fosfan Oksydan Sulfan Selan tellan

Nazewnictwo wodorotlenków Wzór ogólny wodorotlenków – M(OH)n gdzie M oznacza atom metalu Nazwy wodorotlenków tworzy się łącząc słowo wodorotlenek z nazwą pierwiastka w dopełniaczu w nawiasie podając stopień utlenienia lub wg systemu Stocka. KOH - wodorotlenek potasu Cu(OH)2 – wodorotlenek miedzi(II) lub diwodorotlenek miedzi Cr(OH)2 – wodortlenek chromu(II) lub diwodorotlenek chromu Cr(OH)3 – wodortlenek chromu(III) lub triwodorotlenek chromu

Nazewnictwo kwasów Wzór ogólny kwasów Hn. R Kwasy beztlenowe nie zawierają w swojej cząsteczce grupy E-O-H Nazwy anionów kwasów beztlenowych mają końcówkę –owy, a nazwy soli tych kwasów –ek. Kwasy tlenowe - oksykwasy zawierają w swojej cząsteczce grupę E-O-H Nazwy zwyczajowe kwasów tlenowych mają końcówkę –owy, nazwy ich anionów –anowy, a nazwy soli -an
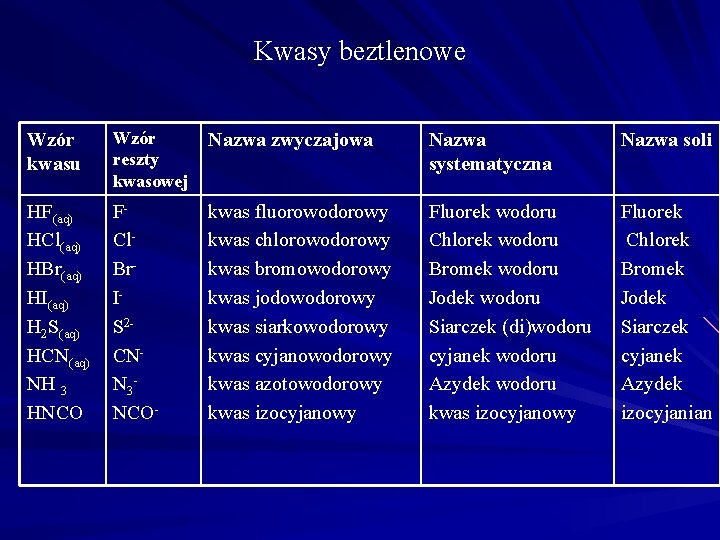
Kwasy beztlenowe Wzór kwasu Wzór reszty kwasowej Nazwa zwyczajowa Nazwa systematyczna Nazwa soli HF(aq) HCl(aq) HBr(aq) HI(aq) H 2 S(aq) HCN(aq) NH 3 HNCO FCl. Br. IS 2 CNN 3 NCO- kwas fluorowodorowy kwas chlorowodorowy kwas bromowodorowy kwas jodowodorowy kwas siarkowodorowy kwas cyjanowodorowy kwas azotowodorowy kwas izocyjanowy Fluorek wodoru Chlorek wodoru Bromek wodoru Jodek wodoru Siarczek (di)wodoru cyjanek wodoru Azydek wodoru kwas izocyjanowy Fluorek Chlorek Bromek Jodek Siarczek cyjanek Azydek izocyjanian
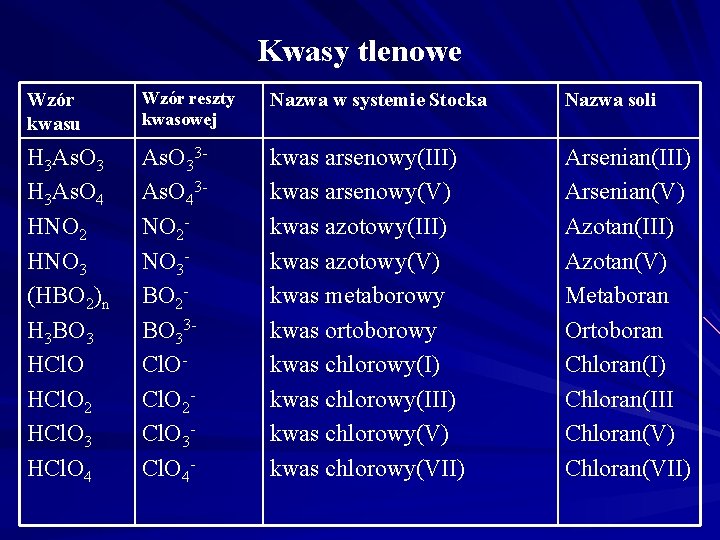
Kwasy tlenowe Wzór kwasu Wzór reszty kwasowej Nazwa w systemie Stocka Nazwa soli H 3 As. O 3 H 3 As. O 4 HNO 2 HNO 3 (HBO 2)n H 3 BO 3 HCl. O 2 HCl. O 3 HCl. O 4 As. O 33 As. O 43 NO 2 NO 3 BO 2 BO 33 Cl. O 2 Cl. O 3 Cl. O 4 - kwas arsenowy(III) kwas arsenowy(V) kwas azotowy(III) kwas azotowy(V) kwas metaborowy kwas ortoborowy kwas chlorowy(I) kwas chlorowy(III) kwas chlorowy(VII) Arsenian(III) Arsenian(V) Azotan(III) Azotan(V) Metaboran Ortoboran Chloran(I) Chloran(III Chloran(V) Chloran(VII)

Kwasy tlenowe Wzór kwasu Wzór reszty Nazwa w systemie Stocka kwasowej Nazwa soli H 2 Cr. O 4 H 2 Cr 2 O 7 H 3 PO 3 (H 2 PHO 3) (HPO 3)n H 3 PO 4 H 4 P 2 O 7 HIO 4 H 5 IO 6 H 4 Si. O 4 (H 2 Si. O 3 )n Cr. O 42 Cr 2 O 72 PHO 32 PO 3 PO 43 P 2 O 74 IO 65 Si. O 44 Si. O 32 - Chromian(VI) Dichromian(VI) fosforan(III) metafosforan(V) (orto)fosforan(V) Difosforan(V) (meta)jodan(VII) ortojodan(VII ) ortokrzemian metakrzemi kwas chromowy(VI) kwas dichromowy(VI) kwas fosforowy(III) kwas metafosforowy(V) kwas (orto)fosforowy(V) kwas difosforowy(V) kwas (meta)jodowy(VII) kwas ortokrzemowy kwas metakrzemowy
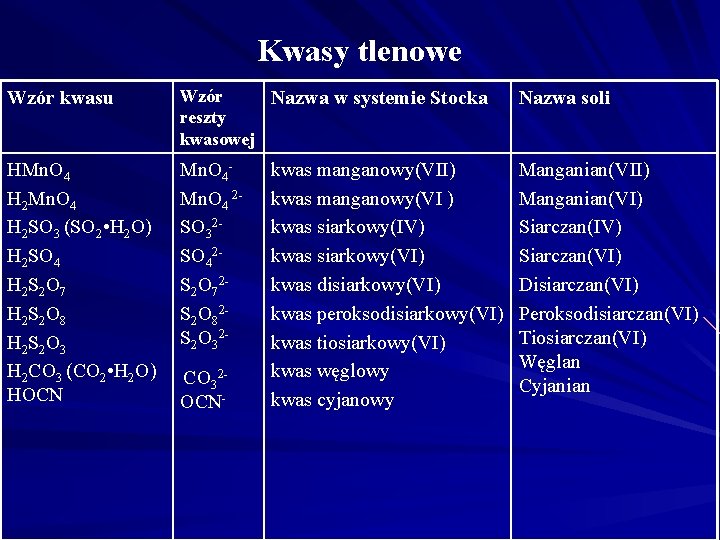
Kwasy tlenowe Wzór kwasu Wzór Nazwa w systemie Stocka reszty kwasowej Nazwa soli HMn. O 4 H 2 SO 3 (SO 2 • H 2 O) H 2 SO 4 H 2 S 2 O 7 H 2 S 2 O 8 H 2 S 2 O 3 H 2 CO 3 (CO 2 • H 2 O) HOCN Mn. O 4 2 SO 32 SO 42 S 2 O 72 S 2 O 82 S 2 O 32 - Manganian(VII) Manganian(VI) Siarczan(IV) Siarczan(VI) Disiarczan(VI) Peroksodisiarczan(VI) Tiosiarczan(VI) Węglan Cyjanian CO 32 OCN- kwas manganowy(VII) kwas manganowy(VI ) kwas siarkowy(IV) kwas siarkowy(VI) kwas disiarkowy(VI) kwas peroksodisiarkowy(VI) kwas tiosiarkowy(VI) kwas węglowy kwas cyjanowy

Nazwy związków jonowych (soli) Nazwa związku jonowego składa się z nazwy anionu i kationu w dopełniaczu, ewentualnie także z cyfry rzymskiej określającej ładunek jonu (stopień utlenienia) w przypadku gdy ten ładunek może być różny. Cu. Cl 2 – chlorek miedzi(II) Pb(NO 3)2 – azotan(V) ołowiu(II) Niektóre związki jonowe tworzą kryształy zawierające jony związku i określoną liczbę cząsteczek wody. Związki te noszą nazwę hydratów. Cu. SO 4 • 5 H 2 O – pentahydrat siarczanu(VI) miedzi(II)

Nazewnictwo soli – główne reguły nazwy są dwuwyrazowe: pierwszy człon określa resztę kwasową, drugi nazwę metalu i wartościowość: q sole kwasów tlenowych - nazwa reszty kwasowej z końcówką –an, np. Na. NO 3 azotan (V) sodu, Na. NO 2 azotan(III) sodu, Na. Cl. O 3 – chloran(V) sodu, Mg 3(PO 4)2 – ortofosforan(V) magnezu q sole kwasów beztlenowych - nazwa reszty kwasowej z końcówką –ek, np. Na 2 S – siarczek sodu, Fe. Cl 3 - chlorek żelaza(III), Fe. Cl 2 - chlorek żelaza(II) q wodorosole - przedrostek wodoro- dodaje się przed nazwę reszty kwasowej i przedrostek di-, tri- (atomów wodoru >1), np. Na. HCO 3 – wodorowęglan sodu q hydroksosole – nazwa reszty kwasowej i dalej wodorotlenek oraz nazwa kationu, np. Ca(OH)Cl – hydroksychlorek wapnia

Nomenklatura wybranych związków organicznych
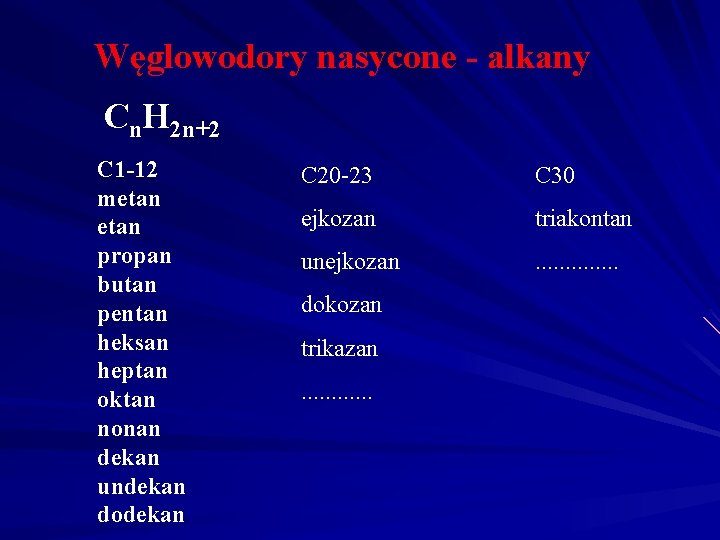
Węglowodory nasycone - alkany Cn. H 2 n+2 C 1 -12 metan propan butan pentan heksan heptan oktan nonan dekan undekan dodekan C 20 -23 C 30 ejkozan triakontan unejkozan . . . dokozan trikazan. . .
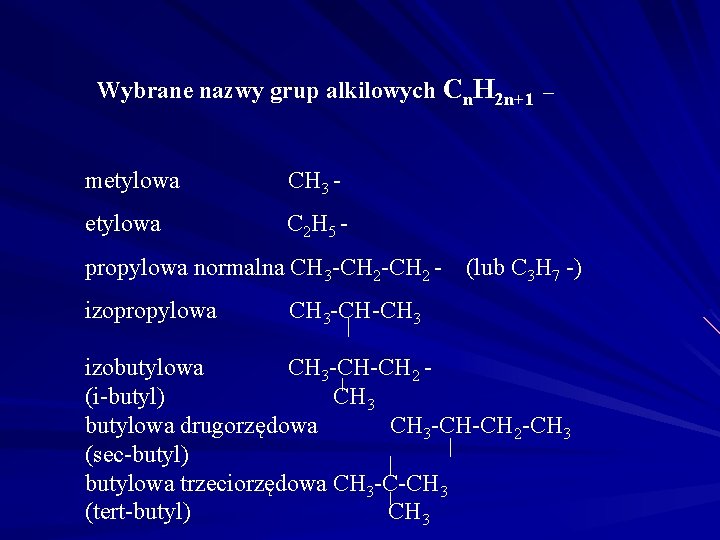
Wybrane nazwy grup alkilowych Cn. H 2 n+1 _ metylowa CH 3 - etylowa C 2 H 5 - propylowa normalna CH 3 -CH 2 izopropylowa (lub C 3 H 7 -) CH 3 -CH-CH 3 izobutylowa CH 3 -CH-CH 2 (i-butyl) CH 3 butylowa drugorzędowa CH 3 -CH-CH 2 -CH 3 (sec-butyl) butylowa trzeciorzędowa CH 3 -C-CH 3 (tert-butyl) CH 3
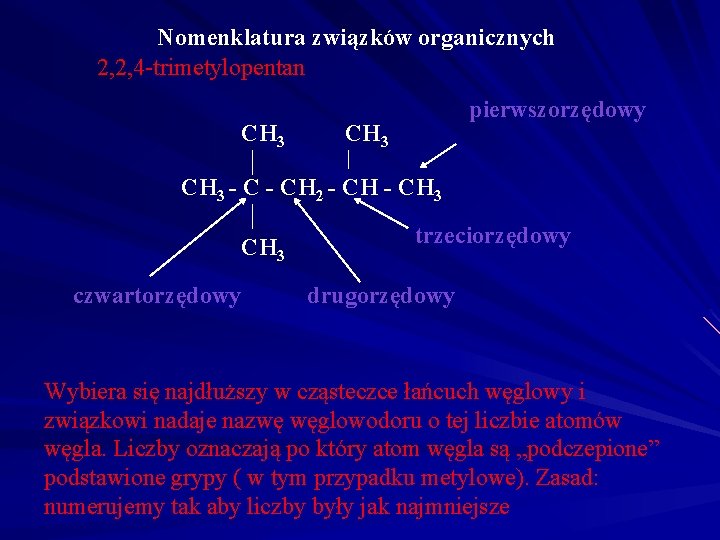
Nomenklatura związków organicznych 2, 2, 4 -trimetylopentan CH 3 pierwszorzędowy CH 3 - CH 2 - CH 3 czwartorzędowy trzeciorzędowy drugorzędowy Wybiera się najdłuższy w cząsteczce łańcuch węglowy i związkowi nadaje nazwę węglowodoru o tej liczbie atomów węgla. Liczby oznaczają po który atom węgla są „podczepione” podstawione grypy ( w tym przypadku metylowe). Zasad: numerujemy tak aby liczby były jak najmniejsze

Alkeny (olefiny) Ogólny wzór : C 1 -12 eten propen buten penten heksen hepten octen nonen deken undeken dodeken Węglowodory nienasycone z jednym wiązaniem podwójnym Cn. H 2 n Izomery: CH 3 -CH 2 -CH=CH 2 (1 -heksen) CH 3 -CH 2 -CH=CH-CH 3 (2 -heksen) CH 3 -CH 2 -CH=CH-CH 2 -CH 3 (3 -heksen)

Alkiny (acetyleny) Węglowodory nienasycone z jednym wiązaniem potrójnym Ogólny wzór : C 1 -12 etyn (acetylen) propyn butyn pentyn heksyn heptyn octyn nonyn dekyn undekyn dodekyn Cn. H 2 n-2 Izomery: CH 3 -CH 2 -CH 2 -C=CH (1 -heksyn) CH 3 -CH 2 -C=C-CH 3 (2 -heksyn) CH 3 -CH 2 -C=C-CH 2 -CH 3 (3 -heksyn)

Alkohole to grupa związków organicznych będących jednofunkcyjnymi pochodnymi węglowodorów, w których wodór podstawiony jest przez grupę hydroksylową (wodorotlenową). Alkohole można uważać za organiczne pochodne wody H-O-H, w której jeden z atomów wodoru został zastąpiony rodnikiem organicznym R-OH. Jednofunkcyjne pochodne węglowodorów są to pochodne węglowodorów zawierające jeden rodzaj grup funkcyjnych, ale nie wyklucza to, że w danym związku ta sama grupa może powtarzać się dwa lub więcej razy. Grupa funkcyjna to atom lub grupa atomów nadająca cząsteczce związku organicznego specyficzne właściwości chemiczne.

Szereg homologiczny alkoholi Alkohole, podobnie jak węglowodory, tworzą szeregi homologiczne. Najbardziej rozpowszechnione alifatyczne alkohole jednowodorotlenowe (monohydroksylowe) tworzą szereg homologiczny o wzorze ogólnym. Pochodne alkanów nazywa się alkanolami, a alkenów - alkenolami.
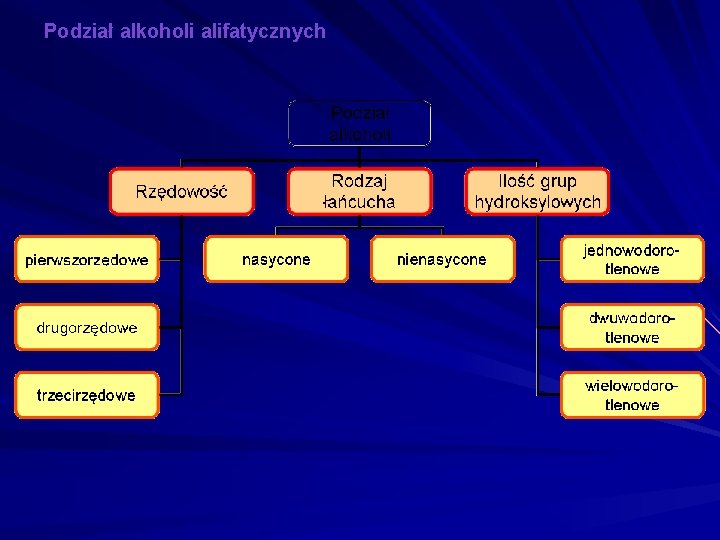
Podział alkoholi alifatycznych

Rzędowość alkoholi W łańcuchu węglowym rozróżnić można atomy węgla pierwszo-, drugoi trzeciorzędowe. Zależnie od tego, z którym z tych atomów węgla związana jest grupa – OH, rozróżniamy alkohole I-szo-(1 o), II –go-(2 o) i III-ciorzędowe(3 o).
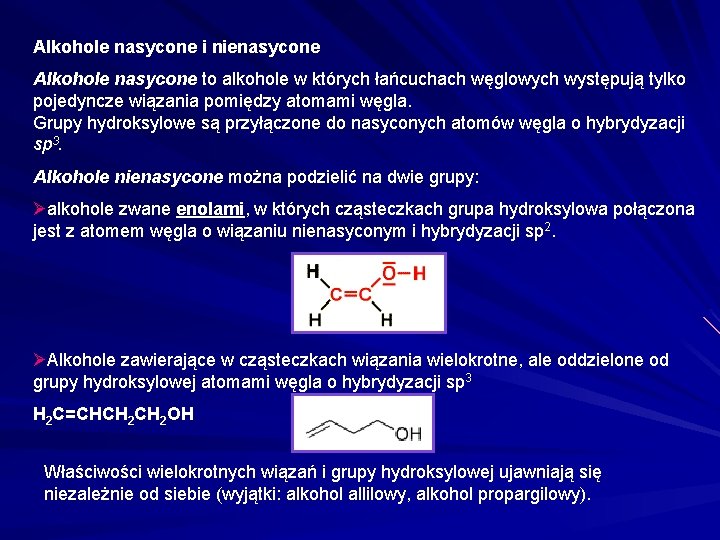
Alkohole nasycone i nienasycone Alkohole nasycone to alkohole w których łańcuchach węglowych występują tylko pojedyncze wiązania pomiędzy atomami węgla. Grupy hydroksylowe są przyłączone do nasyconych atomów węgla o hybrydyzacji sp 3. Alkohole nienasycone można podzielić na dwie grupy: Øalkohole zwane enolami, w których cząsteczkach grupa hydroksylowa połączona jest z atomem węgla o wiązaniu nienasyconym i hybrydyzacji sp 2. ØAlkohole zawierające w cząsteczkach wiązania wielokrotne, ale oddzielone od grupy hydroksylowej atomami węgla o hybrydyzacji sp 3 H 2 C=CHCH 2 OH Właściwości wielokrotnych wiązań i grupy hydroksylowej ujawniają się niezależnie od siebie (wyjątki: alkohol allilowy, alkohol propargilowy).

Alkohole wielowodorotlenowe (polihydroksylowe) Alkohole mające dwie lub więcej grup wodorotlenowych -OH przyłączonych do różnych atomów węgla. W zależności od liczby grup -OH, dzielimy je na diole, triole itd.

Nazewnictwo systematyczne q. Nazwę alkoholu tworzy się przez dodanie do nazwy odpowiedniego węglowodoru końcówki –ol. q. Najpierw należy wybrać główny łańcuch węglowy, który musi spełniać następujące warunki: - jest to najdłuższy łańcuch zawierający atom węgla połączony z grupą –OH - atomy C w tym łańcuchu ponumerowane są tak, aby atom C połączony z grupą –OH miał jak najmniejszy numer. q. Numer atomu węgla połączonego z grupą -OH podaje się w nazwie bezpośrednio przedrostkiem –ol Przykłady butan-1 - ol butan-2 -ol 2 -metylo-butan-2 -ol

q. Jeżeli grup -OH jest więcej jak jedna to w nazwie podajemy liczebnik pochodzenia greckiego (di, tri) Alkohole zawierające w cząsteczce dwie grupy wodorotlenowe nazywane są ogólnie diolami (dawniej glikolami), zaś alkohole zawierające w cząsteczce trzy grupy wodorotlenowe nazywane są triolami. q. W wypadku alkoholi zawierających wiązania wielokrotne (podwójne lub potrójne) pierwszeństwo w numeracji łańcucha ma grupa –OH. Nazwy zwyczajowe alkoholi składają się z nazwy grupy alkilowej związanej z grupą –OH w cząsteczce, poprzedzonej wyrazem „alkohol” (dotyczy prostszych alkoholi).

Przykładowe ustalanie nazwy alkoholu 1. Wybieramy łańcuch główny i numerujemy atomy C Uwaga: Najdłuższy łańcuch węglowy nie jest łańcuchem głównym, gdyż nie zawiera grupy -OH 2. Określamy położenie grupy –OH i potrójnego wiązania (but-3 -yn-1 -ol) 3. Podajemy nazwy i położenie podstawników 2 -etylo 4. Pełna nazwa związku: 2 -etylobut-3 -yn-1 -ol

ALDEHYDY H R - C=O Zbudowane z rodnika i grupy aldehydowej -CHO Nazwa alkdehydu ma końcówkę -al

R KETONY R C=O Zbudowane z dwóch rodników i grupy ketonowej (karbonylowej) =C=O Nazwa alkoholu ma końcówkę -on

KWASY KARBOKSYKOWE R - COOH Zbudowane z rodnika i grupy karboksylowej --COOH OH R-C O

AMINY Powstają przez zastąpienie atomów wodoru w cząsteczce amoniaku rodnikami (grupami alkilowymi lub arylowymi) Rzędowość amin CH 3 NH 2 metyloamina pierwszorzędowa CH 3 NHCH 3 dimetyloamina drugorzędowa N(CH 3)3 trimetyloamina trzeciorzędowa

Węglowodory aromatyczne Związki cykliczne o wiązaniach pośrednich między pojedynczym a podwójnym (0, 139 nm) Najprostszy związek: benzen lepiej

Pochodne węglowodorów aromatycznych X X = rodniki alkilowe : alkilobenzen (np. metylobenzen czyli toluen) X = grupa nitrowa -NO 2 : nitrobenzen X = grupa halogenowa, np. . Cl: chlorobenzen
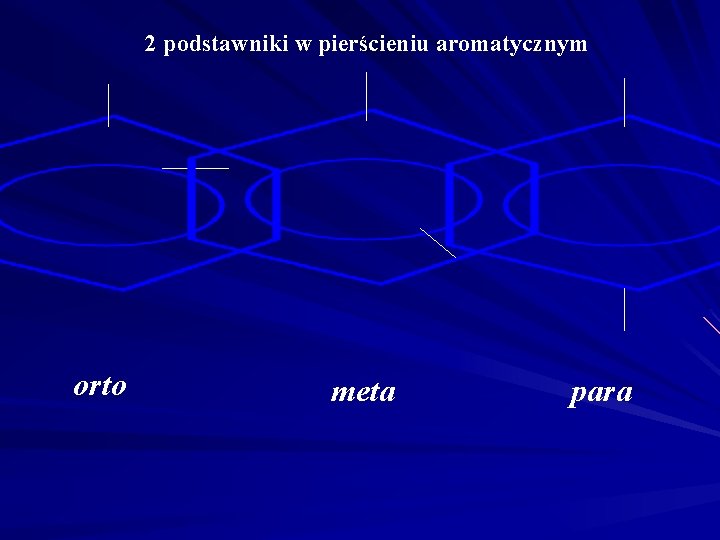
2 podstawniki w pierścieniu aromatycznym orto meta para

Nazwij te związki organiczne CH 3 HC - CH 3 - CH 2 -CH 3 2, 5, 6 -trimetyloheptan

Nazwij te związki organiczne CH 3 - CH 2 -CH 2 - CH 3 CH 2 - CH 3 2 -metylo-5 -butylononan
- Slides: 40