Nomenclatura de Compuestos Binarios y Terciarios Profa Wendy

Nomenclatura de Compuestos Binarios y Terciarios Profa. Wendy Marisol López 1

Nomenclatura química de los compuestos inorgánicos Para iniciar el estudio de la nomenclatura es necesario distinguir primero entre compuestos orgánicos e inorgánicos. Los compuestos orgánicos contienen carbono, comúnmente en combinación con elementos como hidrógeno, oxígeno, nitrógeno y azufre. El resto de los compuestos se clasifican como compuestos inorgánicos. 2

Tipos de Nomenclaturas Se aceptan 3 tipos de nomenclaturas para nombrar compuestos químicos inorgánicos: 1. - Nomenclatura sistemática 2. - Nomenclatura stock 3. -Nomenclatura tradicional 3

Nomenclatura sistemática: para nombrar de este modo se usan prefijos numéricos excepto para indicar que el primer elemento de la fórmula sólo aparece una vez (mono) o cuando no puede haber confusión posible debido a que tenga una única valencia. 4

Nomenclatura stock: En este caso, cuando el elemento que forma el compuesto tiene más de una valencia atómica, se indica en números romanos al final y entre paréntesis. Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro átomo (compuestos binarios). 5

Nomenclatura tradicional: Aquí se indica la valencia del elemento que forma el compuesto con una serie de prefijos y sufijos. 6

1. - Compuestos Binarios Oxigenados Es la combinación de un metal con oxigeno, se le denomina OXIDO. Ejemplo: Nombre Genérico: Óxido Nombre específico: El nombre del metal en unitivo o adjetivado. F 2 O 3 Sistema Clásico: Oxido Férrico Sistema Estequiométrico: Trióxido de dihierro Sistema Stock: Oxido de hierro III Ca. O Sistema Clásico: Oxido Calcico ó Oxido de Calcio Sistema Estequiométrico: Monoxico de calcio Sistema Stock: Oxido de calcio II 7
Completando la Tabla con los Sistemas Compuesto Sistema Clásico Sist. Estquiométrico Sistema Stock Au 2 O 3 Pt. O 2 Cu. O Cd. O Ag 2 O Sn. O Cr 2 O 3 Ca. O Cu 2 O 8
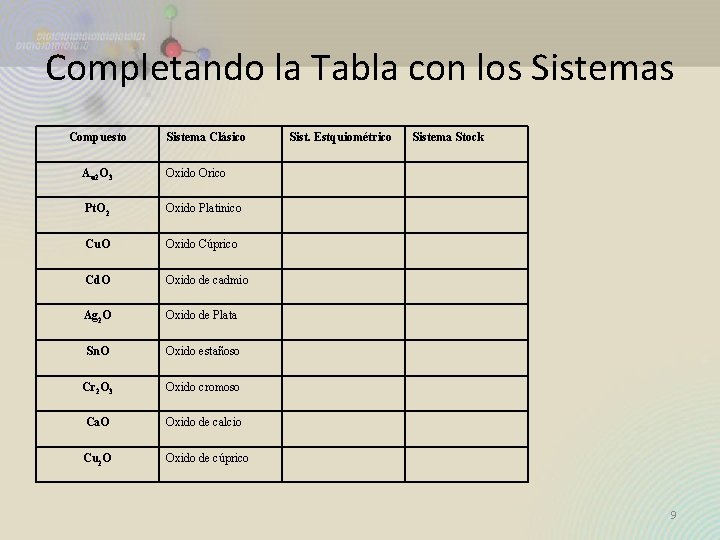
Completando la Tabla con los Sistemas Compuesto Sistema Clásico Au 2 O 3 Oxido Orico Pt. O 2 Oxido Platinico Cu. O Oxido Cúprico Cd. O Oxido de cadmio Ag 2 O Oxido de Plata Sn. O Oxido estañoso Cr 2 O 3 Oxido cromoso Ca. O Oxido de calcio Cu 2 O Oxido de cúprico Sist. Estquiométrico Sistema Stock 9
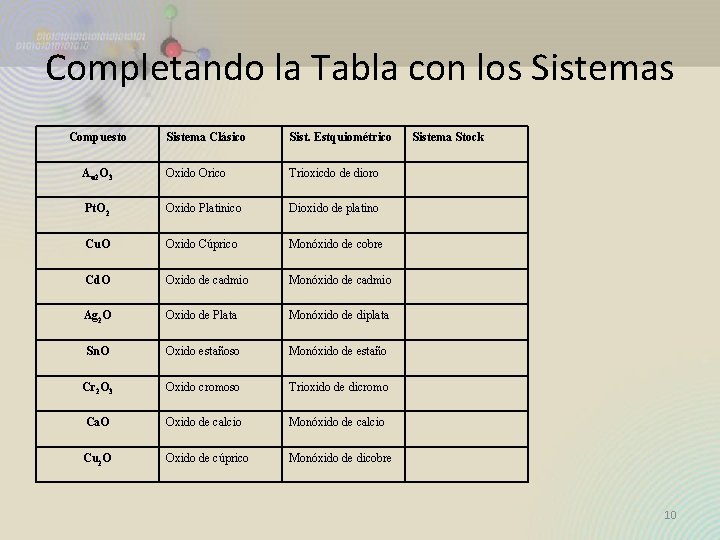
Completando la Tabla con los Sistemas Compuesto Sistema Clásico Sist. Estquiométrico Au 2 O 3 Oxido Orico Trioxicdo de dioro Pt. O 2 Oxido Platinico Dioxido de platino Cu. O Oxido Cúprico Monóxido de cobre Cd. O Oxido de cadmio Monóxido de cadmio Ag 2 O Oxido de Plata Monóxido de diplata Sn. O Oxido estañoso Monóxido de estaño Cr 2 O 3 Oxido cromoso Trioxido de dicromo Ca. O Oxido de calcio Monóxido de calcio Cu 2 O Oxido de cúprico Monóxido de dicobre Sistema Stock 10
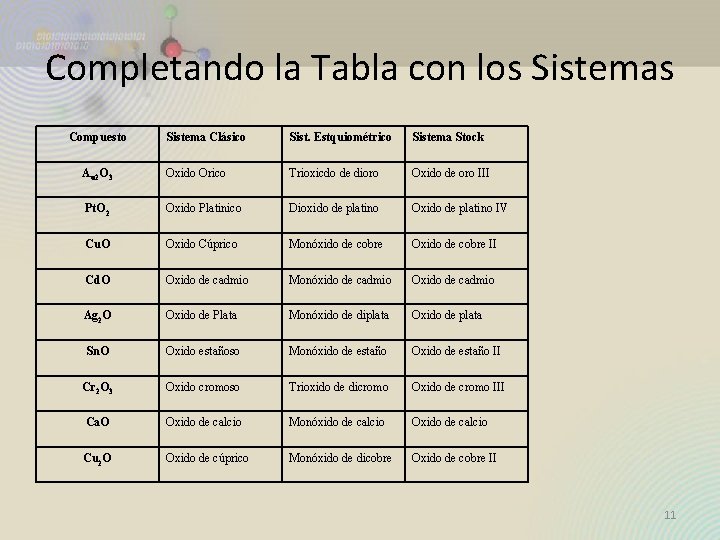
Completando la Tabla con los Sistemas Compuesto Sistema Clásico Sist. Estquiométrico Sistema Stock Au 2 O 3 Oxido Orico Trioxicdo de dioro Oxido de oro III Pt. O 2 Oxido Platinico Dioxido de platino Oxido de platino IV Cu. O Oxido Cúprico Monóxido de cobre Oxido de cobre II Cd. O Oxido de cadmio Monóxido de cadmio Oxido de cadmio Ag 2 O Oxido de Plata Monóxido de diplata Oxido de plata Sn. O Oxido estañoso Monóxido de estaño Oxido de estaño II Cr 2 O 3 Oxido cromoso Trioxido de dicromo Oxido de cromo III Ca. O Oxido de calcio Monóxido de calcio Oxido de calcio Cu 2 O Oxido de cúprico Monóxido de dicobre Oxido de cobre II 11

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Oxido de Bario Oxido de Zinc Oxido Estañico Trioxido de dicromo Oxido de cobre II Oxido mercurioso Oxido de hierro II Oxido sódico 12

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Oxido de Bario Ba. O Oxido de Zinc Zn. O Oxido Estañico Sn. O 2 Trioxido de dicromo Cr. O 3 Oxido de cobre II Cu. O 2 Oxido mercurioso Hg 2 O Oxido de hierro II Fe. O 2 Oxido sódico Na 2 O 13

2. - Compuestos Binarios Anhídridos Es la combinación de un no metal con oxígeno, se le denomina Anhídrido. Ejemplo: Nombre Genérico: Anhídrido Nombre específico: Es del elemento no metálico con prefijos y sufijos que indique su valencia positiva, según el cuadro siguiente: Valencia del no metal 1ó 2 Nombre del anhídrido Hipo Oso 3ó 4 Oso 5ó 6 Ico 7 per Ico Cl 2 O 5 Sistema Clásico: Anhídrido clórico Sistema Estequiométrico: pentaóxido de dicloro Sistema Stock: Óxido de cloro V 14
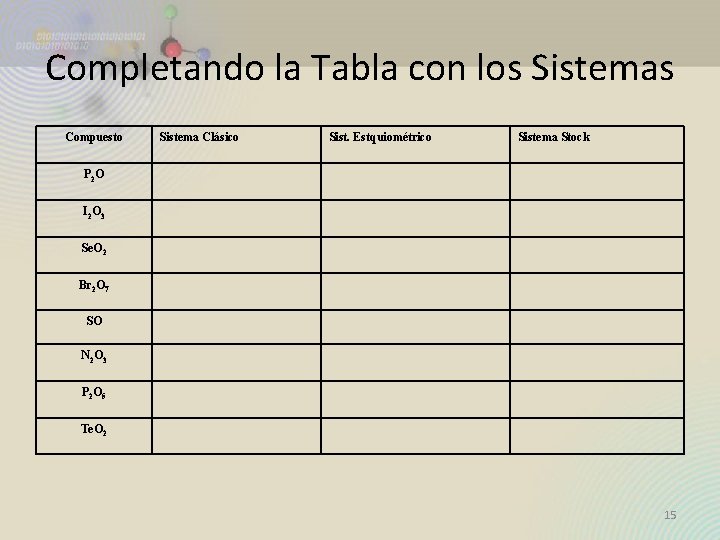
Completando la Tabla con los Sistemas Compuesto Sistema Clásico Sist. Estquiométrico Sistema Stock P 2 O I 2 O 3 Se. O 2 Br 2 O 7 SO N 2 O 3 P 2 O 5 Te. O 2 15
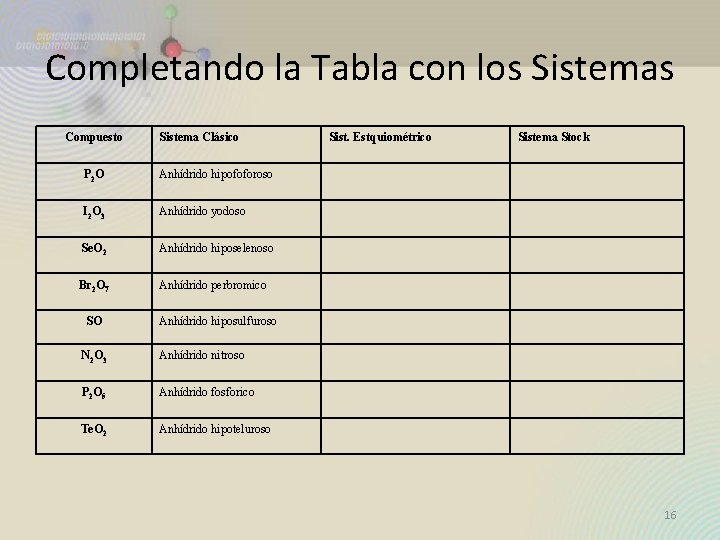
Completando la Tabla con los Sistemas Compuesto Sistema Clásico P 2 O Anhídrido hipofoforoso I 2 O 3 Anhídrido yodoso Se. O 2 Anhídrido hiposelenoso Br 2 O 7 Anhídrido perbromico SO Sist. Estquiométrico Sistema Stock Anhídrido hiposulfuroso N 2 O 3 Anhídrido nitroso P 2 O 5 Anhídrido fosforico Te. O 2 Anhídrido hipoteluroso 16
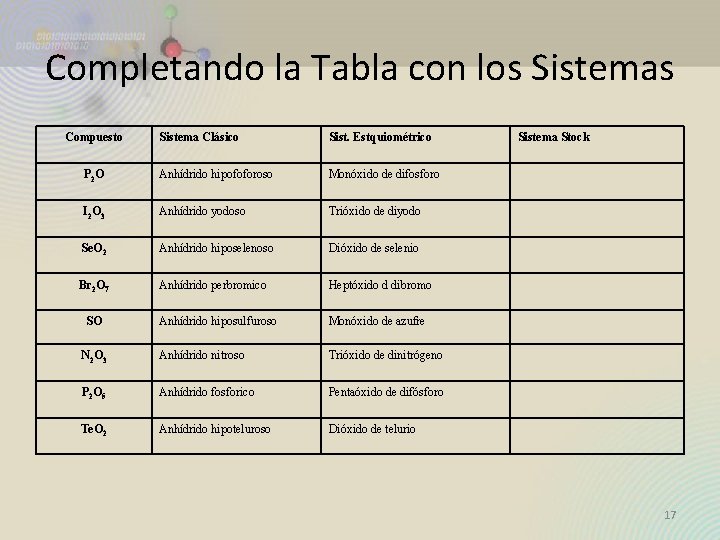
Completando la Tabla con los Sistemas Compuesto Sistema Clásico Sist. Estquiométrico P 2 O Anhídrido hipofoforoso Monóxido de difosforo I 2 O 3 Anhídrido yodoso Trióxido de diyodo Se. O 2 Anhídrido hiposelenoso Dióxido de selenio Br 2 O 7 Anhídrido perbromico Heptóxido d dibromo Anhídrido hiposulfuroso Monóxido de azufre N 2 O 3 Anhídrido nitroso Trióxido de dinitrógeno P 2 O 5 Anhídrido fosforico Pentaóxido de difósforo Te. O 2 Anhídrido hipoteluroso Dióxido de telurio SO Sistema Stock 17
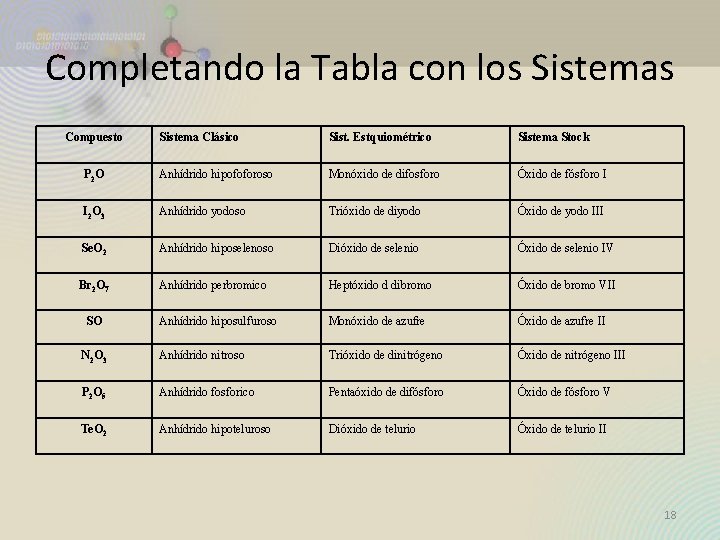
Completando la Tabla con los Sistemas Compuesto Sistema Clásico Sist. Estquiométrico Sistema Stock P 2 O Anhídrido hipofoforoso Monóxido de difosforo Óxido de fósforo I I 2 O 3 Anhídrido yodoso Trióxido de diyodo Óxido de yodo III Se. O 2 Anhídrido hiposelenoso Dióxido de selenio Óxido de selenio IV Br 2 O 7 Anhídrido perbromico Heptóxido d dibromo Óxido de bromo VII Anhídrido hiposulfuroso Monóxido de azufre Óxido de azufre II N 2 O 3 Anhídrido nitroso Trióxido de dinitrógeno Óxido de nitrógeno III P 2 O 5 Anhídrido fosforico Pentaóxido de difósforo Óxido de fósforo V Te. O 2 Anhídrido hipoteluroso Dióxido de telurio Óxido de telurio II SO 18

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Anhídrido sulfúrico Anhídrido carbonico Anhídrido periódico Trióxido de dicloro Óxido de boro III Anhídrido hipofosforoso Anhídrido nitroso Anhídrido perbromico 19

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Anhídrido sulfúrico SO 6 Anhídrido carbonico CO 6 Anhídrido periódico IO 7 Trióxido de dicloro Cl 2 O 3 Óxido de boro III Br 2 O 3 Anhídrido hipofosforoso PO Anhídrido nitroso N 2 O 3 Anhídrido perbromico Br. O 7 20

3. - Compuestos Binarios Hidruros Es la combinación de los elementos pertenecientes a los grupos I-A, II-A y III-A con el hidrógeno. Cuando el hidrógeno se combina con los metales lo hace con su valencia negativa -1 y cuando se combina con los no metales actúa con su valencia positiva +1. Ejemplo: Nombre Genérico: Hidruro Nombre específico: El del metal en genitivo o adjetivado Sistema Clásico: Li. H Hidruro de Litio El Boro, Primer elemento del grupo III-A, forma compuestos que reciben nombres especiales. El mas sencillo que se conoce es el DIBORANO, B 2 H 6 21

Completando la Tabla con los Sistemas Compuesto Sistema Clásico Na. H Be. H 2 Ca. H 2 Rb. H 22

Completando la Tabla con los Sistemas Compuesto Sistema Clásico Na. H Hidruro de Sodio Be. H 2 Hidruro de Berilio Ca. H 2 Hidruro de Calcio Rb. H Hidruro de Rubidio 23

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Hidruro de estroncio Hidruro de potasio Hidruro de magnesio 24

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Hidruro de estroncio Sr. H 2 Hidruro de potasio KH Hidruro de magnesio Mg. H 2 25

4. - Compuestos Binarios Hidrácidos Es la combinación de los elementos pertenecientes a los grupos VI-A y VIIA con hidrógeno. Ejemplo Caso 1 Nombre Genérico: Ácido Nombre específico: El del elemento no metálico terminado en HIDRÁCIDO Caso 2 Nombre Genérico: El nombre del no metal terminado en URO Nombre específico: “de hidrógeno” H 2 S Sistema Clásico: Acido sulfhídrico Sulfuro de hidrogeno 26

Completando la Tabla con los Sistemas Compuesto Sistema Clasico HCl H 2 Se HBr HI 27

Completando la Tabla con los Sistemas Compuesto Sistema Clasico HCl Acido Clorhídrico H 2 Se Acido Selhídrico HBr Acido Bromhídrico HI Acido Yodhídrico 28

Completando la Tabla con los Sistemas Compuesto Sistema Clasico HCl Acido Clorhídrico Cloruro de hidrógeno H 2 Se Acido Selhídrico Selenuro de hidrógeno HBr Acido Bromhídrico Bromuro de hidrógeno HI Acido Yodhídrico Yoduro de hidrógeno 29

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Ácido yodhidrico Ácido fluorhídrico 30

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Ácido yodhidrico HI Ácido fluorhídrico HF 31

5. - Compuestos Binarios Hidrogenados de los grupos IV-A y V-A Los elementos de estos compuestos reciben nombres especiales. Ejemplo: Grupo IV-A Grupo V-A CH 4 Metano NH 3 Amoniaco Si. H 4 Gas silano PH 3 Fosfina Ge. H 4 germano As. H 3 Arsina Sb. H 3 Estibina Bi. H 3 Bismutina BH 3 borana 32

6. - Compuestos Binarios formados por un metal y un no metal Estos compuestos resultan de la sustitución total de los hidrógenos de los hidrácidos y reciben el nombre de sales haloides neutras. Ejemplo: Nombre Genérico: El del no metal terminado en URO Nombre específico: En caso de que el metal tenga una valencia, éste se adjetiva o se pone en genitivo. Si tiene más de una valencia entonces el nombre específico terminará en OSO, cuando trabaje con la menor y en ICO cuando funcione con la mayor. Sistema Clásico: Sistema Estequiométrico: Na. Cl Cloruro de sodio ó sódico Monocloruro de sodio Fe. Cl 2 Sistema Clásico: Sistema Estequiométrico: Cloruro Ferroso Bicloruro de hierro 33
7. - Compuestos Binarios formados por dos no metales Cuando se combinan dos elementos electronegativos uno de ellos, el menos negativo, funciona como si fuese electropositivo. Ejemplo: Nombre Genérico: El del elemento más negativo terminado en URO Nombre específico: el del otro elemento en genitivo o adjetivado Sistema Clásico: Sistema Estequiométrico: As 2 S 5 Pentasulfuro de diarsenio 34

7. - Compuestos Binarios formados por dos metales Pueden darse dos casos. Ejemplo: Aleación: Nombre Genérico: Aleación Nombre específico: El nombre de los metales, mencionando primero el más electropositivo. Cu. Sn Sistema Clásico: Aleación de cobre y estaño (bronce) Amalgama Nombre Genérico: Amalgama Nombre específico: El del metal que acompaña al mercurio. Ag. Hg Sistema Clásico: Amalgama de plata (espejo) 35
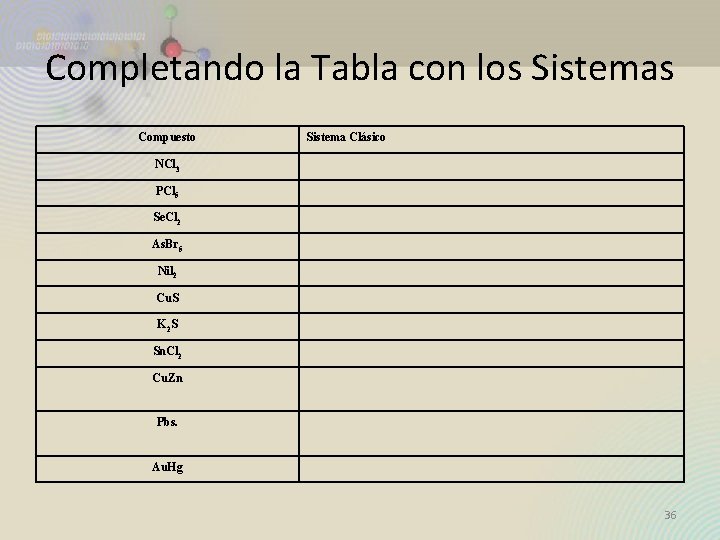
Completando la Tabla con los Sistemas Compuesto Sistema Clásico NCl 3 PCl 5 Se. Cl 2 As. Br 5 Nil 2 Cu. S K 2 S Sn. Cl 2 Cu. Zn Pbs. Au. Hg 36
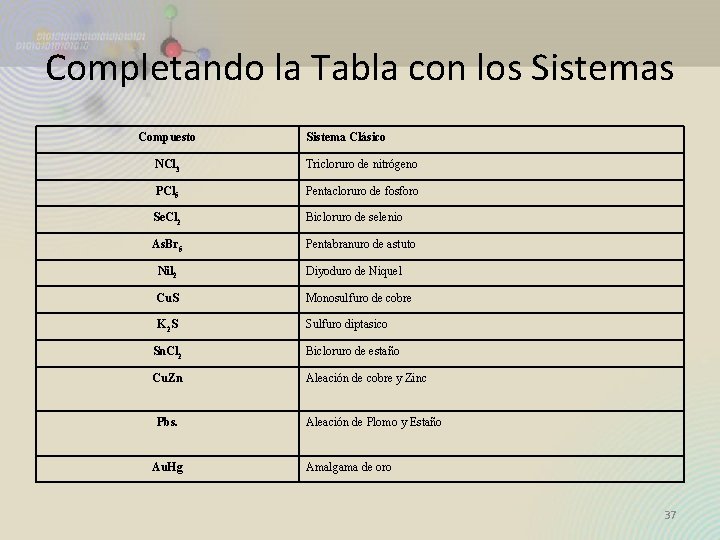
Completando la Tabla con los Sistemas Compuesto Sistema Clásico NCl 3 Tricloruro de nitrógeno PCl 5 Pentacloruro de fosforo Se. Cl 2 Bicloruro de selenio As. Br 5 Pentabranuro de astuto Nil 2 Diyoduro de Niquel Cu. S Monosulfuro de cobre K 2 S Sulfuro diptasico Sn. Cl 2 Bicloruro de estaño Cu. Zn Aleación de cobre y Zinc Pbs. Au. Hg Aleación de Plomo y Estaño Amalgama de oro 37

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Cloruro de plata Bromuro férrico Yoduro de potasio Bromuro de hidrógeno Sulfuro de hidrógeno Tricloruro de nitrógeno Bicloruro de diazubre Triyoduro de fósforo Amalgama de cadmio Aleación de cobre y zinc 38
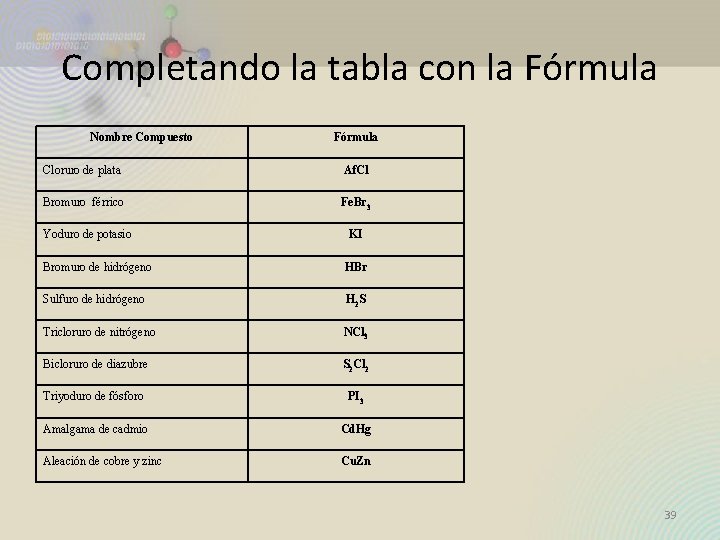
Completando la tabla con la Fórmula Nombre Compuesto Fórmula Cloruro de plata Af. Cl Bromuro férrico Fe. Br 3 Yoduro de potasio KI Bromuro de hidrógeno HBr Sulfuro de hidrógeno H 2 S Tricloruro de nitrógeno NCl 3 Bicloruro de diazubre S 2 Cl 2 Triyoduro de fósforo PI 3 Amalgama de cadmio Cd. Hg Aleación de cobre y zinc Cu. Zn 39

Compuestos Ternarios 40

1. - Hidróxidos Son sustancias que en solución contienen el ión Oxhidrilo (OH)-. Resultan de la combinación de un óxido metálico con el agua. Hidróxido = Óxido metálico + H 2 O Nombre Genérico: Hidróxido Nombre específico: Que el metal tenga una sola valencia, en este caso su nombre se pone en genitivo o se adjetiva. Que el metal tenga dos valencias, entonces su nombre terminará en OSO, cuando trabaje con la menor y en ICO cuando trabaje con la mayor. Ca. O + H 2 O -> Ca. O 2 H 2 -> Ca(OH)2 Hidróxido de calcio o calcico 41

Reacción y Nombre Compuesto Reacción Nombre KOH Au. OH Mg(OH)2 42

Reacción y Nombre Compuesto Reacción KOH K 2 O + H 2 O -> K 2 O 2 H 2 -> K(OH)2 Au. OH Au 2 OH + H 2 O -> Au 2 O 2 H 2 -> Au(OH)2 Mg 2 + H 2 O -> Mg 2 O 2 H 2 -> Mg(OH)2 Nombre 43

Reacción y Nombre Compuesto Reacción Nombre KOH K 2 O + H 2 O -> K 2 O 2 H 2 -> K(OH)2 Hidróxido de potasio Au. OH Au 2 OH + H 2 O -> Au 2 O 2 H 2 -> Au(OH)2 Hidróxido de Oro Mg(OH)2 Mg 2 + H 2 O -> Mg 2 O 2 H 2 -> Mg(OH)2 Hidróxido de Magnesio 44

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Hidróxido de cadmio Hidróxido cobaltito Hidróxido Aurico Hidróxido de platino II Hidróxido crómico Hidróxido de aluminio Hidróxido de plomo II Hidróxido estáñico Hidróxido cruproso 45

Completando la tabla con la Fórmula Nombre Compuesto Fórmula Hidróxido de cadmio Cd(OH)2 Hidróxido cobaltito Co(OH)3 Hidróxido Aurico Au(OH)3 Hidróxido de platino II Pt(OH)2 Hidróxido crómico Cr(OH)6 Hidróxido de aluminio Al(OH)3 Hidróxido de plomo II Pb(OH)2 Hidróxido estáñico Sn(OH)4 Hidróxido cruproso Cu(OH) 46
- Slides: 46