Nomenclatua degli Idrocarburi Alcani ALCANI n Gli alcani

Nomenclatua degli Idrocarburi Alcani

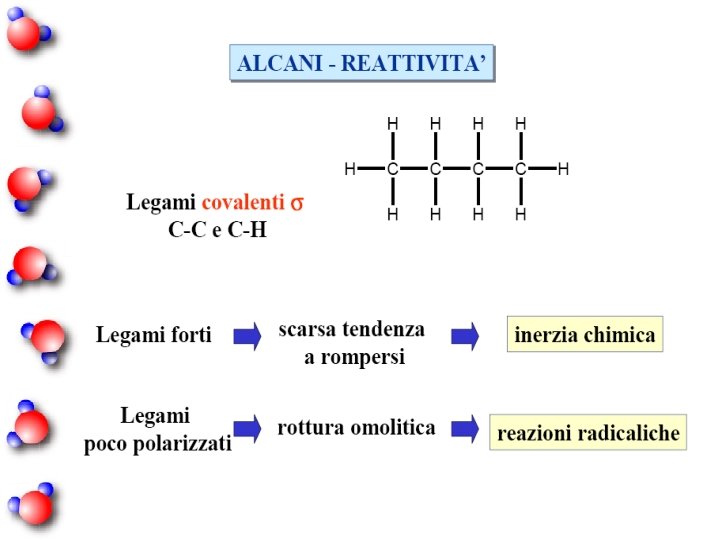
ALCANI n Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (e per questo appartenenti alla più ampia classe degli idrocarburi) aventi formula bruta Cn H 2 n + 2 n Noti anche come "paraffine" (dal latino parum affinis) a causa della loro scarsa reattività in condizioni normali.

n A temperatura e pressione ambiente i più leggeri tra loro (fino a 4 atomi di carbonio) sono gassosi, sono liquidi incolori quelli aventi da 5 a 16 atomi di carbonio, sono solidi cerosi quelli più pesanti. n Gli alcani, soprattutto i più leggeri, vengono largamente impiegati come carburanti per via dell'elevata entalpia di combustione per unità di massa, della notevole inerzia chimica e dell'abbondante - ma non illimitata disponibilità sulla Terra.

REGOLE IUPAC nomenclatura sistematica I nternational U nion of P ure and A pplied C hemistry

CARATTERISTICHE DELLA NOMENCLATURA IUPAC È un sistema nel quale ogni composto ha un suo nome. Seguendo le regole, chiunque assegna il medesimo nome a un dato composto. Viceversa, dato il nome di un composto, ognuno è in grado di disegnare il composto. STRUTTURA IUPAC NOME

Modelli molecolari Sferette e bastoncini Stuart-Briegleb

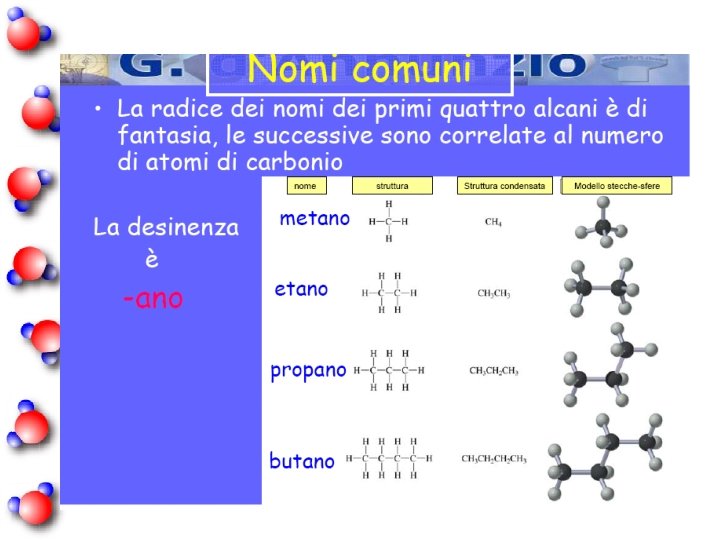
Alcani a catena lineare C 1 metano C 2 etano C 3 propano C 4 butano C 5 pentano C 6 esano C 7 eptano C 8 ottano C 9 nonano C 10 decano

Che nome ha il seguente composto? pentano
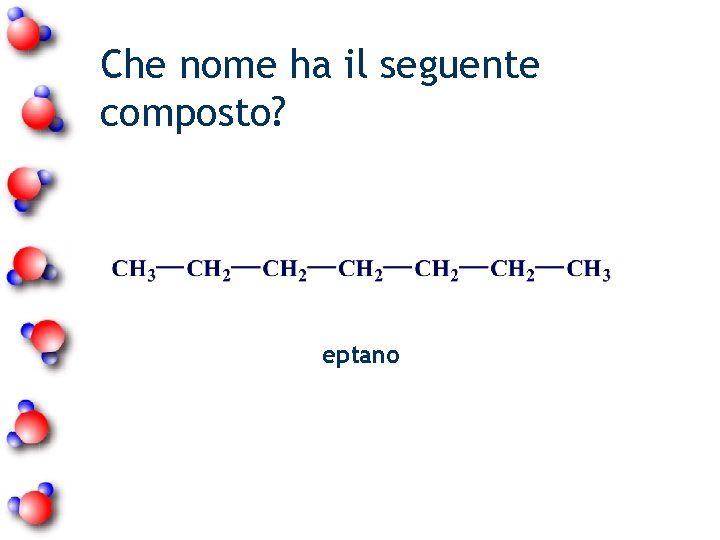
Che nome ha il seguente composto? eptano
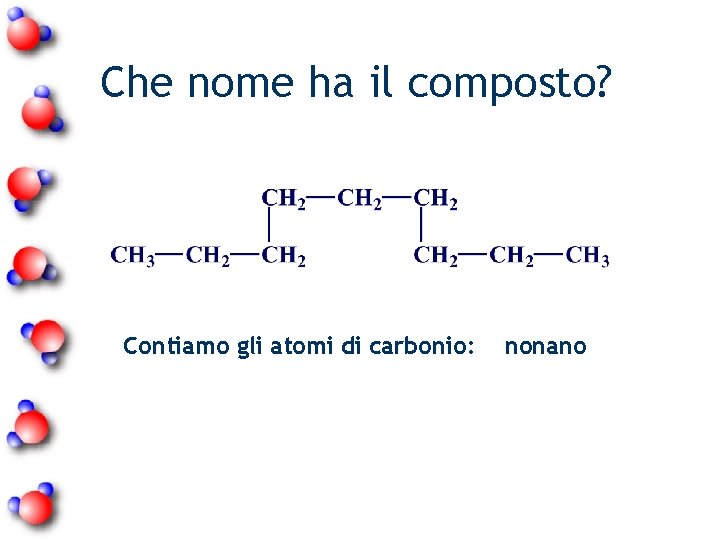
Che nome ha il composto? Contiamo gli atomi di carbonio: nonano

Alcani a catena ramificata n Gli alcani a catena ramificata presentano dei sostituenti che vanno a sostituire atomi di idrogeno nella catena lineare. n Questi sostituenti sono detti radicali (o gruppi ) alchilici. Radicali alchilici
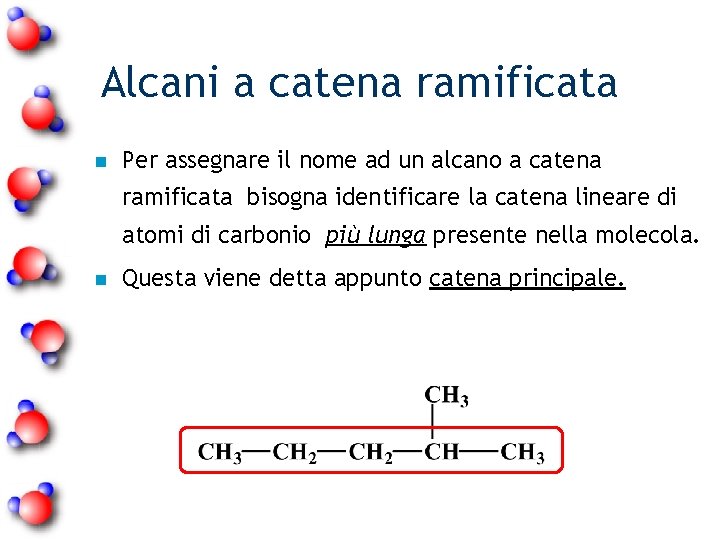
Alcani a catena ramificata n Per assegnare il nome ad un alcano a catena ramificata bisogna identificare la catena lineare di atomi di carbonio più lunga presente nella molecola. n Questa viene detta appunto catena principale.
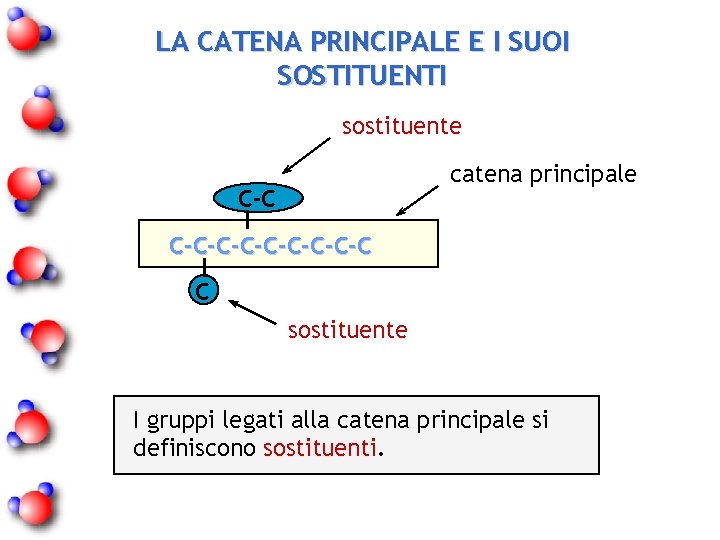
LA CATENA PRINCIPALE E I SUOI SOSTITUENTI sostituente catena principale C-C-C-C-C-C C sostituente I gruppi legati alla catena principale si definiscono sostituenti.
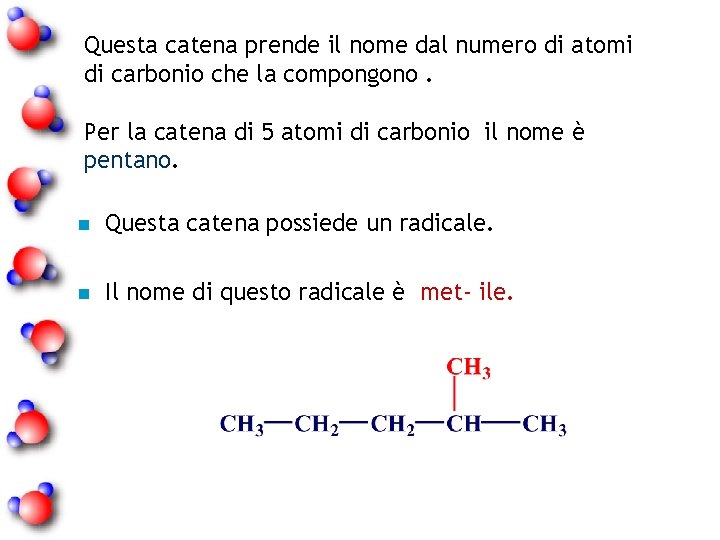
Questa catena prende il nome dal numero di atomi di carbonio che la compongono. Per la catena di 5 atomi di carbonio il nome è pentano. n Questa catena possiede un radicale. n Il nome di questo radicale è met- ile.
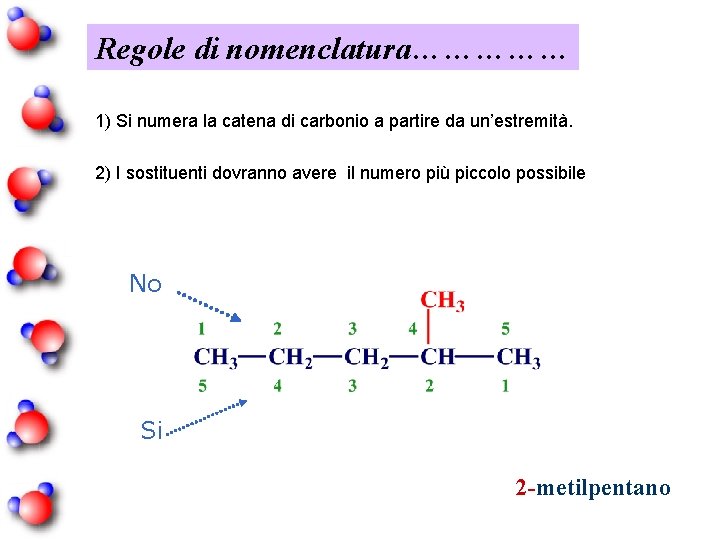
Regole di nomenclatura…………… 1) Si numera la catena di carbonio a partire da un’estremità. 2) I sostituenti dovranno avere il numero più piccolo possibile No Si 2 -metilpentano
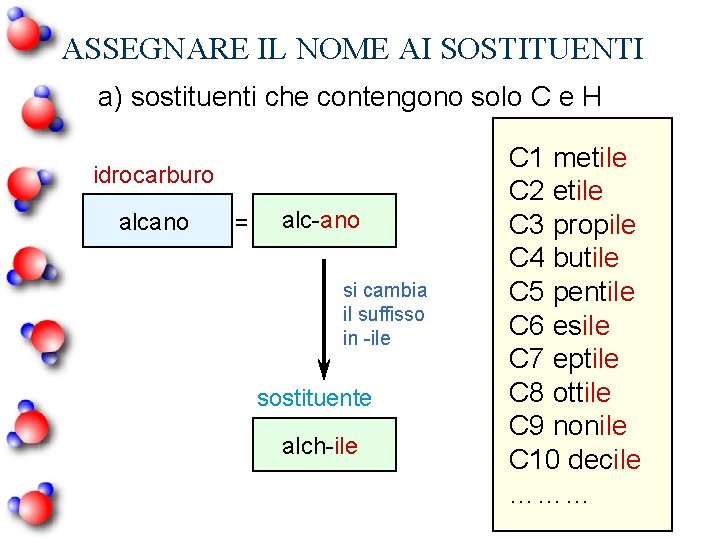
ASSEGNARE IL NOME AI SOSTITUENTI a) sostituenti che contengono solo C e H idrocarburo alcano = alc-ano si cambia il suffisso in -ile sostituente alch-ile C 1 metile C 2 etile C 3 propile C 4 butile C 5 pentile C 6 esile C 7 eptile C 8 ottile C 9 nonile C 10 decile ………

Diamo il nome al seguente composto …. .
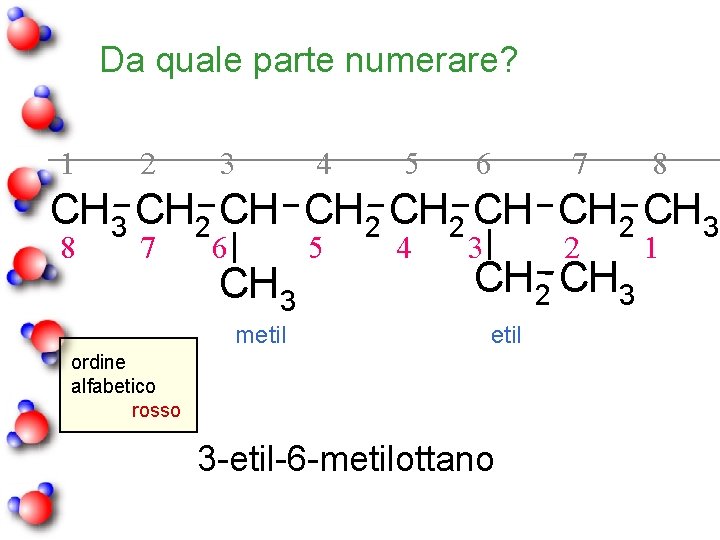
Da quale parte numerare? 1 2 3 4 5 6 7 8 CH 3 CH 2 CH 3 8 7 6 5 4 3 2 1 CH 3 metil CH 2 CH 3 etil ordine alfabetico rosso 3 -etil-6 -metilottano
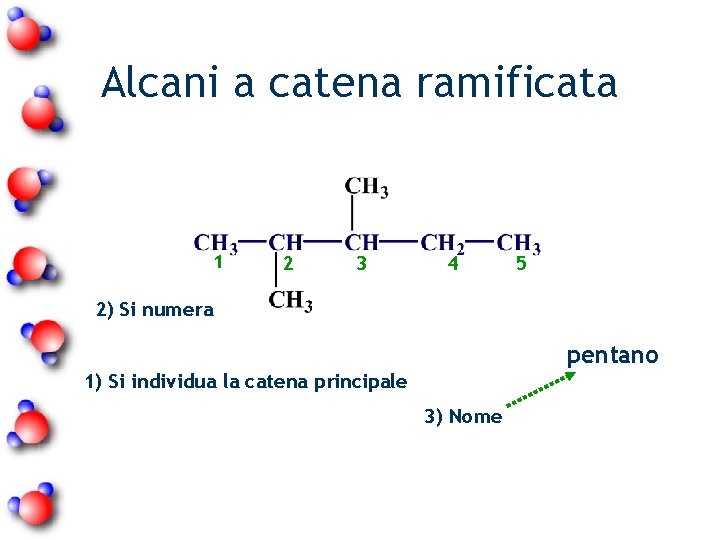
Alcani a catena ramificata 1 2 3 4 5 2) Si numera pentano 1) Si individua la catena principale 3) Nome

Alcani a catena ramificata Metil 4) Si individuano i gruppi sostituenti n 2, 3 dimetilpentano Quando vi sono più sostituenti identici, si utilizzano i prefissi di, tri o tetra per indicare il numero dei gruppi alchilici uguali.

Alcani a catena ramificata 2, 3 -dimetilpentano 6) Si assegna la posizione ai radicali n Il numero delle cifre posizione deve corrispondere sempre al numero di radicali.
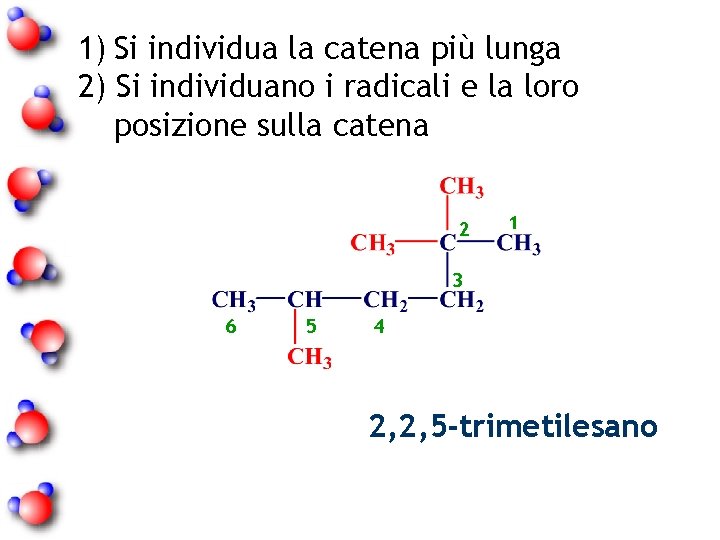
1) Si individua la catena più lunga 2) Si individuano i radicali e la loro posizione sulla catena 2 1 3 6 5 4 2, 2, 5 -trimetilesano
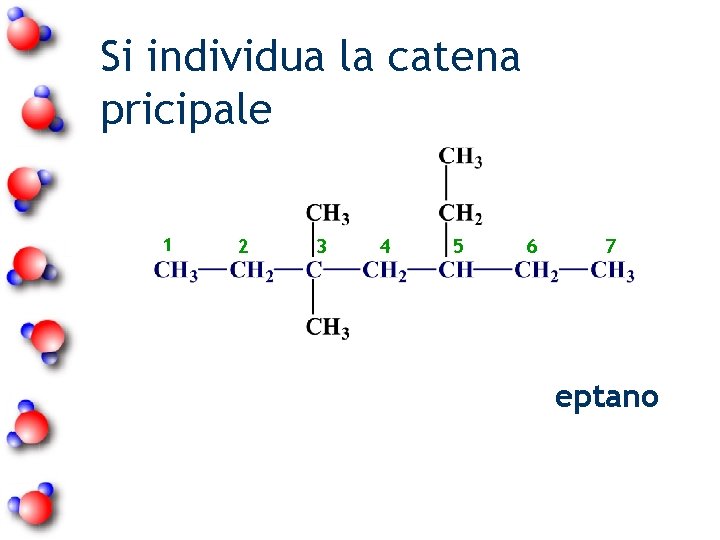
Si individua la catena pricipale 1 2 3 4 5 6 7 eptano

etil metil 1 2 3 4 5 6 7 5 -etil-3, 3 -dimetileptano n n Si individua la posizione dei radicali Si scrivono i radicali in ordine alfabetico.
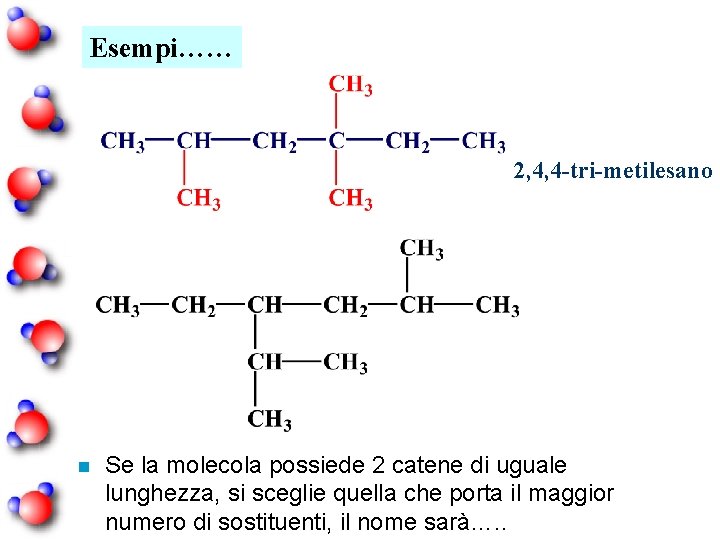
Esempi…… 2, 4, 4 -tri-metilesano n Se la molecola possiede 2 catene di uguale lunghezza, si sceglie quella che porta il maggior numero di sostituenti, il nome sarà…. .
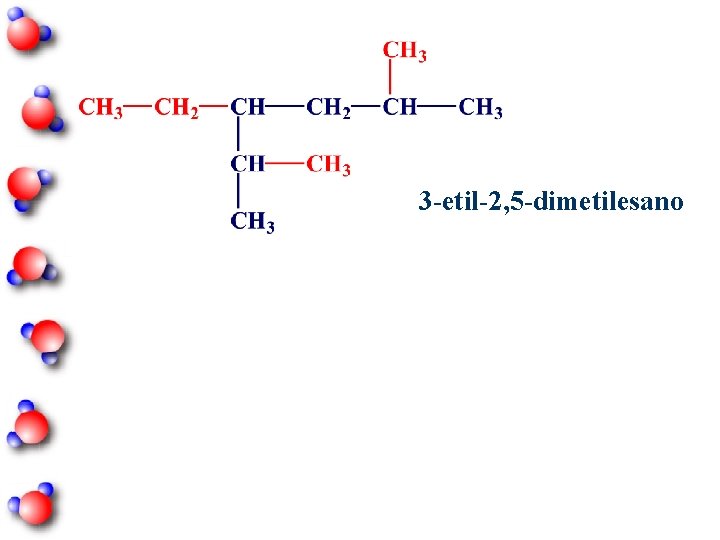
3 -etil-2, 5 -dimetilesano

RENDERE MASSIMO IL NUMERO DI SOSTITUENTI QUANDO SONO POSSIBILI PIÙ CATENE DELLA STESSA LUNGHEZZA: SCEGLIERE LA CATENA CON IL MAGGIOR NUMERO DI SOSTITUENTI Ciò eviterà l’uso di gruppi speciali a favore di gruppi più semplici ….

Scrivere la formula di struttura del 2, 2, 4 trimetil-pentano MULTIPLI DITRITETRAPENTAESAEPTAOTTANONADECA-
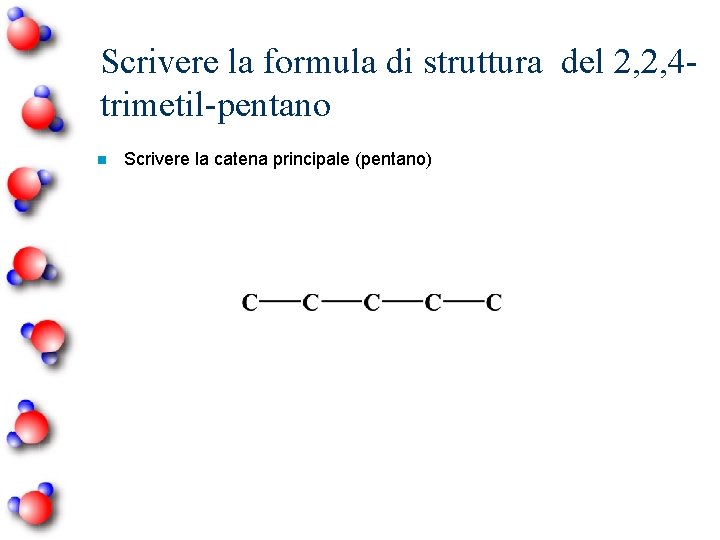
Scrivere la formula di struttura del 2, 2, 4 trimetil-pentano n Scrivere la catena principale (pentano)
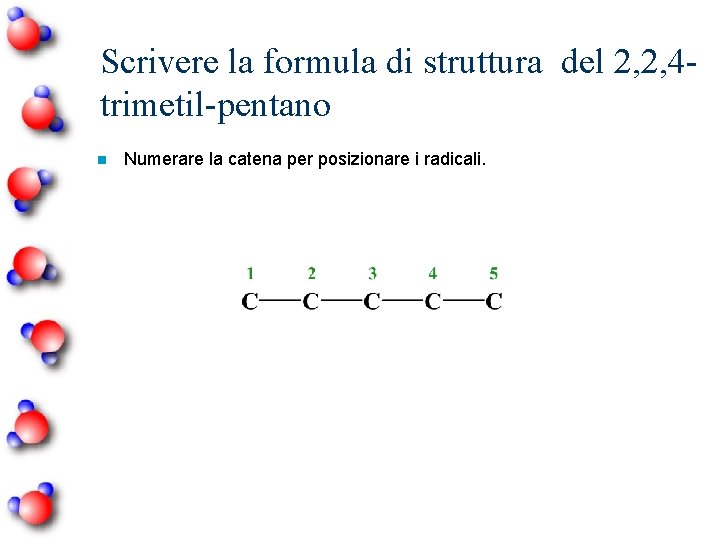
Scrivere la formula di struttura del 2, 2, 4 trimetil-pentano n Numerare la catena per posizionare i radicali.
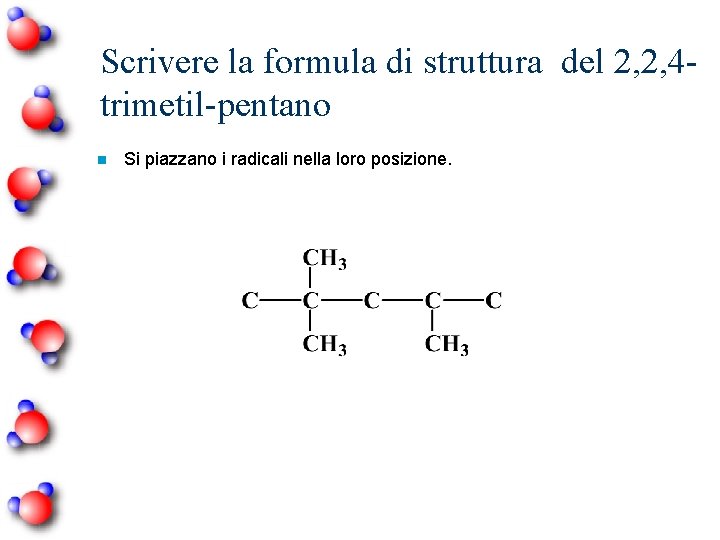
Scrivere la formula di struttura del 2, 2, 4 trimetil-pentano n Si piazzano i radicali nella loro posizione.

Scrivere la formula di struttura del 2, 2, 4 trimetil-pentano n Aggiungere gli atomi di H che mancano.

ALCUNE COSE DA RICORDARE 1 Il nome base usa sempre la catena più lunga 2 Numerare dalla fine più vicina al primo sostituente 3 I gruppi si scrivono in ordine alfabetico 4 Nell’alfabetizzazione i multipli sono ignorati dietil = e 5 Carboni disostituiti (due gruppi) sono più importanti dei monosostituiti (un gruppo) 6 I numeri sono separati dai numeri da virgole 2, 3 7 I numeri sono separati dalle parole da trattini 3 -etil 8 L’ultimo sostituente e la radice non sono separati … metilesano 9 I nomi non iniziano per lettera maiuscola se non a inizio di frase a, b, c…. .

ESEMPI 2 -metilbutano 3 -metilpentano 4 -etileptano
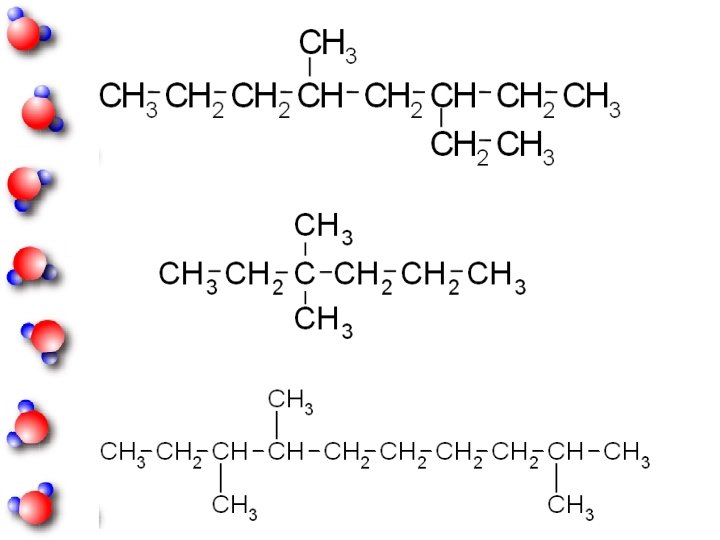
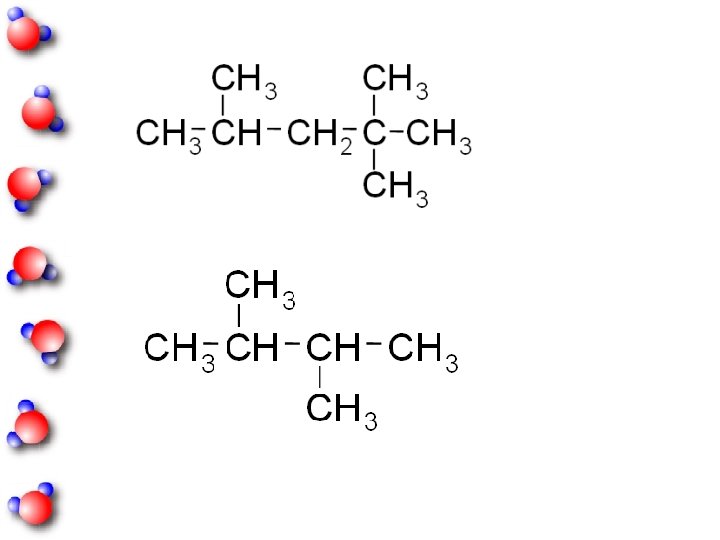


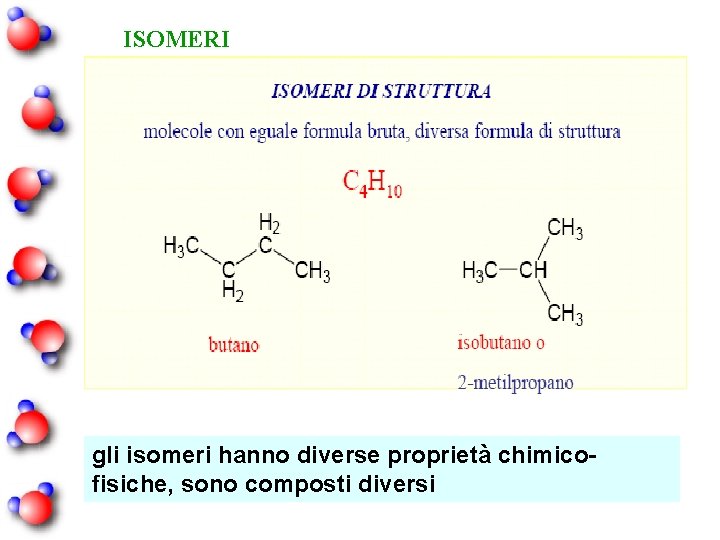
ISOMERI gli isomeri hanno diverse proprietà chimicofisiche, sono composti diversi
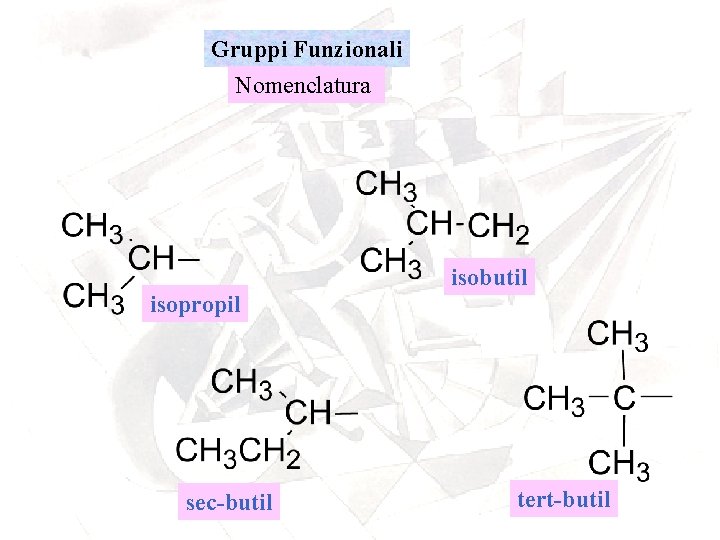
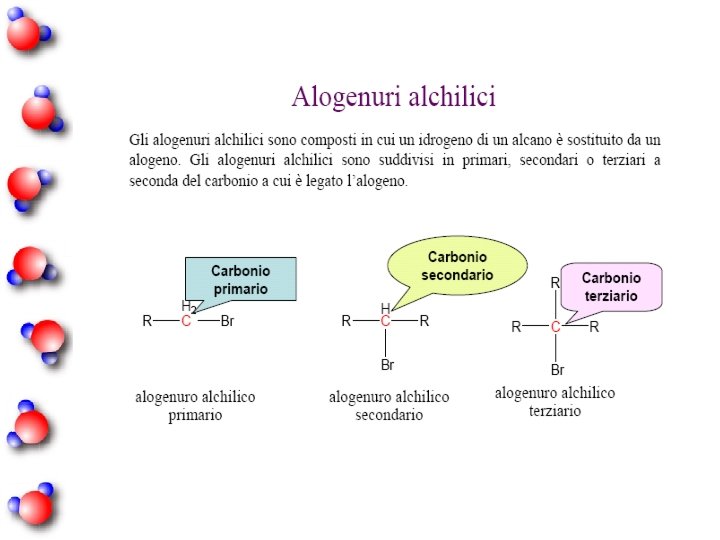
Gruppi Funzionali Nomenclatura isobutil isopropil sec-butil tert-butil





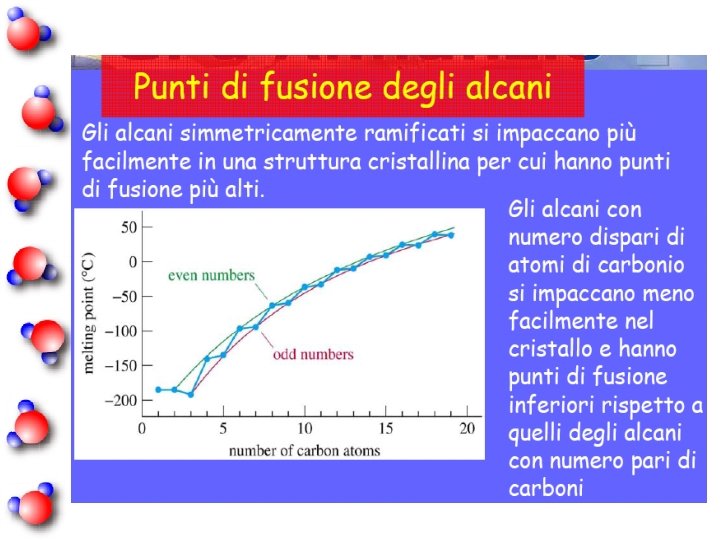
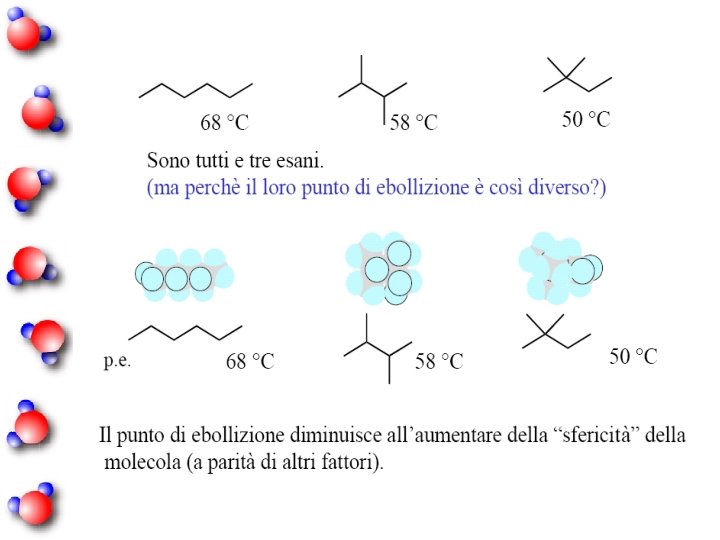



Poichè tutti i legami covalenti presenti nella molecola di reagente vengono rotti, la quantità di calore liberato dipende dal numero e dalla forza di questi legami.
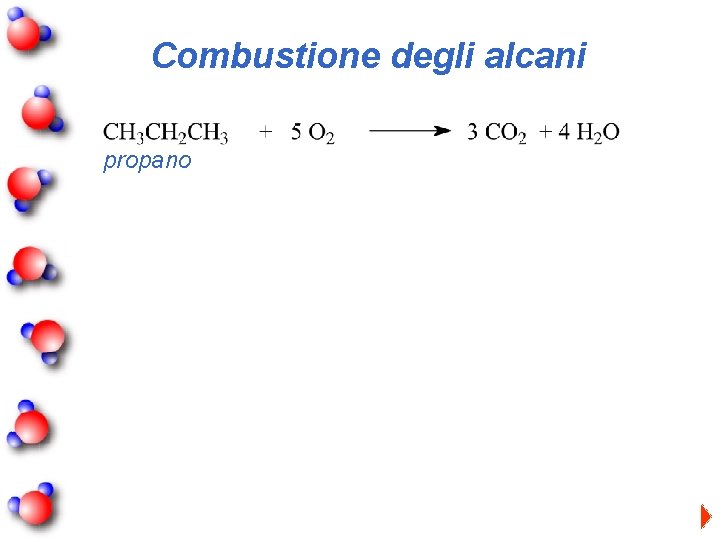
Combustione degli alcani propano

Combustione degli alcani Ossigeno in eccesso: CH 4 + 2 O 2 CO 2 + 2 H 2 O Ossigeno in difetto: 3 CH 4 + O 2 CO + 2 H 2 O 2 CH 4 + O 2 + H 2 O metanale
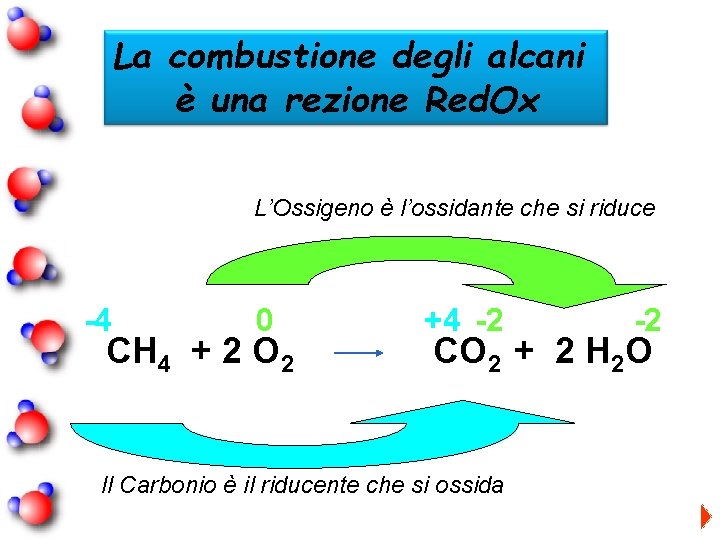
La combustione degli alcani è una rezione Red. Ox L’Ossigeno è l’ossidante che si riduce -4 0 CH 4 + 2 O 2 +4 -2 -2 CO 2 + 2 H 2 O Il Carbonio è il riducente che si ossida
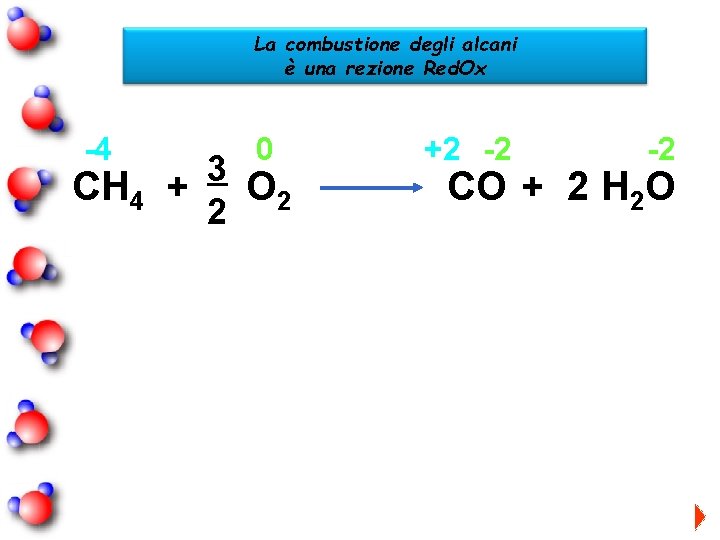
La combustione degli alcani è una rezione Red. Ox -4 CH 4 -4 0 +2 -2 3 + O 2 2 0 CH 4 + O 2 -2 CO + 2 H 2 O +1 H 0 C metanale +1 H -2 + H 2 O O -2

Alogenazione: CH 4 + Cl 2 + energia ___> CH 3 Cl + HCl 1. La reattività degli alogeni decresce nell'ordine : F 2 > Cl 2 > Br 2 > I 2. In pratica il Fluoro è così reattivo che la reazione è esplosiva mentre generalmente lo iodio non reagisce affatto. 3. Per iniziare la clorurazione e la bromurazione in genere è necessario fornire inizialmente energia sotto forma di calore o luce. 5. La presenza di ossigeno (o di altri radical trap) inibisce la reazione, i perossidi favoriscono la reazione.
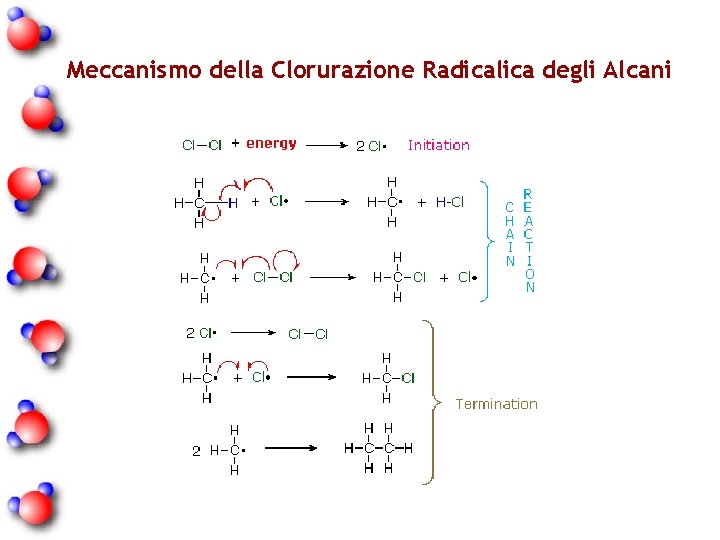
Meccanismo della Clorurazione Radicalica degli Alcani

Meccanismo della Bromurazione Radicalica
- Slides: 60