No hay nada en la vida que no















































- Slides: 86

“No hay nada en la vida que no contenga sus lecciones. Si estás vivo, siempre tendrás algo para aprender” Benjamín Franklin. TECNOVIGILANCIA EXPERIENCIAS EN COLOMBIA Elkin Hernán Otálvaro Cifuentes Director de Dispositivos Médicos y Otras Tecnologías Invima Mukoil Ahmed Romanos Zapata Coordinador Grupo de Tecnovigilancia Reunión Técnica Internacional de los Centros de Referencia Regionales e Institucionales de Farmacovigilancia y Tecnovigilancia Lima – Bogotá, 15 de Noviembre de 2017

GRUPO DE TECNOVIGILANCIA Carolina Moreno Trujillo Ingeniera Biomédica Especialista en Auditoría y Garantía de la Calidad en Salud Lizzy Catherine Castañeda Ingeniera Biomédica Especialista en Gerencia de Calidad y Auditoria en Salud Coordinador del Grupo de Tecnovigilancia Mukoil Ahmed Romanos Zapata Ingeniero Biomédico Especialista en Gerencia de Proyectos Master en Dirección y Administración de Empresas 7 PROFESIONALES Lideres en Gestión de Eventos e Incidentes Adversos Asociados a Dispositivos Médicos Jaime Orlando Ávila Ingeniero Biomédico Especialista en Auditoría en Salud Líder en gestión y análisis de alertas, informes de seguridad y retiros del producto del mercado de Dispositivos Médicos Pedro Alexander Gutierrez Ingeniero Electromecánico Especialista en Gestión de Productividad y Calidad Líder de Educación Sanitaria y Facilitador de Calidad de la Dirección María Victoria Urrea Duque Ingeniera Química Especialista en Gerencia de Calidad Líder del Aula Virtual y Señalización de Dispositivos Médicos Erick Dussan Valencia Tecnólogo en Mantenimiento de Equipos Biomédicos Estudiante 8°Semestre de Ingeniería Biomédica Líder de la Red Nacional de Tecnovigilancia Implementación de Sistemas de Gestión de Riesgo Clínico Metodologías de Análisis de Eventos Adversos y Tutores Virtuales

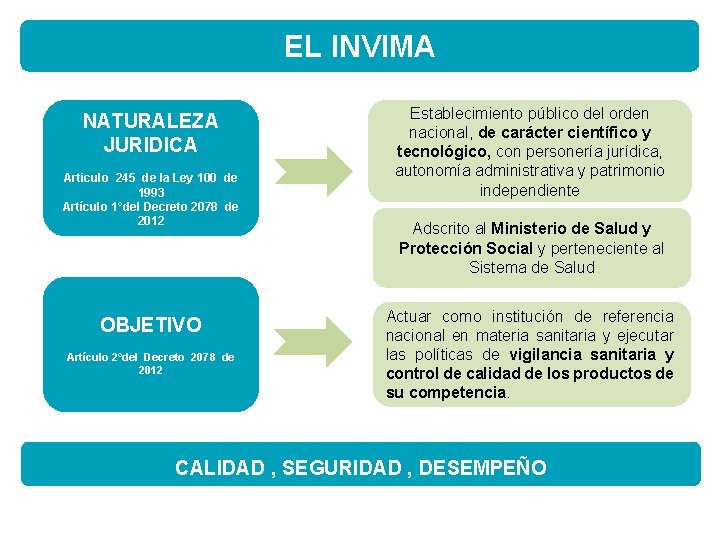
EL INVIMA NATURALEZA JURIDICA Articulo 245 de la Ley 100 de 1993 Artículo 1°del Decreto 2078 de 2012 OBJETIVO Artículo 2°del Decreto 2078 de 2012 Establecimiento público del orden nacional, de carácter científico y tecnológico, con personería jurídica, autonomía administrativa y patrimonio independiente Adscrito al Ministerio de Salud y Protección Social y perteneciente al Sistema de Salud Actuar como institución de referencia nacional en materia sanitaria y ejecutar las políticas de vigilancia sanitaria y control de calidad de los productos de su competencia. CALIDAD , SEGURIDAD , DESEMPEÑO

MARCO ESTRATÉGICO MISIÓN Proteger y promover la salud de la población, mediante la gestión del riesgo asociada al consumo y uso de alimentos, medicamentos, dispositivos médicos y otros productos objeto de vigilancia sanitaria. VISIÓN Afianzar el reconocimiento nacional e internacional del INVIMA como líder articulador, referente y regulador en la vigilancia sanitaria con enfoque de riesgo, comprometido con la excelencia en el servicio, eficacia técnico- científica y los mejores estándares tecnológicos, generando confianza, seguridad y calidad de vida a la población.

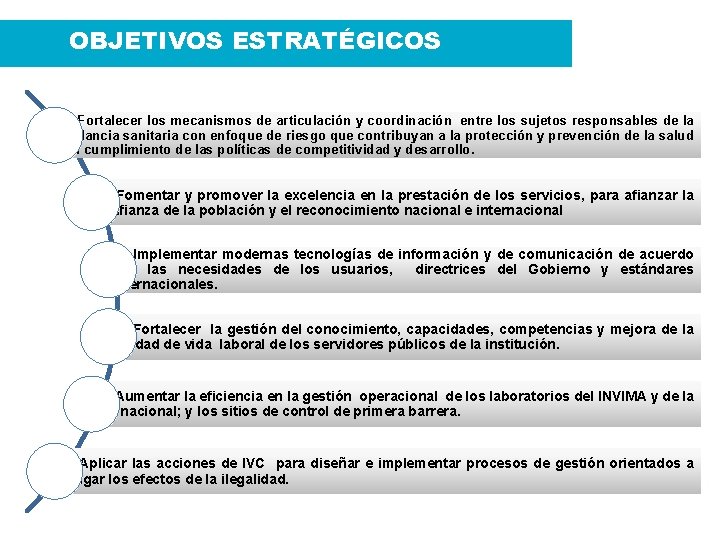
OBJETIVOS ESTRATÉGICOS 1. - Fortalecer los mecanismos de articulación y coordinación entre los sujetos responsables de la vigilancia sanitaria con enfoque de riesgo que contribuyan a la protección y prevención de la salud y al cumplimiento de las políticas de competitividad y desarrollo. 2. - Fomentar y promover la excelencia en la prestación de los servicios, para afianzar la confianza de la población y el reconocimiento nacional e internacional 3. - Implementar modernas tecnologías de información y de comunicación de acuerdo con las necesidades de los usuarios, directrices del Gobierno y estándares internacionales. 4. - Fortalecer la gestión del conocimiento, capacidades, competencias y mejora de la calidad de vida laboral de los servidores públicos de la institución. 5. - Aumentar la eficiencia en la gestión operacional de los laboratorios del INVIMA y de la red nacional; y los sitios de control de primera barrera. 6. - Aplicar las acciones de IVC para diseñar e implementar procesos de gestión orientados a mitigar los efectos de la ilegalidad.

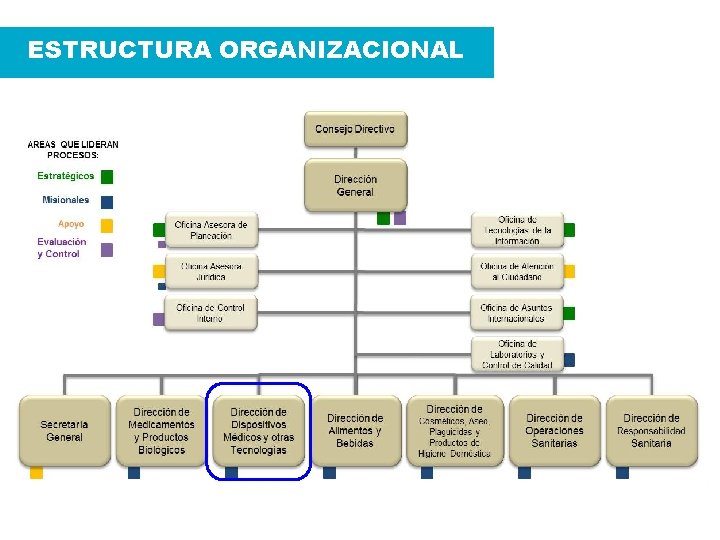
ESTRUCTURA ORGANIZACIONAL Decreto 2078 de 20012 Capitulo III y IV

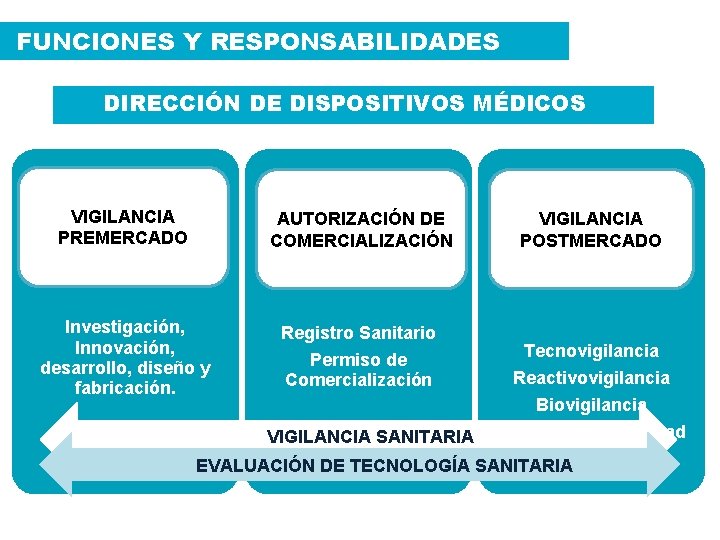
FUNCIONES Y RESPONSABILIDADES DIRECCIÓN DE DISPOSITIVOS MÉDICOS VIGILANCIA PREMERCADO AUTORIZACIÓN DE COMERCIALIZACIÓN Investigación, Innovación, desarrollo, diseño y fabricación. Registro Sanitario Permiso de Comercialización VIGILANCIA POSTMERCADO Tecnovigilancia Reactivovigilancia Biovigilancia Demuestra La Calidad EVALUACIÓN DE TECNOLOGÍA SANITARIA VIGILANCIA SANITARIA

PRODUCTOS COMPETENCIA DISPOSITIVOS MÉDICOS (ESTÁNDAR, SOBRE MEDIDA) REACTIVOS DE DIAGNÓSTICO IN VITRO BANCOS DE TEJIDOS UNIDADES DE BIOMEDICINA REPRODUCTIVA

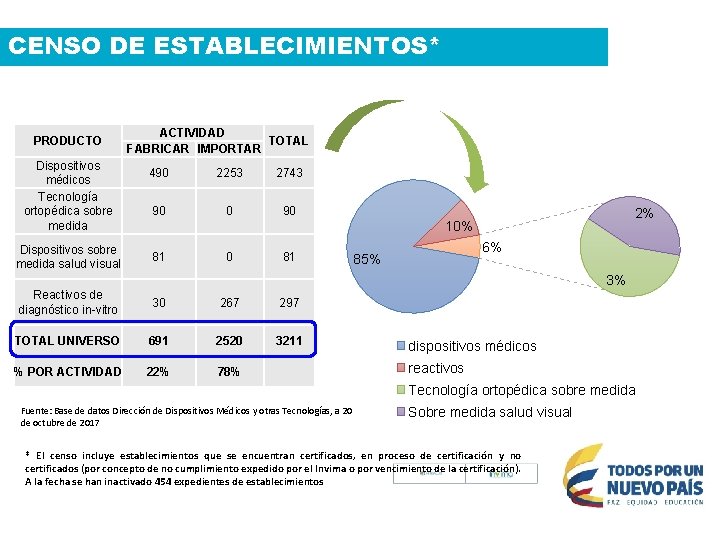
CENSO DE ESTABLECIMIENTOS* PRODUCTO Dispositivos médicos Tecnología ortopédica sobre medida Dispositivos sobre medida salud visual ACTIVIDAD TOTAL FABRICAR IMPORTAR 490 2253 2743 90 0 90 2% 10% 81 0 81 6% 85% 3% Reactivos de diagnóstico in-vitro 30 267 297 TOTAL UNIVERSO 691 2520 3211 % POR ACTIVIDAD 22% 78% dispositivos médicos reactivos Tecnología ortopédica sobre medida Fuente: Base de datos Dirección de Dispositivos Médicos y otras Tecnologías, a 20 de octubre de 2017 Sobre medida salud visual * El censo incluye establecimientos que se encuentran certificados, en proceso de certificación y no certificados (por concepto de no cumplimiento expedido por el Invima o por vencimiento de la certificación). A la fecha se han inactivado 454 expedientes de establecimientos

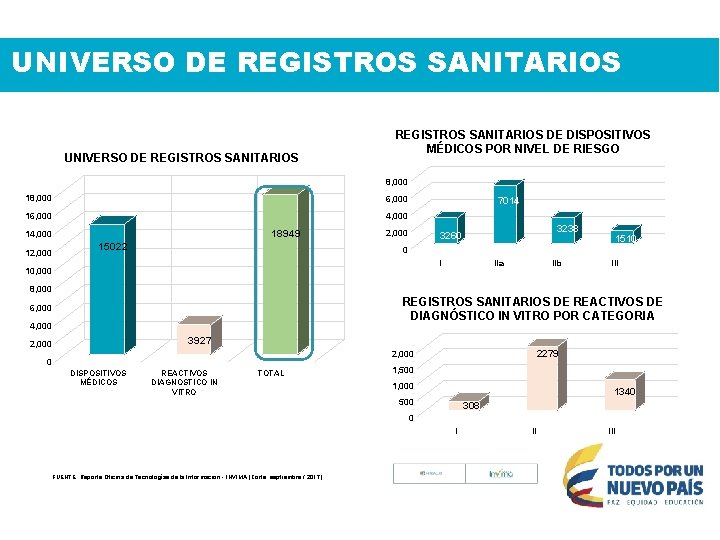
UNIVERSO DE REGISTROS SANITARIOS DE DISPOSITIVOS MÉDICOS POR NIVEL DE RIESGO 8, 000 18, 000 6, 000 16, 000 4, 000 18949 14, 000 12, 000 15022 7014 2, 000 3238 3260 1510 0 I 10, 000 IIa IIb III 8, 000 REGISTROS SANITARIOS DE REACTIVOS DE DIAGNÓSTICO IN VITRO POR CATEGORIA 6, 000 4, 000 3927 2, 000 2279 2, 000 0 DISPOSITIVOS MÉDICOS REACTIVOS DIAGNOSTICO IN VITRO TOTAL 1, 500 1, 000 1340 500 308 0 I FUENTE: Reporte Oficina de Tecnologías de la Información - INVIMA (Corte septiembre / 2017) II III

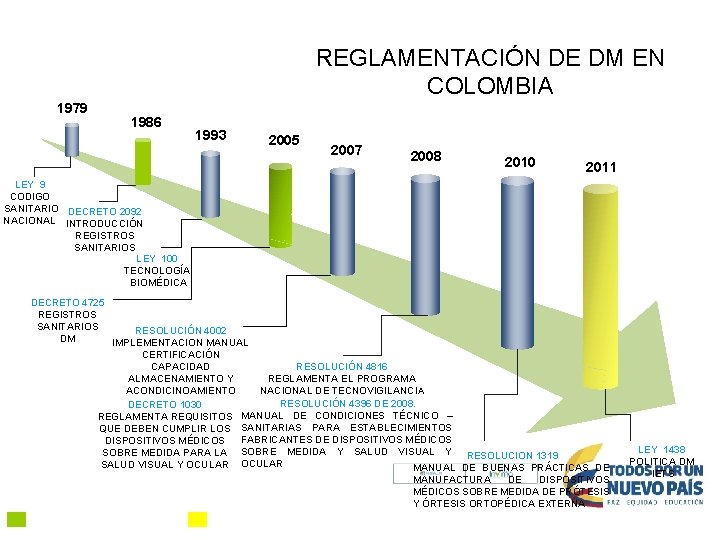
REGLAMENTACIÓN DE DM EN COLOMBIA 1979 1986 1993 2005 2007 2008 2010 2011 LEY 9 CODIGO SANITARIO DECRETO 2092 NACIONAL INTRODUCCIÓN REGISTROS SANITARIOS LEY 100 TECNOLOGÍA BIOMÉDICA DECRETO 4725 REGISTROS SANITARIOS RESOLUCIÓN 4002 DM IMPLEMENTACION MANUAL CERTIFICACIÓN CAPACIDAD RESOLUCIÓN 4816 ALMACENAMIENTO Y REGLAMENTA EL PROGRAMA ACONDICINOAMIENTO NACIONAL DE TECNOVIGILANCIA RESOLUCIÓN 4396 DE 2008. DECRETO 1030 MANUAL DE CONDICIONES TÉCNICO – REGLAMENTA REQUISITOS SANITARIAS PARA ESTABLECIMIENTOS QUE DEBEN CUMPLIR LOS FABRICANTES DE DISPOSITIVOS MÉDICOS SOBRE MEDIDA PARA LA SOBRE MEDIDA Y SALUD VISUAL Y RESOLUCION 1319 SALUD VISUAL Y OCULAR MANUAL DE BUENAS PRÁCTICAS DE MANUFACTURA DE DISPOSITIVOS MÉDICOS SOBRE MEDIDA DE PRÓTESIS Y ÓRTESIS ORTOPÉDICA EXTERNA. Avance trascendental El país requiere de una Política Nacional de DM LEY 1438 POLITICA DM IETS

CONCEPTO DE DISPOSITIVOS MÉDICOS EN NUESTRA NORMATIVIDAD Decreto 4725 de 2005 DISPOSITIVO MÉDICO PARA USO HUMANO Cualquier instrumento, aparato, máquina, software, equipo biomédico u otro artículo similar o relacionado, utilizado solo o en combinación, incluyendo sus componentes, partes, accesorios y programas informáticos que intervengan en su correcta aplicación propuesta por el fabricante para su uso en:

CONCEPTO DE DISPOSITIVOS MÉDICOS EN NUESTRA NORMATIVIDAD v v v Diagnóstico, prevención, tratamiento, alivio de una enfermedad o compensación de una lesión o de una deficiencia Investigación, sustitución, modificación o soporte de la estructura anatómica o de un proceso fisiológico Diagnóstico del embarazo y control de la concepción Cuidado durante el embarazo, el nacimiento o después del mismo, incluyendo el cuidado del recién nacido Productos para desinfección y/o esterilización de dispositivos médicos. Los dispositivos médicos para uso humano no deberán ejercer la acción principal que se desea por medios farmacológicos, inmunológicos o metabólicos.

¿POR QUÉ SE VIGILA?

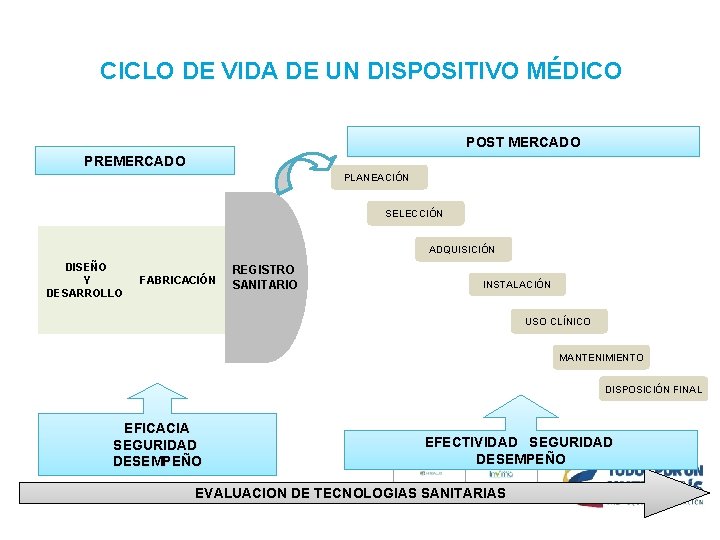
CICLO DE VIDA DE UN DISPOSITIVO MÉDICO POST MERCADO PREMERCADO PLANEACIÓN SELECCIÓN ADQUISICIÓN DISEÑO Y DESARROLLO FABRICACIÓN REGISTRO SANITARIO INSTALACIÓN USO CLÍNICO MANTENIMIENTO DISPOSICIÓN FINAL EFICACIA SEGURIDAD DESEMPEÑO EFECTIVIDAD SEGURIDAD DESEMPEÑO EVALUACION DE TECNOLOGIAS SANITARIAS

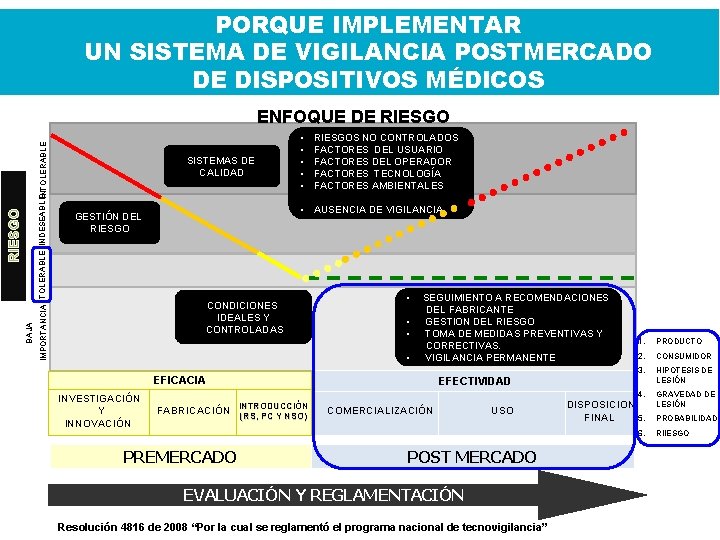
PORQUE IMPLEMENTAR UN SISTEMA DE VIGILANCIA POSTMERCADO DE DISPOSITIVOS MÉDICOS INTOLERABLE IMPORTANCIA TOLERABLE INDESEABLE BAJA RIESGO ENFOQUE DE RIESGO SISTEMAS DE CALIDAD GESTIÓN DEL RIESGO • • • RIESGOS NO CONTROLADOS FACTORES DEL USUARIO FACTORES DEL OPERADOR FACTORES TECNOLOGÍA FACTORES AMBIENTALES ¿Por qué la vigilancia? • AUSENCIA DE VIGILANCIA CONDICIONES IDEALES Y CONTROLADAS • SEGUIMIENTO A RECOMENDACIONES DEL FABRICANTE • GESTION DEL RIESGO • TOMA DE MEDIDAS PREVENTIVAS Y CORRECTIVAS. • VIGILANCIA PERMANENTE EFICACIA INVESTIGACIÓN Y INNOVACIÓN INTRODUCCIÓN FABRICACIÓN (RS, PC Y NSO) 1. PRODUCTO 2. CONSUMIDOR 3. HIPOTESIS DE LESIÓN 4. GRAVEDAD DE LESIÓN EFECTIVIDAD COMERCIALIZACIÓN USO DISPOSICION FINAL 5. 6. PREMERCADO POST MERCADO EVALUACIÓN Y REGLAMENTACIÓN Resolución 4816 de 2008 “Por la cual se reglamentó el programa nacional de tecnovigilancia” PROBABILIDAD RIIESGO

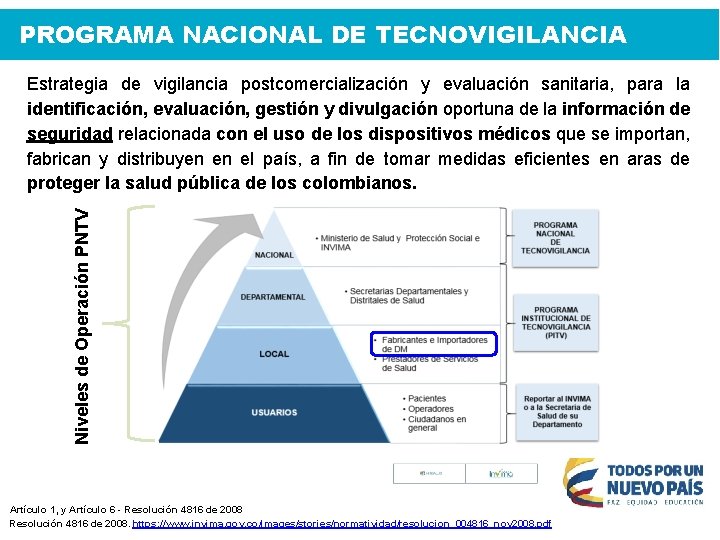
PROGRAMA NACIONAL DE TECNOVIGILANCIA Estrategia de vigilancia post-comercialización y evaluación sanitaria, para la identificación, evaluación, gestión y divulgación oportuna de la información de seguridad relacionada con el uso de los dispositivos médicos que se importan, fabrican y distribuyen en el país, a fin de tomar medidas eficientes en aras de proteger la salud pública de los colombianos. Artículo 1°. Resolución 4816 de 2008

PROGRAMA NACIONAL DE TECNOVIGILANCIA Niveles de Operación PNTV Estrategia de vigilancia postcomercialización y evaluación sanitaria, para la identificación, evaluación, gestión y divulgación oportuna de la información de seguridad relacionada con el uso de los dispositivos médicos que se importan, fabrican y distribuyen en el país, a fin de tomar medidas eficientes en aras de proteger la salud pública de los colombianos. Artículo 1, y Artículo 6 - Resolución 4816 de 2008. https: //www. invima. gov. co/images/stories/normatividad/resolucion_004816_nov 2008. pdf

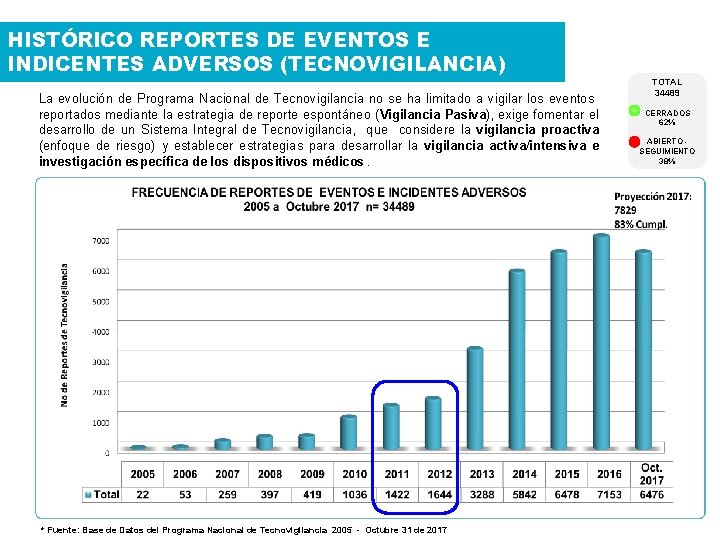
HISTÓRICO REPORTES DE EVENTOS E INDICENTES ADVERSOS (TECNOVIGILANCIA) La evolución de Programa Nacional de Tecnovigilancia no se ha limitado a vigilar los eventos reportados mediante la estrategia de reporte espontáneo (Vigilancia Pasiva), exige fomentar el desarrollo de un Sistema Integral de Tecnovigilancia, que considere la vigilancia proactiva (enfoque de riesgo) y establecer estrategias para desarrollar la vigilancia activa/intensiva e investigación específica de los dispositivos médicos. * Fuente: Base de Datos del Programa Nacional de Tecnovigilancia 2005 - Octubre 31 de 2017 TOTAL 34489 CERRADOS 62% ABIERTO SEGUIMIENTO 38%

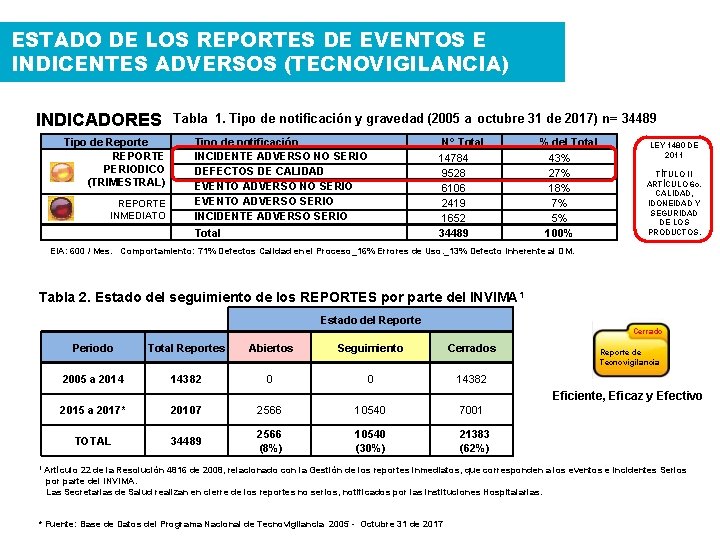
ESTADO DE LOS REPORTES DE EVENTOS E INDICENTES ADVERSOS (TECNOVIGILANCIA) INDICADORES Tabla 1. Tipo de notificación y gravedad (2005 a octubre 31 de 2017) n= 34489 Tipo de Reporte REPORTE PERIODICO (TRIMESTRAL) REPORTE INMEDIATO Tipo de notificación INCIDENTE ADVERSO NO SERIO DEFECTOS DE CALIDAD EVENTO ADVERSO NO SERIO EVENTO ADVERSO SERIO INCIDENTE ADVERSO SERIO Total N° Total 14784 9528 6106 2419 1652 34489 % del Total 43% 27% 18% 7% 5% 100% LEY 1480 DE 2011 TÍTULO II ARTÍCULO 6 o. CALIDAD, IDONEIDAD Y SEGURIDAD DE LOS PRODUCTOS. EIA: 600 / Mes. Comportamiento: 71% Defectos Calidad en el Proceso_16% Errores de Uso. _13% Defecto Inherente al DM. Tabla 2. Estado del seguimiento de los REPORTES por parte del INVIMA 1 Estado del Reporte Cerrado Periodo Total Reportes Abiertos Seguimiento Cerrados 2005 a 2014 14382 0 0 14382 2015 a 2017* 20107 2566 10540 7001 TOTAL 34489 2566 (8%) 10540 (30%) 21383 (62%) Reporte de Tecnovigilancia Eficiente, Eficaz y Efectivo 1 Artículo 22 de la Resolución 4816 de 2008, relacionado con la Gestión de los reportes inmediatos, que corresponden a los eventos e incidentes Serios por parte del INVIMA. Las Secretarias de Salud realizan en cierre de los reportes no serios, notificados por las instituciones Hospitalarias. * Fuente: Base de Datos del Programa Nacional de Tecnovigilancia 2005 - Octubre 31 de 2017

GESTIÓN DE REPORTES DE EVENTOS E INCIDENTES ADVERSOS

GESTIÓN DE REPORTES DE EVENTOS E INCIDENTES ADVERSOS Formato de Reporte: Es el medio por el cual un reportante notifica a la institución hospitalaria, al fabricante y/o a la autoridad sanitaria, sobre un evento o incidente adverso asociado a un dispositivo médico. Reportes inmediatos de Tecnovigilancia: Reportes de Tecnovigilancia que relacionan un evento adverso serio o un incidente adverso serio con un dispositivo médico en particular. Definiciones Reportes periódicos de Tecnovigilancia: Conjunto de reportes de Tecnovigilancia que relacionan la ocurrencia de eventos adversos no serios e información sobre la seguridad de un dispositivo médico o grupos de dispositivos médicos en un período definido y en donde se ha realizado un proceso de gestión interna eficiente por parte del reportante.

GESTIÓN DE REPORTES DE EVENTOS E INCIDENTES ADVERSOS Evento Adverso Serio: Evento no intencionado que pudo haber llevado a la muerte o al deterioro serio de la salud del paciente, operador o todo aquel que se vea implicado directa o indirectamente, como consecuencia de la utilización de un dispositivo médico. Se considera como deterioro serio de la salud: Definiciones a) Enfermedad o daño que amenace la vida. b) Daño de una función o estructura corporal. c)Condición que requiera una intervención médica o quirúrgica para prevenir un daño permanente de una estructura o función corporal. d) Evento que lleve a una incapacidad permanente parcial. e) Evento que necesite una hospitalización o una prolongación en la hospitalización. f) Evento que sea el origen de una malformación congénita. Evento adverso no serio: Evento no intencionado, diferente a los que pudieron haber llevado a la muerte o al deterioro serio de la salud del paciente, operador o todo aquel que se vea implicado directa o indirectamente, como consecuencia de la utilización de un dispositivo o aparato de uso médico.

GESTIÓN DE REPORTES DE EVENTOS E INCIDENTES ADVERSOS Incidente Adverso Serio: Potencial riesgo de daño no intencionado que pudo haber llevado a la muerte o al deterioro serio de la salud del paciente, pero que por causa del azar o la intervención de un profesional de la salud u otra persona, o una barrera de seguridad, no generó un desenlace adverso. Definiciones Incidente adverso no serio: Potencial riesgo de daño no intencionado diferente a los que pudieron haber llevado a la muerte o al deterioro serio de la salud del paciente, pero que por causa del azar o la intervención de un profesional de la salud u otra persona, o una barrera de seguridad, no generó un desenlace adverso.

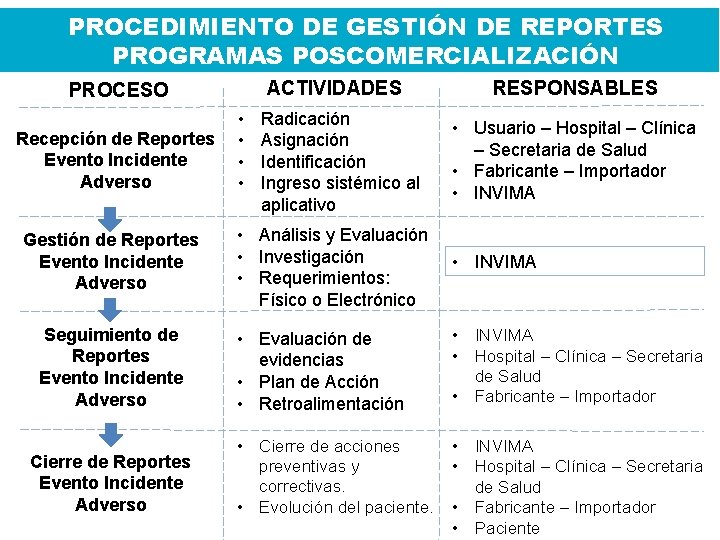
PROCEDIMIENTO DE GESTIÓN DE REPORTES PROGRAMAS POSCOMERCIALIZACIÓN ACTIVIDADES PROCESO • Recepción de Reportes • Evento Incidente • Adverso • Gestión de Reportes Evento Incidente Adverso Seguimiento de Reportes Evento Incidente Adverso Cierre de Reportes Evento Incidente Adverso Radicación Asignación Identificación Ingreso sistémico al aplicativo RESPONSABLES • Usuario – Hospital – Clínica – Secretaria de Salud • Fabricante – Importador • INVIMA • Análisis y Evaluación • Investigación • Requerimientos: Físico o Electrónico • INVIMA • Evaluación de evidencias • Plan de Acción • Retroalimentación • INVIMA • Hospital – Clínica – Secretaria de Salud • Fabricante – Importador • Cierre de acciones • INVIMA preventivas y • Hospital – Clínica – Secretaria correctivas. de Salud • Evolución del paciente. • Fabricante – Importador • Paciente

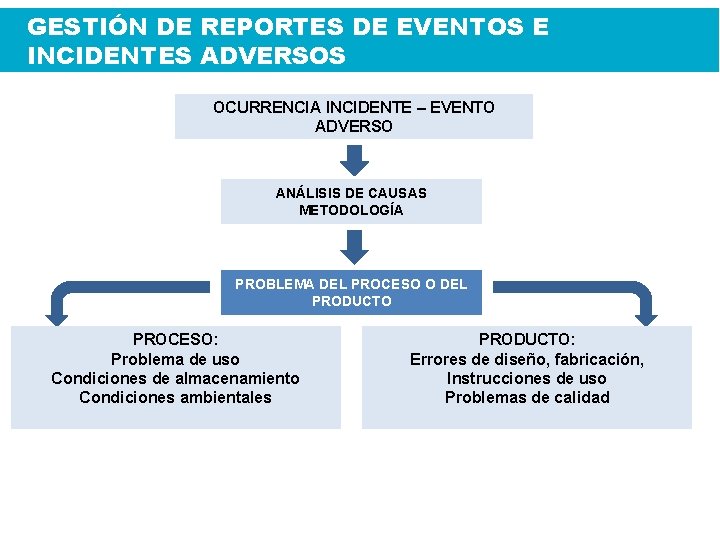
GESTIÓN DE REPORTES DE EVENTOS E INCIDENTES ADVERSOS OCURRENCIA INCIDENTE – EVENTO ADVERSO ANÁLISIS DE CAUSAS METODOLOGÍA PROBLEMA DEL PROCESO O DEL PRODUCTO PROCESO: Problema de uso Condiciones de almacenamiento Condiciones ambientales PRODUCTO: Errores de diseño, fabricación, Instrucciones de uso Problemas de calidad

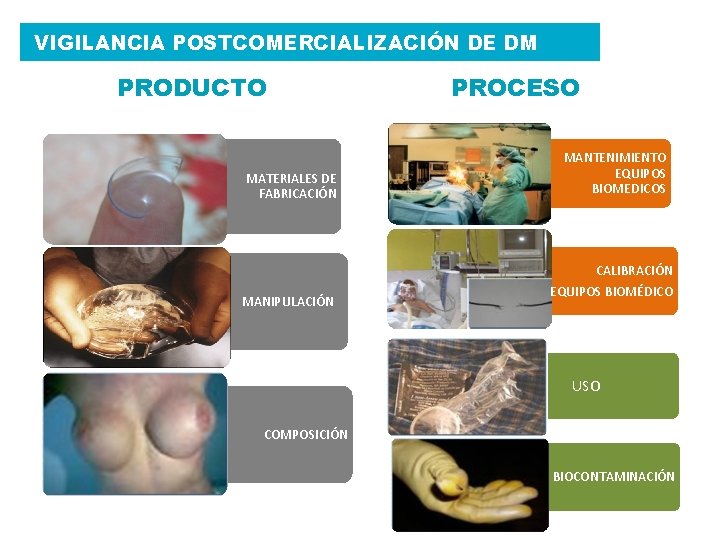
VIGILANCIA POSTCOMERCIALIZACIÓN DE DM PRODUCTO MATERIALES DE FABRICACIÓN MANIPULACIÓN PROCESO MANTENIMIENTO EQUIPOS BIOMEDICOS CALIBRACIÓN EQUIPOS BIOMÉDICO USO COMPOSICIÓN BIOCONTAMINACIÓN

Se considera como DETERIORO SERIO DE LA SALUD • • Muerte Enfermedad o daño que amenace la vida. Daño de una función o estructura corporal. Condición que requiera una intervención médica o quirúrgica para prevenir un daño permanente de una estructura o función corporal. • Evento que lleve a una incapacidad permanente parcial. • Evento que necesite una hospitalización o una prolongación en la hospitalización. • Evento que sea el origen de una malformación congénita.

4. GESTIÓN DE EVENTOS E INCIDENTES ADVERSOS Ejemplo En el Servicio de Hospitalización de la Clínica “LA LOMA” dos pacientes en la misma fecha presentan alergia con prurito y enrojecimiento por el uso de Esparadrapo, el caso se da con el mismo lote de un producto. ¿EVENTO O INCIDENTE? ¿SERIO O NO SERIO? ¿ DETECCIÓN DEL EVENTO? ¿CUÁL ES LA CAUSA?

GESTIÓN DE EVENTOS E INCIDENTES ADVERSOS Ejemplo 5 pares de guantes de una caja, salen con perforaciones, el mismo caso se da en todos los servicios del hospital. ¿EVENTO O INCIDENTE? ¿SERIO O NO SERIO? ¿ DETECCIÓN DEL EVENTO? ¿CUÁL ES LA CAUSA?

4. GESTIÓN DE EVENTOS E INCIDENTES ADVERSOS Ejemplo En el Laboratorio “LABTEC” en la toma de muestras, al realizar citología, la cabeza del CITOCEPILLO se desprendió y quedó en el cuello del cérvix ocasionando laceraciones en la paciente y fue necesario realizar especuloscopia y manipular con cureta para extraer la cabeza. ¿EVENTO O INCIDENTE? ¿SERIO O NO SERIO? ¿ DETECCIÓN DEL EVENTO? ¿CUÁL ES LA CAUSA?

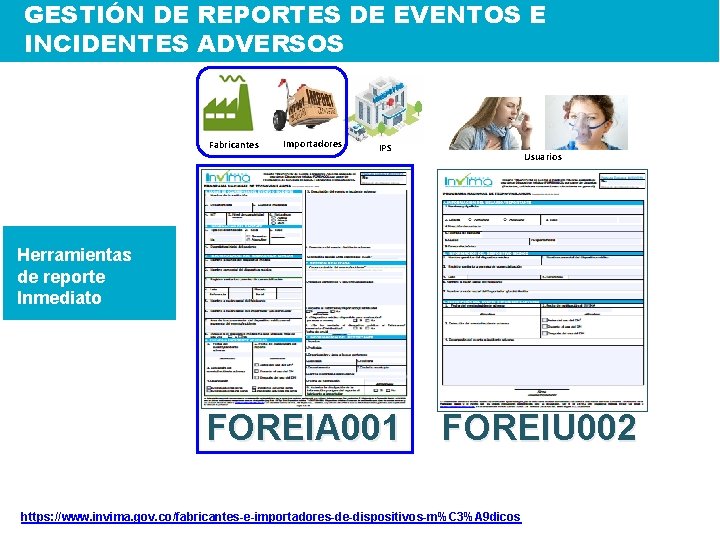
GESTIÓN DE REPORTES DE EVENTOS E INCIDENTES ADVERSOS Fabricantes Importadores IPS Usuarios Herramientas de reporte Inmediato FOREIA 001 FOREIU 002 https: //www. invima. gov. co/fabricantes-e-importadores-de-dispositivos-m%C 3%A 9 dicos

DILIGENCIAMIENTO DEL REPORTE FOREIA

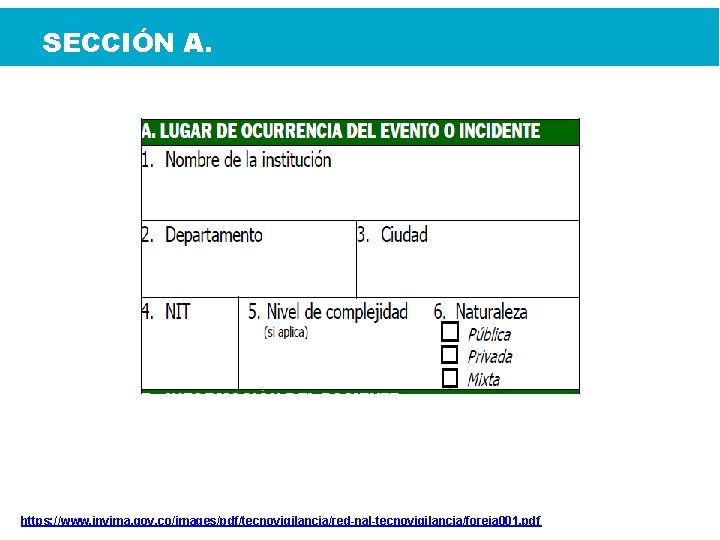
SECCIÓN A. https: //www. invima. gov. co/images/pdf/tecnovigilancia/red-nal-tecnovigilancia/foreia 001. pdf

SECCIÓN B. https: //www. invima. gov. co/images/pdf/tecnovigilancia/red-nal-tecnovigilancia/foreia 001. pdf

SECCIÓN C. https: //www. invima. gov. co/images/pdf/tecnovigilancia/red-nal-tecnovigilancia/foreia 001. pdf

SECCIÓN D. https: //www. invima. gov. co/images/pdf/tecnovigilancia/red-nal-tecnovigilancia/foreia 001. pdf

SECCIÓN E. https: //www. invima. gov. co/images/pdf/tecnovigilancia/red-nal-tecnovigilancia/foreia 001. pdf

SIGNAL https: //www. invima. gov. co/images/pdf/tecnovigilancia/red-nal-tecnovigilancia/foreia 001. pdf

SECCIÓN F. https: //www. invima. gov. co/images/pdf/tecnovigilancia/red-nal-tecnovigilancia/foreia 001. pdf

METODOLOGÍAS PARA ANÁLISIS DE EVENTOS E INCIDENTES ADVERSOS Metodologías de Análisis (Sistemas de Gestión de Riesgo Clínico) 1. 2. 3. 4. 5. 6. 7. Lluvia de ideas Los cinco ¿por qué? Diagrama de Ishikawa – Causa – Efecto Modelo SHELL Protocolo de Londres ANCLA Análisis de Modo Falla - Efecto (AMFE) PROACTIVO

METODOLOGÍAS PARA ANÁLISIS DE EVENTOS E INCIDENTES ADVERSOS ü Lluvia de ideas (Brainstorming) Para el análisis de causas de un problema, se requiere recoger información y consultar a partir de un equipo multidisciplinario (experto en el campo específico y confiar en su experiencia), las posibles causas y soluciones al problema dado. Sin embargo, esta información puede ser subjetiva.

METODOLOGÍAS PARA ANÁLISIS DE EVENTOS E INCIDENTES ADVERSOS ü Los cinco ¿por qué? Es una serie de preguntas realizadas sistemáticamente, utilizadas para buscar posibles causas principales de un dato, una situación, oportunidad o problema. La técnica requiere que el equipo pregunte “Por Qué” al menos cinco veces, o trabaje a través de cinco niveles de detalle. Una vez que sea difícil para el equipo responder al “Por Qué”, la causa más probable habrá sido identificada.

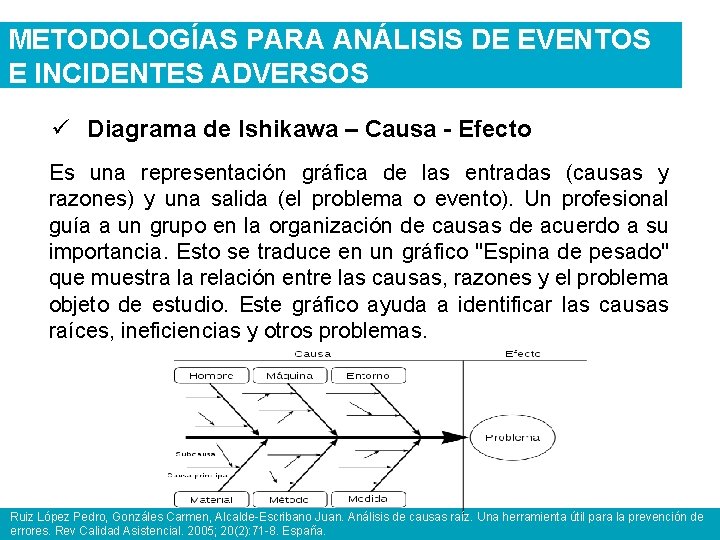
METODOLOGÍAS PARA ANÁLISIS DE EVENTOS E INCIDENTES ADVERSOS ü Diagrama de Ishikawa – Causa - Efecto Es una representación gráfica de las entradas (causas y razones) y una salida (el problema o evento). Un profesional guía a un grupo en la organización de causas de acuerdo a su importancia. Esto se traduce en un gráfico "Espina de pesado" que muestra la relación entre las causas, razones y el problema objeto de estudio. Este gráfico ayuda a identificar las causas raíces, ineficiencias y otros problemas. Ruiz López Pedro, Gonzáles Carmen, Alcalde-Escribano Juan. Análisis de causas raíz. Una herramienta útil para la prevención de errores. Rev Calidad Asistencial. 2005; 20(2): 71 -8. España.

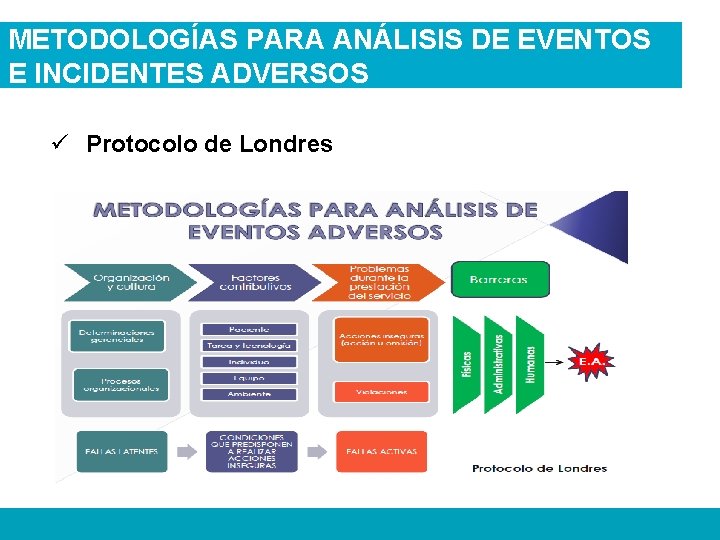
METODOLOGÍAS PARA ANÁLISIS DE EVENTOS E INCIDENTES ADVERSOS ü Protocolo de Londres es una metodología basada en el modelo organizacional de accidentes de James Reason, el cual facilita el análisis de los incidentes, en la medida que incluye desde elementos clínicos relacionados con el paciente, hasta factores del más alto nivel organizacional y de su entorno, que pueden haber jugado un papel causal. El primer paso en la investigación es la identificación de las acciones inseguras, para luego analizar las circunstancias en que ocurrieron, es decir, identificar los factores que contribuyeron o predispusieron a dicha conducta, para así crear las recomendaciones y planes de acción cuyo propósito son mejorar las debilidades identificadas. Ministerio de Protección Social. Herramientas para promover la Estrategia de la Seguridad del Paciente en el Sistema Obligatorio de Garantía de Calidad de la Atención en Salud. Sistema Obligatorio de Garantía de la Calidad en Salud. República de Colombia, 2008.

METODOLOGÍAS PARA ANÁLISIS DE EVENTOS E INCIDENTES ADVERSOS ü Protocolo de Londres

METODOLOGÍAS PARA ANÁLISIS DE EVENTOS E INCIDENTES ADVERSOS ü Análisis de modo falla - efecto (AMEF) Este es la metodología para un Sistema de Gestión de Riesgo Clínico que anticipa errores y diseña un sistema que minimiza su impacto. Es una herramienta de seguridad del paciente, que da a los gerentes de riesgo la oportunidad de adelantarse a los eventos e impactar positivamente el ambiente del cuidado de los pacientes. AMFE es un proceso de calidad el cual reconoce que los errores son evitables y predecibles. AMFE utiliza técnicas de investigación cualitativas como grupos focales, entrevistas estructuradas para la recolección de la información en varias fases del proceso. Siguiendo AMFE, los equipos pueden tomar dos tipos de acciones: prevenir que los errores perjudiquen a los pacientes y mitigar los efectos de los errores que alcanzan a los pacientes. Gaitán Hernando, Torres Marcela. Gestión de riesgo clínico para el mejoramiento de la calidad de la atención en instituciones hospitalarias. 2011

CASO PLACA DE ELECTROBISTURÍ

EJERCICIO DE ANÁLISIS DE CAUSALIDAD Metodología: 1. Explicación de la herramienta de análisis (Diagrama causa efecto) 2. Presentación del caso 3. Los asistentes deben describir las actividades y evidencias que se deben analizar en cada causa principal 4. Se presentarán el resultado de las evidencias 5. Conclusión del caso

DESCRIPCIÓN DEL CASO EL DIA 18 DE MARZO DE 2017 A LAS 7: 30 AM INGRESA AL SERVICIO DE URGENCIAS PACIENTE CON EMBARAZO A TERMINO DE 38 SEMANAS CON TRABAJO DE PARTO EN FASE LATENTE, POR LO CUAL EL GINECOOBSTETRA DECIDE HOSPITALIZARLA. EL DIA 19 DE MARZO PRESENTA DILATACION Y BORRAMIENTO COMPLETO, ADEMAS DE SENSACION DE PUJO PARA LO CUAL SE ASISTIO, PERO NO HUBO PROGRESO EN EL DESCENSO, SE DETERMINO REALIZACION DE CESAREA POR URGENCIAS LA CUAL CONCLUYO SIN COMPLICACIONES. PACIENTE SE PASO A SALA DE RECUPERACION, DONDE EL PESONAL DE ENFERMERIA EVIDENCIO UNA LESION EN EL GLUTEO DERECHO, EL MEDICO TRATANTE VALORO LA PACIENTE Y ENCONTRO LESION CENTRO NECROTICO DE APROXIMADAMENTE 6 cm CON ENTEMAS Y FLICTENAS PERILESIONALES, SE HACE CX POR QUEMADURA DE GRADO II Y III, SE HACE VALORACION POR SERVICIO DE CIRUGIA PLASTICA, DE QUIENES SE TIENE LA INFORMACIÓN DE SER QUEMADURA DE GRADO III Y SE PASA A DESBRIDAMIENTO.

GESTIÓN DEL EVENTO INVESTIGACION PRELIMINAR 1. ENTREVISTA CON EL EQUIPO DE SALUD QUE EVIDENCIO LA QUEMADURA. 2. REVISION DE PROTOCOLO O GUIA MEDICA ESTABLECIDA PARA EVITAR QUEMADURAS EN SALA DE PARTO. 3. IDENTIFICACION DE LOS DISPOSITIVOS MEDICOS UTILIZADOS DURANTE EL PROCEDIMIENTO DE CESAREA MEDIDAS PREVENTIVAS DE SEGURIDAD 1. VERIFICACION DEL ESTADO FISICO FUNCIONAL DE LOS DISPOSITIVOS MEDICOS E INSTALACIONES FISICAS ASOCIADOS AL EVENTO. 2. ENTRENAMIENTO Y CAPACITACION A LOS PROFESIONALES QUE INTERACTUAN CON DISPOSITIVOS MEDICOS USADOS EN SALA DE PARTOS, EN EL USO MANEJO Y RIESGOS.

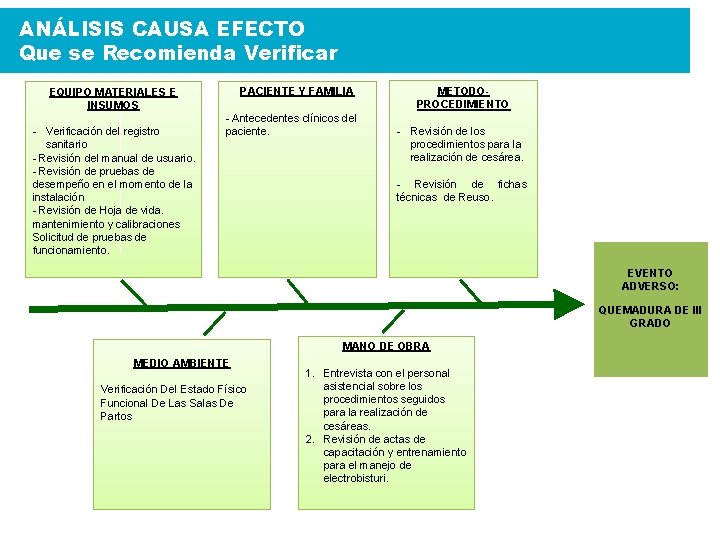
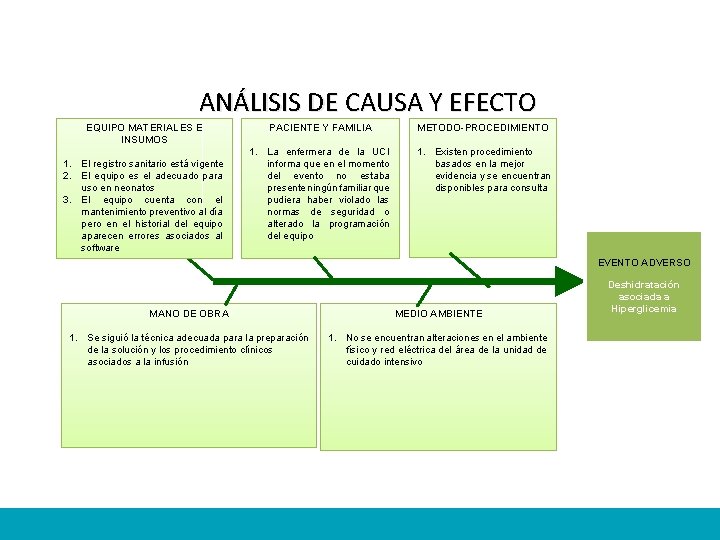
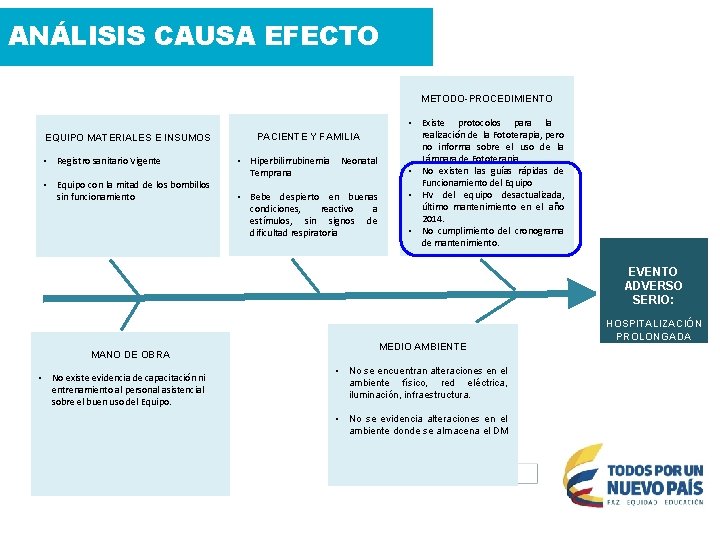
ANÁLISIS CAUSA EFECTO Que se Recomienda Verificar PACIENTE Y FAMILIA EQUIPO MATERIALES E INSUMOS - Verificación del registro sanitario - Revisión del manual de usuario. - Revisión de pruebas de desempeño en el momento de la instalación - Revisión de Hoja de vida. mantenimiento y calibraciones Solicitud de pruebas de funcionamiento. - Antecedentes clínicos del paciente. METODOPROCEDIMIENTO - Revisión de los procedimientos para la realización de cesárea. - Revisión de fichas técnicas de Reuso. EVENTO ADVERSO: QUEMADURA DE III GRADO MANO DE OBRA MEDIO AMBIENTE Verificación Del Estado Físico Funcional De Las Salas De Partos 1. Entrevista con el personal asistencial sobre los procedimientos seguidos para la realización de cesáreas. 2. Revisión de actas de capacitación y entrenamiento para el manejo de electrobisturi.

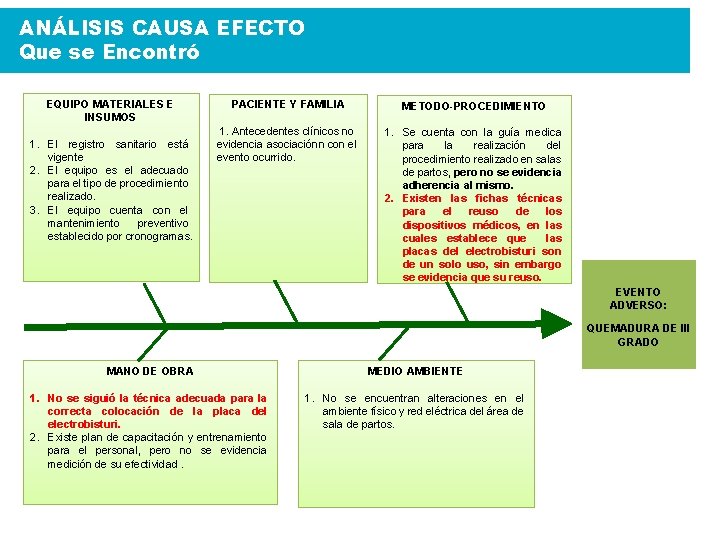
ANÁLISIS CAUSA EFECTO Que se Encontró EQUIPO MATERIALES E INSUMOS 1. El registro sanitario está vigente 2. El equipo es el adecuado para el tipo de procedimiento realizado. 3. El equipo cuenta con el mantenimiento preventivo establecido por cronogramas. PACIENTE Y FAMILIA 1. Antecedentes clínicos no evidencia asociaciónn con el evento ocurrido. METODO-PROCEDIMIENTO 1. Se cuenta con la guía medica para la realización del procedimiento realizado en salas de partos, pero no se evidencia adherencia al mismo. 2. Existen las fichas técnicas para el reuso de los dispositivos médicos, en las cuales establece que las placas del electrobisturi son de un solo uso, sin embargo se evidencia que su reuso. EVENTO ADVERSO: QUEMADURA DE III GRADO MANO DE OBRA MEDIO AMBIENTE 1. No se siguió la técnica adecuada para la correcta colocación de la placa del electrobisturi. 2. Existe plan de capacitación y entrenamiento para el personal, pero no se evidencia medición de su efectividad. 1. No se encuentran alteraciones en el ambiente físico y red eléctrica del área de sala de partos.

ACCIONES REALIZADAS POR EL IMPORTADOR 1. Tener acceso al Electrobisturí para su investigación. 2. Iniciar la investigación realizando las pruebas técnicas al Equipo 3. Resultados obtenidos de la investigación. Se encontraba dentro de los parámetros establecidos por el fabricante 4. Acciones correctivas y/o preventivas adoptadas. Reinducción sobre técnicas de uso del equipo y ajuste del procedimiento. 5. Supervisión adicional al dispositivo en cuestión.

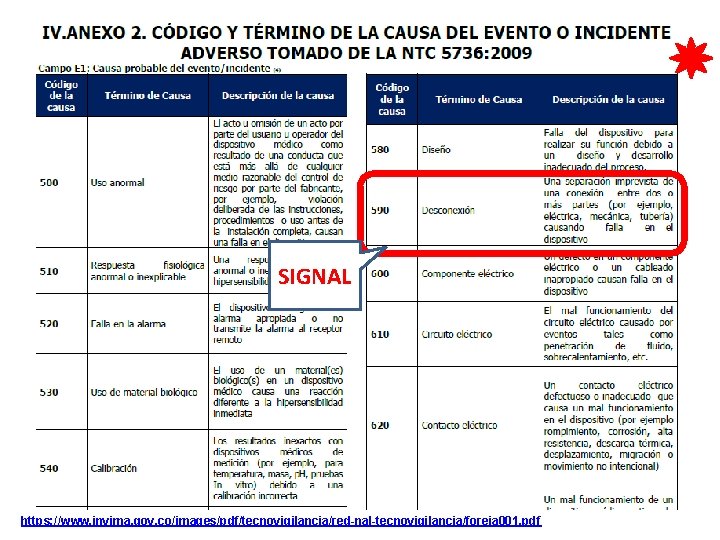
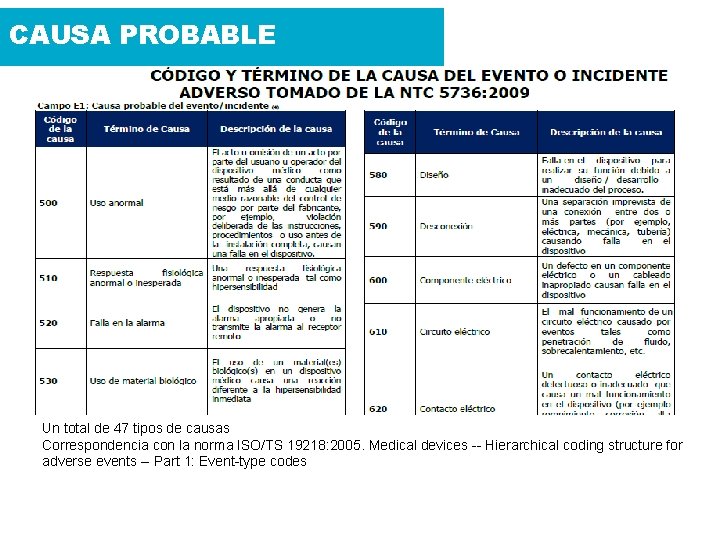
CONCLUSIÓN DEL CASO ¿Causa Probable del Evento o incidente adverso? 910 Entrenamiento 500 Uso anormal Acciones correctivas y preventivas iniciadas: • Cuarentena del equipo biomédico • Asistencia clínica para controlar y corregir los problemas de salud de la paciente • Revisión y análisis del histórico de mantenimientos correctivos y preventivos • Notificación al ente regulador y al proveedor • Indemnización a la paciente 2 NTC 5736: 2009 “Dispositivos Médicos. Estructura de codificación para tipos de eventos adversos y sus causas”

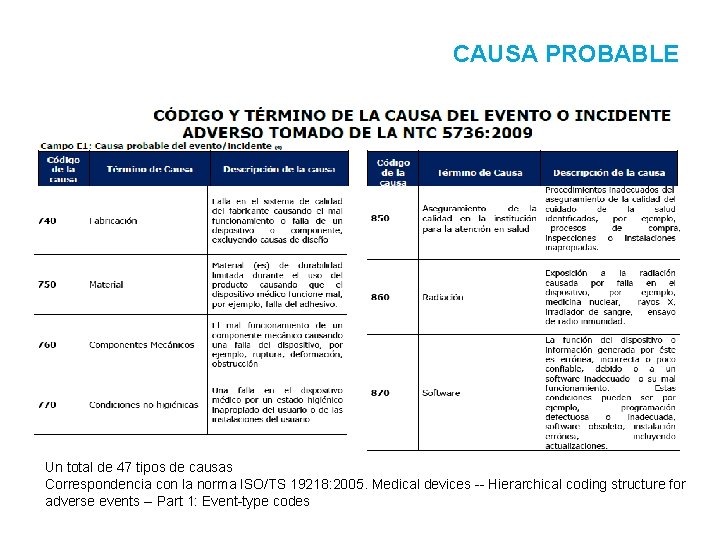
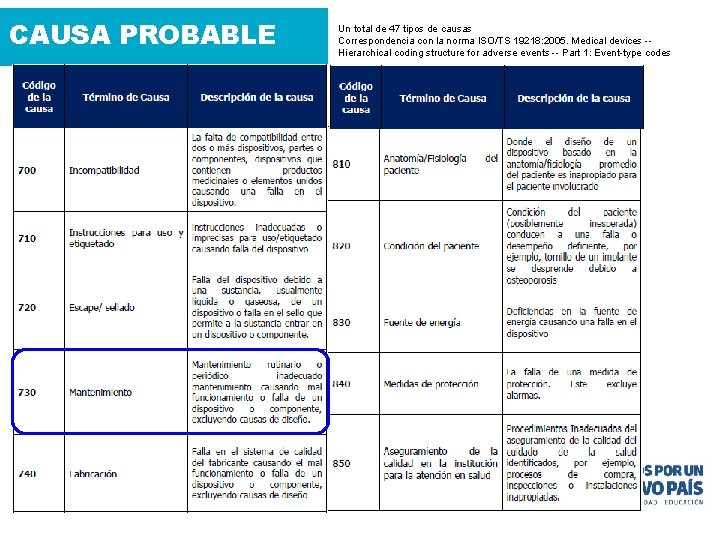
CAUSA PROBABLE Un total de 47 tipos de causas Correspondencia con la norma ISO/TS 19218: 2005. Medical devices -- Hierarchical coding structure for adverse events -- Part 1: Event-type codes

RECOMENDACIONES • • • Realizar la notificación en los tiempos establecidos por la normatividad vigente. Recopilación de la mayor cantidad de información sobre –Paciente - Dispositivo médico - Factores externos Enviar evidencia necesaria (muestra del dispositivo médico o en su defecto fotografías). Reportar al fabricante, no desechar el dispositivo médico. Multiplicar la información de uso entregada por el fabricante/importador a las diferentes áreas de la Institución.

CASO BOMBA DE INFUSIÓN

EJERCICIO DE ANÁLISIS DE CAUSALIDAD Metodología: 1. Explicación de la herramienta de análisis (Diagrama causa efecto) 2. Presentación del caso 3. Los asistentes deben describir las actividades y evidencias que se deben analizar en cada causa principal 4. Se presentarán el resultado de las evidencias 5. Conclusión del caso

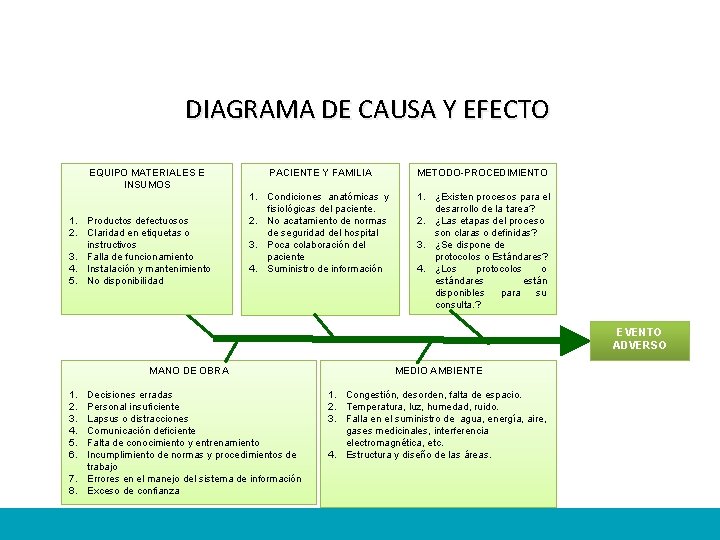
DIAGRAMA DE CAUSA Y EFECTO EQUIPO MATERIALES E INSUMOS 1. Productos defectuosos 2. Claridad en etiquetas o instructivos 3. Falla de funcionamiento 4. Instalación y mantenimiento 5. No disponibilidad PACIENTE Y FAMILIA METODO-PROCEDIMIENTO 1. Condiciones anatómicas y fisiológicas del paciente. 2. No acatamiento de normas de seguridad del hospital 3. Poca colaboración del paciente 4. Suministro de información 1. ¿Existen procesos para el desarrollo de la tarea? 2. ¿Las etapas del proceso son claras o definidas? 3. ¿Se dispone de protocolos o Estándares? 4. ¿Los protocolos o estándares están disponibles para su consulta. ? EVENTO ADVERSO MANO DE OBRA 1. 2. 3. 4. 5. 6. Decisiones erradas Personal insuficiente Lapsus o distracciones Comunicación deficiente Falta de conocimiento y entrenamiento Incumplimiento de normas y procedimientos de trabajo 7. Errores en el manejo del sistema de información 8. Exceso de confianza MEDIO AMBIENTE 1. Congestión, desorden, falta de espacio. 2. Temperatura, luz, humedad, ruido. 3. Falla en el suministro de agua, energía, aire, gases medicinales, interferencia electromagnética, etc. 4. Estructura y diseño de las áreas.

DESCRIPCIÓN DEL CASO Paciente de sexo masculino que nace el 20 de julio del 2011 y es trasladado a la Unidad de Cuidado Intensivo neonatal debido a su prematurez, bajo peso y presentar dificultad respiratoria. El paciente el día 26 de julio de 2011, se ordena infundir Dextrosa al 10% en un tiempo de 24 horas, lo cual consta en las notas de enfermería. El paciente presenta signos de deshidratación asociados a hiperglicemia lo cual amerita manejo farmacológico y prolongación de la instancia en la Unidad de Cuidados Intensivos Neonatal (UCIN). La enfermera de la UCIN informa al referente de Tecnovigilancia de la institución el evento adverso presentado y se presume un error en la bomba de infusión.

DESCRIPCIÓN DEL CASO Datos complementarios: Iníciales del paciente: RFT Hospital San Cipriano Ciudad Bogotá Fecha de Notificación: 27 de julio de 2011

DESCRIPCIÓN DEL EVENTO Investigación preliminar Entrevista a la Jefe de enfermería quien notificó el evento Indagar sobre la adecuada programación de la Bomba de infusión, Verificación de la dosis recomendada por el médico Identificación de la Bomba de infusión Identificación de la solución de dextrosa Medidas preventivas de seguridad Poner en cuarentena la bomba de infusión hasta que el fabricante realice la investigación.

¿COMO REPORTAR?

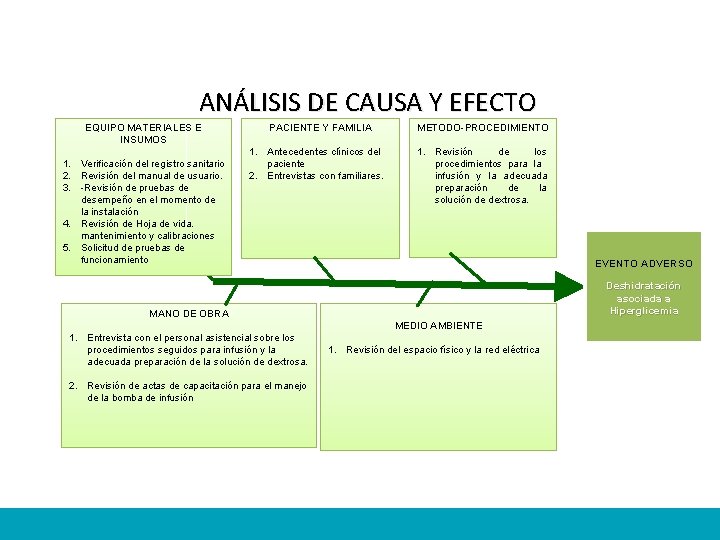
ANÁLISIS DE CAUSA Y EFECTO EQUIPO MATERIALES E INSUMOS 1. Verificación del registro sanitario 2. Revisión del manual de usuario. 3. -Revisión de pruebas de desempeño en el momento de la instalación 4. Revisión de Hoja de vida. mantenimiento y calibraciones 5. Solicitud de pruebas de funcionamiento PACIENTE Y FAMILIA METODO-PROCEDIMIENTO 1. Antecedentes clínicos del paciente 2. Entrevistas con familiares. 1. Revisión de los procedimientos para la infusión y la adecuada preparación de la solución de dextrosa. EVENTO ADVERSO Deshidratación asociada a Hiperglicemia MANO DE OBRA MEDIO AMBIENTE 1. Entrevista con el personal asistencial sobre los procedimientos seguidos para infusión y la adecuada preparación de la solución de dextrosa. 2. Revisión de actas de capacitación para el manejo de la bomba de infusión 1. Revisión del espacio físico y la red eléctrica

ANÁLISIS DE CAUSA Y EFECTO EQUIPO MATERIALES E INSUMOS 1. El registro sanitario está vigente 2. El equipo es el adecuado para uso en neonatos 3. El equipo cuenta con el mantenimiento preventivo al día pero en el historial del equipo aparecen errores asociados al software PACIENTE Y FAMILIA 1. La enfermera de la UCI informa que en el momento del evento no estaba presente ningún familiar que pudiera haber violado las normas de seguridad o alterado la programación del equipo METODO-PROCEDIMIENTO 1. Existen procedimiento basados en la mejor evidencia y se encuentran disponibles para consulta EVENTO ADVERSO MANO DE OBRA MEDIO AMBIENTE 1. Se siguió la técnica adecuada para la preparación de la solución y los procedimiento clínicos asociados a la infusión 1. No se encuentran alteraciones en el ambiente físico y red eléctrica del área de la unidad de cuidado intensivo Deshidratación asociada a Hiperglicemia

INVESTIGACIÓN POR PARTE DEL FABRICANTE/IMPORTADOR 1. Tener acceso a la Bomba de Infusión para su investigación. 2. Iniciar la investigación realizando las pruebas técnicas al Equipo 3. Resultados obtenidos de la investigación. Fallas en la programación del Software de la Bomba de Infusión 4. Acciones correctivas y/o preventivas adoptadas. Asesoramiento al usuario sobre la metodología para programación de la Bomba de infusión por parte del ingeniero encargado del mantenimiento en la institución. 5. Supervisión adicional al dispositivo en cuestión.

CONCLUSIÓN DEL CASO ¿Causa Probable del Evento o incidente adverso? 870 Software Acciones correctivas y preventivas iniciadas: • Cuarentena del equipo biomédico • Asistencia clínica para controlar y corregir los problemas de salud de la paciente • Revisión y análisis del histórico de mantenimientos correctivos y preventivos • Notificación al ente regulador y al proveedor 2 NTC 5736: 2009 “Dispositivos Médicos. Estructura de codificación para tipos de eventos adversos y sus causas”

CAUSA PROBABLE Un total de 47 tipos de causas Correspondencia con la norma ISO/TS 19218: 2005. Medical devices -- Hierarchical coding structure for adverse events -- Part 1: Event-type codes INSTITUTO COLOMBIANO DE NORMALIZACIÓN Y CERTIFICACIÓN. “Dispositivos Médicos. Estructura de codificación para tipos de eventos adversos y sus causas”. NTC-ISO 5736. Bogotá D. C: El instituto, 2009.

RECOMENDACIONES • • • Realizar la notificación en los tiempos establecidos por la normatividad vigente. Recopilación de la mayor cantidad de información sobre –Paciente - Dispositivo médico - Factores externos Enviar evidencia necesaria (muestra del dispositivo médico o en su defecto fotografías). Reportar al fabricante, no desechar el dispositivo médico. Multiplicar la información de uso entregada por el fabricante/importador a las diferentes áreas de la Institución.

CASO LÁMPARA DE FOTOTERAPIA

CASO TECNOVIGILANCIA – LÁMPARA DE FOTOTERAPIA DESCRIPCIÓN DEL EVENTO (transcrito textualmente) PACIENTE CON DIAGNOSTICO DE HIPERBILIRRUBINEMIA NEONATAL TEMPRANA, HOY 21/02/2016 CON BILIRRUBINAS QUE LO CLASIFICAN EN RIESGO INTERMEDIO Y POR DEBAJO DE LAS CURVAS DE FOTOTERAPIA, SE REALIZA CONTROL DE BILIRRUBINAS, BEBE DESPIERTO EN BUENAS CONDICIONES, REACTIVO A ESTIMULOS, SIN SIGNOS DE DIFICULTAD RESPIRATORIA. SE INICIA FOTOTERAPIA. SE REALIZA CONTROL POR SANGRE DE BILIRRUBINA TOTAL, INDIRECTA Y DIRECTA EL 22/02/2016, BEBE NO MEJORA, CUANDO SE REVISA LA LAMPARA DE FOTOTERAPIA QUE TIENE EL PACIENTE, SE ENCUENTRA QUE LA MITAD DE LOS BOMBILLOS FLUORESCENTES ESTA FUNDIDA (3 DE 6 BOMBILLOS) LO QUE GENERA HOSPITALIZACION PROLONGADA POR 1 DIA MAS. BEBE RECIEN NACIDO A TERMINO HOY (23/02/2016) BILIRRUBINAS EN ZONA DE RIESGO BAJO QUE NO REQUIERE FOTOTERAPIA POR LO QUE SE DA DE ALTA CON INSTRUCCIONES Y SIGNOS DE ALARMA Y RECOMENDACIÓN DE FOTOTERAPIA SOLAR.

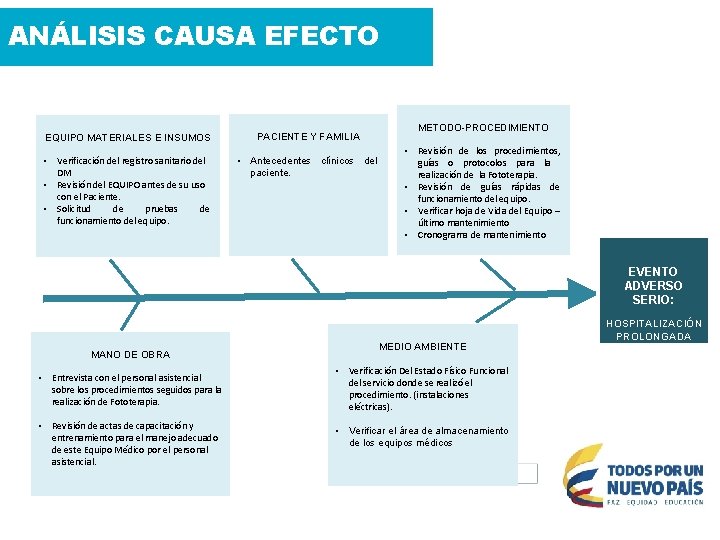
ANÁLISIS CAUSA EFECTO METODO-PROCEDIMIENTO EQUIPO MATERIALES E INSUMOS PACIENTE Y FAMILIA • Verificación del registro sanitario del DM • Revisión del EQUIPO antes de su uso con el Paciente. • Solicitud de pruebas de funcionamiento del equipo. • Antecedentes clínicos del paciente. • Revisión de los procedimientos, guías o protocolos para la realización de la Fototerapia. • Revisión de guías rápidas de funcionamiento del equipo. • Verificar hoja de Vida del Equipo – último mantenimiento • Cronograma de mantenimiento EVENTO ADVERSO SERIO: MANO DE OBRA • Entrevista con el personal asistencial sobre los procedimientos seguidos para la realización de Fototerapia. • Revisión de actas de capacitación y entrenamiento para el manejo adecuado de este Equipo Médico por el personal asistencial. MEDIO AMBIENTE • Verificación Del Estado Físico Funcional del servicio donde se realizó el procedimiento. (instalaciones eléctricas). • Verificar el área de almacenamiento de los equipos médicos HOSPITALIZACIÓN PROLONGADA

ANÁLISIS CAUSA EFECTO METODO-PROCEDIMIENTO PACIENTE Y FAMILIA EQUIPO MATERIALES E INSUMOS • Registro sanitario Vigente • Equipo con la mitad de los bombillos sin funcionamiento • Hiperbilirrubinemia Neonatal Temprana • Bebe despierto en buenas condiciones, reactivo a estímulos, sin signos de dificultad respiratoria • Existe protocolos para la realización de la Fototerapia, pero no informa sobre el uso de la Lámpara de Fototerapia. • No existen las guías rápidas de Funcionamiento del Equipo • HV del equipo desactualizada, último mantenimiento en el año 2014. • No cumplimiento del cronograma de mantenimiento. EVENTO ADVERSO SERIO: MANO DE OBRA • No existe evidencia de capacitación ni entrenamiento al personal asistencial sobre el buen uso del Equipo. MEDIO AMBIENTE • No se encuentran alteraciones en el ambiente físico, red eléctrica, iluminación, infraestructura. • No se evidencia alteraciones en el ambiente donde se almacena el DM HOSPITALIZACIÓN PROLONGADA

CAUSA PROBABLE Un total de 47 tipos de causas Correspondencia con la norma ISO/TS 19218: 2005. Medical devices -- Hierarchical coding structure for adverse events -- Part 1: Event-type codes

CONCLUSIÓN DEL CASO Causa Probable del Evento o incidente adverso 730 Mantenimiento Acciones correctivas y preventivas iniciadas: 1. Retención y aislamiento del Equipo. 2. El evento es reportado al área de mantenimiento y se realiza el cambio de los bombillos, quedando funcional y apto para el procedimiento. 3. Cambio de equipo para continuar con el tratamiento 4. Notificación al ente regulador y al proveedor 5. Seguimiento a la evolución del paciente 2 NTC 5736: 2009 “Dispositivos Médicos. Estructura de codificación para tipos de eventos adversos y sus causas” ISO 19218 de 2005

INVESTIGACIÓN: FABRICANTE - IMPORTADOR - CLÍNICA 1. Tener acceso al Equipo para su investigación. 2. Resultados obtenidos de la investigación. Verificación de registros de producción de la serie del equipo, sin desviaciones o no conformidades. 3. Acciones correctivas y/o preventivas adoptadas. Capacitación al personal asistencial manejo de la Lámpara de Fototerapia. Socializar con el personal asistencial programa de Tecnovigilancia haciendo énfasis en la importancia y la calidad del reporte

AVANCES Y PROYECCIÓN DE LA VIGILANCIA POSTCOMERCIALIZACIÓN DE DISPOSITIVOS MÉDICOS EN COLOMBIA

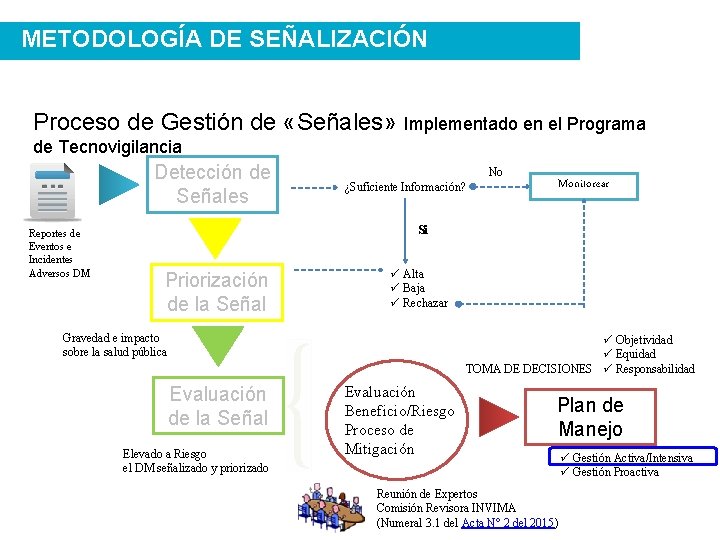
METODOLOGÍA DE SEÑALIZACIÓN Proceso de Gestión de «Señales» Implementado en el Programa de Tecnovigilancia Detección de Señales Reportes de Eventos e Incidentes Adversos DM No ¿Suficiente Información? Monitorear Si Priorización de la Señal ü Alta ü Baja ü Rechazar Gravedad e impacto sobre la salud pública ü Objetividad ü Equidad TOMA DE DECISIONES ü Responsabilidad Evaluación de la Señal Elevado a Riesgo el DM señalizado y priorizado Evaluación Beneficio/Riesgo Proceso de Mitigación Plan de Manejo Reunión de Expertos Comisión Revisora INVIMA (Numeral 3. 1 del Acta N° 2 del 2015) ü Gestión Activa/Intensiva ü Gestión Proactiva

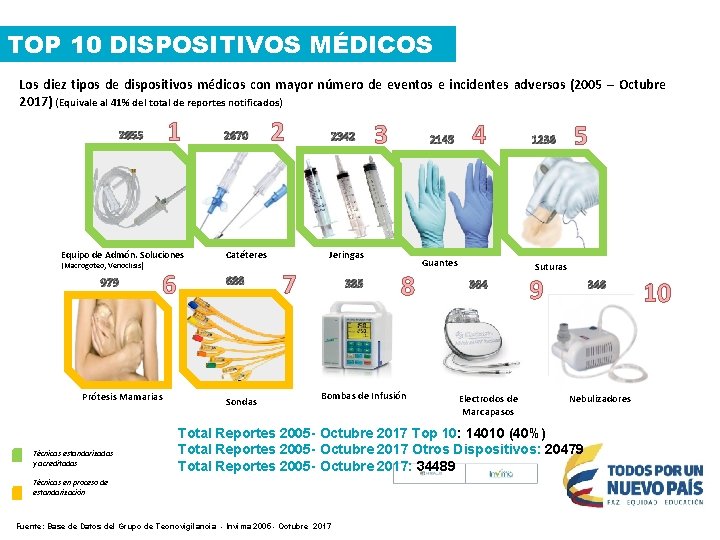
TOP 10 DISPOSITIVOS MÉDICOS Los diez tipos de dispositivos médicos con mayor número de eventos e incidentes adversos (2005 – Octubre 2017) (Equivale al 41% del total de reportes notificados) 1 2855 Equipo de Admón. Soluciones (Macrogoteo, Venoclisis) 979 6 Prótesis Mamarias Técnicas estandarizadas y acreditadas 2670 2 Sondas 3 2145 Jeringas Catéteres 688 2342 7 385 8 Bombas de Infusión 4 Guantes 1236 5 Suturas 364 Electrodos de Marcapasos 9 346 Nebulizadores Total Reportes 2005 - Octubre 2017 Top 10: 14010 (40%) Total Reportes 2005 - Octubre 2017 Otros Dispositivos: 20479 Total Reportes 2005 - Octubre 2017: 34489 Técnicas en proceso de estandarización Fuente: Base de Datos del Grupo de Tecnovigilancia - Invima 2005 - Octubre 2017 10

TECNOVIGILANCIA INTENSIVA Es la recolección de datos en forma sistemática y detallada de todos los posibles eventos adversos o incidentes adversos asociados al uso de un Dispositivo Médico especifico, que puedan presentarse en una población definida, con el fin de determinar su incidencia y los factores que las predisponen.

TECNOVIGILANCIA INTENSIVA – PROACTIVA • El enfoque actual del Programa frente al Proceso de Gestión de Señales, que actualmente se está consolidando, será insumo para fortalecer la información de Beneficio Riesgo de los dispositivos médicos señalizados y priorizados, para iniciar estudios de investigación que serán desarrollados en el marco de la Tecnovigilancia Intensiva. • Fomentar desde el Programa de Tecnovigilancia la vigilancia intensiva - proactiva a partir de los resultados de la metodología de señalización, para efectuar estudios de investigación sobre los dispositivos médicos señalizados y priorizados.

EVOLUCIÓN DEL PROGRAMA RESULTADOS DE LA VIGILANCIA INTENSIVA 2015 • Revisión de 473 historias clínicas correspondientes a 773 dispositivos implantables obteniendo 189 reportes válidos. Marcapasos Prótesis Mamarias Lente Intraocular Stent Coronario • Causas con mayor frecuencia asociadas a los eventos adversos: • 820 Condición del paciente. (51%) • 510 Respuesta fisiológica anormal o inesperada. (18%) • 780 No relacionado con el dispositivo. (8, 1%) • 790 Otra causa de evento. (7, 9%) • 930 Sin identificar Causa definitiva o no probable determinada. (7, 0%) • 810 Anatomía/Fisiología del paciente donde el diseño del dispositivo basado en la anatomía/ fisiología promedio del paciente es inapropiado. (5, 8%) • 770 Condiciones no higiénicas, una falla en el dispositivo médico por un estado higiénico inapropiado del usuario. (1, 2%) • 500 Uso anormal, acto u omisión de un acto por parte del usuario u operador. (1, 0%) 2016 • Protocolo de estudio de utilización de cada dispositivo médico no implantable de difícil trazabilidad señalizado. Bombas de Infusión • Estandarización de técnicas para evaluación de conformidad de calidad en Catéteres y Equipos de Administración de Soluciones. (Laboratorio de Dispositivos). Catéteres • Informes de seguridad nacionales con enfoque de contención de riesgos y uso racional de dispositivos médicos https: //www. invima. gov. co/vigilancia-intensiva-en-colombia Equipos de Administración de soluciones

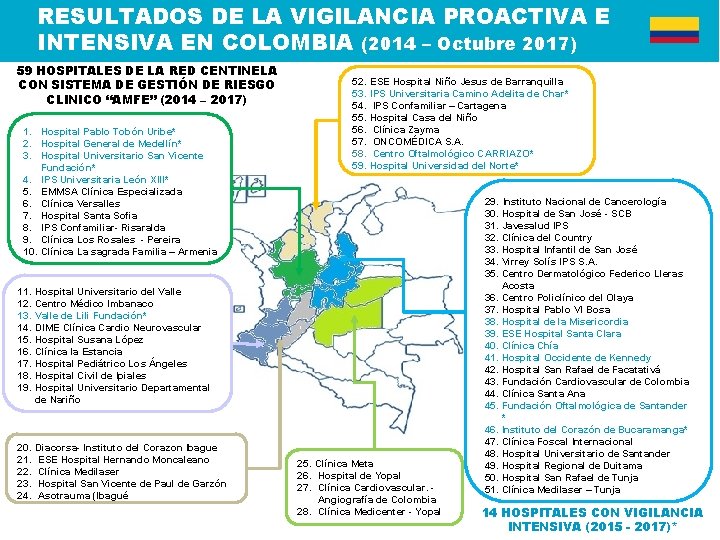
RESULTADOS DE LA VIGILANCIA PROACTIVA E INTENSIVA EN COLOMBIA (2014 – Octubre 2017) 59 HOSPITALES DE LA RED CENTINELA CON SISTEMA DE GESTIÓN DE RIESGO CLINICO “AMFE” (2014 – 2017) 1. Hospital Pablo Tobón Uribe* 2. Hospital General de Medellín* 3. Hospital Universitario San Vicente Fundación* 4. IPS Universitaria León XIII* 5. EMMSA Clínica Especializada 6. Clínica Versalles 7. Hospital Santa Sofia 8. IPS Confamiliar- Risaralda 9. Clínica Los Rosales - Pereira 10. Clínica La sagrada Familia – Armenia 52. ESE Hospital Niño Jesus de Barranquilla 53. IPS Universitaria Camino Adelita de Char* 54. IPS Confamiliar – Cartagena Hospital Casa del Niño 55. 56. Clínica Zayma 57. ONCOMÉDICA S. A. 58. Centro Oftalmológico CARRIAZO* 59. Hospital Universidad del Norte* 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. Hospital Universitario del Valle Centro Médico Imbanaco Valle de Lili Fundación* DIME Clínica Cardio Neurovascular Hospital Susana López Clínica la Estancia Hospital Pediátrico Los Ángeles Hospital Civil de Ipiales Hospital Universitario Departamental de Nariño Diacorsa- Instituto del Corazon Ibague ESE Hospital Hernando Moncaleano Clínica Medilaser Hospital San Vicente de Paul de Garzón Asotrauma (Ibagué 25. Clínica Meta 26. Hospital de Yopal 27. Clínica Cardiovascular. - Angiografía de Colombia 28. Clínica Medicenter - Yopal 29. Instituto Nacional de Cancerología 30. Hospital de San José - SCB 31. Javesalud IPS 32. Clínica del Country 33. Hospital Infantil de San José 34. Virrey Solís IPS S. A. 35. Centro Dermatológico Federico Lleras Acosta 36. Centro Policlínico del Olaya 37. Hospital Pablo VI Bosa 38. Hospital de la Misericordia 39. ESE Hospital Santa Clara 40. Clínica Chía 41. Hospital Occidente de Kennedy 42. Hospital San Rafael de Facatativá 43. Fundación Cardiovascular de Colombia 44. Clínica Santa Ana 45. Fundación Oftalmológica de Santander * 46. Instituto del Corazón de Bucaramanga* 47. Clínica Foscal Internacional 48. Hospital Universitario de Santander 49. Hospital Regional de Duitama 50. Hospital San Rafael de Tunja 51. Clínica Medilaser – Tunja 14 HOSPITALES CON VIGILANCIA INTENSIVA (2015 - 2017)*

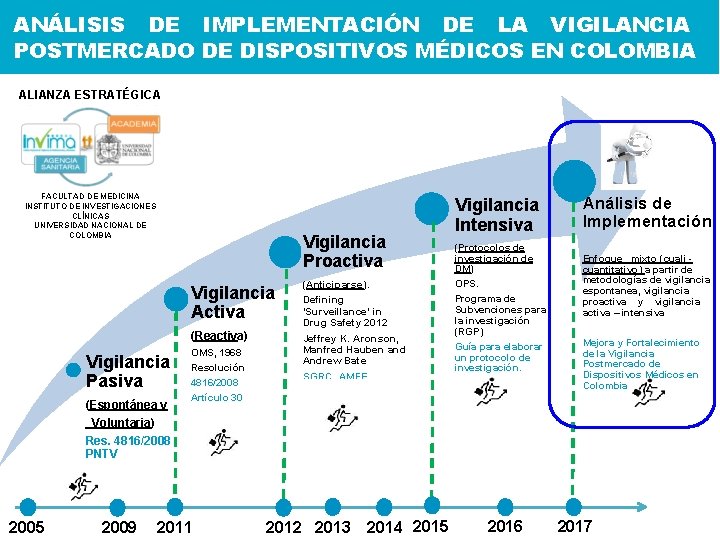
ANÁLISIS DE IMPLEMENTACIÓN DE LA VIGILANCIA POSTMERCADO DE DISPOSITIVOS MÉDICOS EN COLOMBIA ALIANZA ESTRATÉGICA FACULTAD DE MEDICINA INSTITUTO DE INVESTIGACIONES CLÍNICAS UNIVERSIDAD NACIONAL DE COLOMBIA Vigilancia Proactiva Vigilancia Activa (Reactiva) Vigilancia Pasiva (Espontánea y Voluntaria) Res. 4816/2008 PNTV 2005 2009 OMS, 1968 Resolución 4816/2008 Artículo 30 2011 (Anticiparse). Defining ‘Surveillance’ in Drug Safety 2012 Jeffrey K. Aronson, Manfred Hauben and Andrew Bate SGRC_AMFE 2012 2013 2014 2015 Vigilancia Intensiva (Protocolos de investigación de DM) OPS. Programa de Subvenciones para la investigación (RGP) Guía para elaborar un protocolo de investigación. 2016 Análisis de Implementación Enfoque mixto (cuali - cuantitativo) a partir de metodologías de vigilancia espontanea, vigilancia proactiva y vigilancia activa – intensiva Mejora y Fortalecimiento de la Vigilancia Postmercado de Dispositivos Médicos en Colombia 2017

GRACIAS POR SU ATENCIÓN Elkin Hernán Otálvaro Cifuentes Director de Dispositivos Médicos y Otras Tecnologías eotalvaroc@invima. gov. co elkinhoc@yahoo. es Mukoil Ahmed Romanos Zapata mromanosz@invima. gov. co mukoilrz@ Grupo de Tecnovigilancia tecnovigilancia@invima. gov. co Carrera 10 No. 64 – 28 Piso 7° Bogotá, D. C. Colombia