Nmeros Cunticos Presentacin realizada por Alfredo Velsquez Mrquez

























- Slides: 35

Números Cuánticos

Presentación realizada por: Alfredo Velásquez Márquez Profesor de Carrera de la División de Ciencias Basicas de la Facultad de Ingeniería de la UNAM

Objetivo: El alumno reconocerá la importancia del significado de los números cuánticos y la información que éstos proporcionan para ubicar a un electrón dentro de un átomo.

Conceptos Básicos Para una mejor comprensión de esta presentación, se recomienda que el alumno ya este familiarizado con los conceptos siguientes: - Ecuación de Onda de Schrödinger - Diamagnetismo y Paramagnetismo Si desea accesar a una descripción breve de estos conceptos dé un clic en el nombre del concepto.

Antecedentes Los números cuánticos son variables involucradas en la ecuación de onda de Schrödinger. Dependiendo de los valores de los números cuánticos, se obtienen diferentes soluciones para la ecuación de onda. Estas soluciones permiten conocer los lugares de máxima probabilidad para ubicar a un electrón dentro de un átomo.

Antecedentes Los números cuánticos obtenidos de la ecuación de onda son tres: - El número cuántico principal. - El número cuántico secundario, también llamado número cuántico azimutal o número cuántico de momento angular. - El número cuántico magnético.

Número Cuántico Principal El número cuántico principal, se denota con un una letra n y su valor indica la órbita o nivel energético en el que se encuentra el electrón, mientras mayor sea el valor de n, más alejado esta el electrón del núcleo, y mayor es su contenido energético.

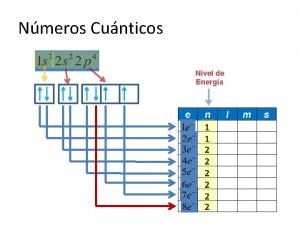
Número Cuántico Principal Los valores que adquiere n, son números enteros mayores de cero; así por ejemplo: Cuando n = 1, el electrón se encuentra en la órbita 1 Cuando n = 2, el electrón se encuentra en la órbita 2 Cuando n = 3, el electrón se encuentra en la órbita 3. . . Cuando n = x, el electrón se encuentra en la órbita x

Número Cuántico Secundario El número cuántico secundario, se denota con una letra l y su valor indica la subórbita o subnivel de energía en el que se encuentra el electrón. Dicha subórbita o subnivel energético, también llamado orbital, se puede entender como la forma geométrica que describe el electrón al moverse dentro del átomo.

Número Cuántico Secundario Para cada valor de n, l adquiere diferentes valores enteros, que van desde cero hasta n-1; así por ejemplo: Cuando n = 1, l adquiere un solo valor: 0 Cuando n = 2, l adquiere dos valores: 0 y 1 Cuando n = 3, . . . l adquiere tres valores: 0, 1 y 2

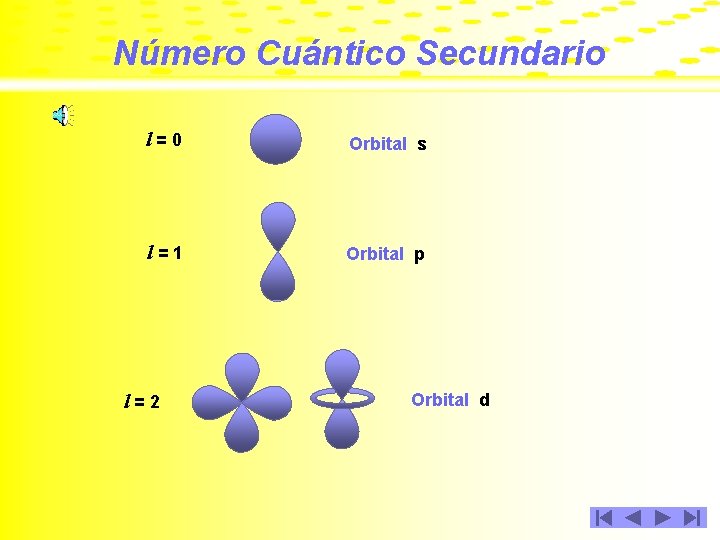
Número Cuántico Secundario Como se mencionó anteriormente, los orbitales son formas geométricas que describen los electrones al moverse en el interior del átomo. Estas formas geométricas son diferentes para cada valor de l y a cada orbital se le asigna una literal.

Número Cuántico Secundario l=0 Orbital s l=1 Orbital p l=2 Orbital d

Número Cuántico Secundario Cuando l = 3, los orbitales son del tipo f; cuando l = 4, los orbitales son del tipo g y a partir de aquí, se van asignando las letras siguientes del abecedario. Conforme aumenta el valor de l, aumenta la complejidad de la figura geométrica que describe el electrón; de hecho, aún no se han determinado las formas que presentan los orbitales del tipo g.

Número Cuántico Magnético El número cuántico magnético, se denota con una letra m y sus valores indican las orientaciones que tienen los orbitales en el espacio.

Número Cuántico Magnético Para cada valor de l, m adquiere diferentes valores enteros que van desde –l hasta +l, pasando por cero; así por ejemplo: Cuando l = 0, m adquiere un solo valor: 0 Cuando l = 1, m adquiere tres valores: – 1, 0 y +1 Cuando l = 2, m adquiere cinco valores: – 2, – 1, 0, +1 y +2 . . .

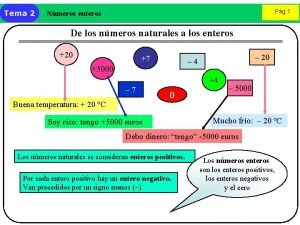
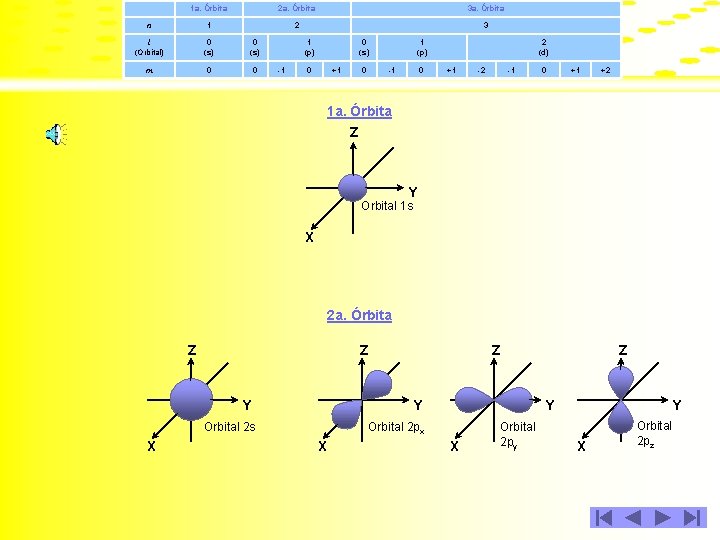
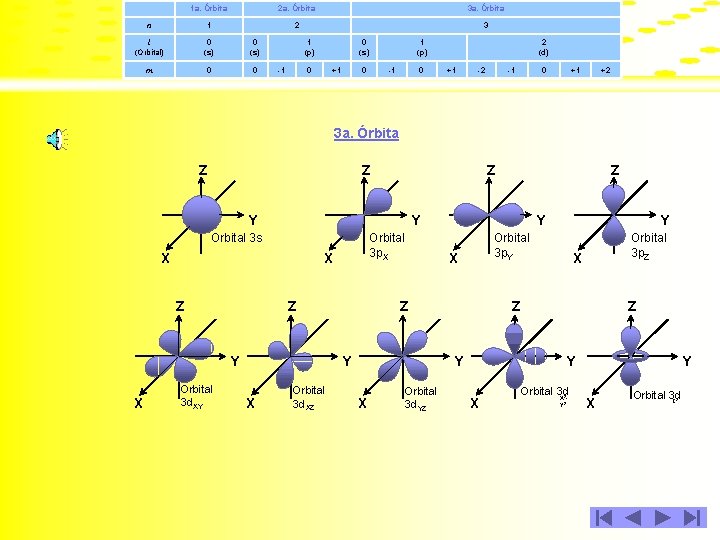
Con base en lo anterior, para las tres primeras órbitas de un átomo, se puede establecer la tabla siguiente: 1 a. Órbita 2 a. Órbita 3 a. Órbita n 1 2 3 l (Orbital) 0 (s) m 0 0 1 (p) -1 0 0 (s) +1 0 1 (p) -1 0 2 (d) +1 -2 -1 0 +1 +2

1 a. Órbita 2 a. Órbita 3 a. Órbita n 1 2 3 l (Orbital) 0 (s) m 0 0 1 (p) -1 0 (s) 0 +1 0 1 (p) -1 0 2 (d) +1 -2 -1 0 +1 +2 1 a. Órbita Z Y Orbital 1 s X 2 a. Órbita Z Z Y Y X Z Y Orbital 2 px Orbital 2 s X Z X Orbital 2 py Y X Orbital 2 pz

1 a. Órbita 2 a. Órbita 3 a. Órbita n 1 2 3 l (Orbital) 0 (s) m 0 0 1 (p) -1 0 (s) 0 +1 1 (p) 0 -1 0 2 (d) +1 -2 -1 0 +1 +2 3 a. Órbita Z Z Z Y Y Orbital 3 s X Z Y X Orbital 3 p. X X Z Orbital 3 d. XY Orbital 3 d. XZ Y Z Orbital 3 d. YZ Orbital 3 p. Z X Z Y X Y Orbital 3 p. Y X Z Z Y X Orbital 3 d X 2 Y X Orbital 3 d Z 2

Al emplear los parámetros n, l y m en la ecuación de onda de Schrödinger, se logró conocer los lugares de máxima probabilidad (orbitales) para ubicar a un electrón dentro de un átomo, esto fue un gran avance para conocer la estructura electrónica del átomo y permitió justificar muchas características físicas y químicas de los elementos; sin embargo, fue necesario introducir un cuarto número cuántico, para tomar en cuenta los efectos relativistas y poder explicar el diamagnetismo y paramagnetismo que presentan los átomos de los elementos.

Número Cuántico de Espin El cuarto número cuántico se denota con una letra s y se le denomina número cuántico de espin o de giro del electrón. Este número tiene dos valores por cada valor del número cuántico m; los valores son +½ y -½, y denotan los dos posibles giros del electrón alrededor de su propio eje. El cuarto número cuántico se denota con una letra s y se le denomina número cuántico de espin o de giro del electrón.

Número Cuántico de Espin Norte magnético Sur magnético Norte magnético

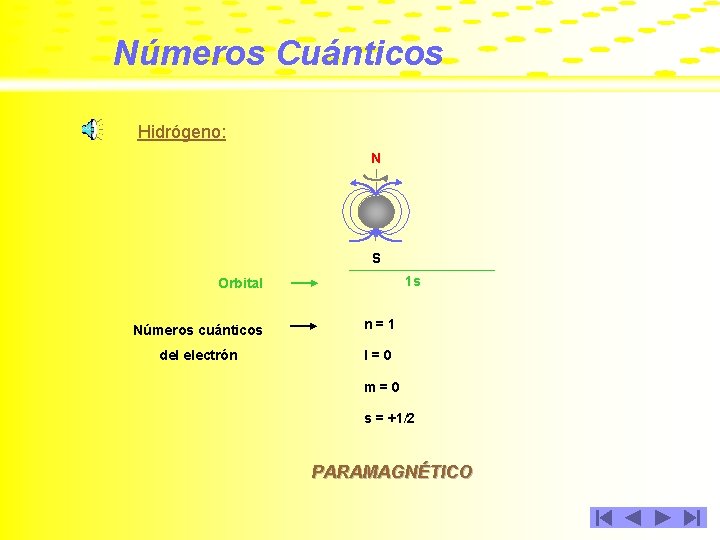
Números Cuánticos Hidrógeno: N S 1 s Orbital Números cuánticos n=1 del electrón l=0 m=0 s = +1/2 PARAMAGNÉTICO

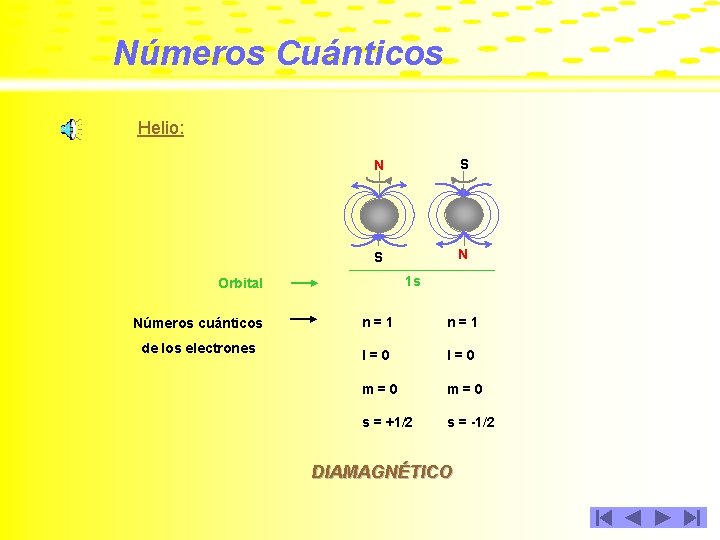
Números Cuánticos Helio: N S S N 1 s Orbital Números cuánticos de los electrones n=1 l=0 m=0 s = +1/2 s = -1/2 DIAMAGNÉTICO

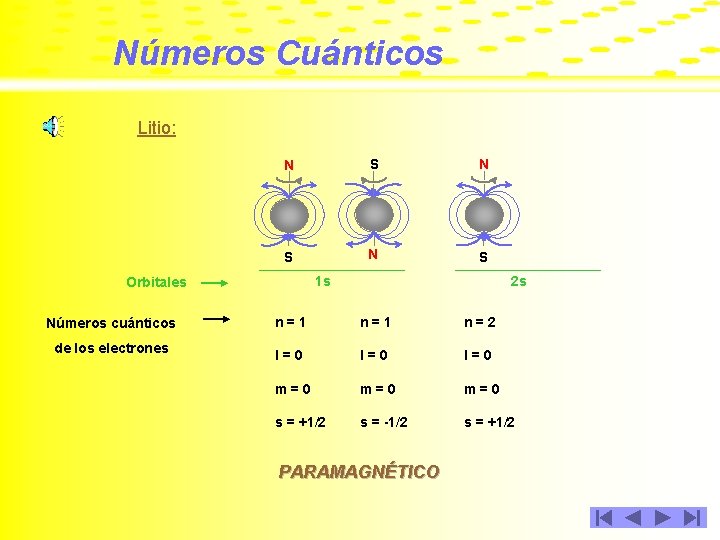
Números Cuánticos Litio: N S N S Números cuánticos de los electrones 2 s 1 s Orbitales n=1 n=2 l=0 l=0 m=0 m=0 s = +1/2 s = -1/2 s = +1/2 PARAMAGNÉTICO

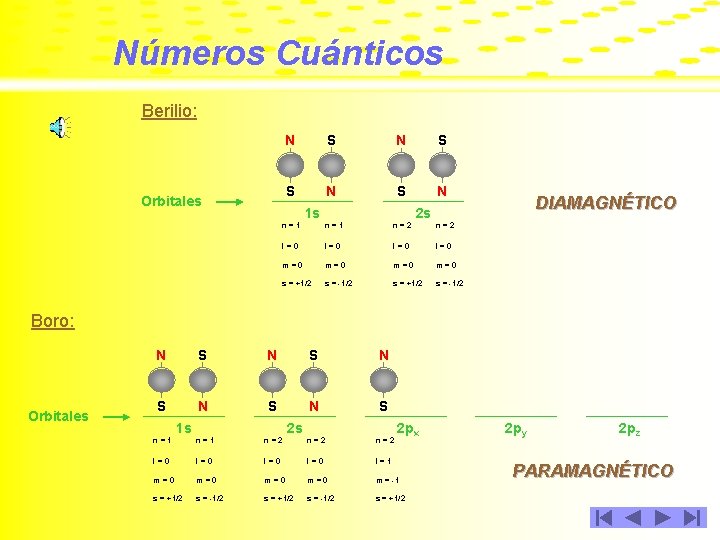
Números Cuánticos Berilio: Orbitales N S S N 1 s DIAMAGNÉTICO 2 s n=1 n=2 l=0 l=0 m=0 m=0 s = +1/2 s = -1/2 Boro: Orbitales N S N S N S 1 s 2 s 2 px n=1 n=2 n=2 l=0 l=0 l=1 m=0 m=0 m = -1 s = +1/2 s = -1/2 s = +1/2 2 py 2 pz PARAMAGNÉTICO

Cuestionario de repaso: Opciones 1 Esférica 2 p 3 De 0 a infinito Enunciado: 4 d a) El número cuántico ___ indica el tipo de orbital que describe el electrón. 5 De –l a + l 6 Secundario 7 Diamagnético 8 s 9 De 0 a n Presiona el número que corresponde a tu elección aquí 1 2 3 4 5 6 7 8 9 10 11 12 13 14 10 Con dos lóbulos 11 Magnético 12 Paramagnético 13 Principal 14 De espín

Cuestionario de repaso: Opciones 1 Esférica 2 p 3 De 0 a infinito Enunciado: b) 4 d Cuando el número cuántico azimutal adquiere el valor de 2, el orbital es del tipo ___. 5 De –l a + l 6 Secundario 7 Diamagnético 8 s 9 De 0 a n Presiona el número que corresponde a tu elección aquí 1 2 3 4 5 6 7 8 9 10 11 12 13 14 10 Con dos lóbulos 11 Magnético 12 Paramagnético 13 Principal 14 De espín

Cuestionario de repaso: Opciones 1 Esférica 2 p 3 De 0 a infinito Enunciado: 4 d c) El número cuántico ___, se denota con una letra m 5 De –l a + l 6 Secundario 7 Diamagnético 8 s 9 De 0 a n Presiona el número que corresponde a tu elección aquí 1 2 3 4 5 6 7 8 9 10 11 12 13 14 10 Con dos lóbulos 11 Magnético 12 Paramagnético 13 Principal 14 De espín

Cuestionario de repaso: Opciones 1 Esférica 2 p 3 De 0 a infinito Enunciado: 4 d d) El número cuántico magnético, adquiere valores que van ___. 5 De –l a + l 6 Secundario 7 Diamagnético 8 s 9 De 0 a n Presiona el número que corresponde a tu elección aquí 1 2 3 4 5 6 7 8 9 10 11 12 13 14 10 Con dos lóbulos 11 Magnético 12 Paramagnético 13 Principal 14 De espín

Cuestionario de repaso: Opciones 1 Esférica 2 p 3 De 0 a infinito Enunciado: 4 d e) Cuando un átomo tiene electrones desapareados, se dice que es un átomo ___. 5 De –l a + l 6 Secundario 7 Diamagnético 8 s 9 De 0 a n Presiona el número que corresponde a tu elección aquí 1 2 3 4 5 6 7 8 9 10 11 12 13 14 10 Con dos lóbulos 11 Magnético 12 Paramagnético 13 Principal 14 De espín

Cuestionario de repaso: Opciones 1 Esférica 2 p 3 De 0 a infinito Enunciado: 4 d f) El número cuántico ___ indica la órbita o nivel energético en el que se encuentra el electrón. 5 De –l a + l 6 Secundario 7 Diamagnético 8 s 9 De 0 a n Presiona el número que corresponde a tu elección aquí 1 2 3 4 5 6 7 8 9 10 11 12 13 14 10 Con dos lóbulos 11 Magnético 12 Paramagnético 13 Principal 14 De espín

Cuestionario de repaso: Opciones 1 Esférica 2 p 3 De 0 a infinito Enunciado: 4 d g) Cuando el número cuántico secundario adquiere el valor de cero, la forma geométrica que describe el 3 4 7 Diamagnético 9 De 0 a n Presiona el número que corresponde a tu elección aquí 2 6 Secundario 8 s electrón es ___. 1 5 De –l a + l 5 6 7 8 9 10 11 12 13 14 10 Con dos lóbulos 11 Magnético 12 Paramagnético 13 Principal 14 De espín

ECUACIÓN DE ONDA DE SCHRÖDINGER En 1926, Erwin Schrödinger postuló una ecuación, conocida como ecuación de onda, que le permitió calcular los niveles de energía en un átomo, fundando así, una nueva mecánica, la de las partículas subatómicas, que se llamó mecánica cuántica. Las soluciones de la ecuación de onda describen los diferentes estados disponibles para los electrones en el interior de los átomos, estos estados quedaban descritos por tres números cuánticos; sin embargo, en 1928, Paul A. M. Dirac reformuló la mecánica cuántica del electrón para tener en cuenta los efectos de la relatividad, dando lugar a un cuarto número cuántico. Regresar

DIAMAGNETISMO Y PARAMAGNETISMO Cuando en una sustancia todos los orbitales contienen dos electrones (electrones apareados), se observa que al colocar dicha sustancia bajo la influencia de un campo magnético externo, es debilmente repelida y se dice entonces que es una sustancia diamagnética; en contraste, una sustancia que contiene uno o más orbitales con un solo electrón (electrones desapareados), es atraída por un campo magnético externo, y se dice que es una sustancia paramagnética. Regresar

Por favor, envíe sus comentarios y sugerencias acerca de esta presentación a la dirección electrónica siguiente: velasquez 4@yahoo. com
 Intervalos automáticos o manuales
Intervalos automáticos o manuales Se despide un genio gabriel garcia marquez
Se despide un genio gabriel garcia marquez Carta de despedida de gabriel garcia marquez
Carta de despedida de gabriel garcia marquez Bibliografia de gabriel garcia marquez
Bibliografia de gabriel garcia marquez Gêneros textuais definição e funcionalidade
Gêneros textuais definição e funcionalidade Nmeros enteros
Nmeros enteros Nmeros enteros
Nmeros enteros Nmeros naturales
Nmeros naturales Nmeros ordinales
Nmeros ordinales Nmeros enteros
Nmeros enteros Numeral cardinal
Numeral cardinal Divisível por 7
Divisível por 7 Nmeros ordinales
Nmeros ordinales Numeros poligonales
Numeros poligonales Nmeros ordinales
Nmeros ordinales Los números romanos
Los números romanos Nmeros naturales
Nmeros naturales Nmeros ordinales
Nmeros ordinales Primero segundo tercero cuarto quinto etc
Primero segundo tercero cuarto quinto etc Recta numerica de numeros enteros
Recta numerica de numeros enteros Numero romano ivx
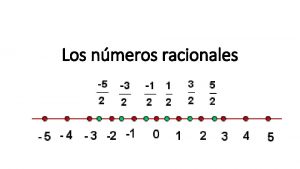
Numero romano ivx Nmeros reales
Nmeros reales Nmeros primos
Nmeros primos Nmeros naturales
Nmeros naturales Nmeros reales
Nmeros reales Ejercicios de números romanos para imprimir
Ejercicios de números romanos para imprimir Nmeros romanos
Nmeros romanos Alfredo di tillio
Alfredo di tillio The sound of silence alfredo jaar
The sound of silence alfredo jaar Alfredo capote
Alfredo capote Antonio alfredo ferreira loureiro
Antonio alfredo ferreira loureiro Alfredo marques gubern
Alfredo marques gubern Alfredo molina triana
Alfredo molina triana Alfredo cuervo barrero
Alfredo cuervo barrero Iepgpe
Iepgpe Alfredo cuervo barrero
Alfredo cuervo barrero