Ng i thc hin Nguyn Yn Th Hong










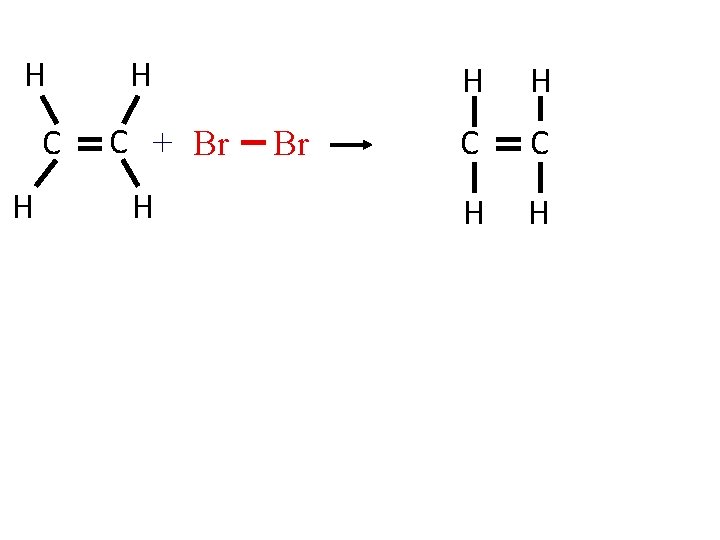










- Slides: 30

Ng êi thùc hiÖn: NguyÔn YÕn ThÞ Hoµng

KiỂM TRA BÀI CŨ Câu 1: Viết công thức cấu tạo của metan (CH 4) và etan (C 2 H 6)? Nêu đặc điểm cấu tạo của metan? Câu 2: Trình bày tính chất hóa học của khí metan (viết PTPƯ minh hoạ)?

Bài 37 - Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: Etilen là chất khí, không màu, ít tan trong nước, nhẹ hơn không khí.

Bài 37 - Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: Etilen là chất khí, không màu, ít tan trong nước, nhẹ hơn không khí. Em hãy so sánh tính chất vật lí của etilen với tính chất vật lí của metan? ? Có hai bình khí không màu, mất nhãn chứa mỗi khí riêng biệt sau: metan và etilen. Dùng tính chất vật lí ta có thể phân biệt được không?

Bài 37 Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: + CTPT: C 2 H 4 H + CTCT: H C H Viết gọn: CH 2 = CH 2 + Đặc điểm liên kết:

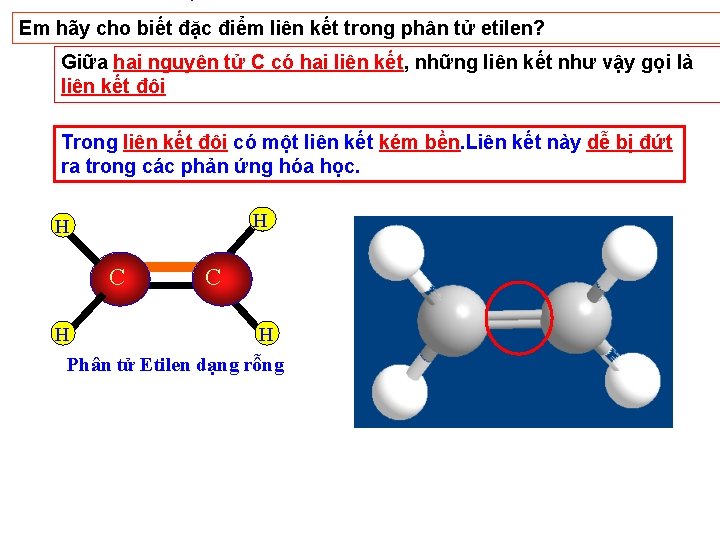
Em hãy cho biết đặc điểm liên kết trong phân tử etilen? Giữa hai nguyên tử C có hai liên kết, những liên kết như vậy gọi là liên kết đôi Trong liên kết đôi có một liên kết kém bền. Liên kết này dễ bị đứt ra trong các phản ứng hóa học. H H C C H H Phân tử Etilen dạng rỗng

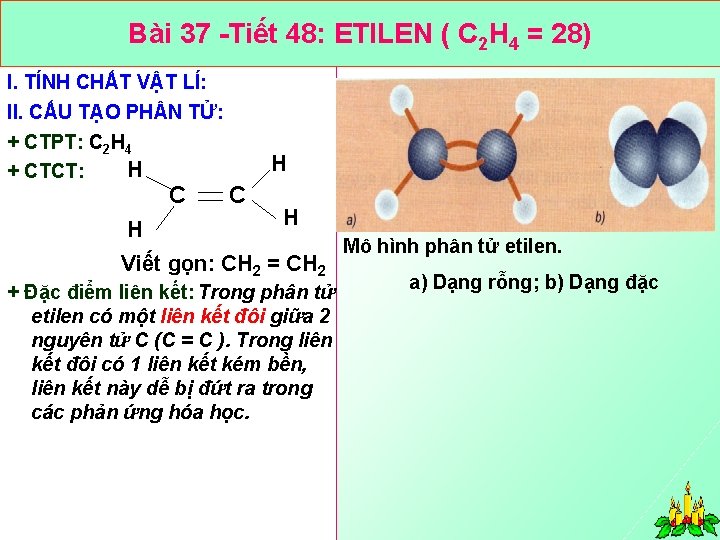
Bài 37 Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: + CTPT: C 2 H 4 H + CTCT: H H C C H Viết gọn: CH 2 = CH 2 + Đặc điểm liên kết: Trong phân tử etilen có một liên kết đôi giữa 2 nguyên tử C (C = C ). Trong liên kết đôi có 1 liên kết kém bền, liên kết này dễ bị đứt ra trong các phản ứng hóa học. Mô hình phân tử etilen. a) Dạng rỗng; b) Dạng đặc

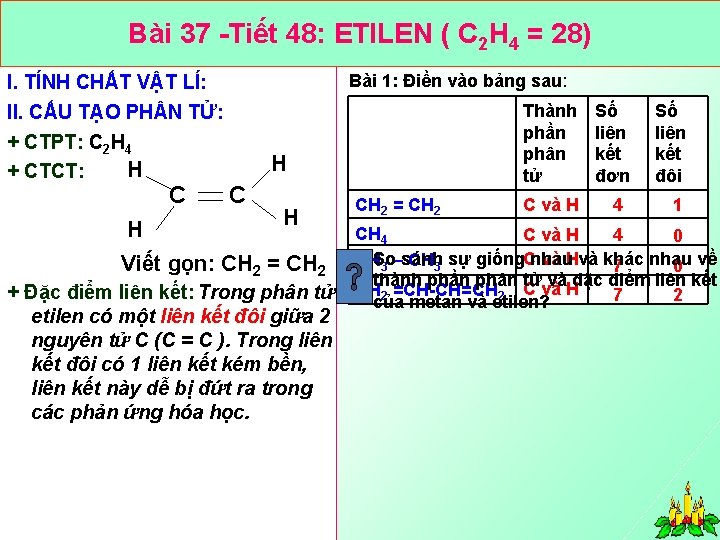
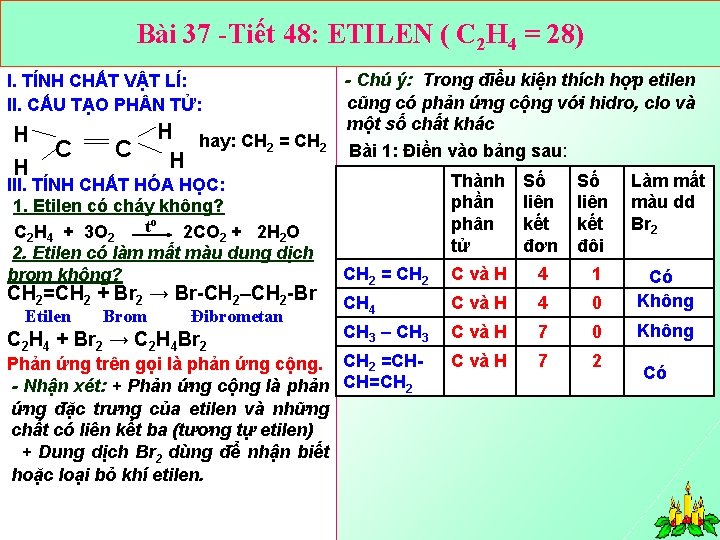
Bài 37 Tiết 48: ETILEN ( C 2 H 4 = 28) Bài 1: Điền vào bảng sau: I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: + CTPT: C 2 H 4 H + CTCT: H Thành phần phân tử H C C H Viết gọn: CH 2 = CH 2 + Đặc điểm liên kết: Trong phân tử etilen có một liên kết đôi giữa 2 nguyên tử C (C = C ). Trong liên kết đôi có 1 liên kết kém bền, liên kết này dễ bị đứt ra trong các phản ứng hóa học. CH 2 = CH 2 C và H Số liên kết đơn 4 Số liên kết đôi 1 CH 4 C và H 4 0 sánh sự giống. Cnhau và Hvà khác CHSo 3 – CH 3 7 nhau 0 về thành phần phân tử và đặc điểm liên kết CH 2 =CH CH=CH 2 C và H 7 2 của metan và etilen?

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 H Trong phân tử etilen có một liên kết đôi giữa 2 nguyên tử C (C = C ). Trong liên kết đôi có 1 liên kết kém bền, liên kết này dễ bị đứt ra trong các phản ứng hóa học. III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2 2 Khi sử dụng các chất khí cháy được Tương tự metan, etilen sinh ra phải ý điều gì? cacbonic và hơi nước, sản chú phẩm là khí đồng thời tỏa nhiều nhiệt

Khi sử dụng các chất khí cháy được phải hết sức cẩn thận.

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 H Có hai bình khí không màu, mất nhãn chứa Tương tự metan, etilen cháy sinh ra mỗi khí riêng biệt sau: metan và etilen. sản phẩm là khí cacbonic và hơi nước, đồng thời tỏa nhiều nhiệt Trong phân tử etilen có một liên kết đôi giữa 2 nguyên tử C (C = C ). Trong liên kết đôi có 1 liên kết kém bền, liên kết này dễ bị đứt ra trong các phản ứng hóa học. III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 Dựa vào phản ứng cháy ta có thể phân 2 2 biệt được không?

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28)

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 H Trong phân tử etilen có một liên kết đôi giữa 2 nguyên tử C (C = C ). Trong liên kết đôi có 1 liên kết kém bền, liên kết này dễ bị đứt ra trong các phản ứng hóa học. III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không?

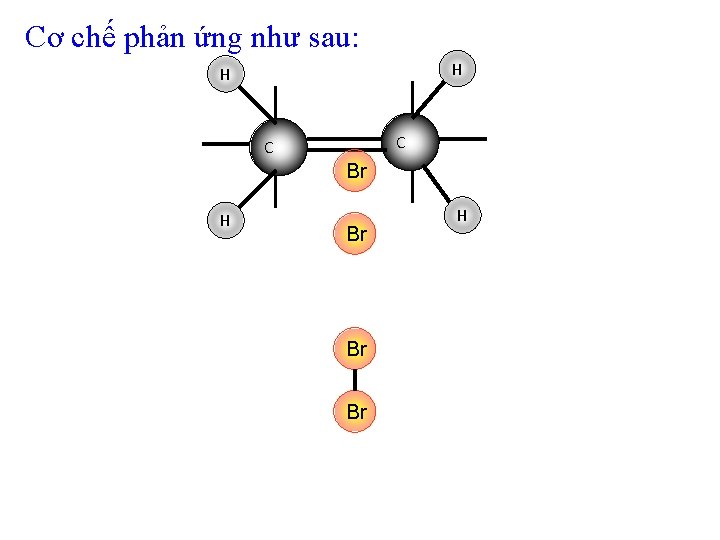
Cơ chế phản ứng như sau: H H C C Br H Br Br Br H

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 H Trong phân tử etilen có một liên kết đôi giữa 2 nguyên tử C (C = C ). Trong liên kết đôi có 1 liên kết kém bền, liên kết này dễ bị đứt ra trong các phản ứng hóa học. III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không?
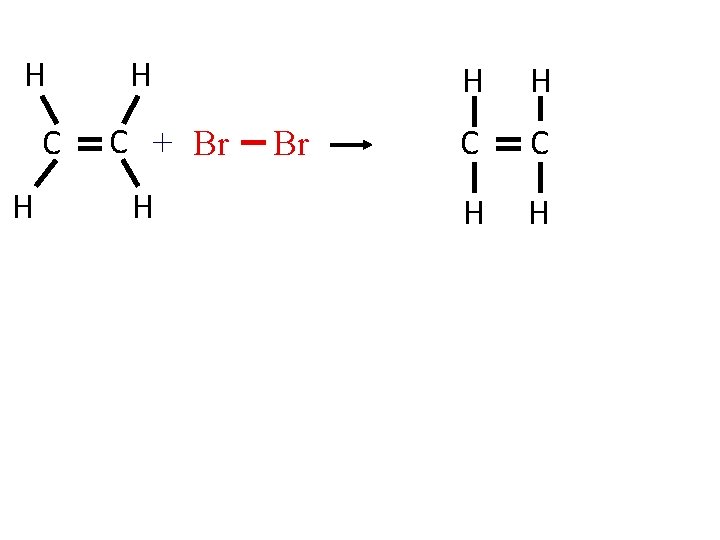
H C H H C + Br H H C C H H

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C - Chú ý: Trong điều kiện thích hợp etilen cũng có phản ứng cộng với hidro, clo và một số chất khác H hay: CH = CH 2 2 Có hai bình khí không màu, mất nhãn chứa H III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không? mỗi khí riêng biệt sau: metan và etilen. CH 2=CH 2 + Br 2 → Br CH 2–CH 2 Br Etilen Brom Đibrometan C 2 H 4 + Br 2 → C 2 H 4 Br 2 Phản ứng trên gọi là phản ứng cộng. Em hãy nêu cách phân biệt chúng? - Nhận xét: + Phản ứng cộng là phản ứng đặc trưng của etilen và những chất có liên kết ba (tương tự etilen) + Dung dịch Br 2 dùng để nhận biết hoặc loại bỏ khí etilen

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 H - Chú ý: Trong điều kiện thích hợp etilen cũng có phản ứng cộng với hidro, clo và một số chất khác Bài 1: Điền vào bảng sau: Thành phần phân tử Số liên kết đơn Số liên kết đôi Làm mất màu dd Br 2 CH 2 = CH 2 C và H 4 1 CH 4 C và H 4 0 Có Không CH 3 – CH 3 C và H 7 0 Không Phản ứng trên gọi là phản ứng cộng. CH 2 =CH - Nhận xét: + Phản ứng cộng là phản CH=CH 2 ứng đặc trưng của etilen và những chất có liên kết ba (tương tự etilen) + Dung dịch Br 2 dùng để nhận biết hoặc loại bỏ khí etilen. C và H 7 2 III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không? CH 2=CH 2 + Br 2 → Br CH 2–CH 2 Br Etilen Brom Đibrometan C 2 H 4 + Br 2 → C 2 H 4 Br 2 Có

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 Bài 2: Dùng phương pháp nào để làm H III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không? CH 2=CH 2 + Br 2 → Br CH 2–CH 2 Br Etilen Brom - Chú ý: Trong điều kiện thích hợp etilen cũng có phản ứng cộng với hidro, clo và một số chất khác Đibrometan C 2 H 4 + Br 2 → C 2 H 4 Br 2 Phản ứng trên gọi là phản ứng cộng. - Nhận xét: + Phản ứng cộng là phản ứng đặc trưng của etilen và những chất có liên kết ba (tương tự etilen) + Dung dịch Br 2 dùng để nhận biết hoặc loại bỏ khí etilen sạch metan có lẫn khí etilen? A. Đốt cháy hỗn hợp. B. Dẫn hỗn hợp lội qua dd Br 2 dư. B C. Dẫn hỗn hợp lội qua dd Ca(OH)2 D. Dẫn hỗn hợp lội qua dd Na. OH.

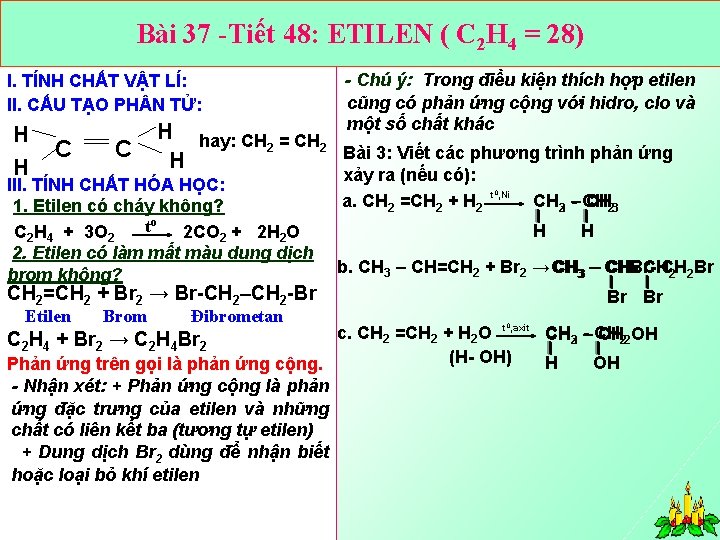
Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C - Chú ý: Trong điều kiện thích hợp etilen cũng có phản ứng cộng với hidro, clo và một số chất khác H hay: CH = CH 2 2 Bài 3: Viết các phương trình phản ứng H III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không? xảy ra (nếu có): a. CH 2 =CH 2 + H 2 t 0, Ni H Brom Đibrometan H b. CH 3 – CH=CH 2 + Br 2 → CH 33 – CHBr CH CHCH 2 2 Br CH 2=CH 2 + Br 2 → Br CH 2–CH 2 Br Etilen CH 32 – CH CH 23 Br Br t , axit c. CH =CH + H O CH 23 – CH CH 22 OH 2 2 2 C 2 H 4 + Br 2 → C 2 H 4 Br 2 (H OH) H OH Phản ứng trên gọi là phản ứng cộng. - Nhận xét: + Phản ứng cộng là phản ứng đặc trưng của etilen và những chất có liên kết ba (tương tự etilen) + Dung dịch Br 2 dùng để nhận biết hoặc loại bỏ khí etilen 0

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 H III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không? CH 2=CH 2 + Br 2 → Br CH 2–CH 2 Br Etilen Brom Đibrometan C 2 H 4 + Br 2 → C 2 H 4 Br 2 Phản ứng trên gọi là phản ứng cộng. - Nhận xét: + Phản ứng cộng là phản ứng đặc trưng của etilen và những chất có liên kết ba (tương tự etilen) + Dung dịch Br 2 dùng để nhận biết hoặc loại bỏ khí etilen Quan sát khả năng kết hợp của các phân tử etilen

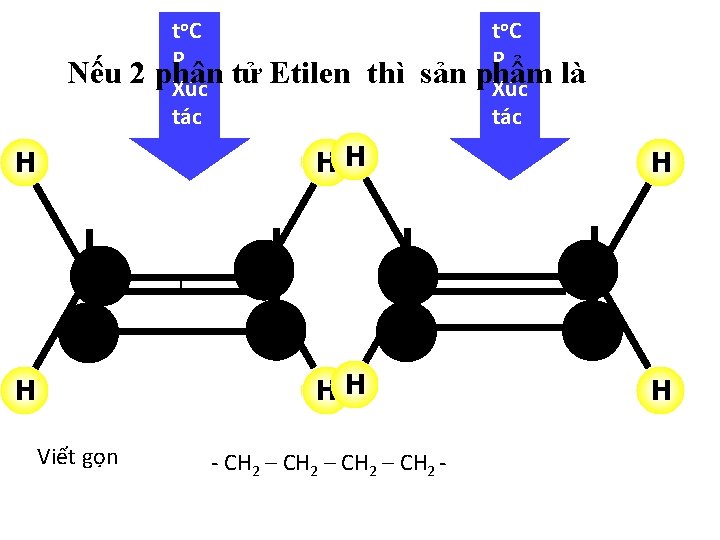
Nếu 2 t o. C P phân Xúc tác H tử Etilen thì sản t o. C P phẩm Xúc tác là HH H 1 H Viết gọn - CH 2 – CH 2 -

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 H III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không? CH 2=CH 2 + Br 2 → Br CH 2–CH 2 Br Etilen Brom Đibrometan C 2 H 4 + Br 2 → C 2 H 4 Br 2 Phản ứng trên gọi là phản ứng cộng. - Nhận xét: + Phản ứng cộng là phản ứng đặc trưng của etilen và những chất có liên kết ba (tương tự etilen) + Dung dịch Br 2 dùng để nhận biết hoặc loại bỏ khí etilen 3. Các phân tử etilen có kết hợp với nhau không? …CH 2=CH 2+CH 2=CH 2+… … CH 2 CH 2 … n. CH 2 = CH 2 Etilen ( CH 2 – CH 2 )n Polietilen (PE) Polietilen là chất rắn, không tan trong nước, không độc. Nó là nguyên liệu quan trọng trong công nghiệp chất dẻo.

Một số sản phẩm làm từ PE

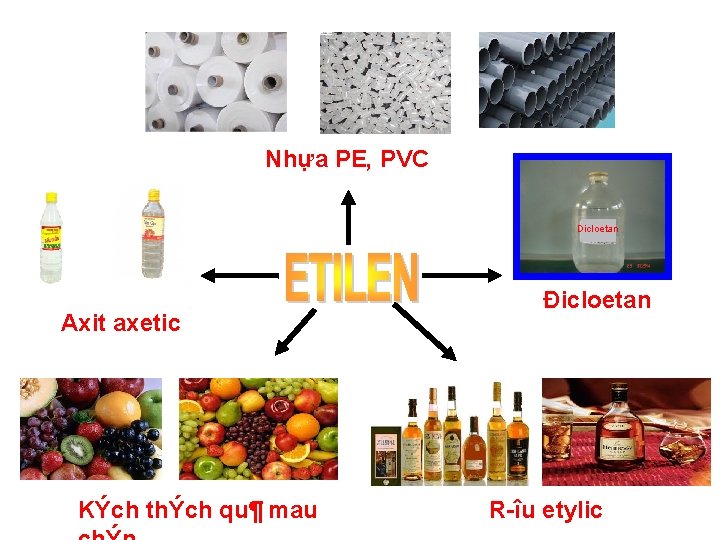
Quan sát hình và nêu ứng dụng của etilen ? Nhựa PE , PVC. ETILEN đicloetan Đicloetan Rượu etylic Kích thích quả mau chín Axit axetic

Nhựa PE, PVC Dicloetan Axit axetic KÝch thÝch qu¶ mau Đicloetan R îu etylic

Bài 37 -Tiết 48: ETILEN ( C 2 H 4 = 28) I. TÍNH CHẤT VẬT LÍ: II. CẤU TẠO PH N TỬ: H H C C H hay: CH = CH 2 2 H III. TÍNH CHẤT HÓA HỌC: 1. Etilen có cháy không? to 2 CO + 2 H O C 2 H 4 + 3 O 2 2. Etilen có làm mất màu dung dịch brom không? CH 2=CH 2 + Br 2 → Br CH 2–CH 2 Br Etilen Brom Đibrometan Phản ứng trên gọi là phản ứng cộng. 3. Các phân tử etilen có kết hợp với nhau không? n. CH 2 = CH 2 ( CH 2 – CH 2 )n Etilen Polietilen (PE) IV. ỨNG DỤNG: Etilen dùng để điều chế PE, PVC, C 2 H 5 OH, CH 3 COOH, đi cloetan…. - Kích thích quả mau chín, …

Bµi tËp 1 Trình bày phương pháp hoá học để phân biệt ba chất khí đựng trong các bình riêng biệt, không dán nhãn: CH 4, C 2 H 4, CO 2 Tr¶ lêi LÇn l ît dÉn 3 chÊt khÝ vµo dung dÞch n íc v «i trong: + NÕu thÊy n íc v «i trong vÈn ®ôc lµ CO 2 + NÕu thÊy n íc v «i trong kh «ng vÈn ®ôc lµ C 2 H 4, CH 4. DÉn hai chÊt khÝ cßn l¹i vµo dung dÞch brom + NÕu thÊy dung dÞch brom bÞ mÊt mµu lµ C 2 H 4. + Cßn l¹i lµ CH 4.

Bài 2: Khi cho 4, 48 li t hô n hơ p khi metan va etilen ơ đktc đi qua bi nh đư ng dung di ch Brom thi lươ ng Brom tham gia pha n ư ng la 16 g. Ti nh tha nh phâ n % thê ti ch mô i khi trong hô n hơ p Vhh m. Br 2 = 44, 8 l =16 g => %VCH 4 =? %VC 2 H 4 =? C 2 H 4 + Br 2 → C 2 H 4 Br 2 Hướng dẫn n. Br 2 = 16/160=0, 1 mol PTHH n. C 2 H 4 = n. Br 2 =0, 1 mol VC 2 H 4 = %VC 2 H 4 =? 0, 1. 22, 4=2, 24 l => %VCH 4 =?

Học kỹ phần tính chất vật lý, công thức cấu tao, đặc điểm liên kết, tính chất hóa học của metan và etilen Làm bài tập 1 4 SGK trang 119 Đọc phần em có biết Đọc bài axetilen