NEOPLASIE GASTRICHE ADENOCARCINOMA 90 95 LINFOMI MALT 4



























- Slides: 38

NEOPLASIE GASTRICHE - ADENOCARCINOMA 90 -95% LINFOMI (MALT) 4% CARCINOIDI 3% SARCOMI 2% GIST-NET <2%

ADENOCARCINOMA EPIDEMIOLOGIA: VI POSTO come incidenza in entrambi i sessi (11, 7 casi/100. 000) V POSTO come mortalità (8, 4 decessi/100. 000) PREVALENZA NEL SESSO MASCHILE (M: F 1, 5: 2, 1) NOTEVOLE VARIAZIONE GEOGRAFICA: - Paesi a più elevata incidenza quali Giappone, Portogallo, Cile, Estonia, Lituania, Slovenia (incidenza intorno ai 20 casi/100. 000); - Paesi ad incidenza più bassa quali USA, Canada, Regno unito, Francia, Norvegia, Svezia (incidenza inferiore ai 10 casi/100. 000) - Paesi ad incidenza intermedia quali Italia, Spagna, Romania, Slovacchia (incidenza tra 10 e 20 casi/100. 000).

DIAGNOSI E STADIAZIONE SOSPETTO CLINICO NEOPLASIA DELLO STOMACO: Malnutrizione con dimagrimento, Anoressia, Dispepsia, Dolore epigastrico, Anemia (ipocromica), Ripienezza e vomito post prandiale, Melena-ematemesi Tumor Nodes Metastases ANAMNESI ESAME OBIETTIVO ETG EGDS CON BIOPSIA TC COMPLETA PER STADIAZIONE ECOENDOSCOPIA LAPAROSCOPIA PET

ISTOTIPI ADENOCARCINOMA PAPILLARE Ben differenziato TUBULARE MUCINOSO Moderato differenziato Scarsamente differenziato FORME RARE Ca adenosquamoso Ca epidermoide Ca a piccole cellule Ca indifferenziato

EGDS CON BIOPSIA L’endoscopia digestiva è fondamentale nella diagnosi del cancro dello stomaco nel 94% dei casi: - Aspetto macroscopico Dimensioni Biopsia per istologico Permette di definire il tipo di resezione che può essere eseguita

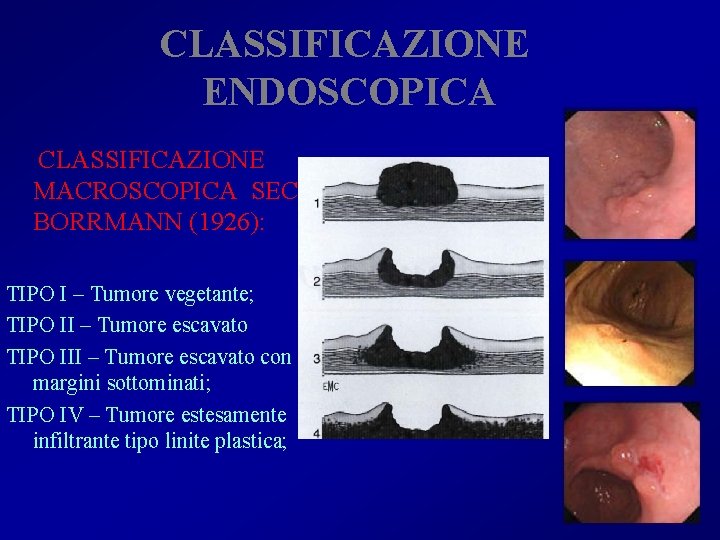
CLASSIFICAZIONE ENDOSCOPICA CLASSIFICAZIONE MACROSCOPICA SEC. BORRMANN (1926): TIPO I – Tumore vegetante; TIPO II – Tumore escavato TIPO III – Tumore escavato con margini sottominati; TIPO IV – Tumore estesamente infiltrante tipo linite plastica;

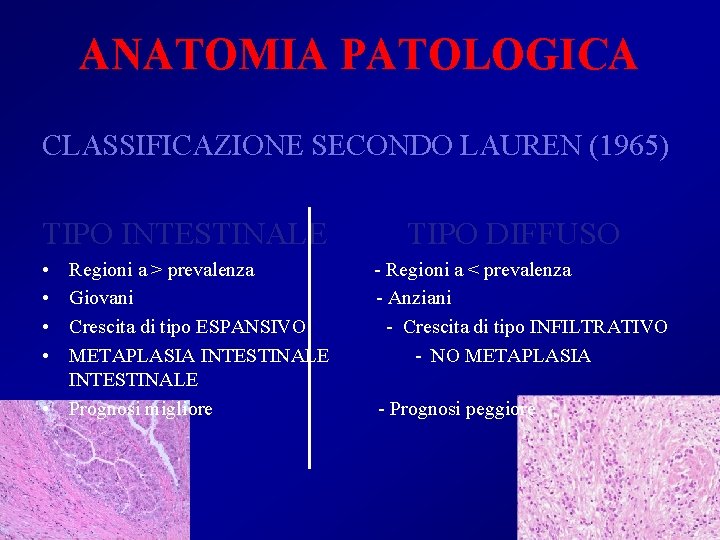
ANATOMIA PATOLOGICA CLASSIFICAZIONE SECONDO LAUREN (1965) TIPO INTESTINALE • • Regioni a > prevalenza Giovani Crescita di tipo ESPANSIVO METAPLASIA INTESTINALE • Prognosi migliore TIPO DIFFUSO - Regioni a < prevalenza - Anziani - Crescita di tipo INFILTRATIVO - NO METAPLASIA - Prognosi peggiore

ANATOMIA PATOLOGICA CLASSIFICAZIONE BIOLOGICO SEC. MING (1977) TIPO ESPANSIVO Noduli esofitici che comprimono le strutture della parete gastrica TIPO INFILTRATIVO Le cellule penetrano diffusamente ed individualmente con coinvolgimento diffuso della parete.

CLASSIFICAZIONE TNM VII ed 2010 • T 1: -T 1 a lamina propria -T 1 b sottomucosa • T 2 muscolare propria • T 3 sottosierosa (era T 2 b) • T 4: - T 4 a perforazione della sierosa - T 4 b strutture adiacenti • • N 1: metastasi in 1 – 2 linfonodi regionali N 2: metastasi in 3 – 6 linfonodi reg. N 3 a: metastasi in 7 – 15 linfonodi reg, N 3 b: metastasi in 16 o più linfonodi reg. Stadio I A T 1 N 0 Stadio I B T 2 N 0 T 1 N 1 Stadio II A T 3 N 0 T 2 N 1 T 1 N 2 Stadio II B T 4 a N 0 T 3 N 1 T 2 N 2 T 1 N 3 Stadio III A T 4 a N 1 T 3 N 2 T 2 N 3 Stadio III B T 4 b N 0, N 1 T 4 a N 2 T 3 N 3 Stadio III C T 4 a N 3 T 4 B N 2, N 3 Stadio IV ogni T ogni N M 1

RIEDIZIONE TNM -> FATTORE N • TNM/UICC 1992: “N 1: interessamento dei linfonodi perigastrici entro tre cm dal tumore; N 2: interessamento dei linfonodi perigastrici oltre 3 cm dal tumore o lungo il tronco celiaco e/o lungo i tre rami del tronco celiaco”. • Ed. 2002: N 1: 1 -6 linfonodi regionali con depositi metastatici; N 2: 7 – 15 linfonodi regionali con depositi metastatici; N 3: più di 15 linfonodi regionali con depositi metastatici” • Ultima ed. 2010: N 1: metastasi in 1 – 2 linfonodi regionali; N 2: metastasi in 3 – 6 linfonodi regionali; N 3 a: metastasi in 7 – 15 linfonodi regionali; N 3 b: metastasi in 16 o più linfonodi regionali Si è giunti all’unificazione internazionale del parametro N e più in generale è stato adottato un comune sistema TNM. E’ ora sottolineato un elemento di notevole significato clinico: nell’adenocarcinoma gastrico è sufficiente l’interessamento metastatico di pochi linfonodi, per ottenere un livello prognostico piuttosto sfavorevole.

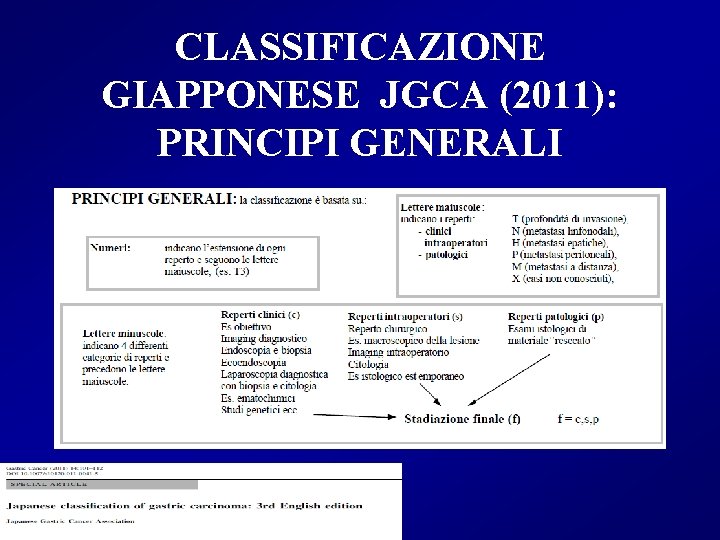
CLASSIFICAZIONE GIAPPONESE JGCA (2011): PRINCIPI GENERALI

CLASSIFICAZIONE GIAPPONESE JGCA (2011): 1) SEDE DEL TUMORE

CLASSIFICAZIONE GIAPPONESE JGCA (2011) 2) MACROSCOPIC TYPES SUBCLASSIFICATION TYPE 0

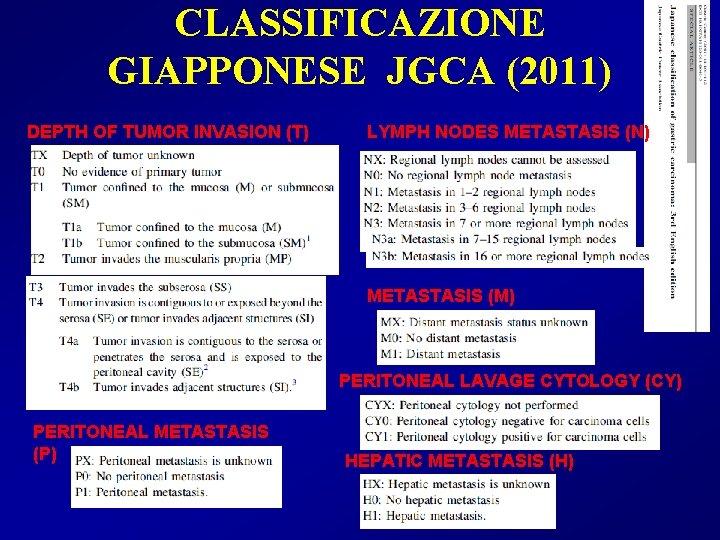
CLASSIFICAZIONE GIAPPONESE JGCA (2011) DEPTH OF TUMOR INVASION (T) LYMPH NODES METASTASIS (N) METASTASIS (M) PERITONEAL LAVAGE CYTOLOGY (CY) PERITONEAL METASTASIS (P) HEPATIC METASTASIS (H)

TRATTAMENTO CHIRURGIA CHEMIOTERAPIA E RADIOTERAPIA ADIUVANTE/NEOADIUVANTE FOLLOW-UP PER 5 ANNI RECIDIVA circa nel 40 -60% dei pazienti trattati chirurgicamente; nell’ 80% entro i primi due anni. RECIDIVA LOCOREGIONALE nel 20 -30%; RECIDIVA A DISTANZA: più frequentemente fegato e peritoneo Follow up prevede: visita clinica incluso il peso, esami ematochimici (Hb, sideremia, funzionalità renale ed epatica) e strumentali da eseguire su necessità clinica. EGDS appare utile in caso di gastrectomia subtotale per la ricerca di recidive locali o cancro su moncone; da ripetere ogni 2 -3 anni.

INDICAZIONI CHIRURGICHE Le indicazioni ed il tipo di trattamento chirurgico dipendono dalle caratteristiche della neoplasia al momento della diagnosi e variano a seconda si tratti di un cancro iniziale (Early Gastric Cancer, EGC), di un cancro avanzato (AGC) , di un cancro avanzato con diffusione agli organi circostanti (T 4 b) o con carcinosi peritoneale.

EARLY GASTRIC CANCER (EGC) ADENOCARCINOMA LIMITATO A MUCOSA E SOTTOMUCOSA SENZA INVASIONE DELLA MUSCOLARIS PROPRIA, SENZA IMPORTANZA PER L’INTERESSAMENTO LINFONODALE. PREVALENZA : USA/EUROPA 10% GIAPPONE 50% Interessamento linfonodale presente nel 5 -20% Sopravvivenza a 10 anni superiore al 90% dopo asportazione

ADVANCED GASTRIC CANCER (AGC) • ADENOCARCINOMA AVANZATO CHE SI ESTENDE OLTRE (LA SOTTOMUCOSA) • PREVALENZA: Europa 60% -> in Italia > nelle regioni del Nord Giappone 40%

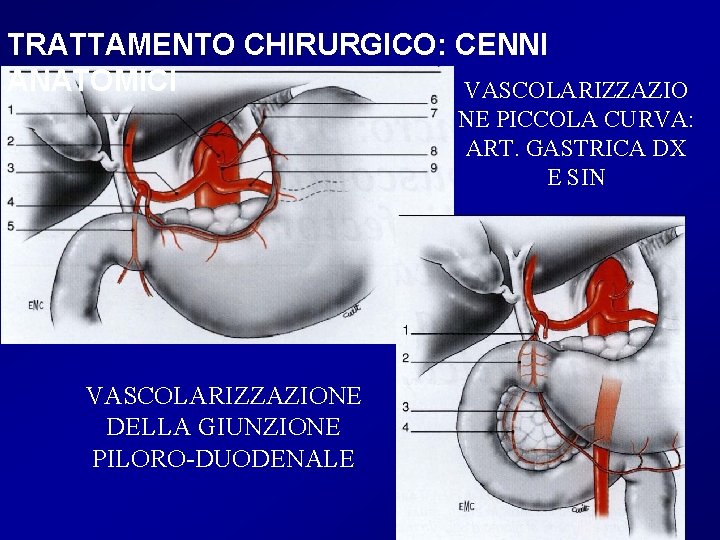
TRATTAMENTO CHIRURGICO: CENNI ANATOMICI VASCOLARIZZAZIO NE PICCOLA CURVA: ART. GASTRICA DX E SIN VASCOLARIZZAZIONE DELLA GIUNZIONE PILORO-DUODENALE

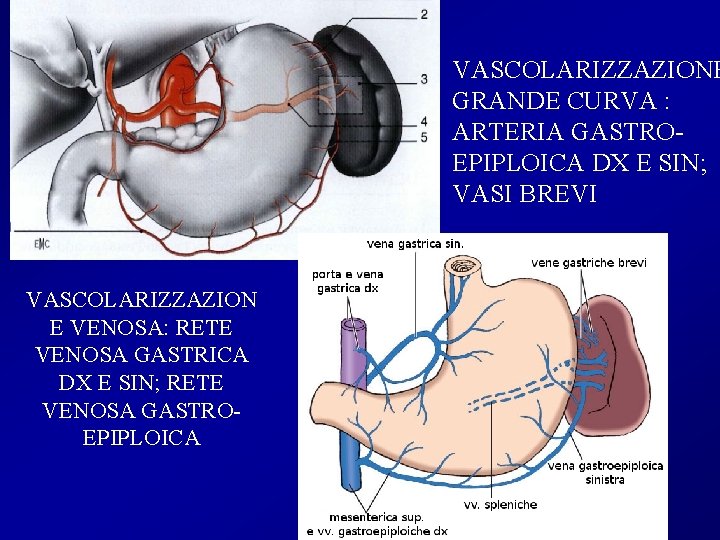
VASCOLARIZZAZIONE GRANDE CURVA : ARTERIA GASTROEPIPLOICA DX E SIN; VASI BREVI VASCOLARIZZAZION E VENOSA: RETE VENOSA GASTRICA DX E SIN; RETE VENOSA GASTROEPIPLOICA

STOMACO: ANATOMIA LINFATICA DRENAGGIO LINFATICO STOMACO SEC. JRSGC: 16 SITI DI DRENAGGIO LINFATICO SIGNIFICATO: ACCRESCERE LA RADICALITA’ ONCOLOGICA E MIGLIORARE LA SOPRAVVIVENZA D 2 R 0


RX: la presenza di tumore residuo non può essere valutata; R 0: assenza di tumore residuo; R 1: residuo tumorale microscopico R 2: residuo tumorale macroscopicamente evidente

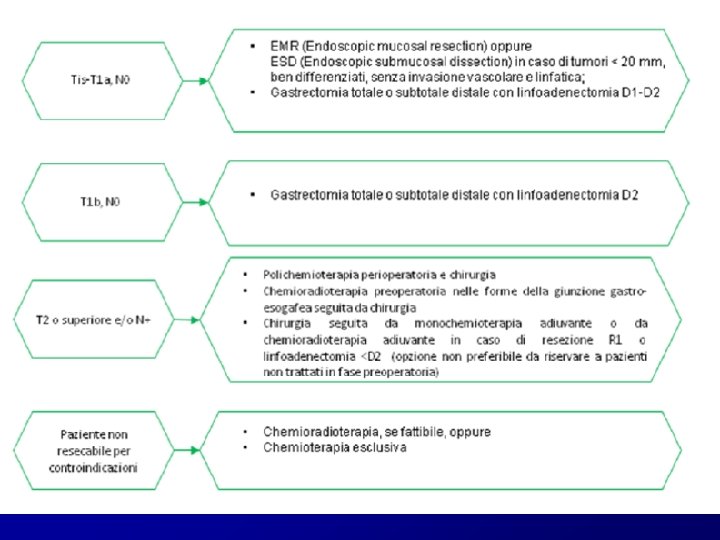
NUOVE TECNICHE DI RESEZIONE ENDOSCOPICA: EMR Resezione Endoscopica limitata alla mucosa ESD Resezione endoscopica comprendente la sottomucosa INDICAZIONI: EGC di tipo intestinale sec. la classificazione di Lauren, limitato alla mucosa, ben differenziato, di diametro non superiore ai 2 cm e senza invasione linfatica o vascolare e/o ulcera intra-lesionale. Se all’esame istologico definitivo si conferma una resezione endoscopica R 0 e la neoplasia presenta tutte le caratteristiche istologiche descritte secondo la Japanese Classification of Gatric Carcinoma, non sono necessari ulteriori trattamenti chirurgici. CONSIGLIATO in casi selezionati e quando la stadiazione preoperatoria della lesione è sufficientemente accurata.

GASTRORESEZIONE TOTALE O SUBTOTALE INDICAZIONI : EGC che non presentino le caratteristiche istologiche o stadiative di cui sopra. TECNICA: trattamento di scelta gastroresezione totale o subtotale distale con un margine libero di almeno 2 cm e linfoadenectomia D 1/D 1+ LINFOADENECTOMIA D 1 RO (sec nuova classificazione giapponese 1 -7) indicata per i T 1 a per cui non è indicata una resezione endoscopica e per i c. T 1 b. N 0 di tipo differenziato e di diametro inferiore a 15 mm. LINFOADENECTOMIA D 1+ (che comprende i linfonodi 1 -9) indicata per gli altri tumori T 1 N 0 LINFOADENECTOMIA D 2 non vi è certezza sulle caratteristiche dell’EGC che rendano improbabile una metastatizzazione linfonodale; TECNICA DEL LINFONODO SENTINELLA impiegata per eseguire linfoadenectomie meno estese TUTTAVIA la tecnica non risulta molto affidabile per l’elevato numero di linfonodi sentinella che vengono identificati e l’alta frequenza di falsi negativi.

TEMPI DELLA GASTRECTOMIA 1° TEMPO: SCOLLAMENTO COLO-EPIPLOICO 2° TEMPO: LEGATURA DELL’ARTERIA GASTRO-EPIPLOICA DX 3° TEMPO: PREPAZIONE DELL’ARTERIA GASTRICA DX 4° TEMPO: SEZIONE DEL DUODENO 5° TEMPO: PREPARAZIONE DELL’ARTERIA GASTRICA SN 6° TEMPO: SEZIONE DELLO STOMACO 7° TEMPO: RIPRISTINO DELLA CONTINUITA’ RESEZIONE LINFONODALE GRUPPI 1 -3 -4 -5 -6 – 7; d 1+ 9


GASTRECTOMIA TOTALE D 1 1°-5° TEMPO: COME GASTRECTOMIA SUBTOTALE 6° TEMPO: LEGATURA DELL’ESOFAGO E RIPRISTINO DELLA CONTINUITA’ LINFOADENECTOMIA D 1 -> STAZIONI LINFONODALI 1 -7 LINFOADENECTOMIA D 1+ ->STAZIONI LINFONODALI 1 -9

GASTRECTOMIA TOTALE D 2 1°-4° TEMPO: COME GASTRECTOMIA TOTALE D 1 5° TEMPO: ACCESSO AL TRONCO CELIACO 6° TEMPO: DISSEZIONE DELL’ESOFAGO 7° TEMPO: RIPRISTINO DELLA CONTINUITA’ LINFOADENECTOMIA D 2 -> STAZIONI LINFONODALI 1 -12 VARIANTE D 2 SEC. MARUYAMA : D 2 CONSERVAZIONE DEL PANCREAS (min. 15 linfonodi) -> EXERESI SPLENO-PANCREATICA

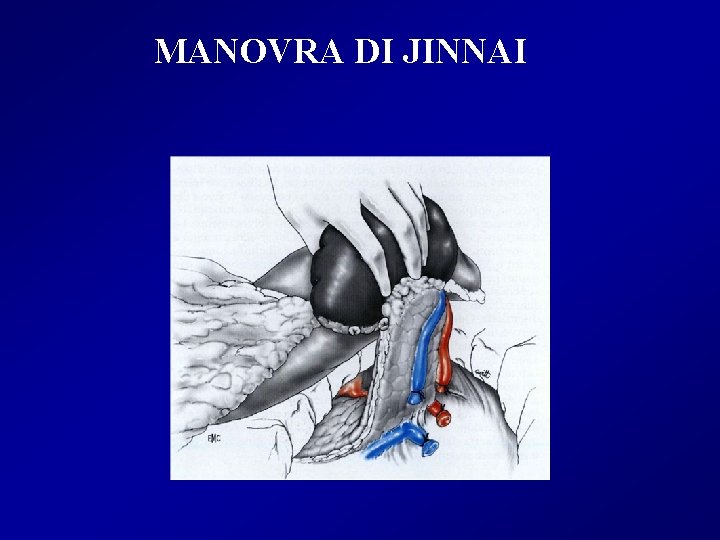
MANOVRA DI JINNAI

GASTRECTOMIA TOTALE D 3 La gastrectomia D 3 è definita D 2+ nell’attuale classificazione. 1° -7° TEMPO: COME D 2 STAZIONI LINFONODALI 12 - 13 -14 -> M 1 sec. JPGCA

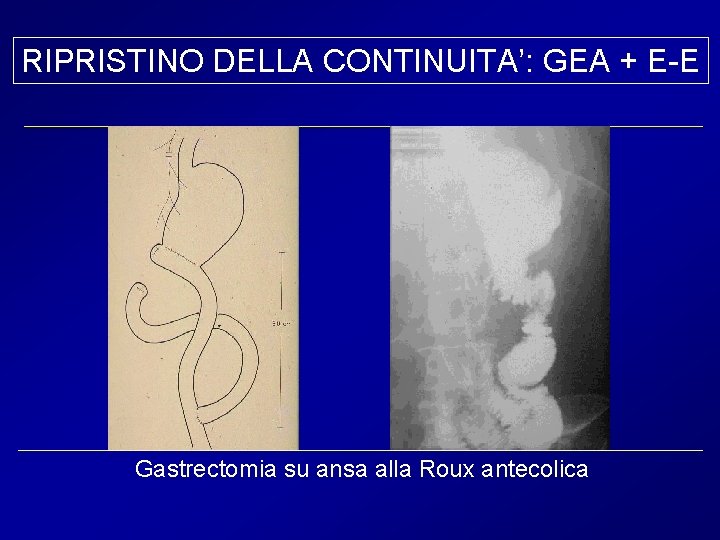
RIPRISTINO DELLA CONTINUITA’: GEA + E-E Gastrectomia su ansa alla Roux antecolica

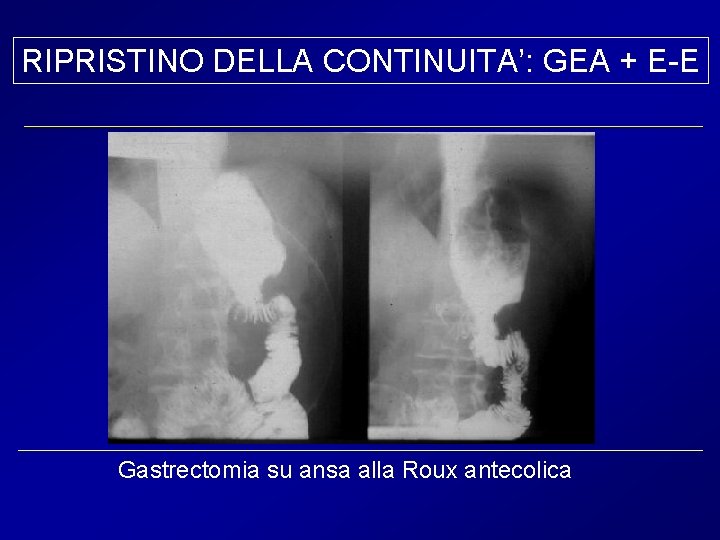
RIPRISTINO DELLA CONTINUITA’: GEA + E-E Gastrectomia su ansa alla Roux antecolica

TRATTAMENTO CHIRURGICO AGC INDICAZIONI: - NP ANTRO E PILORO + LESIONI DEL TERZO MEDIO (a condizione che il margine di resezione prossimale macroscopicamente libero da malattia sia di almeno 4 cm per i tumori di tipo intestinale e di 5 cm in tutti gli altri casi) ->GASTRECTOMIA SUBTOTALE resezione sia prossimale (gastrico) che distale (pilorico) -LESIONI TERZO MEDIO CON MARGINI DI RESEZIONE NON ADEGUATI + LESIONI TERZO SUPERIORE: GASTRECTOMIA TOTALE ESAME ISTOLOGICO DEL MARGINE DI RESEZIONE ESOFAGEO è indicato nelle gastrectomie totali eseguite per neoplasie sotto-cardiali -NP DELLA GIUNZIONE GASTRO- ESOFAGEA (sec TNM 2010 sono classificati come tumori dell’esofago per cui seguono linee guida dedicate sia per estensione parietale sia linfonodale): - GASTRECTOMIA TOTALE ESTESA AD UN TRATTO DI ESOFAGO di almeno 5 cm al di sopra della estensione macroscopica della neoplasia oppure una esofago gastroplastica (Ivory-Lewis) con accesso toraco-addominale. -ovvero RESEZIONE GASTRO-ESOFAGEA conservazione dei 2/3 inferiori dello stomaco ed anastomosi esofago-gastrica. COMPLICANZA PRINCIPALE: RGE. SEMPRE INDICATO ESAME ISTOLOGICO ESTEMPORANEO.

CR GASTRICO AVANZATO T 4 b CON INTERESSAMENTO ORGANI CIRCOSTANTI 15 -20% dei cr gastrici avanzati, al momento della diagnosi, si presenta come una neoplasia T 4 b che supera la sierosa ed infiltra gli organi contigui - 75% infiltrazione limitata ad un solo organo; - 15 -20% sono interessati due organi - 5 -10% sono infiltrati tre o più organi contigui Un intervento curativo per le neoplasie localmente avanzate è realizzabile nel 30 -50% dei casi anche per l’elevata incidenza di metastasi linfonodali extraregionali, riscontrabili nel 10 -20% dei casi. CHEMIOTP PERIOPERATORIA (PRIMA E DOPO) : recenti studi descrivono la potenziale efficacia di trattamenti chemioterapici perioperatori nell'indurre un "downstaging" della neoplasia gastrica localmente avanzata conseguente possibilità di realizzare un numero maggiore di interventi R 0. Questi risultati hanno ridotto, per i tumori T 4, le indicazioni ad interventi chirurgici immediati che vanno quindi riservati a casi molto selezionati.

L’esistenza di un “piano di clivaggio” chirurgico non garantisce l’assenza di infiltrazione di organi circostanti. TECNICA : RESEZIONE GASTRICA ALLARGATA ALLE STRUTTURE E AGLI ORGANI ADIACENTI ALLA NP -SPLENECTOMIA o SPLENECTOMIA CON PANCREASECTOMIA DISTALE indicate in caso di tumori T 4 localizzati al terzo medio e superiore per l’infiltrazione diretta, per l’elevata incidenza di metastasi ai linfonodi dell’ilo splenico e per infiltrazione per contiguità del pancreas. -SURRENALECTOMIA SINISTRA: consigliata sec alcuni autori in caso di linfoadenopatie dubbie dopo accurata esplorazione della regione paraortica laterale sinistra - RESEZIONE DI MESOCOLON, COLON TRASVERSO, SEGMENTI EPATICI DI SIN E DEL DIAFRAMMA: indicate in presenza di una infiltrazione per contiguità

CARCINOSI PERITONEALE La presenza di carcinomatosi peritoneale sincrona o metacrona è frequente in T 3 e T 4, soprattutto nelle forme di tipo diffuso. TRATTAMENTO TRADIZIONALE: -CHIRURGIA RESETTIVA, che non è risultata adeguata; -CHEMIOTP SISTEMICA, che ha dato risultati insoddisfacenti NUOVE METODICHE: PERITONECTOMIA + CHEMIOTP INTRAOPERATORIA IPERTERMICA

Grazie per l’attenzione