Nela Martnkov Anetta Jov VIII B uhlovodky kter

Nela Martínková Anetta Jáňová VIII. B

� uhlovodíky, které obsahují nejméně jeden aromatický kruh � název byl odvozen podle jejich zápachu (vůně) v této době nebyla známa struktura jejich molekul

Názvosloví � často triviální názvy � základní název benzen � uhlovodíkové zbytky se nazývají aryly (např. : benzyl, fenyl, styryl, …)

1. monocyklické – pouze jeden aromatický kruh (např. : benzen, styren) polycyklické – více aromatických kruhů a) s kondenzovanými aromatickými jádry (např. : naftalen, anthracen) b) s izolovanými jádry – jádra jsou oddělena minimálně jednou vazbou (např. : bifenyl) 2.

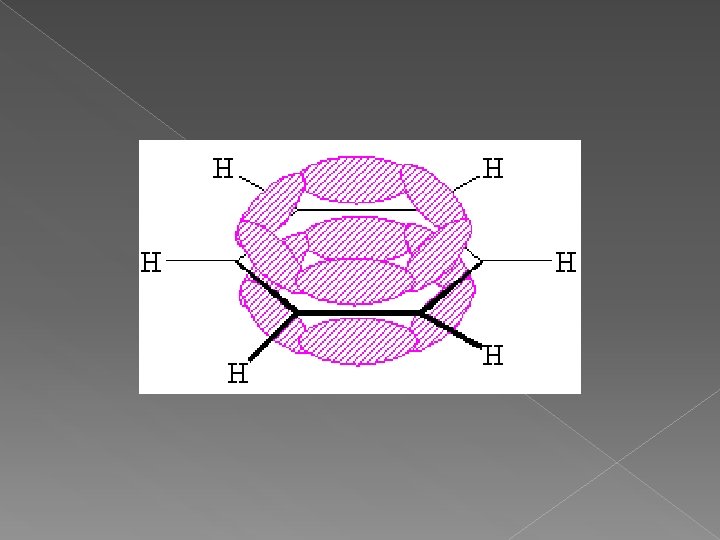
Struktura molekuly benzenu � základní kostru tvoří šestičlenný kruh uhlíkových atomů spojených jednoduchou vazbou � uhlíkové � na atomy leží v jedné rovině každý uhlík vázán jeden atom vodíku jednoduchou vazbou σ

� zbývajících šest elektronů vytváří molekulové orbitaly π ve tvaru kruhového pásu rozprostřeného nad a pod rovinou kruhu � elektrony jsou delokalizovány v těchto pásech a jsou společné všem šesti uhlíkovým atomům � délky vazeb mezi uhlíkovými atomy v kruhu jsou stejné � jsou kratší než u jednoduché vazby, ale delší než u vazby dvojné

Fyzikální vlastnosti � jsou nerozpustné ve vodě, ale rozpustné v organických rozpouštědlech � zapáchají, jsou jedovaté a karcinogenní � benzen, toluen a xylen jsou kapaliny � polycyklické areny jsou pevné látky � vyskytují se v černouhleném dehtu a ropě

Reakce arenů � ELEKTROFILNÍ SUBSTITUCE Typická chemická reakce arenů Ø Π elektrony reagují s elektrofilními činidly Ø Aromatický charakter je zachován Ø Pokud se substituce opakuje, vzniká disubstituovaný produkt Ø
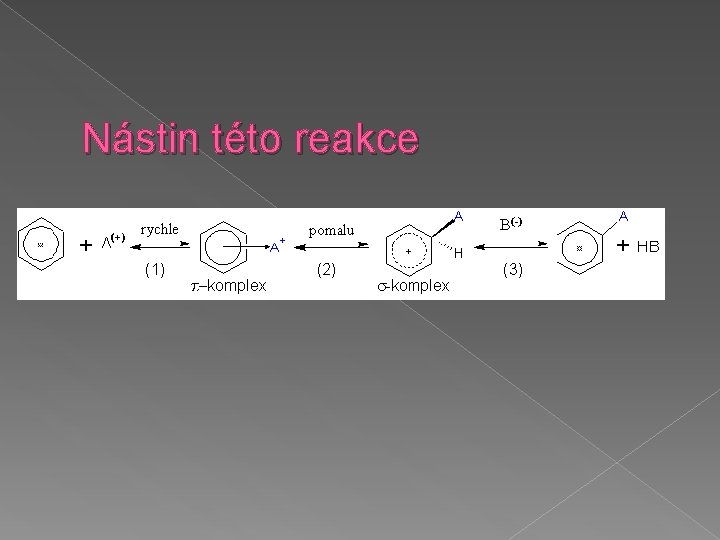
Nástin této reakce

Mezi elektrofilní reakce se řadí: � Nitrace K nitraci se používá kyselina dusičná nebo nitrační směs (HNO 3 + H 2 SO 4) Ø Reakcí obou kyselin vzniká elektrofil NO 2(+). Ø HNO 3 + H 2 SO 4 → H 2 N(+)O 3 + HSO 4(–) (báze) Ø H 2 N(+)O 3 → H 2 O + NO 2(+) (elektrofil) Ø

� Halogenace se provádí halogeny za katalýzy příslušného halogenidu hlinitého či železitého (Lewisovy kyseliny). Ø Xδ+―Xδ–…Al. X 3 → X(+) (elektrofil) + [Al. X 4](–) (báze) Ø Mezi lewisovy kyseliny řadíme: Al. Cl 3, Al. Br 3, Fe. Cl 3, Fe. Br 3 Ø

� Sulfonace Reakce uhlovodíku s H 2 SO 4 Ø Činidlem je oxid sírový Ø Vratná reakce Acylace Ø Působí s acylhalogenidem, anhydridem nebo karboxylovou kyselinou a za přítomnosti Lewisovy kyseliny Ø Vratná reakce Rδ+―Xδ–…Al. X 3 → R(+) (elektrofil) + [Al. X 4](–) (báze) Ø
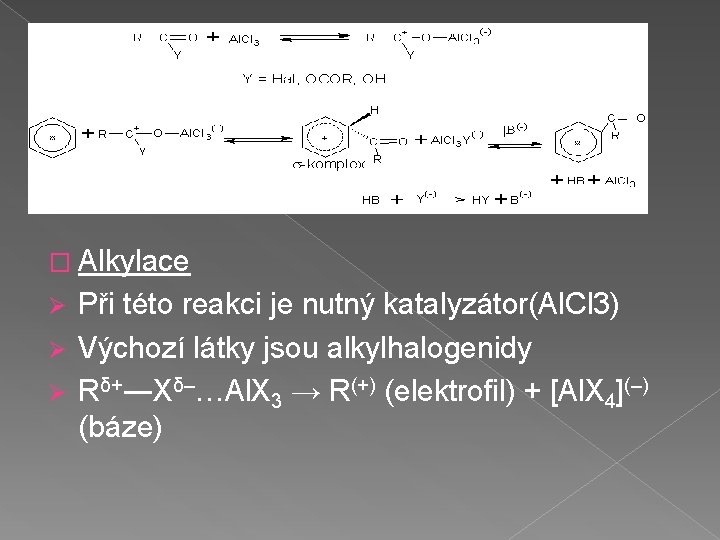
� Alkylace Při této reakci je nutný katalyzátor(Al. Cl 3) Ø Výchozí látky jsou alkylhalogenidy Ø Rδ+―Xδ–…Al. X 3 → R(+) (elektrofil) + [Al. X 4](–) (báze) Ø

Substituenty I. třídy � Usměrňují substituci do poloh orto (2) a para (4). Zároveň jádro vůči dalším elektrofilním substitucím aktivují. � Výjimkou jsou halogeny, které díky svému výraznému -I efektu jádro trochu deaktivují. � Poměr orto a para izomerů ovlivňují především sterické faktory
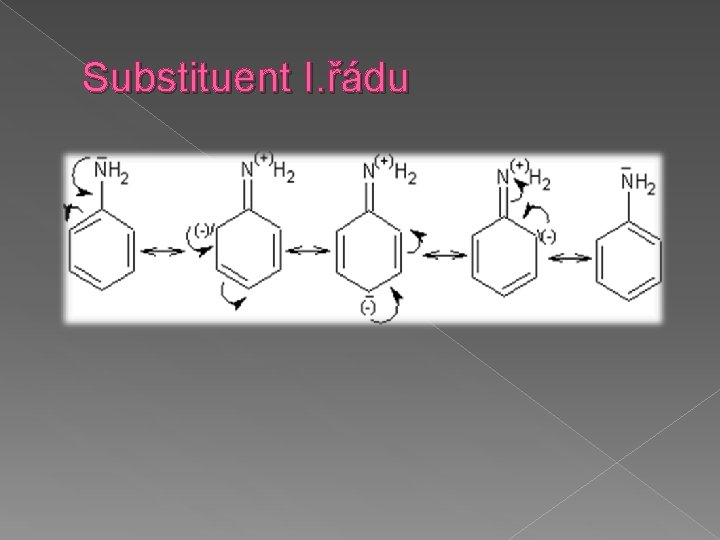
Substituent I. řádu
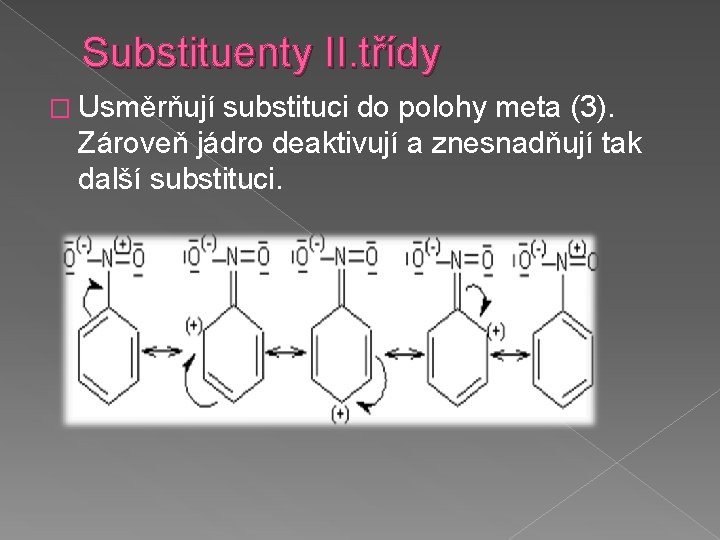
Substituenty II. třídy � Usměrňují substituci do polohy meta (3). Zároveň jádro deaktivují a znesnadňují tak další substituci.

Benzen C 6 H 6 � Organická sloučenina sladkého zápachu � Při pokojové teplotě je to bezbarvá, hořlavá a toxická kapalina známá svými karcinogenními účinky � Má menší hustotu než voda a ve vodě nerozpustný. � Hořením se uvolňují saze. Uhlovodíkový zbytek (funkční skupina) vytvořený od benzenu se nazývá fenyl. � V přírodě se vyskytuje např. v ropě

Využití benzenu: �V průmyslu jako důležité rozpouštědlo a jako výchozí látka � léčiva, kompaktních disků, plastů, syntetické pryže, barviv a výbušnin. � V malém množství se přidává do benzínu pro zlepšení oktanového čísla. Využívá se i k výrobě kosmetických přípravků. Pomocí benzenu se připravují také další důležité chemikálie, především styren, který se používá na výrobu polystyrenu, fenol a cyklohexan používaný při zpracování nylonu.

Zdravotní rizika způsobená benzenem Vdechování malého množství benzenu může způsobit bolest hlavy, pocit únavy, zrychlení srdečního tepu, chvění a ztrátu vědomí. � Velká koncentrace benzenu ve vzduchu může mít za následek i smrt. Benzen poškozuje kostní dřeň a způsobuje chudokrevnost. Benzen je klasifikován jako karcinogen skupiny 1 (rakovinotvorný pro člověka), přičemž způsobuje zejména leukemii a rakovinu plic �
Toluen=methylbenzen Čirá, ve vodě nerozpustná těkavá kapalina, jejíž páry tvoří se vzduchem třaskavou směs. � Zdraví škodlivý. � Toluen se vyskytuje v malém množství v petroleji, z kterého se průmyslově vyrábí. Je možné ho laboratorně připravit reakcí benzenu s chlormethanem, jako katalyzátor se při této reakci používá chlorid hlinitý (Al. Cl 3): CH 3 Cl + C 6 H 6 → C 6 H 5 CH 3 + HCl �

Použití toluenu � Náplň do teploměrů � Rozpouštědlo barev a laků. � Výroba trhaviny TNT, příprava benzenu

Zdravotní rizika způsobená toluenem � Toluen dráždí oči a dýchací cesty, má tlumivý účinek na CNS a kardiovaskulární systém. V organismu se rychle metabolizuje a vylučuje močí. Akutní toxicita je relativně nízká. Při chronické expozici byly popsány neurotoxické účinky, například encefalopatie a poruchy zraku a rovnováhy. Karcinogenita, mutagenita, teratogenita ani reprodukční toxicita zatím nebyly prokázány

Děkujeme za Vaši pozornost. .

� doplnit hybridizaci u molekuly benzenu � zjednodušit definici substituetů I. a II. třídy � reakce arenů zestručnit, ale tak aby zůstala podstata � doplnit podmínky, kdy má látka aromatický charakter
- Slides: 25