Nazwy i wzory soli Kwasy przeciw zasadom Rne































- Slides: 46

• Nazwy i wzory soli. • Kwasy przeciw zasadom. • Różne metody otrzymywania soli. • Sole łatwo i trudno rozpuszczalne w wodzie. • Właściwości soli.

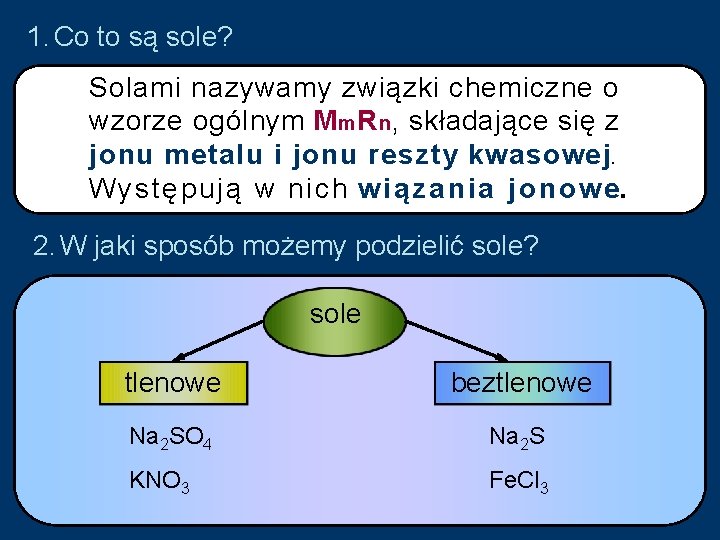
1. Co to są sole? Solami nazywamy związki chemiczne o wzorze ogólnym M m R n, składające się z jonu metalu i jonu reszty kwasowej. Występują w nich w i ą z a n i a j o n o w e. 2. W jaki sposób możemy podzielić sole? sole tlenowe beztlenowe Na 2 SO 4 Na 2 S KNO 3 Fe. Cl 3

3. Jakim reakcjom ulegają wodne roztwory kwasów i zasad? Napisz równania reakcji dysocjacji H 2 SO 4 i KOH. Zarówno kwasy jak i zasady w roztworach wodnych ulegają dysocjacji. Kwas siarkowy (VI) dysocjuje w sposób następujący: Zasada potasowa dysocjuje w sposób następujący:

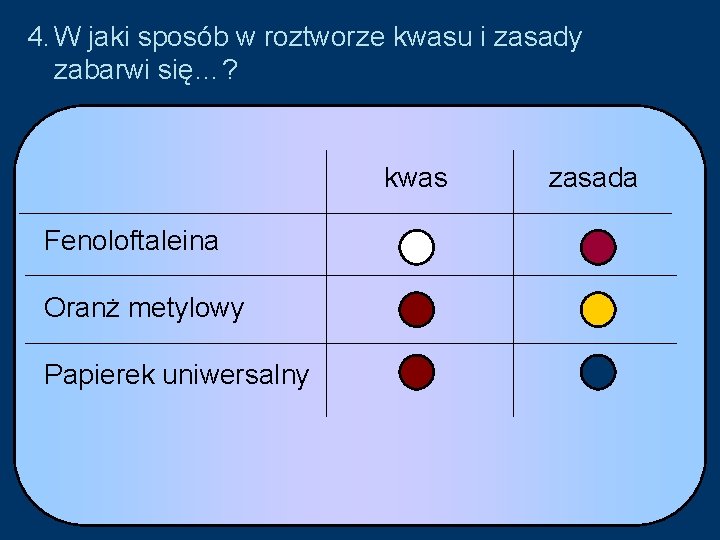
4. W jaki sposób w roztworze kwasu i zasady zabarwi się…? kwas Fenoloftaleina Oranż metylowy Papierek uniwersalny zasada

5. Napisz równanie reakcji (sumarycznie i jonowo) przebiegające pomiędzy kwasem siarkowym (VI) a zasadą potasową. 6. Jak nazywa się typ reakcji, w której kwas reaguje z zasadą? Jest to reakcja zobojętniania.

7. Jaką barwę przyjmie po reakcji wybrany wskaźnik? kwas zasada Fenoloftaleina Oranż metylowy Papierek uniwersalny 8. Jaki jest odczyn soli? Sól ma odczyn obojętny. sól

Temat: Różne metody otrzymywania soli

Różne metody otrzymywania soli METODA I. Reakcja kwasu z zasadą.

METODA I. Reakcja kwasu z zasadą. 1. Napisz równanie reakcji zachodzącej pomiędzy kwasem solnym a zasadą sodową, nazwij produkty. chlorek sodu woda

METODA I. Reakcja kwasu z zasadą. 2. Jak zabarwi się fenoloftaleina w roztworze zasady? Fenoloftaleina zabarwi się na malinowo. 3. Co stanie się z fenoloftaleiną w miarę dodawania kwasu? Fenoloftaleina odbarwi się.

METODA I. Reakcja kwasu z zasadą. Ogólny schemat przebiegu reakcji można zapisać: kwas + zasada → sól + woda np: Jakie będą produkty tej reakcji? 2 HCl + Ca(OH)2 → Ca. Cl 2 + 2 H 2 O chlorek wapnia

Różne metody otrzymywania soli METODA II. Reakcja tlenku metalu z kwasem.

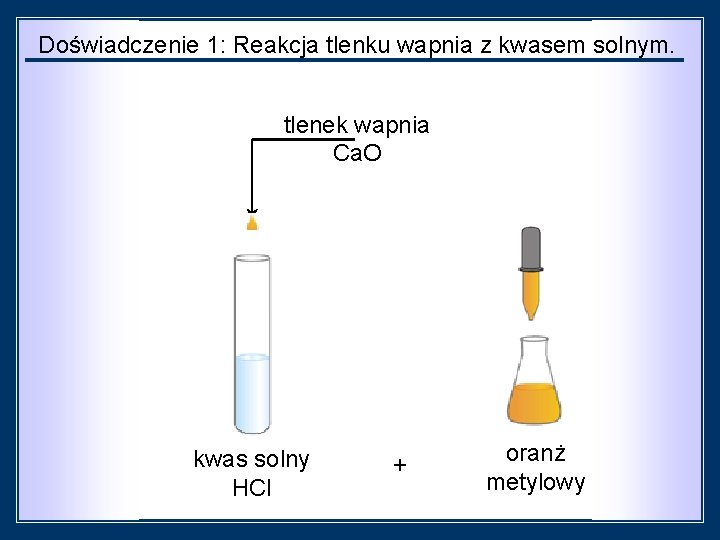
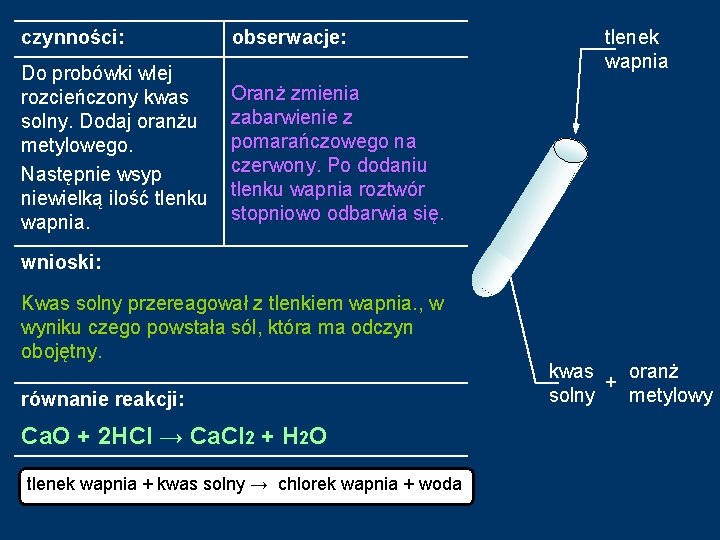
METODA II. Reakcja tlenku metalu z kwasem. Doświadczenie 1: Reakcja tlenku wapnia z kwasem solnym. Sprzęt: 1 probówka Odczynniki: rozcieńczony kwas solny HCl tlenek wapnia Ca. O oranż metylowy

czynności: obserwacje: tlenek wapnia wnioski: równanie reakcji: kwas oranż + solny metylowy

Doświadczenie 1: Reakcja tlenku wapnia z kwasem solnym. tlenek wapnia Ca. O kwas solny HCl + oranż metylowy

czynności: obserwacje: Do probówki wlej rozcieńczony kwas solny. Dodaj oranżu metylowego. Następnie wsyp niewielką ilość tlenku wapnia. Oranż zmienia zabarwienie z pomarańczowego na Oranż zmienia czerwony. Po dodaniu zabarwienie tlenku wapniaz roztwór czerwonego na stopniowo odbarwia się. pomarańczowy. wnioski: Kwas solny przereagował z tlenkiem wapnia. , w wyniku czego powstała sól, która ma odczyn obojętny. równanie reakcji: Ca. O ++2 HCl →→ Ca. Cl 2 + H 2 O Ca. O 2 HCl Ca. Cl 2+ H 2 O tlenek wapnia + kwas solny → chlorek wapnia + woda tlenek wapnia kwas oranż + solny metylowy

METODA II. Reakcja tlenku metalu z kwasem. Ogólny schemat przebiegu reakcji można zapisać: tlenek metalu + kwas → sól + woda np: Jakie będą produkty tej reakcji? Ca. O + 2 HCl → Ca. Cl 2 + H 2 O chlorek wapnia

1. Napisz równanie reakcji przebiegające pomiędzy tlenkiem magnezu a kwasem azotowym (V). Nazwij substraty i produkty reakcji. M g O + 2 H N O 3 → M g ( N O 3 ) 2 + H 2 O tlenek magnezu + kwas azotowy (V) → azotan (V) magnezu + woda

Różne metody otrzymywania soli METODA III. Reakcja tlenku niemetalu z zasadą.

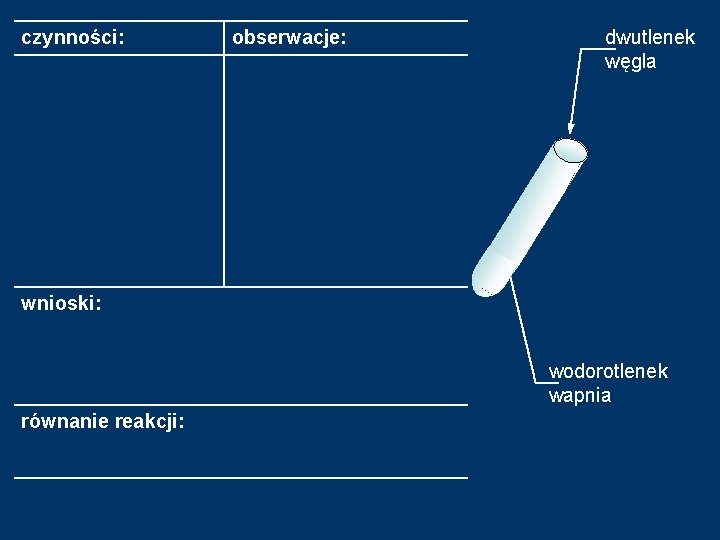
METODA III. Reakcja tlenku niemetalu z zasadą. Doświadczenie 2: Reakcja wodorotlenku wapnia z dwutlenkiem węgla. Sprzęt: 1 probówka rurka szklana Odczynniki: wodorotlenek wapnia Ca(OH)2

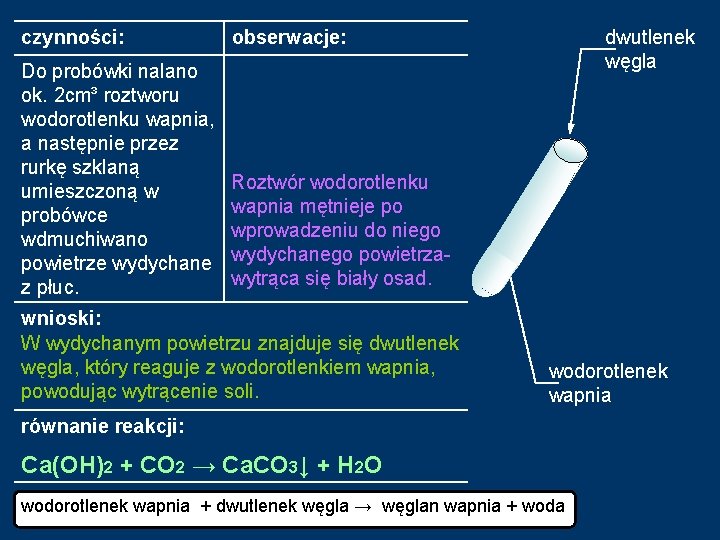
czynności: obserwacje: dwutlenek węgla wnioski: wodorotlenek wapnia równanie reakcji:

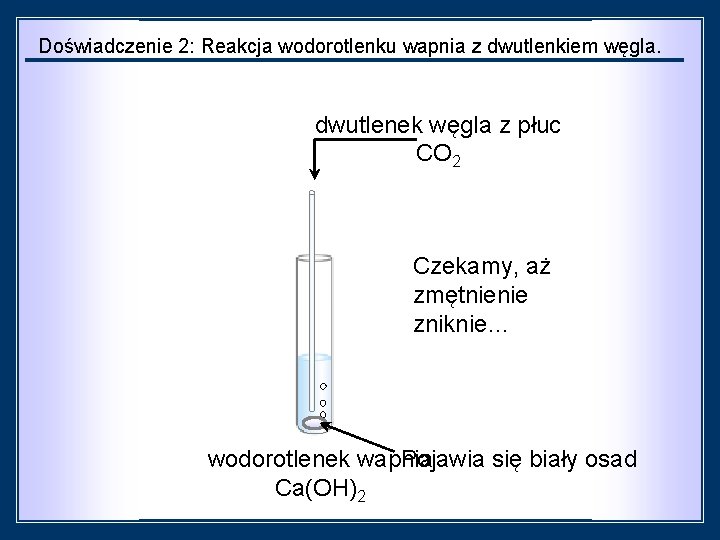
Doświadczenie 2: Reakcja wodorotlenku wapnia z dwutlenkiem węgla. dwutlenek węgla z płuc CO 2 Czekamy, aż zmętnienie zniknie… wodorotlenek wapnia Pojawia się biały osad Ca(OH)2

czynności: obserwacje: Do probówki nalano ok. 2 cm³ roztworu wodorotlenku wapnia, a następnie przez rurkę szklaną umieszczoną w probówce wdmuchiwano powietrze wydychane z płuc. Roztwór wodorotlenku wapnia mętnieje po wprowadzeniu do niego wydychanego powietrzawytrąca siębiałyosad. tworzy się wnioski: W wydychanym powietrzu znajduje się dwutlenek węgla, który reaguje z wodorotlenkiem wapnia, powodując wytrącenie soli. dwutlenek węgla wodorotlenek wapnia równanie reakcji: Ca(OH)2 + CO 2 → ↓Ca. CO 3 + H 2 O Ca(OH)2 + CO 2 → Ca. CO 3↓ + H 2 O wodorotlenek wapnia + dwutlenek węgla → węglan wapnia + woda

METODA III. Reakcja tlenku niemetalu z zasadą. Ogólny schemat przebiegu reakcji można zapisać: tlenek niemetalu + zasada → sól + woda np: Jakie będą produkty tej reakcji? Ca(OH)2 + CO 2 → Ca. CO 3↓ + H 2 O węglan wapnia

Różne metody otrzymywania soli METODA IV. Reakcja metalu z niemetalem.

METODA IV. Reakcja metalu z niemetalem. Ogólny schemat przebiegu reakcji można zapisać: metal + niemetal → sól Jakie będą produkty tej reakcji? np: T Fe + S → Fe. S↓ siarczek żelaza (II)

Różne metody otrzymywania soli METODA V. Reakcja tlenku metalu z tlenkiem niemetalu.

METODA V. Reakcja tlenku metalu z tlenkiem niemetalu. Ogólny schemat przebiegu reakcji można zapisać: tlenek metalu + tlenek niemetalu → sól np: Jakie będą produkty tej reakcji? Ca. O + CO 2 → Ca. CO 3↓ węglan wapnia

Różne metody otrzymywania soli METODA VI. Reakcja metalu z kwasem.

METODA VI. Reakcja metalu z kwasem. Ogólny schemat przebiegu reakcji można zapisać: metal + kwas → sól + wodór↑ np: Jakie będą produkty tej reakcji? 2 Na + H 2 SO 4 → Na 2 SO 4 + H 2↑ siarczan (VI) sodu

Różne metody otrzymywania soli METODA VII. Reakcja soli z zasadą.

METODA VII. Reakcja soli z zasadą. Ogólny schemat przebiegu reakcji można zapisać: sól 1 + zasada 1 → sól 2 + zasada 1 Jakie będą produkty tej reakcji? np: Fe. Cl 3 + 3 Na. OH → 3 Na. Cl + Fe(OH)3↓ chlorek żelaza (III) chlorek sodu

Różne metody otrzymywania soli METODA VIII. Reakcja soli z kwasem.

METODA VIII. Reakcja soli z kwasem. Ogólny schemat przebiegu reakcji można zapisać: sól 1 + kwas 1 → sól 2+ kwas 2 Jakie będą produkty tej reakcji? np: Na 2 CO 3 + 2 HCl → 2 Na. Cl + H 2 O CO +3 CO 2 ↑ węglan sodu chlorek sodu

Różne metody otrzymywania soli METODA IX. Reakcja soli 1 z solą 2.

METODA IX. Reakcja soli 1 z solą 2. Ogólny schemat przebiegu reakcji można zapisać: sól 1+ sól 2 → sól 3 + sól 4 Jakie będą produkty tej reakcji? np: Al. Cl 3 + Na 3 PO 4 → Al. PO 4↓ + 3 Na. Cl chlorek glinu fosforan (V) sodu fosforan (V) glinu chlorek sodu

Różne metody otrzymywania soli Zadania

Zadanie 1 Ułóż równania następujących reakcji otrzymywania soli i podaj ich nazwy. a) cynk z kwasem siarkowym (VI) Zn + H 2 SO 4 → Zn. SO 4 + H 2↑. . . . . . . . b) wodorotlenek wapnia z tlenkiem fosforu (V) 6 Ca(OH)2 + P 4 O 10 → 2 Ca 3(PO 4)2↓ + 6 H 2 O . . . . . . . c) tlenek żelaza (II) z tlenkiem azotu (V) Fe. O + N 2 O 5 → Fe(NO 3)2 . . . . . . . d) srebro z kwasem solnym Ag + 2 HCl → reakcja nie zachodzi . . . . . . .

Zadanie 1 a) b) c) d) Nazwy soli Zn. SO 4 - siarczan (VI) cynku Ca 3(PO 4)2 – ortofosforan (V) wapnia Fe(NO 3)2 – azotan (V) żelaza (II) brak produktu reakcji

Zadanie 2 Uzupełnij równania reakcji, ilustrujące 4 różne sposoby otrzymywania Mg. Cl 2. Podkreśl reakcję zobojętniania. a) …. Mg 2 HCl Mg. Cl 2 + …. H 2 ↑ +. . . . →. . . 2 HCl Mg. Cl 2 b) …. Mg. O +. . . . →. . . + …. H 2 O 2 HCl →. . . Mg. Cl 2 2 H 2 O c) …. Mg(OH)2 +. . . . . Cl 2 Mg. Cl 2 d) …. Mg +. . . . →. . .

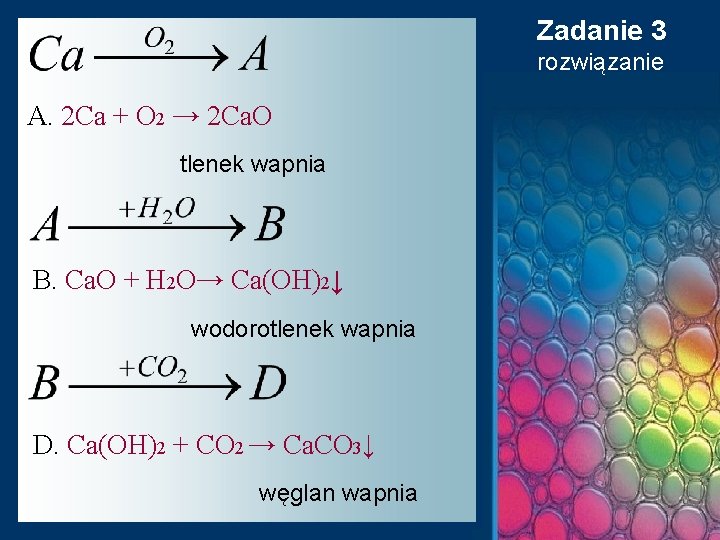
Zadanie 3 Rozwiąż chemograf identyfikując substancje oznaczone literami A, B, D oraz napisz i uzgodnij odpowiednie równania reakcji. Podaj nazwy substancji ukrytych pod literami A, B, D.

Zadanie 3 rozwiązanie A. 2 Ca + O 2 → 2 Ca. O tlenek wapnia B. Ca. O + H 2 O→ Ca(OH)2↓ wodorotlenek wapnia D. Ca(OH)2 + CO 2 → Ca. CO 3↓ węglan wapnia

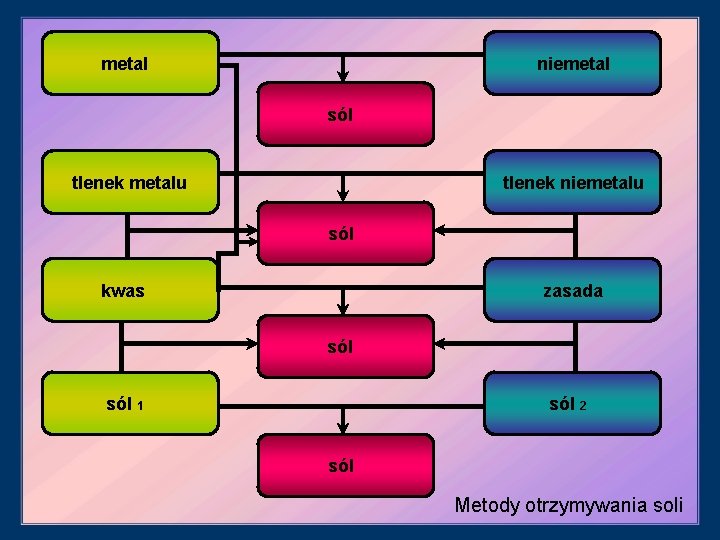
Pytanie Jakie metody otrzymywania soli poznaliście na dzisiejszej lekcji? (9 metod) kwas + zasada → sól + woda tlenek metalu + kwas → sól + woda tlenek niemetalu + zasada → sól + woda metal + niemetal → sól tlenek metalu + tlenek niemetalu → sól metal + kwas → sól + wodór↑ sól 1 + zasada 1 → sól 2 + zasada 1 sól 1 + kwas 1 → sól 2+ kwas 2 sól 1+ sól 2 → sól 3+ sól 4

metal niemetal sól tlenek niemetalu tlenek metalu sól zasada kwas sól 1 sól 2 sól Metody otrzymywania soli

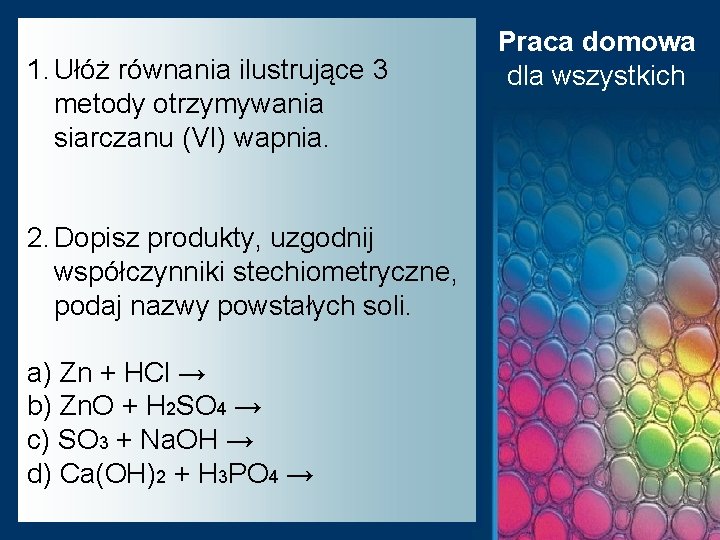
1. Ułóż równania ilustrujące 3 metody otrzymywania siarczanu (VI) wapnia. 2. Dopisz produkty, uzgodnij współczynniki stechiometryczne, podaj nazwy powstałych soli. a) Zn + HCl → b) Zn. O + H 2 SO 4 → c) SO 3 + Na. OH → d) Ca(OH)2 + H 3 PO 4 → Praca domowa dla wszystkich

1. Zaprojektuj doświadczenie mające na celu otrzymanie siarczanu (VI) magnezu. 2. Napisz równanie reakcji zachodzącej podczas prażenia skały wapiennej. Praca domowa dla chętnych