Mthodes alternatives lexprimentation animale l Exprimentation animale Lexprimentation


























- Slides: 37

Méthodes alternatives à l'expérimentation animale l Expérimentation animale : – L'expérimentation animale consiste à analyser le fonctionnement des systèmes biologiques du règne animal à partir d'observations sur un matériel vivant.

Peut-on réaliser des expérimentations animales? l Le chercheur est confronté à la double interrogation morale – Finalités : les finalités ou prolongements des travaux sont ou non socialement légitimes (transgénèse, OGM, clonage) » Comité National d’Ethique (pour l’homme) – Moyens : Ceux ci sont-ils tous acceptables ? » Comité Régional d’Ethique (pour l’animal) » Validité de l’expérience = "manière de faire" » Légitimité de l’expérience (ce qu’elle implique pour l’animal) = "décision de faire"

Peut-on réaliser des expérimentations animales /Ethique - Validité de l'expérimentation/observation. - Légitimité de l'utilisation d'un être vivant (animal/plantes) : Discontinuité Homme – Animal (Descartes, Kant), Continuité (Darwin) - Quel être vivant? Survie de l'espèce. /Scientifique - Validité d'une expérience faite sur une espèce pour des interprétations réalisées dans une autre. - Etude des mécanismes plus simple in vitro. /Economique - Coûts expérimentaux élevés A-t-on le droit de continuer les EA? A-t-on le droit d’arrêter toutes les EA?

Conditions d’expérimentation l Ne sont pas considérés comme expériences – Animaux invertébrés – Formes embryonnaires de vertébrés ovipares – Observation d’animaux l La pratique de l’expérimentation animale est encadrée par diverses dispositions légales que vous devez connaître : http: //ethique. ipbs. fr/sdv/expanim. html http: //www. dossiersdunet. com/spip. php? article 33 Texte fondateur : directive du Conseil des Communautés européennes, 24 novembre 1986 – Agrément des expérimentateurs – Formation des personnels – Provenance des animaux, transport – Conditions d’expérimenter

Conditions d’expérimentation Directive européenne 1986, décret français 1987 modifié 2001 l Les personnes impliquées – Responsable de protocole exp. = Autorisation d’expérimenter (habilitation 1) durée 5 ans – Collaborateurs : Techniciens = habilitation 2 (def) Animaliers = habilitation 3 (def) l Les animaux – Pas d’utilisation d’espèces protégées – Espèces expérimentales de sources autorisées – Tenue des registres l Les établissements – Dossier d’agrément à renouveler (agréées par le ministère de l'Agriculture, via les directions départementales des Services Vétérinaires)

Conditions d’expérimentation – En France, la réglementation repose sur l'autorisation des chercheurs. – Certains pays, les projets d'expérimentation doivent faire l'objet d'une autorisation après évaluation par un comité composé à la fois de chercheurs et de personnes n'expérimentant pas sur animaux. – Double contrainte : autorisation des personnes et autorisation des protocoles (Pays-Bas, Royaume-Uni).

Composition des comités d’éthique l En général, le nombre de membres indiqué est un minimum imposé par la législation. I. VEISSIER 1999, INRA Prod. Anim. , 12, 365

Règle de conduite : les 3 R (Russel et Burch 1959) ü La Réduction • Limiter le nombre d'expériences et d'animaux (min. pour résultats valides) ü Le Raffinement • Réduction de la souffrance animale (anesthésie, euthanasie, méthodes non invasives) ü Le Remplacement • Par des espèces moins sensibles ou non vivantes üLa responsabilité • Cadre réglementaire (douleur animale, personnels, origine des animaux) • Comité d’éthique,

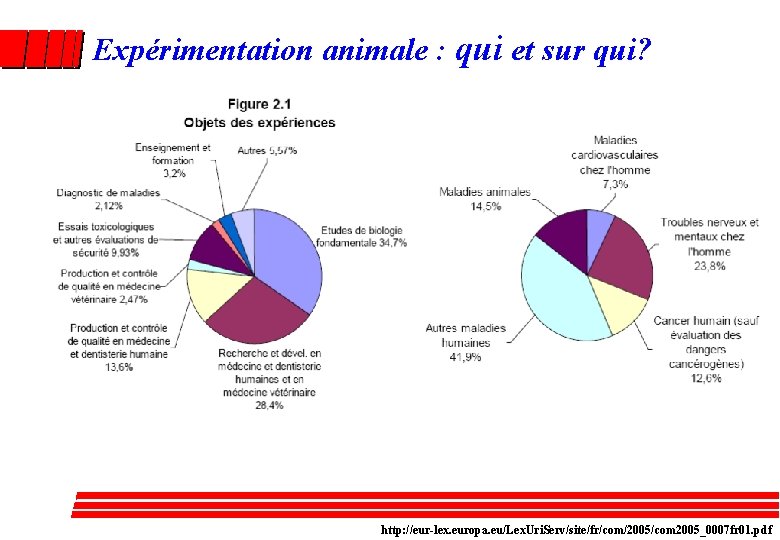
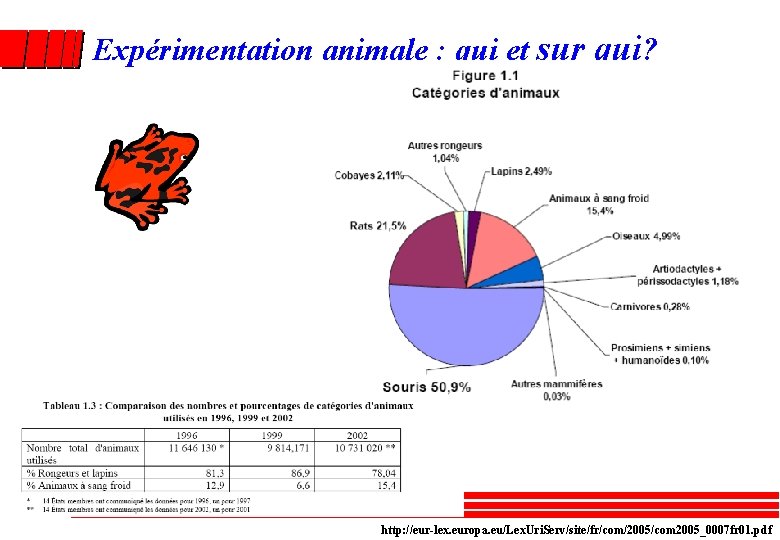
Expérimentation animale : qui et sur qui? http: //eur-lex. europa. eu/Lex. Uri. Serv/site/fr/com/2005/com 2005_0007 fr 01. pdf

Expérimentation animale : qui et sur qui? http: //eur-lex. europa. eu/Lex. Uri. Serv/site/fr/com/2005/com 2005_0007 fr 01. pdf

Les modèles alternatifs l Remplacement relatif – Aboutit à la mort d'animaux mais sans souffrance (utilisation de cellules primaires, organes, tissu, embryons, procaryotes. . . ) l Remplacement total – Les expériences ne nécessites plus de tuer des animaux. (modèles mathématiques, reproduction physico-chimique, lignées cellulaires. . . ) – Les expériences permettent de faire un premier test, mais dont le résultat est vérifier sur un petit nombre d'animaux. (information, lignées cellulaires. . . )

Les modèles alternatifs Information : prévient la duplication des expériences. l Modèles mathématiques : prédiction de l'effet biologique. l Techniques physico-chimiques : l - rumen artificiel, test d'irritation oculaire l Utilisation de procaryotes et d'embryons : - test de genotoxicité sur Salmonella - effet tératogène l Utilisation d'animaux transgéniques : - création d'animaux (souris, nématodes) portants des gènes humains.

Les modèles alternatifs l Modèles cellulaires – cellules primaires – lignées immortelles, transformées, – culture de tissue – culture d'organe – anse ligaturée

Domaines d'utilisation l Toxicité – Test d’irritation oculaire – culture d'hépatocyte – culture d'épithélium respiratoire l Mutagénèse - A l'heure actuelle, plus d'une centaine de tests de mutagenèse in vitro ont été mis au point, une dizaine sont régulièrement utilisés (Salmonella, embryons). - le test in vitro ne remplace rien, mais joue le rôle d'un filtre préventif permettant de gagner du temps, de l'argent et d'éviter de possibles expériences futures sur animaux. • Etude de l'infection LE TEST DE DRAIZE consiste à déposer le produit à tester dans l'œil de plusieurs lapins albinos afin d'analyser les dégâts causés après plusieurs jours (paupière tuméfiée, iris enflammé, cornée ulcérée, œil détruit, mort du sujet). LE TEST DE DL 50 (dose létale 50%) consiste à faire ingérer à un groupe d'animaux des quantités de produit pour que 50% des sujets meurent.

Domaines d'utilisation l. Médical -Allergies l. Métabolisme – Glande mammaire – Intestin l. Production d'anticorps – Polyclonaux, monoclonaux Coupe histologique d'épiderme reconstruit contenant des cellules de Langerhans et des mélanocytes Une peau reconstruite, sensible aux rayons ultra-violets et pourvue de cellules immunitaires fonctionnelles. Ce modèle, construit par les chercheurs de l'Oréal dans le cadre d'un projet européen, est un nouvel outil d'étude in vitro de l'allergie.

Production d'anticorps monoclonaux in vitro. /Avant, il était possible d'obtenir in vivo des sérums polyclonaux, mono- ou polyspécifiques. l Définition : Köhler et Milstein 1976 – Cellules hybrides qui sont immortelles (plasmocytome) et qui sécrètent des anticorps (splénocyte, Lc. B). l Obtention – – Immunisation, fusion, sélection, clonage. Hétérohybridômes, humanisation. Culture : HAT car le myélome est HGPRTRPMI-1640+glu+Ac. A+SVF+antibiotiques Etuve CO 2 à 37°C

Ascites /Lettre Ministérielle du 17 novembre 2005 /Inoculation I. P. à des souris syngéniques de l'hybridôme. Production d'un liquide d'ascite riche en anticorps. l Avantages – l Concentration en AC élevée, facilité, peu onéreux Problèmes – risques de contamination par des virus murins, des cytokines et des immunoglobulines de l'animal. – Formation de tumeurs chez l'animal, de liquides d'ascite, perforation de la paroi abdominale. – Interdiction ou limitation de la production d'ascites. On estime qu'aux Etats-Unis, un million de souris par année sont encore utilisées pour ce type de "production".

Méthodes alternatives : anticorps ü Peut-on produire in vitro des quantités d'anticorps suffisantes à un coût raisonnable? Ø Boites de culture • Faible concentration de cellules et d’anticorps 10 -100 µg/ml Ø Bouteilles agitées par rotation • Faible concentration de cellules, concentration d’anticorps plus élevée 10 -220 µg/ml

Méthodes alternatives : anticorps q Pochettes perméables - Augmentation de la viabilité cellulaire - Augmentation de la concentration en AC - Diminution des contaminations q. Le bio réacteur mini. Perm -Augmentation de la concentration en AC, et en cellules -Augmentation de la pureté (dialyse) Cellules+AC O 2, CO 2 milieu

Méthodes alternatives : anticorps q Bio réacteur à fibres creuses - Forte concentration en AC et en cellules (107 -108) - viabilité cellulaire élevée sur un mois q. Tecnomouse - 5 bio réacteurs en parallèle

Méthodes alternatives : lignées cellulaires Ö Cellules - Culture de cellules provenant d’un organe ou d’un tissu. Il peut être obtenu par dispersion enzymatique ou par culture d’explants Les cellules n’ont subi que peu de modifications Mélange de cellules, viabilité faible, tuer un animal à chaque fois, manque de reproductibilité Ö Lignées - primaires mortelles Obtenues après clonage de cellules primaires (Intestin : macrophages, fibroblastes, entérocytes, caliciformes, argentaffines, de paneth, M). - Durée de vie limitée : 20 à 80 passages (stock), croissance faible Etude sur une population déterminée, bonne reproductibilité Caractérisées par l’inhibition de contact et la croissance dépendante d’ancrage

Méthodes alternatives : lignées cellulaires ÖLignées continues : immortelles - Perte des facteurs responsables de la sénescence : spontanée, induite - Durée de vie illimitée (> 100 passages), croissance forte, anomalies phénotypiques et génotypiques Etude sur une population déterminée, caractérisée, bonne reproductibilité Caractérisées par l’inhibition de contact et la croissance dépendante d’ancrage -

Méthodes alternatives : lignées cellulaires q Lignées continues : faiblement transformées - q Durée de vie illimité (>100 passages), croissance forte, anomalies phénotypiques et génotypiques plus fortes Etude sur une population déterminée, caractérisée, bonne reproductibilité Caractérisées par l’absence d’inhibition de contact et la croissance indépendante d’ancrage (pas de tumeurs, croissance en agarose) Lignées continues : fortement transformées - Ø Durée de vie illimité (>100 passages), croissance forte, anomalies phénotypiques et génotypiques très fortes Etude sur une population déterminée, caractérisée, bonne reproductibilité (en fonction du passage) Caractérisées par l’absence d’inhibition de contact et la croissance indépendante d’ancrage (induction de tumeurs, croissance en agarose et agar) Induction de la transformation par des méthodes génétiques et épigénétiques

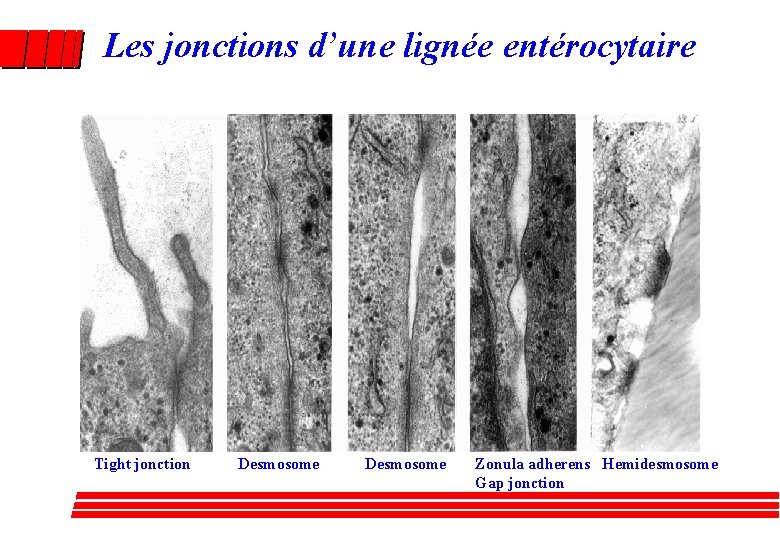
Les jonctions d’une lignée entérocytaire Tight jonction Desmosome Zonula adherens Hemidesmosome Gap jonction

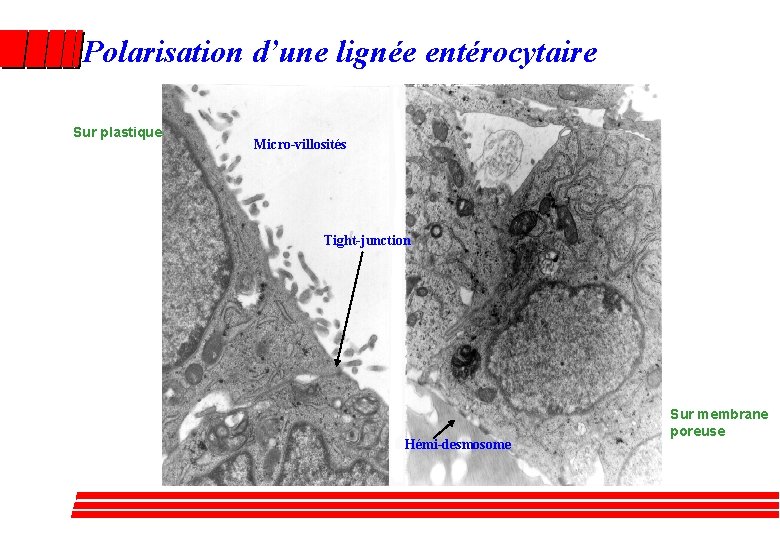
Polarisation d’une lignée entérocytaire Sur plastique Micro-villosités Tight-junction Hémi-desmosome Sur membrane poreuse

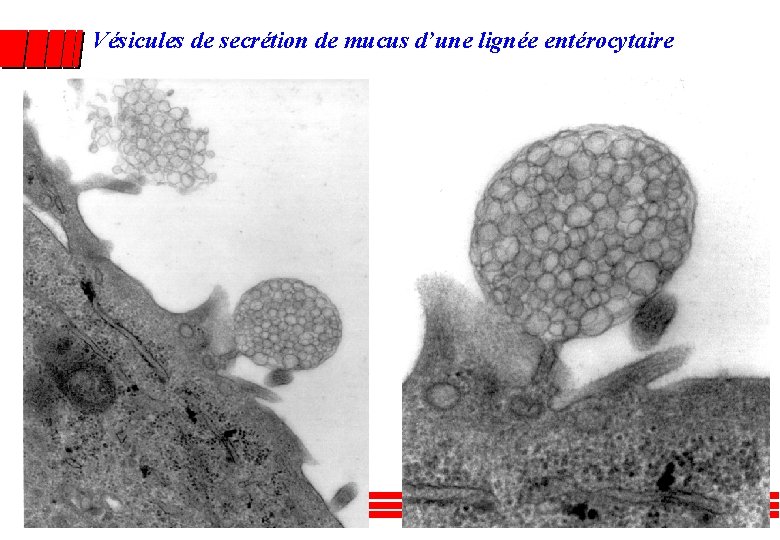
Vésicules de secrétion de mucus d’une lignée entérocytaire

Méthodes alternatives : culture de tissus q Chambre de Ussing - 1 animal permet l’utilisation de plusieurs tissus ou morceaux de tissu - Proche du in vivo, 3 D, plusieurs types cellulaires - Faible reproductibilité, viabilité variable

Méthodes alternatives : culture d’organes q Infection d’organes ex vivo - 1 animal par organe utilisé. Diminution de la souffrance - Conditions proches du in vivo (infection sous flux, tissu entier) Grande variabilité des conditions d’infection : temps, vitesse du flux, [O 2], addition de molécules, flore… Possibilité de faire des comparaisons en parallèles : entérocytes/plaques de Peyer ; jéjunum/caecum Possibilité d’identifier les cellules infectées au FACS Faible reproductibilité, viabilité cellulaire faible même si viabilité tissulaire

Méthodes alternatives : anses ligaturées q 1 animal par organe utilisé (mais plusieurs anses/organe). Diminution de la souffrance ? q Mise à jeun, anesthésie, incision et extériorisation de l’intestin Ligatures (anses), injection des bactéries, (gentamicine) Remise en place, suture Après qq heures, anesthésie, incision et extériorisation, prélèvement, euthanasie -

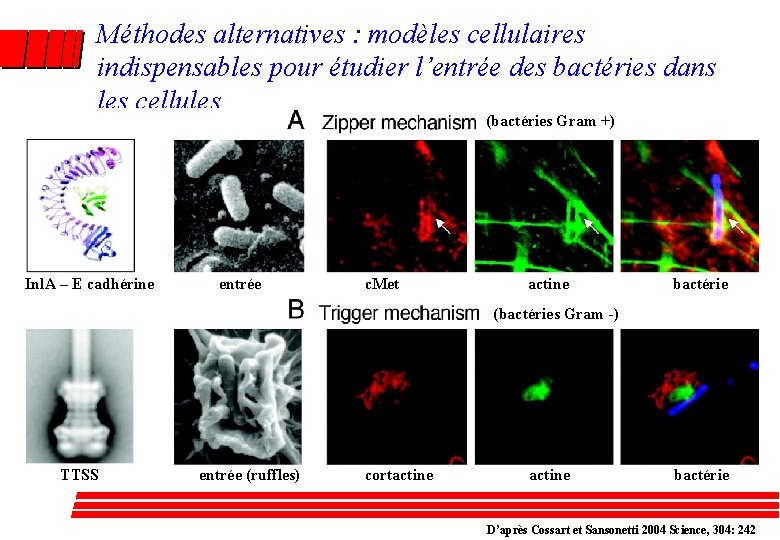
Méthodes alternatives : modèles cellulaires indispensables pour étudier l’entrée des bactéries dans les cellules (bactéries Gram +) Inl. A – E cadhérine entrée c. Met actine bactérie (bactéries Gram -) TTSS entrée (ruffles) cortactine bactérie D’après Cossart et Sansonetti 2004 Science, 304: 242

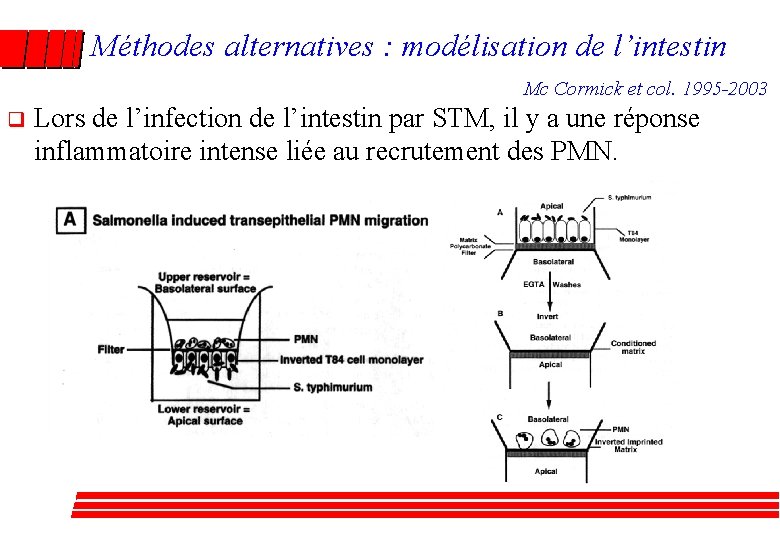
Méthodes alternatives : modélisation de l’intestin Mc Cormick et col. 1995 -2003 q Lors de l’infection de l’intestin par STM, il y a une réponse inflammatoire intense liée au recrutement des PMN.

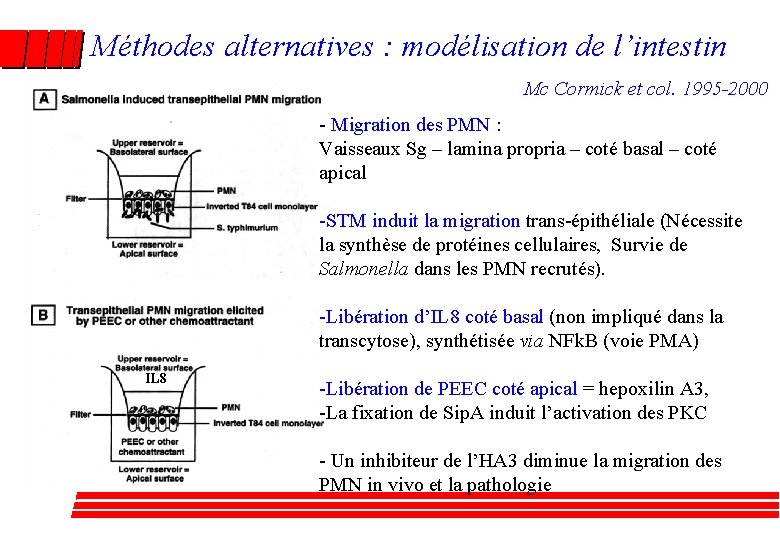
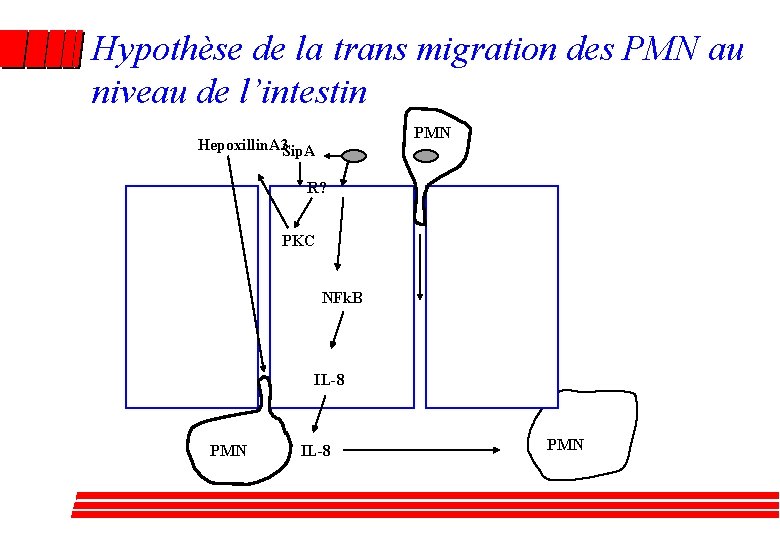
Méthodes alternatives : modélisation de l’intestin Mc Cormick et col. 1995 -2000 - Migration des PMN : Vaisseaux Sg – lamina propria – coté basal – coté apical -STM induit la migration trans-épithéliale (Nécessite la synthèse de protéines cellulaires, Survie de Salmonella dans les PMN recrutés). -Libération d’IL 8 coté basal (non impliqué dans la transcytose), synthétisée via NFk. B (voie PMA) IL 8 -Libération de PEEC coté apical = hepoxilin A 3, -La fixation de Sip. A induit l’activation des PKC - Un inhibiteur de l’HA 3 diminue la migration des PMN in vivo et la pathologie

Hypothèse de la trans migration des PMN au niveau de l’intestin PMN Hepoxillin. A 3 Sip. A R? PKC NFk. B IL-8 PMN

Conclusions l Diminution des expérimentations : En France le nombre d'animaux de laboratoire est passé de 7 millions à 2, 6 millions entre 1980 et 1997. Stabilisation depuis 2000 En recherche : Nécessité d’utiliser au maximum les méthodes in vitro l Complémentarité de l’approche in vivo et in vitro l – Dépend de la question posée – Dépend de l’outil d’investigation (micro-arrays, IVET, pathogénicité…) l Connaître les limites de son modèle (LM-souris)

Où l’in vitro est supérieur à l’in vivo l l La souris est le modèle de référence pour la virulence de L. monocytogenes L’internaline (Inl. A) est impliquée dans l’entrée dans les entérocytes in vitro Le récepteur de l’internaline est la E cadhérine Un mutant délété de Inl. A n’est pas altéré en virulence chez la souris

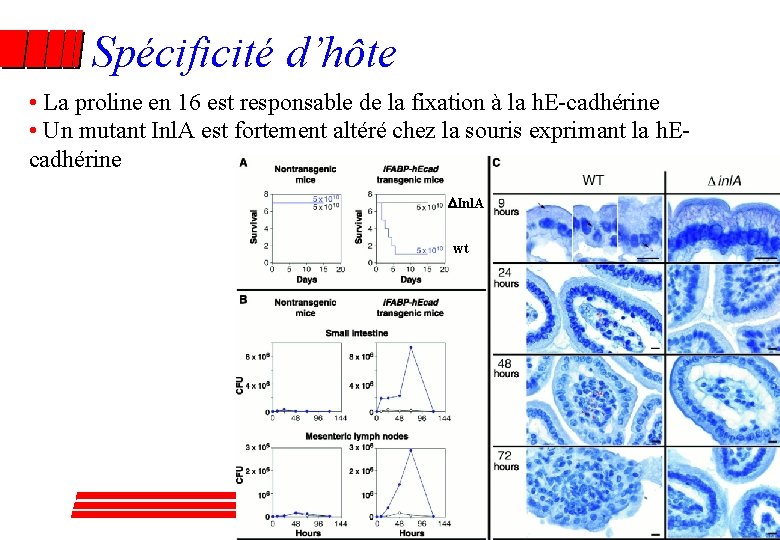
Spécificité d’hôte • La proline en 16 est responsable de la fixation à la h. E-cadhérine • Un mutant Inl. A est fortement altéré chez la souris exprimant la h. Ecadhérine Inl. A wt

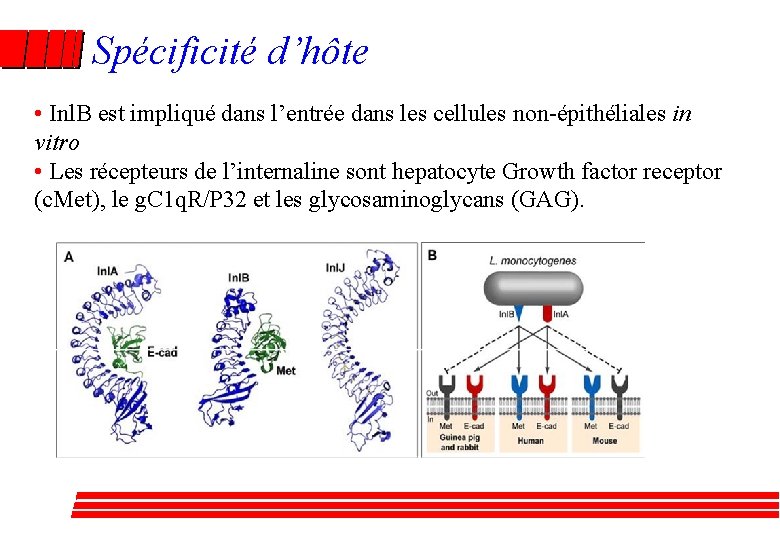
Spécificité d’hôte • Inl. B est impliqué dans l’entrée dans les cellules non-épithéliales in vitro • Les récepteurs de l’internaline sont hepatocyte Growth factor receptor (c. Met), le g. C 1 q. R/P 32 et les glycosaminoglycans (GAG).