MOTheorie von Komplexen Ein Vortrag von Jasmin Fischer






![Allgemeines MO-Schema für σ-Komplexe, diesem Schema folgen sind z. B. : [Ti(H 2 O)6]3+, Allgemeines MO-Schema für σ-Komplexe, diesem Schema folgen sind z. B. : [Ti(H 2 O)6]3+,](https://slidetodoc.com/presentation_image_h/d15e97a96c3b419fa56148424fc9e19e/image-15.jpg)

![Literatur [1] „Organometallchemie“, Elschenbroich, Salzer, B. G. Teubner, 1993, 3. Auflage [2] „Anorganische Chemie“, Literatur [1] „Organometallchemie“, Elschenbroich, Salzer, B. G. Teubner, 1993, 3. Auflage [2] „Anorganische Chemie“,](https://slidetodoc.com/presentation_image_h/d15e97a96c3b419fa56148424fc9e19e/image-23.jpg)
- Slides: 23

MO-Theorie von Komplexen Ein Vortrag von Jasmin Fischer 1

Inhaltsübersicht 1. Elektronenzählregeln 2. Konstruktion eines MO-Schemas für Komplexe 3. -Komplexe 4. -Komplexe 5. CO als Komplexligand 6. Zusammenfassung 7. Literatur 2

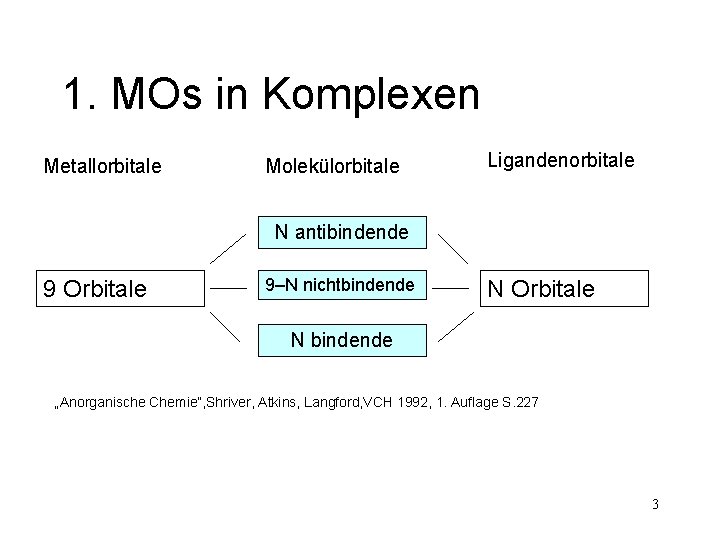
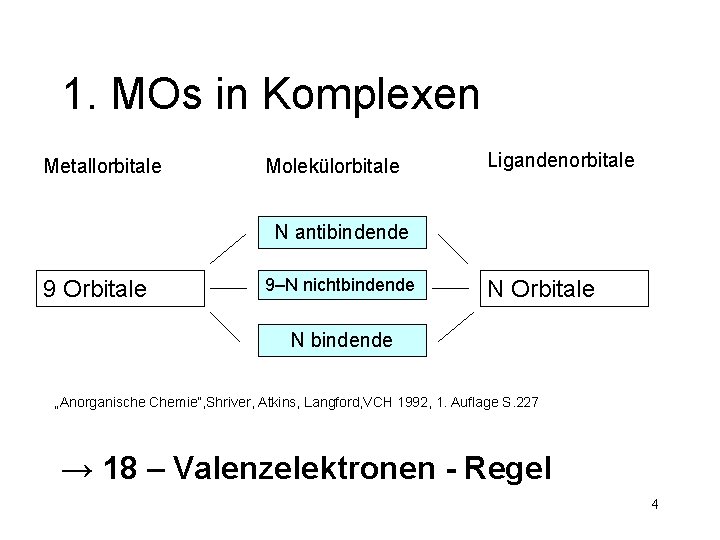
1. MOs in Komplexen Metallorbitale Molekülorbitale Ligandenorbitale N antibindende 9 Orbitale 9–N nichtbindende N Orbitale N bindende „Anorganische Chemie“, Shriver, Atkins, Langford, VCH 1992, 1. Auflage S. 227 3

1. MOs in Komplexen Metallorbitale Molekülorbitale Ligandenorbitale N antibindende 9 Orbitale 9–N nichtbindende N Orbitale N bindende „Anorganische Chemie“, Shriver, Atkins, Langford, VCH 1992, 1. Auflage S. 227 → 18 – Valenzelektronen - Regel 4

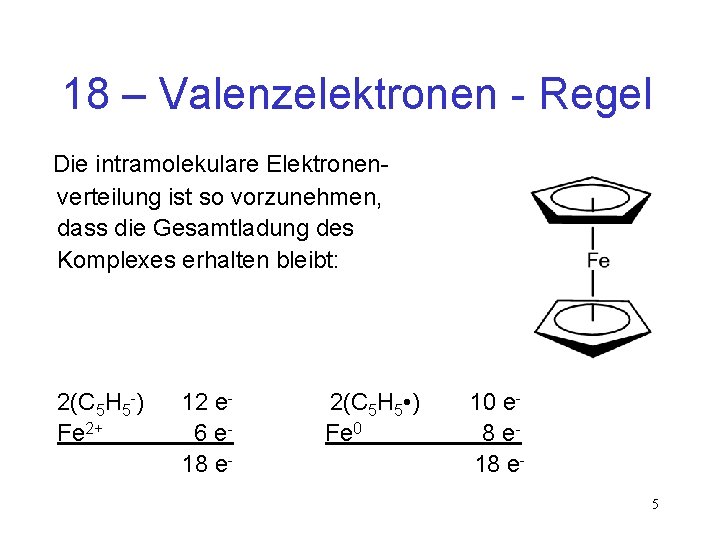
18 – Valenzelektronen - Regel Die intramolekulare Elektronen verteilung ist so vorzunehmen, dass die Gesamtladung des Komplexes erhalten bleibt: 2(C 5 H 5 -) Fe 2+ 12 e 6 e 18 e- 2(C Fe 0 5 H 5 • ) 10 e 8 e 18 e 5

2. Konstruktion eines MO-Schemas Allgemeine Vorgehensweise: 1. Bestimmung der Symmetrieklassen der Metall-Orbitale 2. Ermittlung der entsprechenden Ligandengruppenorbitale 3. Symmetrieadaptierte Linearkombination der Orbitale 6

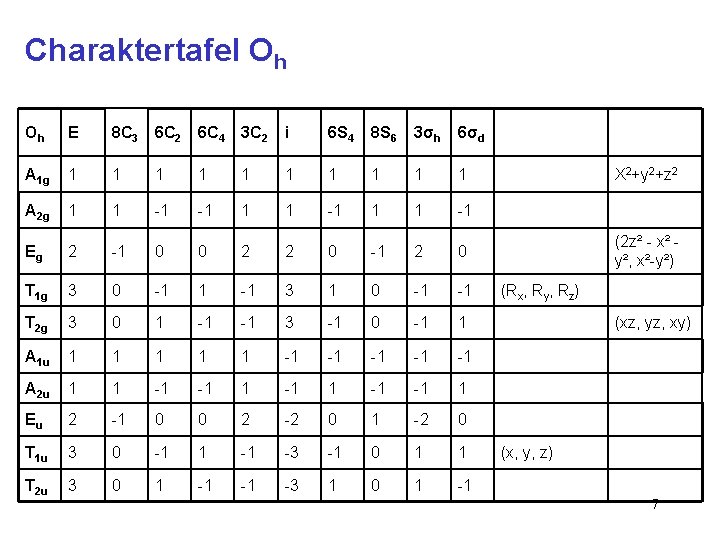
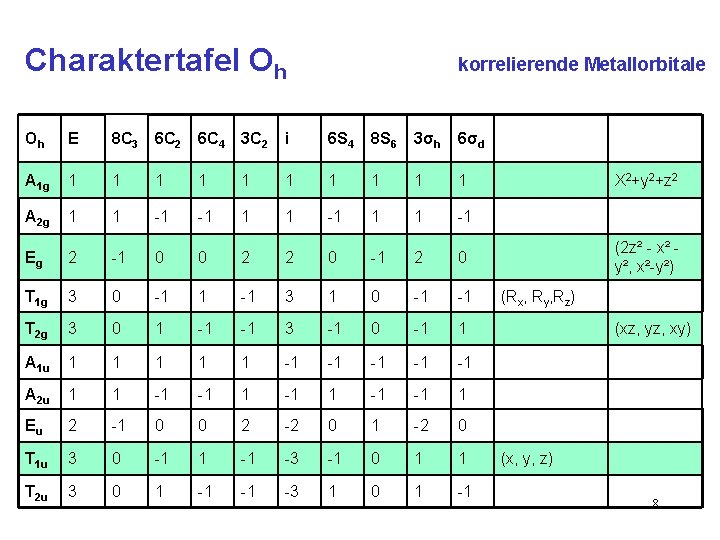
Charaktertafel Oh Oh E 8 C 3 6 C 2 6 C 4 3 C 2 i 6 S 4 8 S 6 3σh 6σd A 1 g 1 1 1 1 1 A 2 g 1 1 -1 -1 1 1 -1 Eg 2 -1 0 0 2 2 0 -1 2 0 T 1 g 3 0 -1 1 -1 3 1 0 -1 -1 T 2 g 3 0 1 -1 -1 3 -1 0 -1 1 A 1 u 1 1 1 -1 -1 -1 A 2 u 1 1 -1 -1 1 Eu 2 -1 0 0 2 -2 0 1 -2 0 T 1 u 3 0 -1 1 -1 -3 -1 0 1 1 T 2 u 3 0 1 -1 -1 -3 1 0 1 -1 X 2+y 2+z 2 (2 z² - x² y², x²-y²) (Rx, Ry, Rz) (xz, yz, xy) (x, y, z) 7

Charaktertafel Oh korrelierende Metallorbitale Oh E 8 C 3 6 C 2 6 C 4 3 C 2 i 6 S 4 8 S 6 3σh 6σd A 1 g 1 1 1 1 1 A 2 g 1 1 -1 -1 1 1 -1 Eg 2 -1 0 0 2 2 0 -1 2 0 T 1 g 3 0 -1 1 -1 3 1 0 -1 -1 T 2 g 3 0 1 -1 -1 3 -1 0 -1 1 A 1 u 1 1 1 -1 -1 -1 A 2 u 1 1 -1 -1 1 Eu 2 -1 0 0 2 -2 0 1 -2 0 T 1 u 3 0 -1 1 -1 -3 -1 0 1 1 T 2 u 3 0 1 -1 -1 -3 1 0 1 -1 X 2+y 2+z 2 (2 z² - x² y², x²-y²) (Rx, Ry, Rz) (xz, yz, xy) (x, y, z) 8

2. Konstruktion eines MO-Schemas Allgemeine Vorgehensweise: 1. Bestimmung der Symmetrieklassen der Metall-Orbitale 2. Ermittlung der entsprechenden Ligandengruppenorbitale 3. Symmetrieadaptierte Linearkombination der Orbitale 9

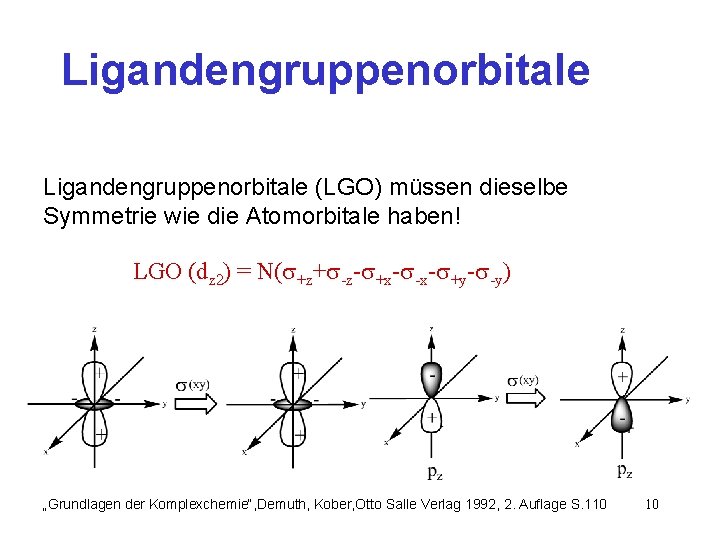
Ligandengruppenorbitale (LGO) müssen dieselbe Symmetrie wie die Atomorbitale haben! LGO (dz 2) = N( +z+ -z- +x- -x- +y- -y) „Grundlagen der Komplexchemie“, Demuth, Kober, Otto Salle Verlag 1992, 2. Auflage S. 110 10

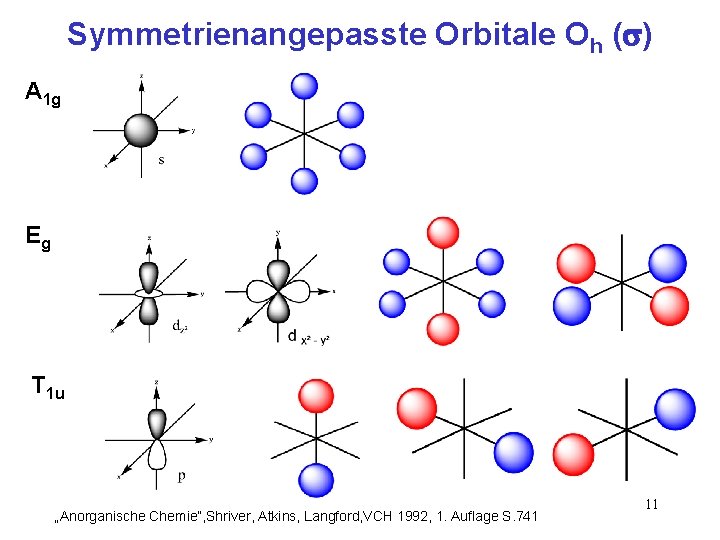
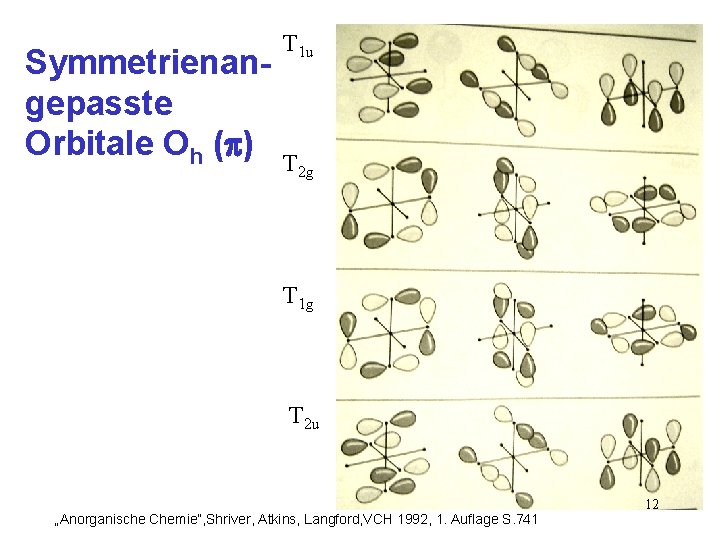
Symmetrienangepasste Orbitale Oh ( ) A 1 g Eg T 1 u „Anorganische Chemie“, Shriver, Atkins, Langford, VCH 1992, 1. Auflage S. 741 11

Symmetrienangepasste Orbitale Oh ( ) T 1 u T 2 g T 1 g T 2 u „Anorganische Chemie“, Shriver, Atkins, Langford, VCH 1992, 1. Auflage S. 741 12

2. Konstruktion eines MO-Schemas Allgemeine Vorgehensweise: 1. Bestimmung der Symmetrieklassen der Metall-Orbitale 2. Ermittlung der entsprechenden Ligandengruppenorbitale 3. Symmetrieadaptierte Linearkombination der Orbitale 13

Bestimmung der Reihenfolge der Energieniveaus in oktaedrischen σ- Komplexen 1. s- und p-Orbitale überlappen stärker als d-Orbitale die a 1 g und t 1 u sind die energieärmsten MOs und die a 1 g* und t 1 u* die am höchsten liegenden MOs 2. d -Orbitale überlappen nur schwach die eg und eg*-Molekülorbitale werden relativ zu ihrem Schwerpunkt wenig verschoben 3. t 2 g-Orbitale sind nichtbindend und daher nicht verschoben 14
![Allgemeines MOSchema für σKomplexe diesem Schema folgen sind z B TiH 2 O63 Allgemeines MO-Schema für σ-Komplexe, diesem Schema folgen sind z. B. : [Ti(H 2 O)6]3+,](https://slidetodoc.com/presentation_image_h/d15e97a96c3b419fa56148424fc9e19e/image-15.jpg)
Allgemeines MO-Schema für σ-Komplexe, diesem Schema folgen sind z. B. : [Ti(H 2 O)6]3+, [Co(NH 3)6]3+ „Grundlagen der Komplexchemie“, Demuth, Kober, Otto Salle Verlag 1992, 2. Auflage S. 110 15

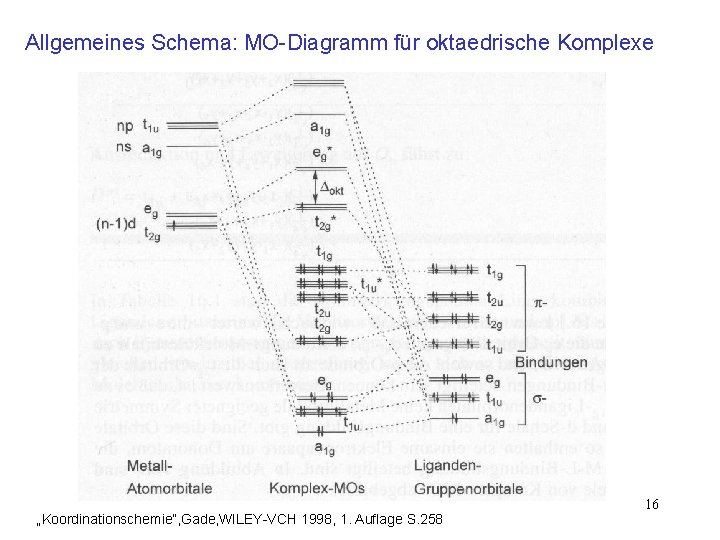
Allgemeines Schema: MO-Diagramm für oktaedrische Komplexe „Koordinationschemie“, Gade, WILEY-VCH 1998, 1. Auflage S. 258 16

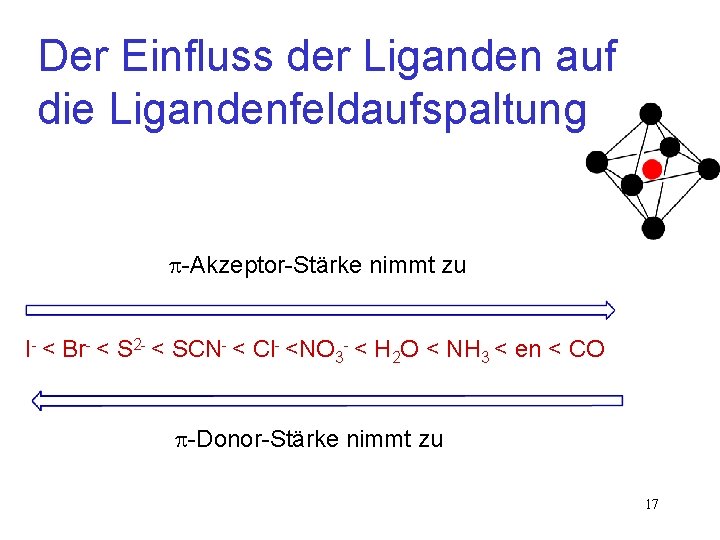
Der Einfluss der Liganden auf die Ligandenfeldaufspaltung -Akzeptor-Stärke nimmt zu I- < Br- < S 2 - < SCN- < Cl- <NO 3 - < H 2 O < NH 3 < en < CO -Donor-Stärke nimmt zu 17

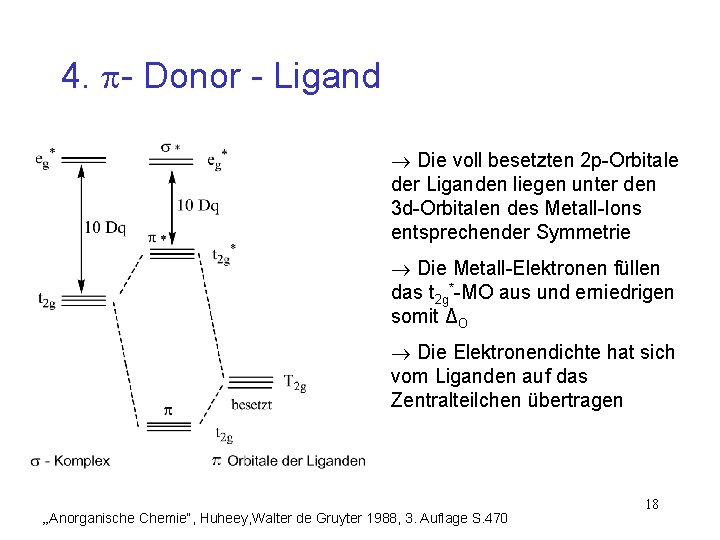
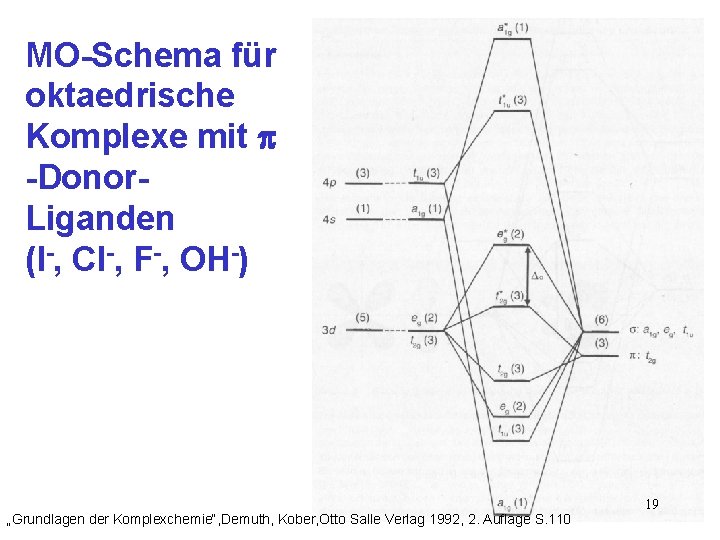
4. - Donor - Ligand Die voll besetzten 2 p-Orbitale der Liganden liegen unter den 3 d-Orbitalen des Metall-Ions entsprechender Symmetrie Die Metall-Elektronen füllen das t 2 g*-MO aus und erniedrigen somit ΔO Die Elektronendichte hat sich vom Liganden auf das Zentralteilchen übertragen „Anorganische Chemie“, Huheey, Walter de Gruyter 1988, 3. Auflage S. 470 18

MO-Schema für oktaedrische Komplexe mit -Donor. Liganden (I-, Cl-, F-, OH-) „Grundlagen der Komplexchemie“, Demuth, Kober, Otto Salle Verlag 1992, 2. Auflage S. 110 19

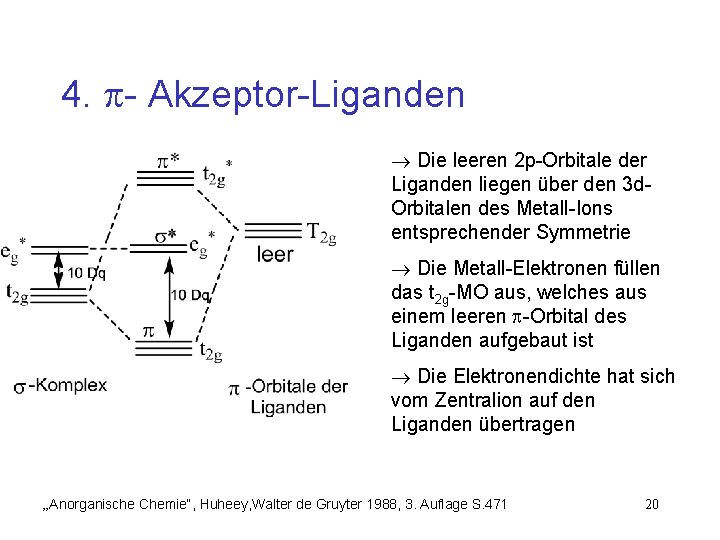
4. - Akzeptor-Liganden Die leeren 2 p-Orbitale der Liganden liegen über den 3 d. Orbitalen des Metall-Ions entsprechender Symmetrie Die Metall-Elektronen füllen das t 2 g-MO aus, welches aus einem leeren -Orbital des Liganden aufgebaut ist Die Elektronendichte hat sich vom Zentralion auf den Liganden übertragen „Anorganische Chemie“, Huheey, Walter de Gruyter 1988, 3. Auflage S. 471 20

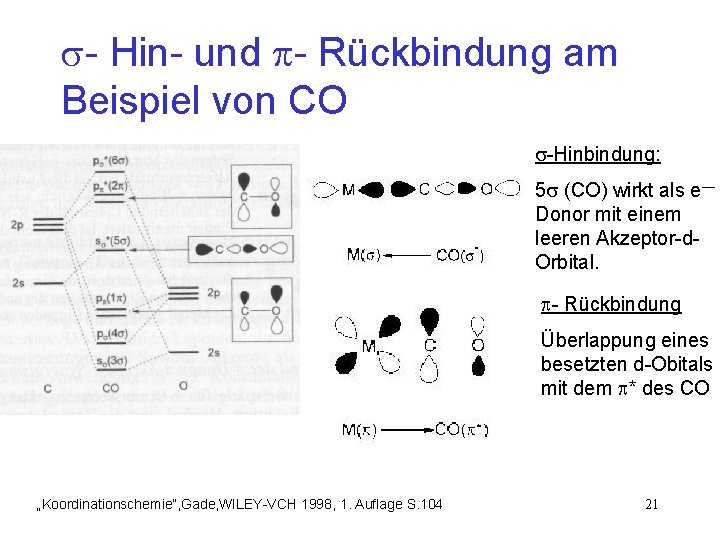
- Hin- und - Rückbindung am Beispiel von CO -Hinbindung: 5 (CO) wirkt als e— Donor mit einem leeren Akzeptor-d. Orbital. - Rückbindung Überlappung eines besetzten d-Obitals mit dem * des CO „Koordinationschemie“, Gade, WILEY-VCH 1998, 1. Auflage S. 104 21

Zusammenfassung Bei der Konstruktion von MO-Schematas muss beachtet werden: • Die Symmetrie des Komplexes • Die Symmetrie der Metallorbitale • Die Symmetire der Ligandenorbitale • Die Art der Liganden (π- und σ-Liganden) Die Kombination der Orbitale erfolgt dann nach dem selben Schema wie bei kleineren Systemen. 22
![Literatur 1 Organometallchemie Elschenbroich Salzer B G Teubner 1993 3 Auflage 2 Anorganische Chemie Literatur [1] „Organometallchemie“, Elschenbroich, Salzer, B. G. Teubner, 1993, 3. Auflage [2] „Anorganische Chemie“,](https://slidetodoc.com/presentation_image_h/d15e97a96c3b419fa56148424fc9e19e/image-23.jpg)
Literatur [1] „Organometallchemie“, Elschenbroich, Salzer, B. G. Teubner, 1993, 3. Auflage [2] „Anorganische Chemie“, Shriver, Atkins, Langford, VCH 1992, 1. Auflage [3] „Anorganische Chemie“, Huheey, Walter de Gruyter 1988, 3. Auflage [4] „Grundlagen der Komplexchemie“, Demuth, Kober, Otto Salle Verlag 1992, 2. Auflage [5] „Koordinationschemie“, Gade, WILEY-VCH 1998, 1. Auflage [6] „Anorganische Chemie“, Riedel, de Gruyter 1999 23
 Ein volk ein reich ein führer
Ein volk ein reich ein führer Vortrag stressprävention
Vortrag stressprävention Vortrag zusammenarbeit
Vortrag zusammenarbeit Vortrag grundschule kriterien
Vortrag grundschule kriterien Ein neuer tag und ein neuer morgen
Ein neuer tag und ein neuer morgen Ein geschäftsmann sendet ein fax an seine frau
Ein geschäftsmann sendet ein fax an seine frau Wann ist ein mann ein mann text
Wann ist ein mann ein mann text Trapez
Trapez Ein mann wie ein baum sie nannten ihn bonsai
Ein mann wie ein baum sie nannten ihn bonsai Heidenröslein analyse
Heidenröslein analyse Ein tag der sagts dem anderen
Ein tag der sagts dem anderen Stromkreismodell
Stromkreismodell Ein neuer tag und ein neuer morgen
Ein neuer tag und ein neuer morgen Ein hund ist ein herz auf vier pfoten
Ein hund ist ein herz auf vier pfoten Gott schenkt dir das gesicht lächeln musst du selber
Gott schenkt dir das gesicht lächeln musst du selber Was sind vielfache
Was sind vielfache Jasmin accounts portal
Jasmin accounts portal Jasmin leon
Jasmin leon Batteries in electric cars
Batteries in electric cars Spencer the painter balamory
Spencer the painter balamory Le geai gélatineux geignait dans le jasmin
Le geai gélatineux geignait dans le jasmin Jasmin margolin
Jasmin margolin Jasmin fischbach
Jasmin fischbach Sascha h jasmin g
Sascha h jasmin g