Molcules et gomtrie La gomtrie molculaire Cest le





























- Slides: 44

Molécules et géométrie

La géométrie moléculaire C’est le domaine de la stéréochimie Comment décrire la géométrie des molécules? Au moyen de : Distances de liaison. {R} Angles de valence. {a} Angles de torsion. {f} O ROO O

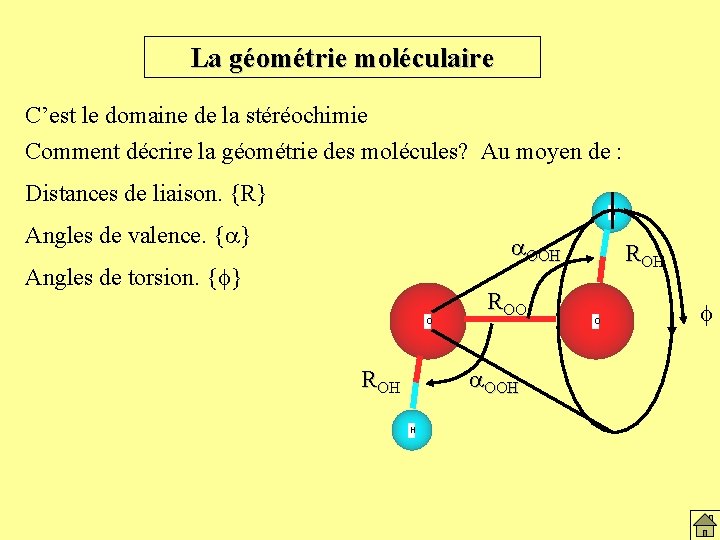
La géométrie moléculaire C’est le domaine de la stéréochimie Comment décrire la géométrie des molécules? Au moyen de : Distances de liaison. {R} Angles de valence. {a} Angles de torsion. {f} O ROO a. OOH ROH H O

La géométrie moléculaire C’est le domaine de la stéréochimie Comment décrire la géométrie des molécules? Au moyen de : Distances de liaison. {R} H Angles de valence. {a} a. OOH Angles de torsion. {f} O ROO a. OOH ROH O f

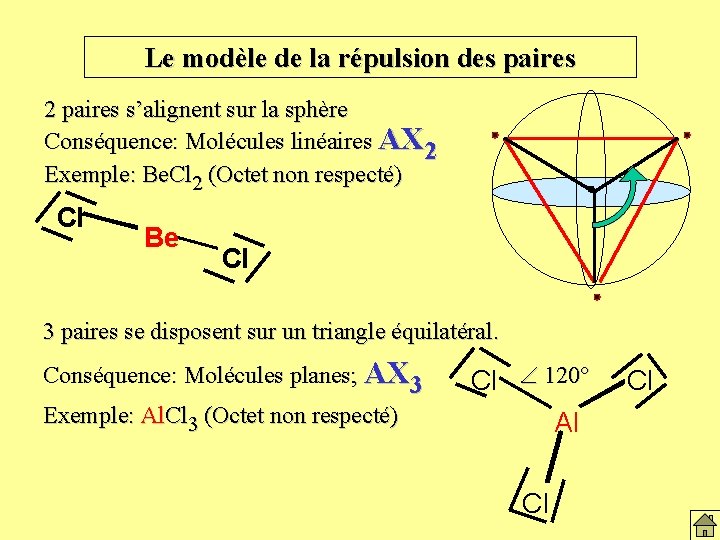
Le modèle de la répulsion des paires Les paires d’électrons se distribuent autour des noyaux « porteurs » A et déterminent la géométrie moléculaire. Ces paires se repoussent et mènent au modèle de répulsion des paires. 2 paires s’alignent sur la sphère Conséquence: Molécules linéaires. AX 2 Exemple: Be. Cl 2 (Octet non respecté) Cl Be Cl 180°

Le modèle de la répulsion des paires 2 paires s’alignent sur la sphère Conséquence: Molécules linéaires AX 2 Exemple: Be. Cl 2 (Octet non respecté) Cl Be Cl 3 paires se disposent sur un triangle équilatéral. Conséquence: Molécules planes; AX 3 Exemple: Al. Cl 3 (Octet non respecté) Cl 120° Al Cl Cl

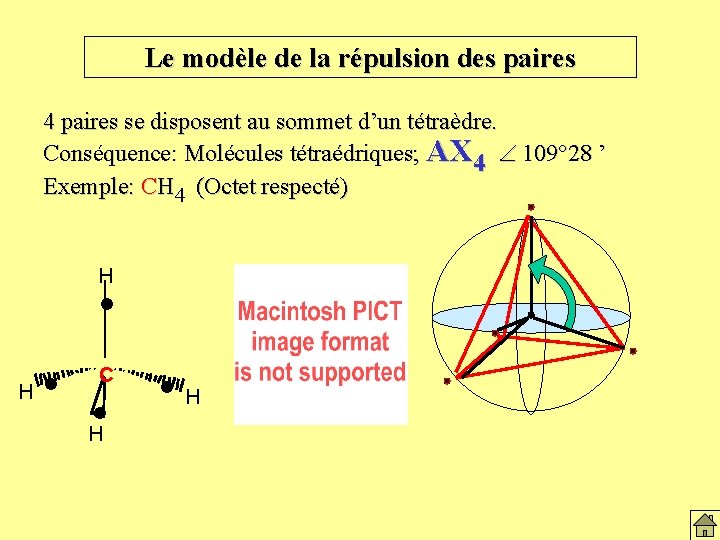
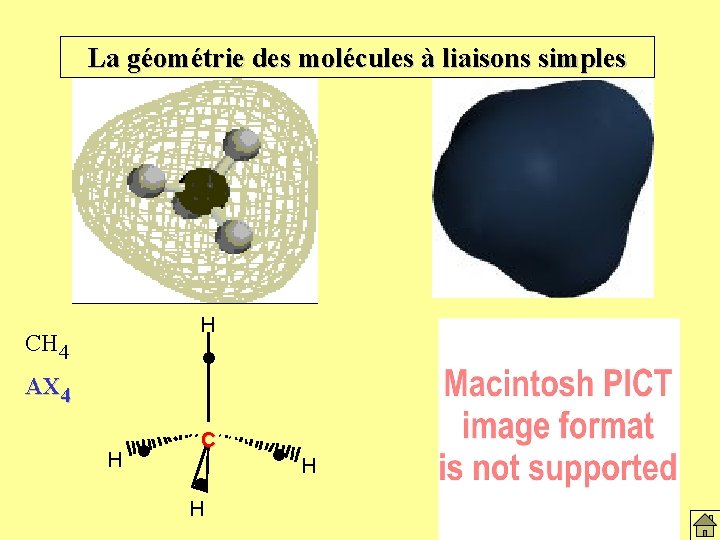
Le modèle de la répulsion des paires 4 paires se disposent au sommet d’un tétraèdre. Conséquence: Molécules tétraédriques; AX 4 109° 28 ’ Exemple: CH 4 (Octet respecté) H l C l H

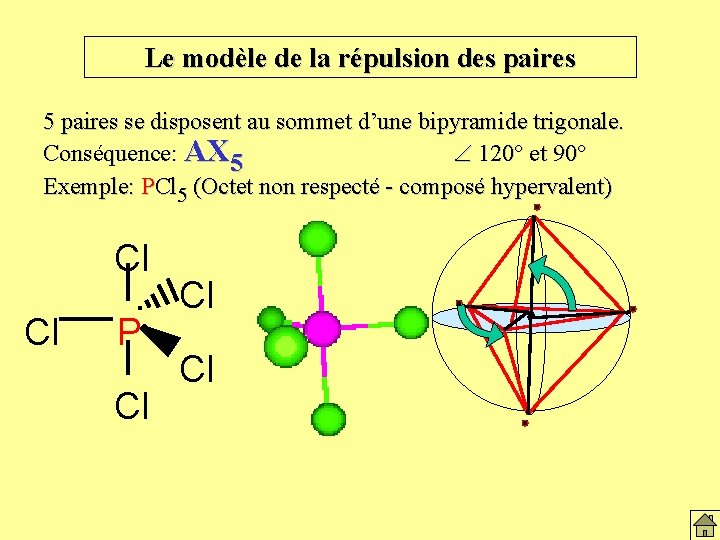
Le modèle de la répulsion des paires 5 paires se disposent au sommet d’une bipyramide trigonale. Conséquence: AX 5 120° et 90° Exemple: PCl 5 (Octet non respecté - composé hypervalent) Cl Cl P Cl Cl Cl

Le modèle de la répulsion des paires 6 paires se disposent au sommet d’un octaèdre. Conséquence: AX 6 90° Exemple: S F 6 (Octet non respecté - composé hypervalent) F F F S F F F

La géométrie des molécules à liaisons simples H CH 4 l AX 4 H l C l H

H NH 3 EAX 3 H N H

H 2 O E 2 AX 2 H O H

La géométrie des molécules à liaisons simples Ethane, méthylamine, méthanol, . . .

La géométrie des molécules à liaisons multiples éthane éthylène acétylène. . . 1, 34Å 1, 54Å 1, 20Å Molécule linéaire Molécule plane

La notion d ’hybridation Les molécules sont tétraédriques, mais les orbitales atomiques sont orthogonales (perpendiculaires entre-elles). L’hybridation est la transformation des orbitales de l’atome pour les adapter à une meilleure description de la géométrie moléculaire.

La notion d ’hybridation Les molécules sont tétraédriques, mais les orbitales atomiques sont orthogonales (perpendiculaires entre-elles). L’hybridation est la transformation des orbitales de l’atome pour les adapter à une meilleure description de la géométrie moléculaire.

L’hybridation sp s’obtient en combinant l’orbitale 2 s à une orbitale 2 p, sans modifier les deux autres. Deux orbitales (2 s, 2 p) se transforment par combinaison (addition et soustraction) en deux hybrides sp.

L’hybridation sp s’obtient en combinant l’orbitale 2 s à une orbitale 2 p, sans modifier les deux autres. Deux orbitales (2 s, 2 p) se transforment par combinaison (addition et soustraction) en deux hybrides sp.

L’hybridation sp Au total: 180° Les hybrides permettront de décrire les liaisons. Cette hybridation est adaptée à la représentation des atomes dans des molécules linéaires telles que Be. Cl 2, HC CH, HC N … ou contenant des fragments linéaires.

L’hybridation sp 2 s’obtient en combinant la fonction 2 s à deux fonctions 2 p, sans modifier la dernière. 120° elle est adaptée à la représentation ddes atomes dans les molécules planes telles que Al. Cl 3, H 2 C=O , H 2 C=CH 2… ou contenant des fragments planes.

L’hybridation sp 2 s’obtient en combinant la fonction 2 s à deux fonctions 2 p, sans modifier la dernière. elle est adaptée à la représentation de molécules planes telles que H 2 C=O que H 2 C=CH 2… ou contenant des fragments planes.

L’hybridation sp 3 s’obtient en combinant la fonction 2 s aux trois fonctions 2 p. 109° 28 ’ elle est adaptée à la représentation de molécules tétraédriques telles que CH 4 , H 3 C—OH que H 3 C—CH 3, …. D’autres hybridations incluant les orbitales d existent. Par exemple sp 3 d pour décrire PCl 5 ou sp 3 d 2 pour décrire SF 6

La formation de liaisons L’hybride spn se combine à une orbitale 1 s de l’hydrogène, ou à une autre orbitale hybride pour former les liaisons s CH, CC, CO, . . + Les traits de liaison symbolisent la liaison chimique décrite par la superposition des orbitales atomiques hybrides ( ) ou originales.

Description de l ’éthylène C 2 H 4 Les hybrides sp 2 forment les liaisons s CH et CC de l ’éthylène ( ) s p La fusion des orbitales 2 p inchangées forme la liaison p CC de l ’éthylène

La résonance du benzène L’exemple du benzène montre que par fusion des orbitales 2 p inchangées, on décrit le phénomène de conjugaison des électrons p.

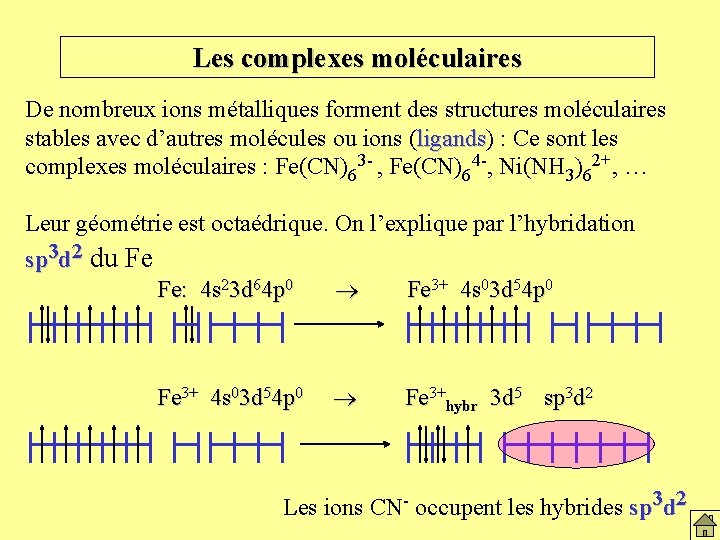
Les complexes moléculaires De nombreux ions métalliques forment des structures moléculaires stables avec d’autres molécules ou ions (ligands) ligands : Ce sont les complexes moléculaires : Fe(CN)63 - , Fe(CN)64 -, Ni(NH 3)62+, … Leur géométrie est octaédrique. On l’explique par l’hybridation sp 3 d 2 du Fe Fe: 4 s 23 d 64 p 0 Fe 3+ 4 s 03 d 54 p 0 Fe 3+hybr 3 d 5 sp 3 d 2 Les ions CN- occupent les hybrides sp 3 d 2

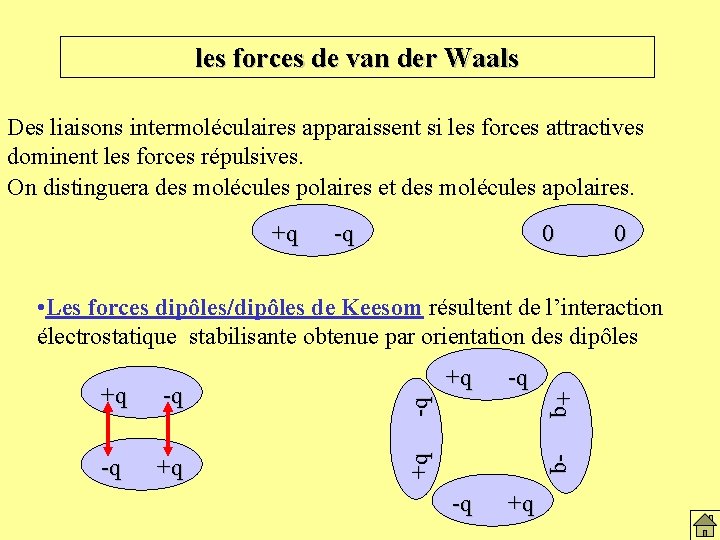
les liaisons intermoléculaires Si des molécules identiques existent dans des états physiques différents, c’est parce qu ’elles sont soumises à des interactions intermoléculaires, intermoléculaires qui s’expriment via des forces intermoléculaires. On distingue: • Les forces de van der Waals. • Les forces dipôles/dipôles de Keesom • Les forces dipôles/dipôles induits de Debye • Les forces de dispersion de London • Les ponts hydrogènes:

les forces de van der Waals Des liaisons intermoléculaires apparaissent si les forces attractives dominent les forces répulsives. On distinguera des molécules polaires et des molécules apolaires. +q -q 0 0 -q -q +q +q • Les forces dipôles/dipôles de Keesom résultent de l’interaction électrostatique stabilisante obtenue par orientation des dipôles

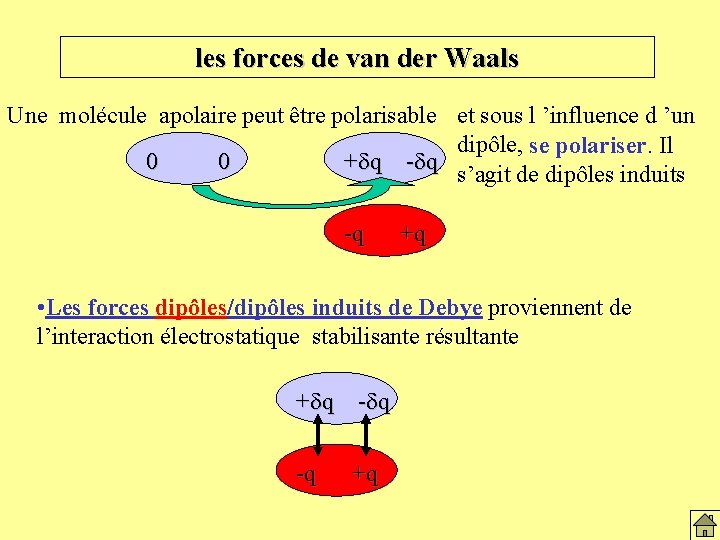
les forces de van der Waals Une molécule apolaire peut être polarisable et sous l ’influence d ’un dipôle, se polariser. Il 0 0 + d q -d q s’agit de dipôles induits -q +q • Les forces dipôles/dipôles induits de Debye proviennent de l’interaction électrostatique stabilisante résultante + d q -q +q

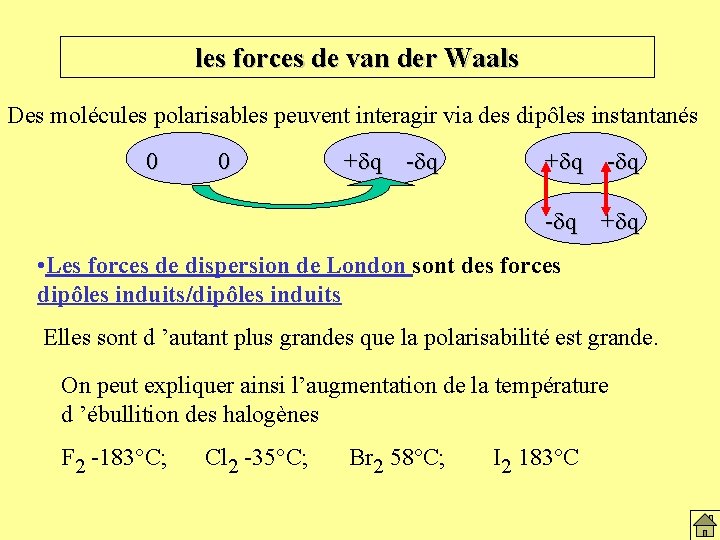
les forces de van der Waals Des molécules polarisables peuvent interagir via des dipôles instantanés 0 0 + d q -d q + d q • Les forces de dispersion de London sont des forces dipôles induits/dipôles induits Elles sont d ’autant plus grandes que la polarisabilité est grande. On peut expliquer ainsi l’augmentation de la température d ’ébullition des halogènes F 2 -183°C; Cl 2 -35°C; Br 2 58°C; I 2 183°C

les ponts Hydrogène Lorsque des hydrogènes sont liés à des atomes fortement électronégatifs, la liaison formée est très polarisée (transfert électronique important). Les hydrogènes (d+) s’associent aux atomes (d-) d’une molécule voisine. Celle-ci s’établit entre H et F, O, N. N Cette association constitue un pont Hydrogène qui mène souvent à des réseaux de molécules. Par exemple entre H et O dans les alcools: O R H O R H

les ponts Hydrogène L ’eau constitue un autre exemple Cette liaison intermoléculaire explique le point d ’ébullition élevé de H 2 O (100°C) et HF (20°C) comparés à H 2 S (-60°C) et HCl (-85°C)

Retour sur les états de la matière Les états condensés trouvent leur origine dans l’agrégation des molécules. Cette cohésion résulte des interactions intermoléculaires L’agitation des molécules s’oppose à cette cohésion. Celle-ci est de nature thermique et confère la mobilité aux molécules. Forces de cohésion >> Agitation thermique Etat Solide (Energie Réticulaire) Rigidité Positions fixes Forces de cohésion << Agitation thermique Etat Gazeux mouvements libres Forces de cohésion Agitation thermique Etat Liquide Fluidité Positions libres, mobilité restreinte

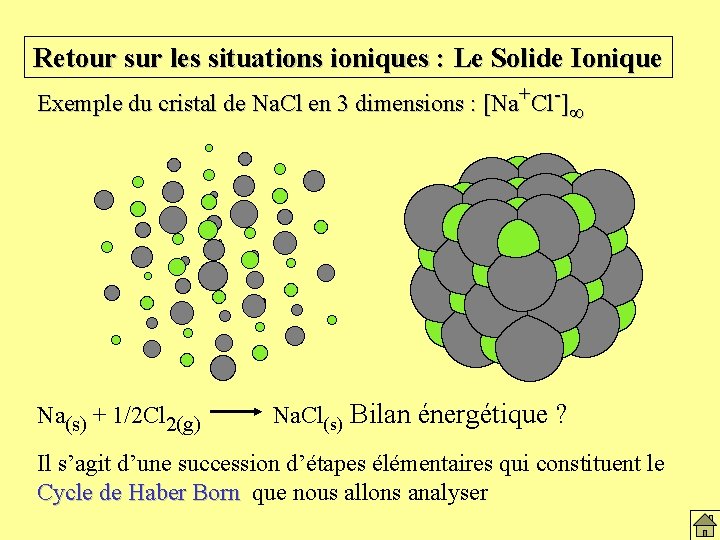
Retour sur les situations ioniques : Le Solide Ionique Exemple du cristal de Na. Cl en 3 dimensions : [Na+Cl-] Na(s) + 1/2 Cl 2(g) Na. Cl(s) Bilan énergétique ? Il s’agit d’une succession d’étapes élémentaires qui constituent le Cycle de Haber Born que nous allons analyser

Cycle de Haber Born Na(s) + 1/2 Cl 2(g) Na. Cl(s) Bilan énergétique? (k. J. mol-1) 3 et 4 1. Vaporisation Na(s) -> Na(g) E= +93 2. Dissociation 1/2 Cl 2(g) -> Cl E=+122 3. Ionisation Na -> Na+ + e- E=+496 4. Ionisation Cl + e- -> Cl. E=-348 5. Association Na++Cl--> Na. Cl(s) E=-780 (énergie réticulaire) réticulaire Energie réticulaire = (363) Na+ Cl- Na (215) Cl 1 et 2 0 Na(s) 1/2 Cl 2

Cycle de Haber Born Exemple du cristal de Na. Cl en 3 dimensions : [Na+Cl-] Energie réticulaire =

Cycle de Haber Born Na(s) + 1/2 Cl 2(g) Na. Cl(s) Bilan énergétique? (k. J. mol-1) 3 et 4 1. Vaporisation Na(s) -> Na(g) E= +93 3. Ionisation Na -> Na+ + e- E=+496 1 et 2 4. Ionisation Cl + e- -> Cl. E=-348 5. Association Na++Cl--> Na. Cl(s) E=-780 (énergie réticulaire) réticulaire Energie réticulaire = Na+ Cl- Na (215) Cl 2. Dissociation 1/2 Cl 2(g) -> Cl E=+122 Bilan global: Na(s) + 1/2 Cl 2(g) (363) Na. Cl(s) ) 0 Na(s) 1/2 Cl 2 5 E=-417 Na. Cl(s)

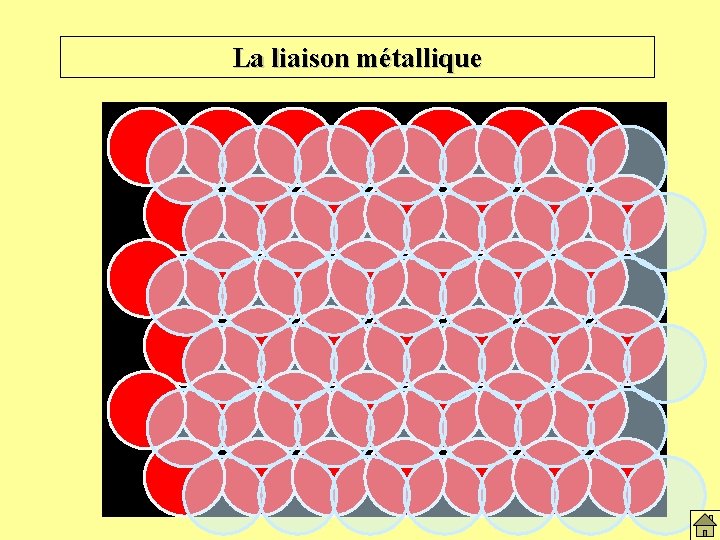
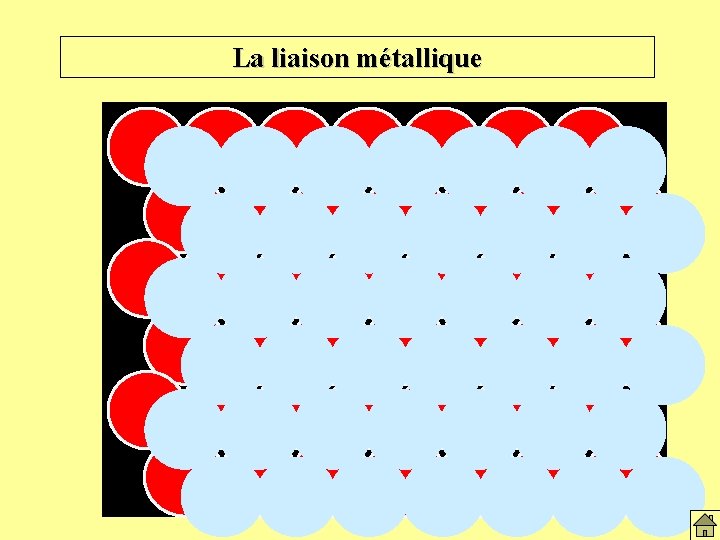
La liaison métallique

La liaison métallique

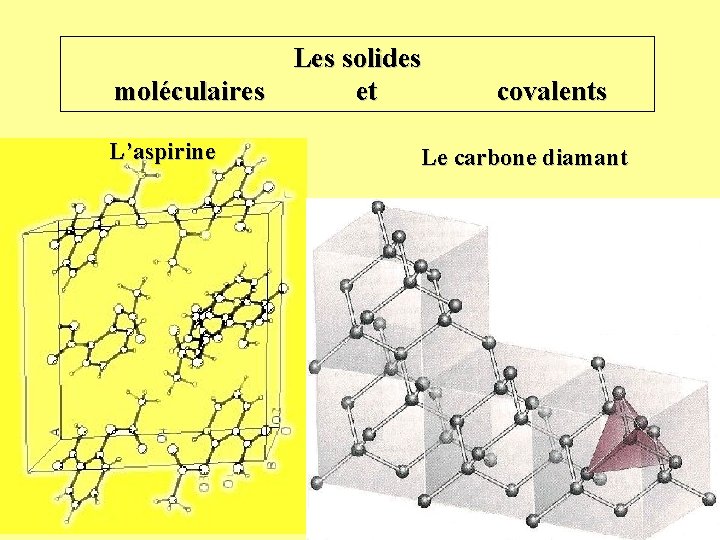
Les solides moléculaires et L’aspirine covalents Le carbone diamant

Molécules et Nomenclature A ce stade, la connaissance de la nomenclature s’impose. Cfr ANNEXE

Les notions de base La nomenclature chimique donne un nom rationnel aux molécules. Une fonction chimique est un ensemble de propriétés portées par un atome ou un groupe structuré d’atomes (Acide; Base; …). Ce groupe structuré d’atomes s’appelle groupe fonctionnel. Les noms reposent sur une association « préfixe/élément/suffixe » . L’ensemble constitue un radical.

Les grandes familles Les oxydes: • de non-métaux: Ma. Ob • de métaux: Ma. Ob [oxydes de Métal (X) avec x=2*b/a] Les acides • les hydracides: Ha. Xb • les oxacides: Ha. Mb. Oc Les bases • hydroxylées: Ma(OH)b • aminées: Rn. NHn’ (n+n’=3) Les sels

Les grandes familles Les mots-clés utiles : • suffixes « ure » , « ate » mais aussi ique; eux; ite; H 2 S, Na 3 PO 4, H 2 SO 3, Na. NO 2 • préfixes hypo et per (HCl. O, HCl. O 2, HCl. O 3, HCl. O 4) • préfixes pyro, thio et peroxo • nomenclature des sels (hydrogéno… Na. HSO 4) • quelques radicaux