Module 3 LES SOLUTIONS Questce quune solution Une
























- Slides: 55

Module 3 LES SOLUTIONS

Qu’est-ce qu’une solution? Une solution est un mélange ______ formé de ____ homogène plusieurs substances.

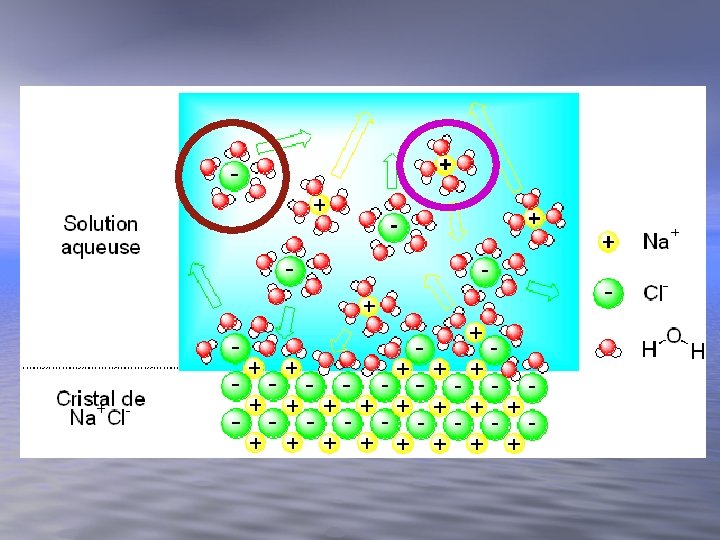
Dans une solution, la substance qui dissout d’autres substances (souvent présente en plus grande quantité) se solvant nomme le ____. Celle(s) qui est(sont) dissoute(s) (souvent présente(s) en plus petite quantité) est (sont) le(s) _____. soluté (s) solvant Exemple: l'eau est le _______ et le sel solutés et le sucre sont les _______. C'est le solvant et le(s) soluté(s) qui forment la solution.

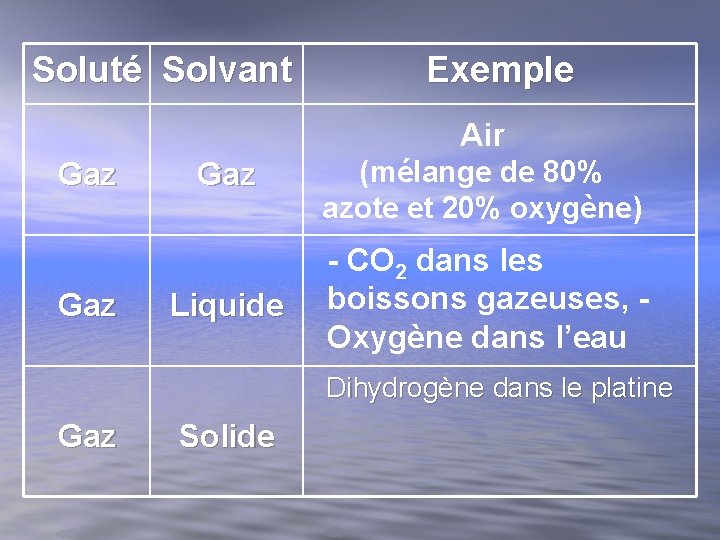
Types de solutions Il existe différents types de solutions. Les solutés et les solvants peuvent se retrouver sous les trois états de la matière. Il y a donc neuf types de solutions possibles. Complète les cases vides.

Soluté Solvant Exemple Air Gaz Gaz Liquide (mélange de 80% azote et 20% oxygène) - CO 2 dans les boissons gazeuses, - Oxygène dans l’eau Dihydrogène dans le platine Gaz Solide

Soluté Solvant Liquide Gaz Liquide Solide Exemple Humidité de l’air Vodka (40% alcool, 60 % eau Amalgame dentaire (alliage de mercure et autre métaux)

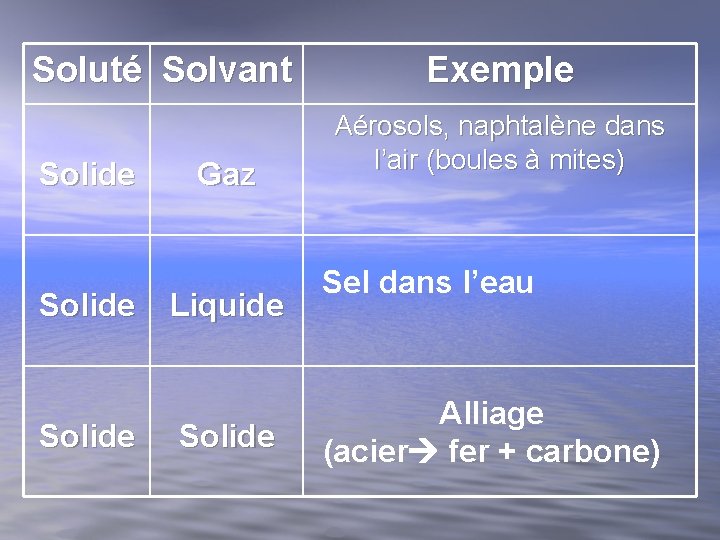
Soluté Solvant Solide Gaz Liquide Solide Exemple Aérosols, naphtalène dans l’air (boules à mites) Sel dans l’eau Alliage (acier fer + carbone)

La solubilité et la miscibilité Lorsqu'un soluté peut se dissoudre dans soluble un solvant, on dit qu'il est _______. Les solutés polaires se dissolvent habituellement mieux dans les solvants polaires. Exemples: sel dans eau (2 polaires); huile dans l’essence (2 non-polaires)


La solubilité et la miscibilité Lorsqu'un soluté ne peut pas se dissoudre dans un solvant, on dit qu'il est _____. insoluble Les solutés non-polaires se dissolvent souvent peu dans les solvants polaires et vice-versa. Exemple: sel (polaire) dans l’alcool (non-polaire), cire (non-polaire) dans l’eau (polaire). Lien vers explications

La solubilité et la miscibilité Lorsqu’on parle de substances dans le même état qui se mélangent, on dit qu’ils sont _____. miscibles Exemples : eau et alcool essence et huile dioxygène et dihydrogène.

La solubilité et la miscibilité S’ils ne se mélangent pas, on dit _______. non-miscibles Ex : eau et huile Le sel est ____ dans l’eau soluble L’alcool est _____ dans l’eau. miscible

Limite de solubilité La _____ d'un soluté, solubilité c'est la quantité qu’on peut en dissoudre dans une telle _____ de solvant à une quantité certaine ______. température

Limite de solubilité Quand une solution contient le maximum de soluté qu'elle peut contenir à une température donnée, on dit que la solution est ____. saturée Quand elle n'en contient pas son maximum, on insaturée dit qu'elle est ______. Quand la solution est sursaturée, elle renferme plus _______ de soluté dissous qu'elle devrait en contenir à cette température. (Il est rare de trouver des solutions sursaturées dans la nature, mais le miel en est un exemple. )

Solution diluée : Quand il y a _____ de peu soluté dans un solvant. Comment peut-on diluer une solution ? ____________ En rajoutant du solvant

Solution concentrée : Quand il y a _____ de soluté dans un solvant beaucoup Comment peut-on rendre une solution plus concentrée ? En rajoutant du soluté à la solution _________________ En évaporant une partie du solvant _________________

Exercices à faire Page 289 # 1, 2, 3, 5, 6, 8, 10.

Correction 1. Soluté et solvant 2. Solide Alliage liquide boisson gazeuse de l’air 3. Mélange homogène Plusieurs particules sont entremêlées mais on ne peut pas les distinguer. Le mélange est pareil partout.

Correction 5. Mélange homogène jus de pommes Mélange hétérogène Soupe aux légumes 6. Soluble Se dit d’une substance qui se dissout, c’est-à-dire devient « invisible » dans une autre substance. Miscible se dit de deux substances dans le même état qui peuvent se mélanger. Non-miscible se dit de deux substances dans le même état qui ne se mélangent pas

Correction 8. Soluté qui se dissout dans l’eau ? Les soluté polaires : les sels, les acides et les bases. 10. Deux liquides chauffés : A Aucun résidu Seulement de l’eau ? B Résidu blanc Eau + autre chose Substance pure Solution ?

Facteurs affectant la solubilité ou la vitesse de dissolution 1 – La température La plupart des solutés se dissolvent mieux lorsqu’on augmente la température du solvant (plus d’énergie). Exceptions : – Les gaz – Les substances qui se réchauffent lorsqu’elles se dissolvent.

Facteurs affectant la solubilité ou la vitesse de dissolution 2 – La surface de contact Plus la substance à dissoudre est en contact avec le solvant, plus rapide est la dissolution. On peut augmenter la surface de contact de deux façons : _________________ Réduire la taille des particules (broyer) ________ Agiter la solution

Facteurs affectant la solubilité ou la vitesse de dissolution 3 - La nature du soluté et du solvant Habituellement, les solutés et solvants de même nature se dissolvent bien (polaire avec polaire, non- polaire avec non-polaire) Animation

Facteurs affectant la solubilité ou la vitesse de dissolution 4 – La pression N’influence pas la solubilité des liquides et des solides, mais influence grandement la solubilité des gaz : Grande pression = grande solubilité (boisson gazeuse fermée) Faible pression = faible solubilité (boisson gazeuse ouverte, gaz s’échappe) Animation

Les courbes de solubilité La solubilité des solutés varie avec la température. On représente la solubilité des substances par une courbe de solubilité _________ dans un ______. graphique

La courbe dans le graphique représente la quantité maximale qu’on peut dissoudre dans _______ d’eau à 100 g différentes _______. températures Tous les points sur la ligne représentent saturée la solution ____ Tous les points sous la ligne représentent une solution qui peut encore dissoudre du soluté, donc une insaturée solution _____.

Tous les points au-dessus de la ligne représentent une de deux choses : Si la solution contient la quantité indiquée de soluté et qu’il est dissout, la substance est _______ sursaturée Si la solution contient la quantité indiquée de soluté, mais qu’un dépôt se forme au fond (une partie n’est pas dissoute, la solution ne contient que le maximum saturée dissout), donc elle est ______

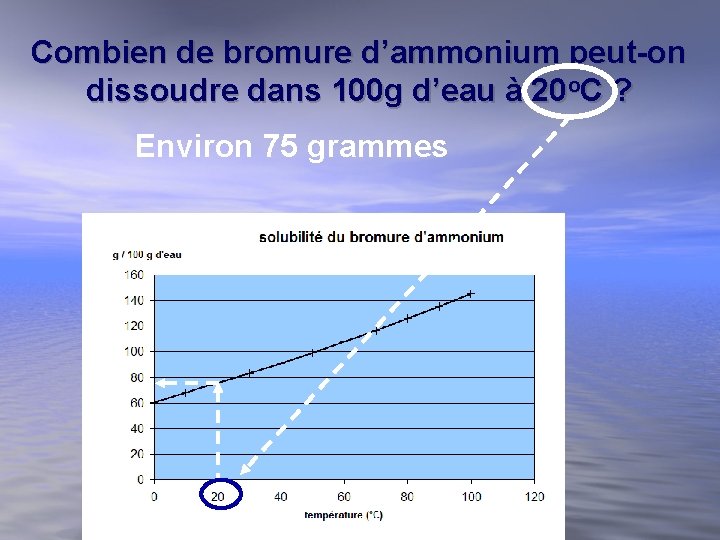
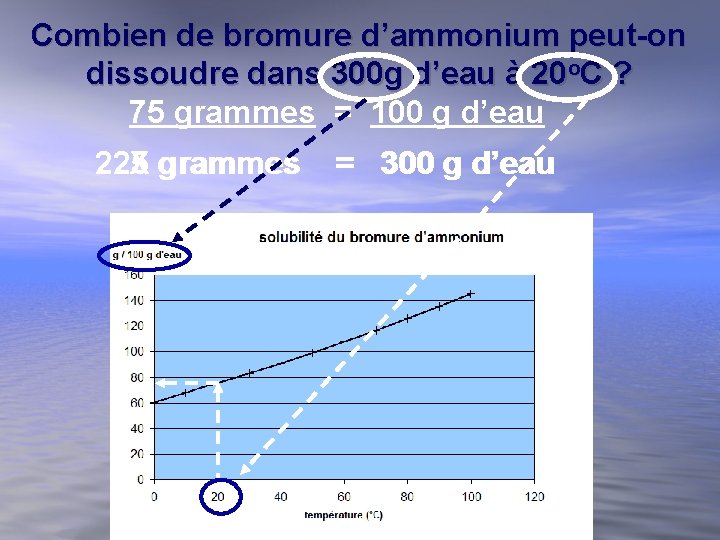
Combien de bromure d’ammonium peut-on dissoudre dans 100 g d’eau à 20 o. C ? Environ 75 grammes

Combien de bromure d’ammonium peut-on dissoudre dans 300 g d’eau à 20 o. C ? 75 grammes = 100 g d’eau 225 grammes = 300 g d’eau X grammes = 300 g d’eau

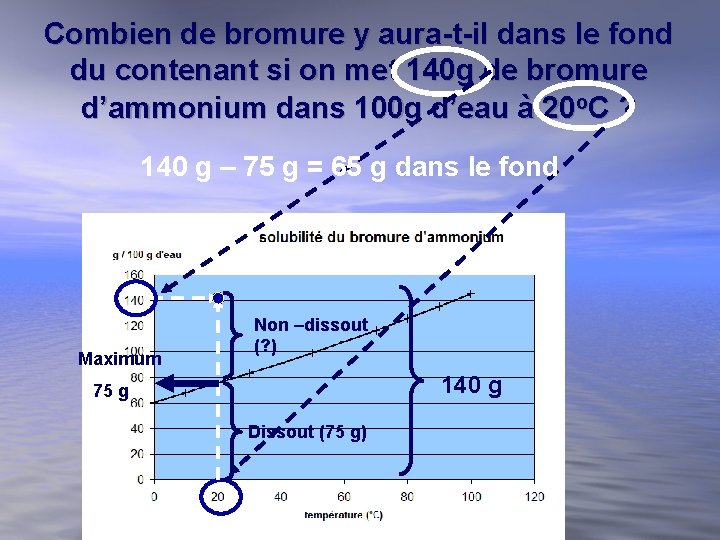
Combien de bromure y aura-t-il dans le fond du contenant si on met 140 g de bromure d’ammonium dans 100 g d’eau à 20 o. C ? 140 g – 75 g = 65 g dans le fond Maximum Non –dissout (? ) 140 g 75 g Dissout (75 g)

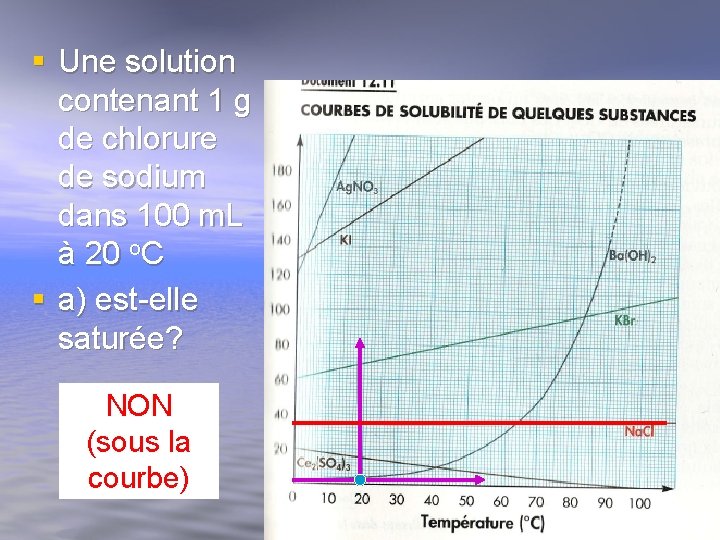
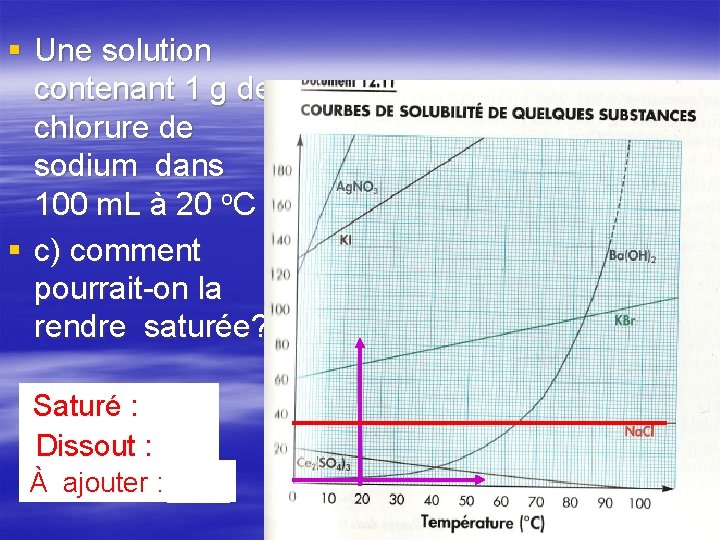
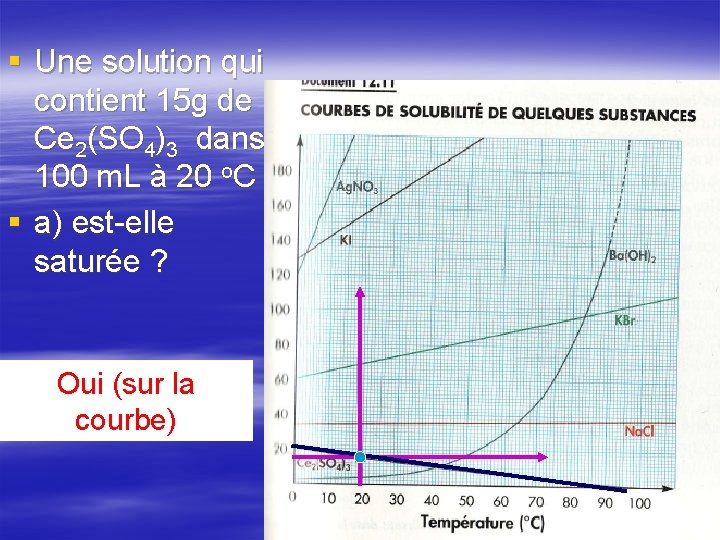
§ Une solution contenant 1 g de chlorure de sodium dans 100 m. L à 20 o. C § a) est-elle saturée? NON (sous la courbe)

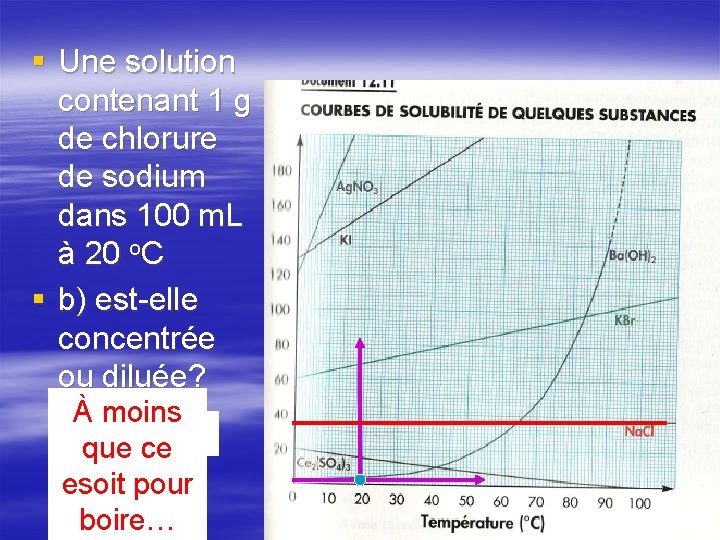
§ Une solution contenant 1 g de chlorure de sodium dans 100 m. L à 20 o. C § b) est-elle concentrée ou diluée? À moins dilué que ce esoit pour boire…

§ Une solution contenant 1 g de chlorure de sodium dans 100 m. L à 20 o. C § c) comment pourrait-on la rendre saturée? Saturé : 36 g Dissout : 1 g À ajouter : 35 g

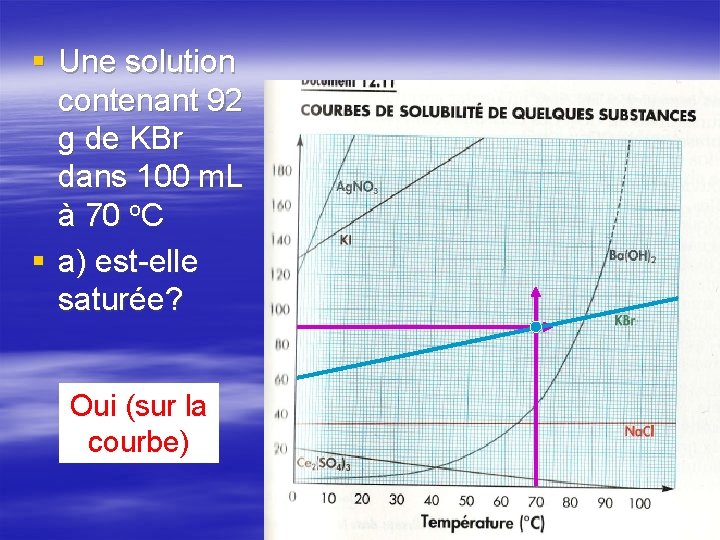
§ Une solution contenant 92 g de KBr dans 100 m. L à 70 o. C § a) est-elle saturée? Oui (sur la courbe)

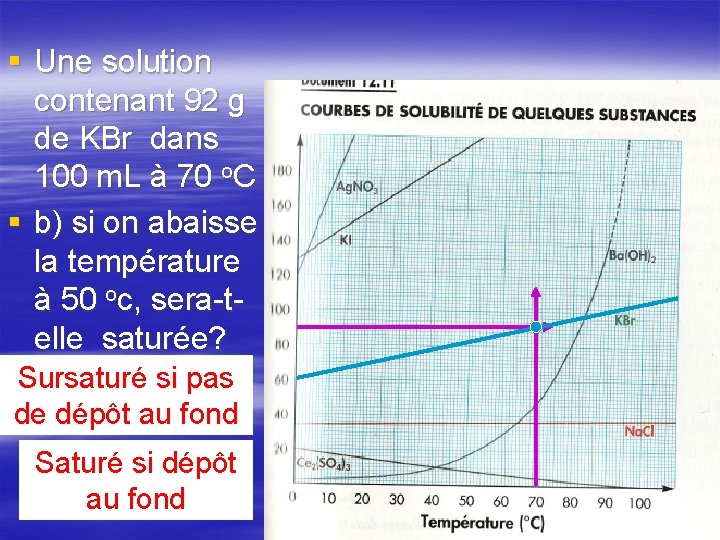
§ Une solution contenant 92 g de KBr dans 100 m. L à 70 o. C § b) si on abaisse la température à 50 oc, sera-telle saturée? Sursaturé si pas de dépôt au fond Saturé si dépôt au fond

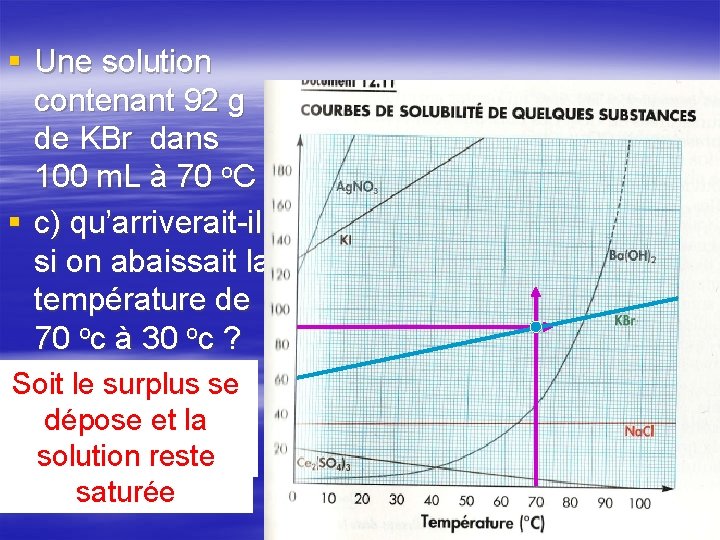
§ Une solution contenant 92 g de KBr dans 100 m. L à 70 o. C § c) qu’arriverait-il si on abaissait la température de 70 oc à 30 oc ? Soit le surplus se Soit elle devient sursaturée (pas dépose et la de dépôt au fond) solution reste saturée

§ Une solution qui contient 15 g de Ce 2(SO 4)3 dans 100 m. L à 20 o. C § a) est-elle saturée ? Oui (sur la courbe)

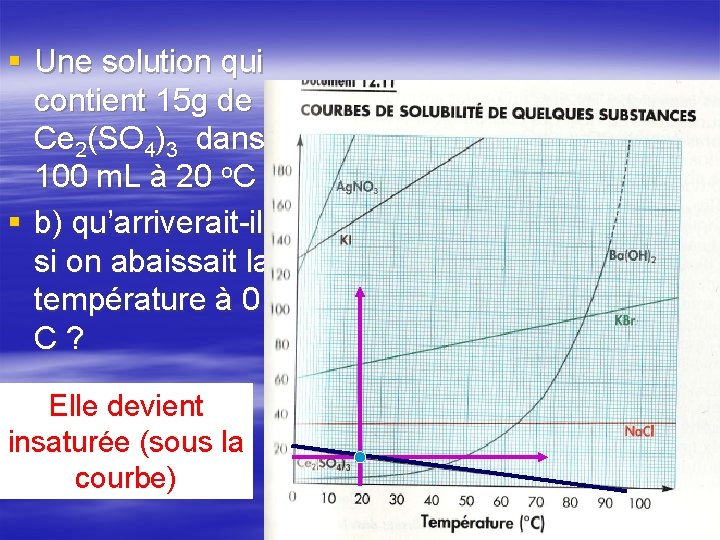
§ Une solution qui contient 15 g de Ce 2(SO 4)3 dans 100 m. L à 20 o. C § b) qu’arriverait-il si on abaissait la température à 0 o C ? Elle devient insaturée (sous la courbe)

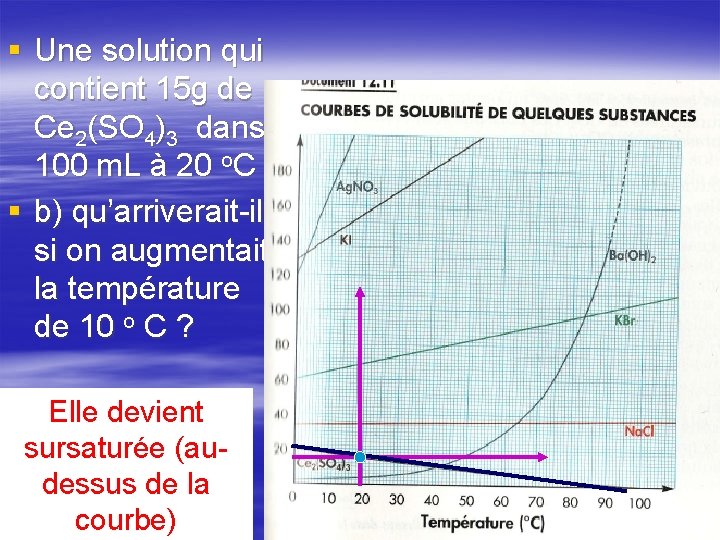
§ Une solution qui contient 15 g de Ce 2(SO 4)3 dans 100 m. L à 20 o. C § b) qu’arriverait-il si on augmentait la température de 10 o C ? Elle devient sursaturée (audessus de la courbe)

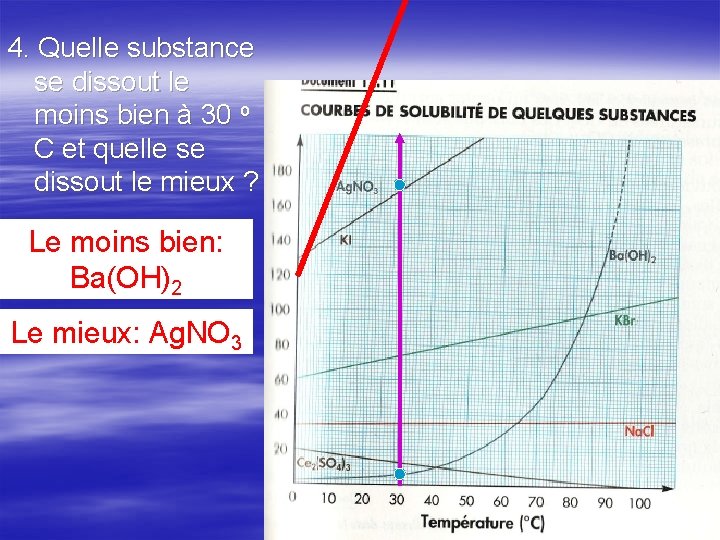
4. Quelle substance se dissout le moins bien à 30 o C et quelle se dissout le mieux ? Le moins bien: Ba(OH)2 Le mieux: Ag. NO 3

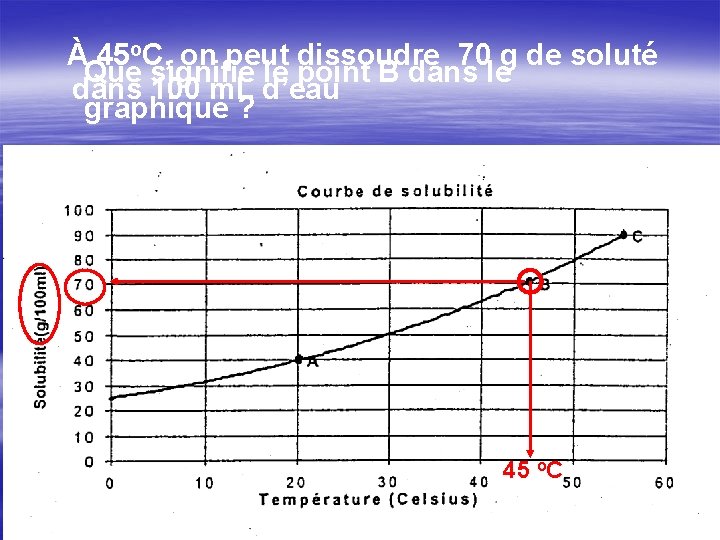
À 45 o. C, on peut dissoudre 70 g de soluté Que signifie le point B dans le dans 100 m. L d’eau graphique ? 45 o. C

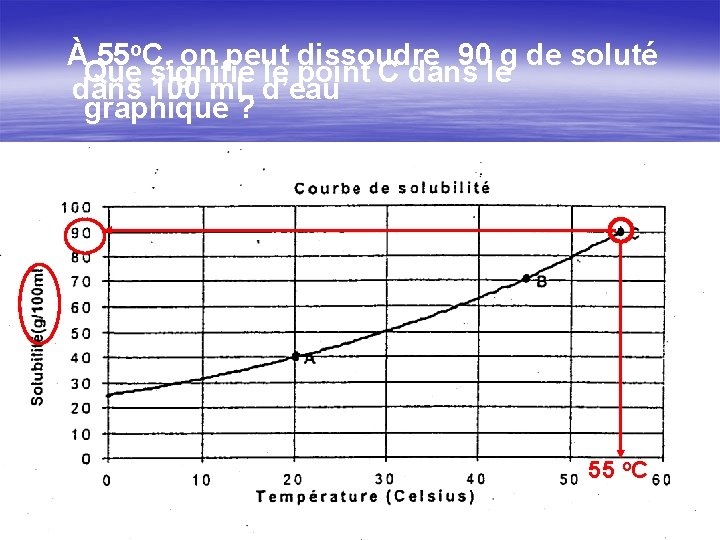
À 55 o. C, on peut dissoudre 90 g de soluté Que signifie le point C dans le dans 100 m. L d’eau graphique ? 55 o. C

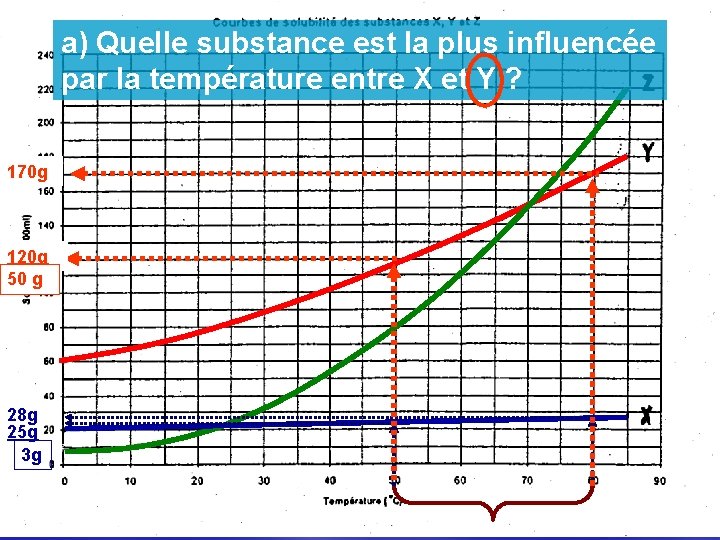
a) Quelle substance est la plus influencée par la température entre X et Y ? 170 g 120 g 50 g 28 g 25 g 3 g

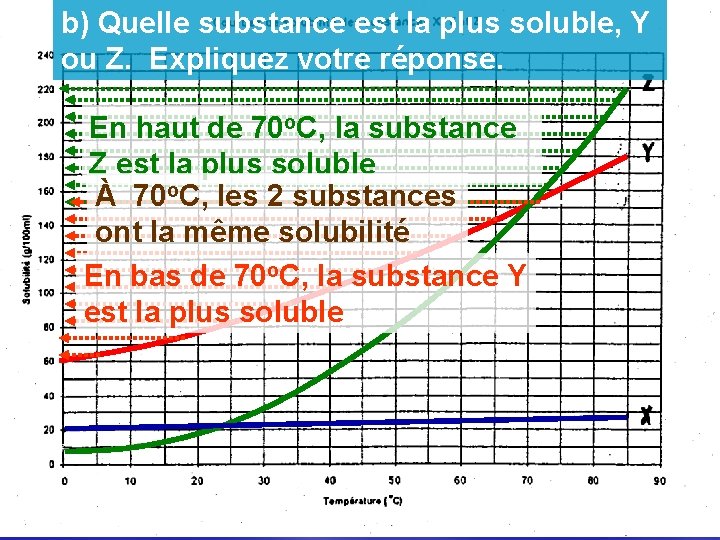
b) Quelle substance est la plus soluble, Y ou Z. Expliquez votre réponse. En haut de 70 o. C, la substance Z est la plus soluble À 70 o. C, les 2 substances ont la même solubilité En bas de 70 o. C, la substance Y est la plus soluble

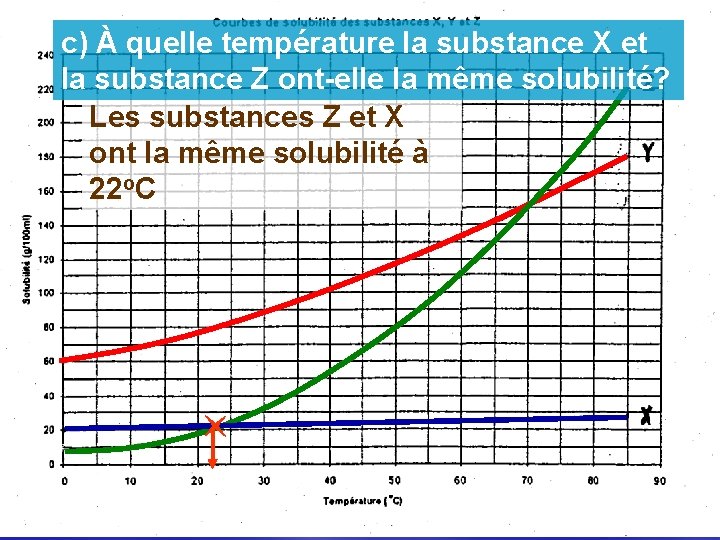
c) À quelle température la substance X et la substance Z ont-elle la même solubilité? Les substances Z et X ont la même solubilité à 22 o. C

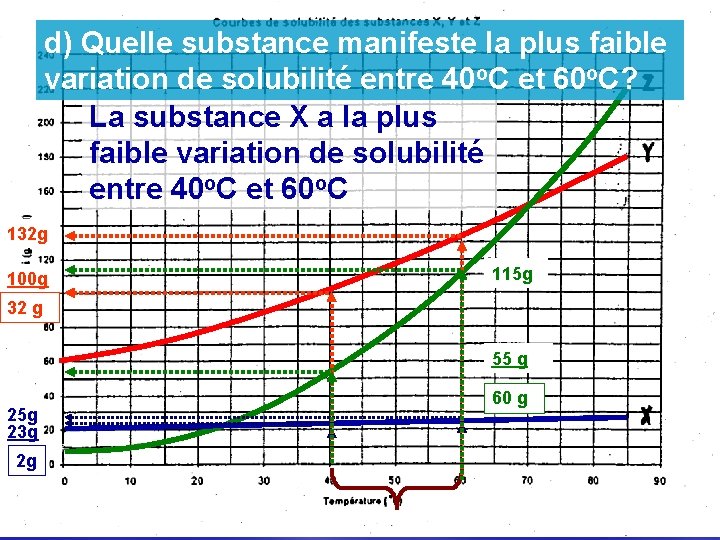
d) Quelle substance manifeste la plus faible variation de solubilité entre 40 o. C et 60 o. C? La substance X a la plus faible variation de solubilité entre 40 o. C et 60 o. C 132 g 100 g 115 g 32 g 55 g 25 g 23 g 2 g 60 g

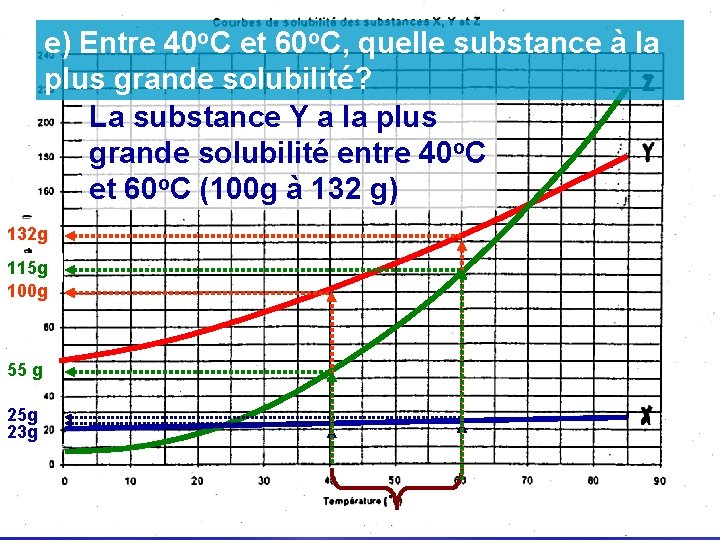
e) Entre 40 o. C et 60 o. C, quelle substance à la plus grande solubilité? La substance Y a la plus grande solubilité entre 40 o. C et 60 o. C (100 g à 132 g) 132 g 115 g 100 g 55 g 25 g 23 g

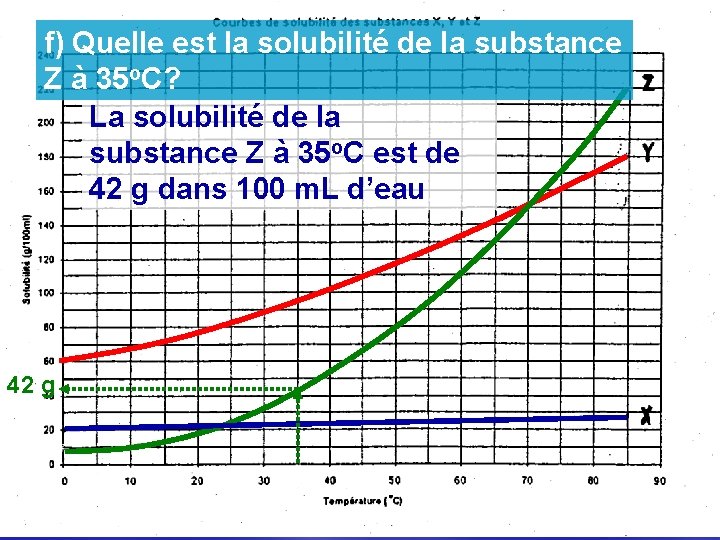
f) Quelle est la solubilité de la substance Z à 35 o. C? La solubilité de la substance Z à 35 o. C est de 42 g dans 100 m. L d’eau 42 g

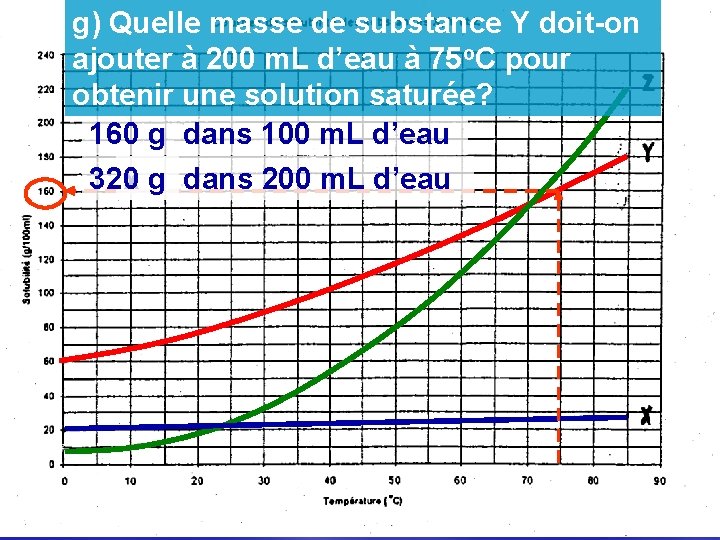
g) Quelle masse de substance Y doit-on ajouter à 200 m. L d’eau à 75 o. C pour obtenir une solution saturée? 160 g dans 100 m. L d’eau 320 g x g dans 200 m. L d’eau

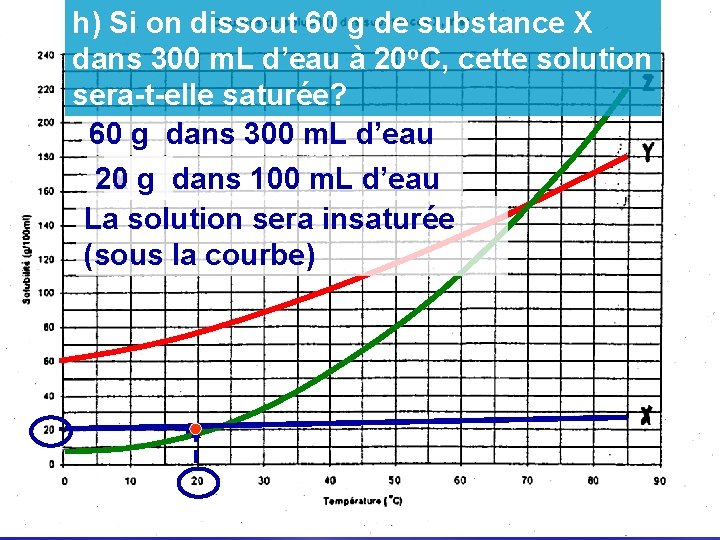
h) Si on dissout 60 g de substance X dans 300 m. L d’eau à 20 o. C, cette solution sera-t-elle saturée? 60 g dans 300 m. L d’eau 20 g x g dans 100 m. L d’eau La solution sera insaturée (sous la courbe)

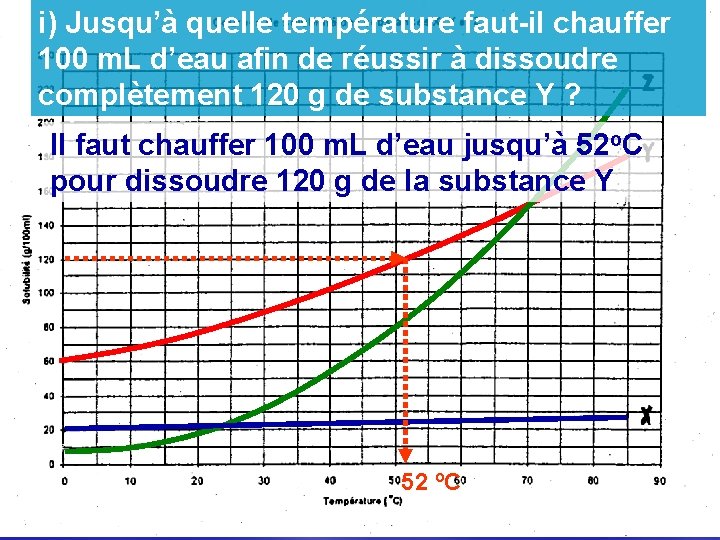
i) Jusqu’à quelle température faut-il chauffer 100 m. L d’eau afin de réussir à dissoudre complètement 120 g de substance Y ? Il faut chauffer 100 m. L d’eau jusqu’à 52 o. C pour dissoudre 120 g de la substance Y 52 o. C

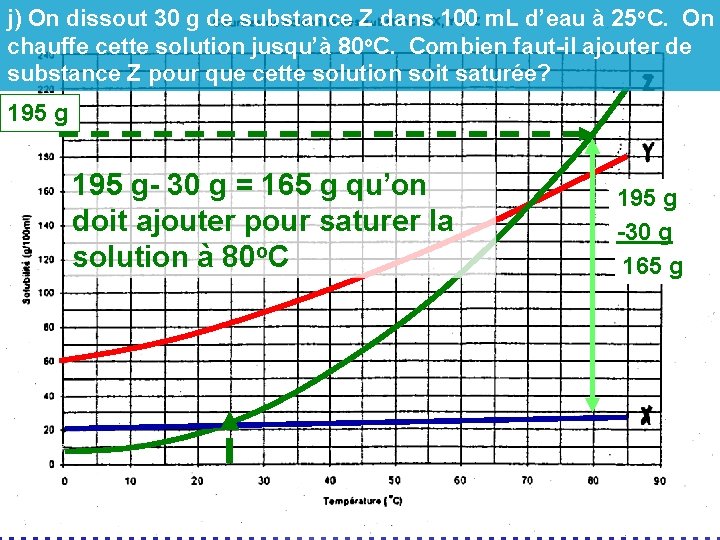
j) On dissout 30 g de substance Z dans 100 m. L d’eau à 25 o. C. On chauffe cette solution jusqu’à 80 o. C. Combien faut-il ajouter de substance Z pour que cette solution soit saturée? 195 g- 30 g = 165 g qu’on doit ajouter pour saturer la solution à 80 o. C 195 g -30 g 165 g

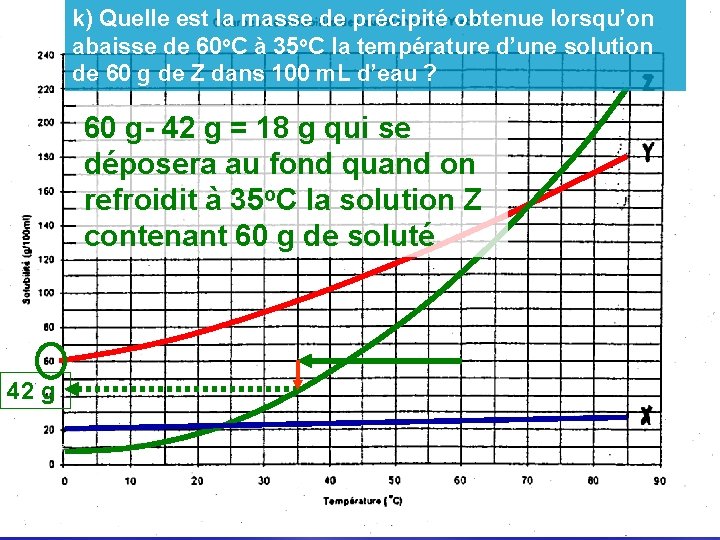
k) Quelle est la masse de précipité obtenue lorsqu’on abaisse de 60 o. C à 35 o. C la température d’une solution de 60 g de Z dans 100 m. L d’eau ? 60 g- 42 g = 18 g qui se déposera au fond quand on refroidit à 35 o. C la solution Z contenant 60 g de soluté 42 g

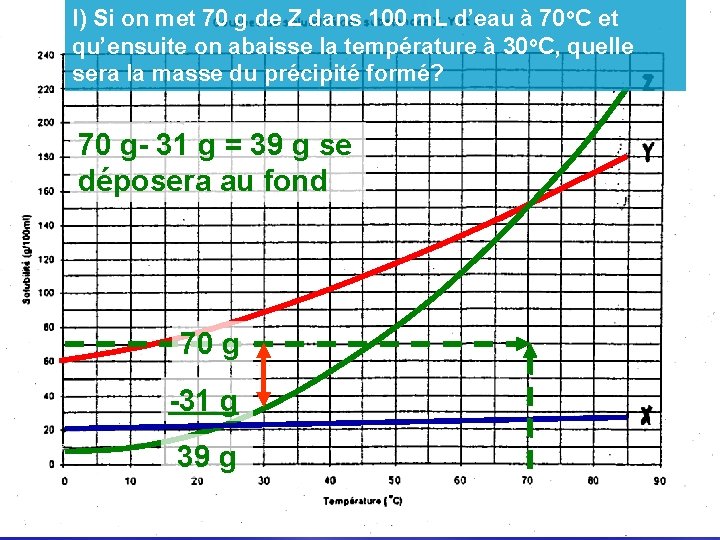
l) Si on met 70 g de Z dans 100 m. L d’eau à 70 o. C et qu’ensuite on abaisse la température à 30 o. C, quelle sera la masse du précipité formé? 70 g- 31 g = 39 g se déposera au fond 70 g -31 g 39 g

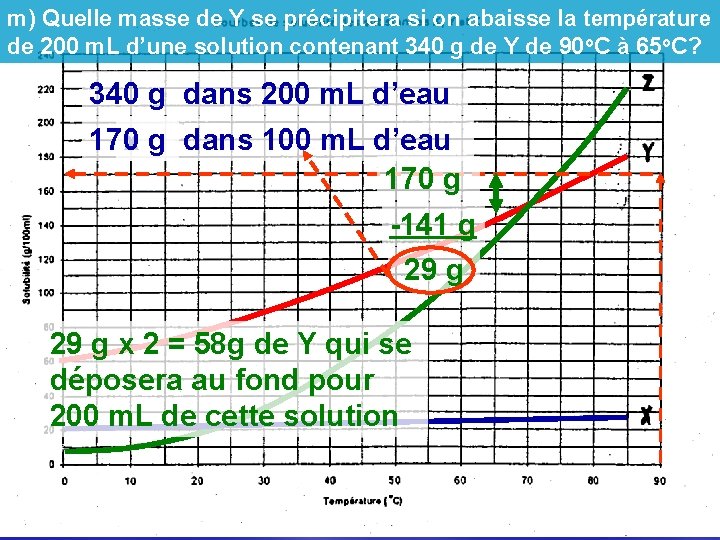
m) Quelle masse de Y se précipitera si on abaisse la température de 200 m. L d’une solution contenant 340 g de Y de 90 o. C à 65 o. C? 340 g dans 200 m. L d’eau 170 g x g dans 100 m. L d’eau 170 g -141 g 29 g x 2 = 58 g de Y qui se déposera au fond pour 200 m. L de cette solution