MODELO DE COLISIONES Tema 6 MODELO DE COLISIONES









- Slides: 22

MODELO DE COLISIONES Tema 6

MODELO DE COLISIONES Teoría cinético molecular • En una reacción química se rompen enlaces y se forman nuevos enlaces • Las moléculas pueden reaccionar si: _colisionan con otras de forman correcta _ ellas tienen suficiente energía de activación

MODELOS DE COLISIONES • Las moléculas deben chocar con la orientación correcta y con suficiente energía para causar el rompimiento y la formación de nuevos enlaces

ENERGÍA DE ACTIVACIÓN • Es la cantidad mínima de energía necesaria para que ocurra la reacción. • Al igual que una pelota no puede rodar por la colina, si no posee la suficiente energía para ello. Una reacción no puede ocurrir a menos que las moléculas posean la suficiente energía para superar la barrera de la energía de activación

• Hay reacciones que se producen en varias etapas. La etapa determinante en la velocidad de reacción será aquella que presente la mayor energía de activación, la cual será la etapa más lenta de la reacción.

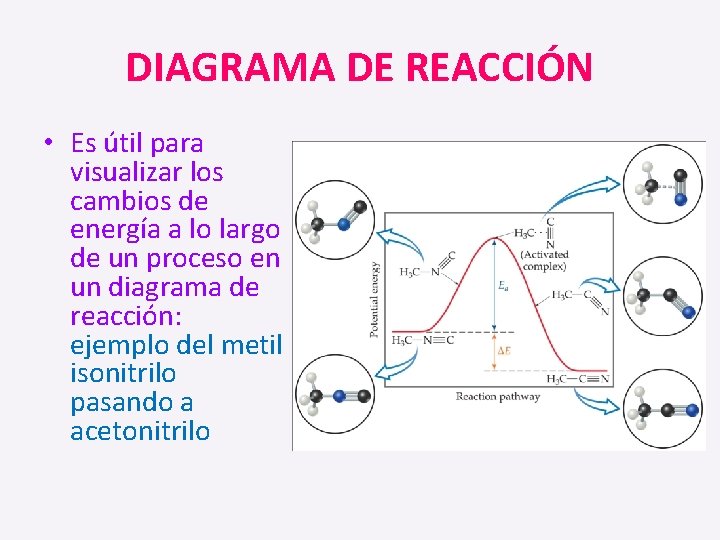
DIAGRAMA DE REACCIÓN • Es útil para visualizar los cambios de energía a lo largo de un proceso en un diagrama de reacción: ejemplo del metil isonitrilo pasando a acetonitrilo

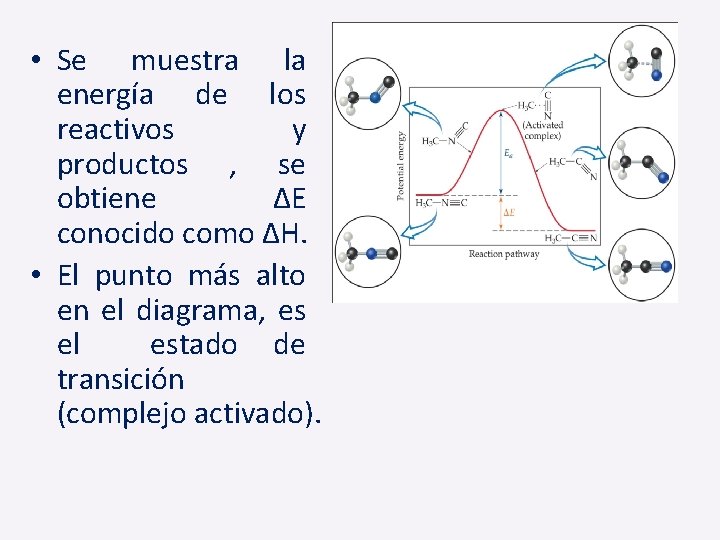
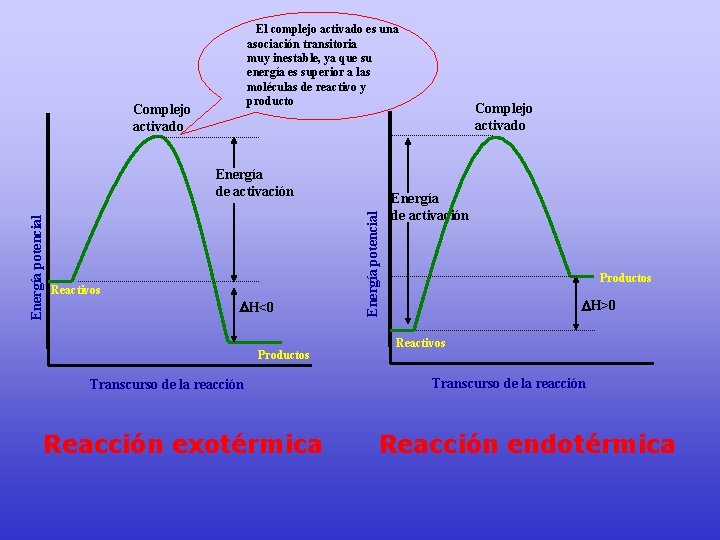
• Se muestra la energía de los reactivos y productos , se obtiene ∆E conocido como ∆H. • El punto más alto en el diagrama, es el estado de transición (complejo activado).

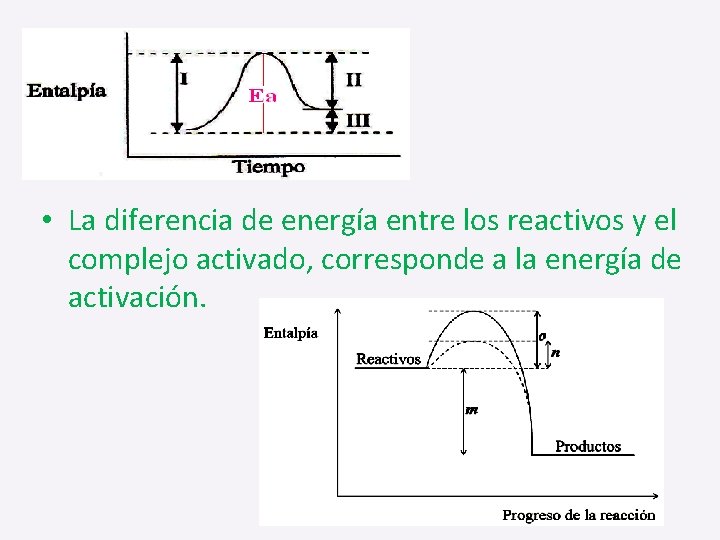
• La diferencia de energía entre los reactivos y el complejo activado, corresponde a la energía de activación.

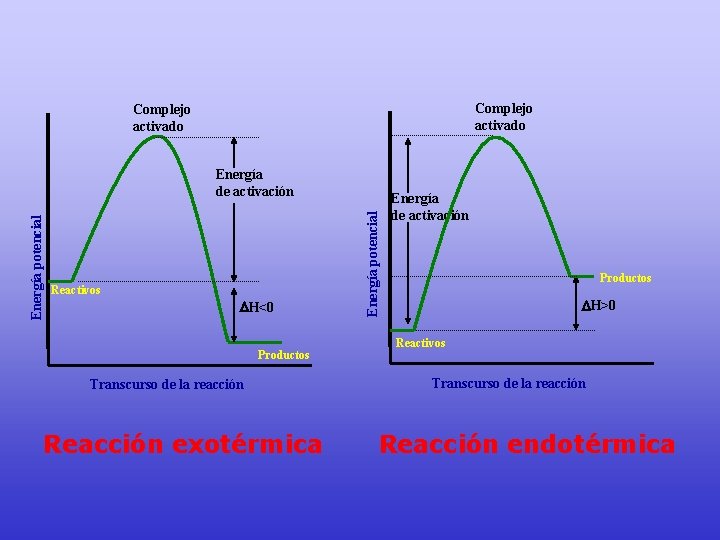
Complejo activado Reactivos H<0 Productos Transcurso de la reacción Reacción exotérmica Energía potencial Energía de activación Productos H>0 Reactivos Transcurso de la reacción Reacción endotérmica

El complejo activado es una asociación transitoria muy inestable, ya que su energía es superior a las moléculas de reactivo y producto Complejo activado Reactivos H<0 Productos Transcurso de la reacción Reacción exotérmica Energía potencial Energía de activación Complejo activado Energía de activación Productos H>0 Reactivos Transcurso de la reacción Reacción endotérmica

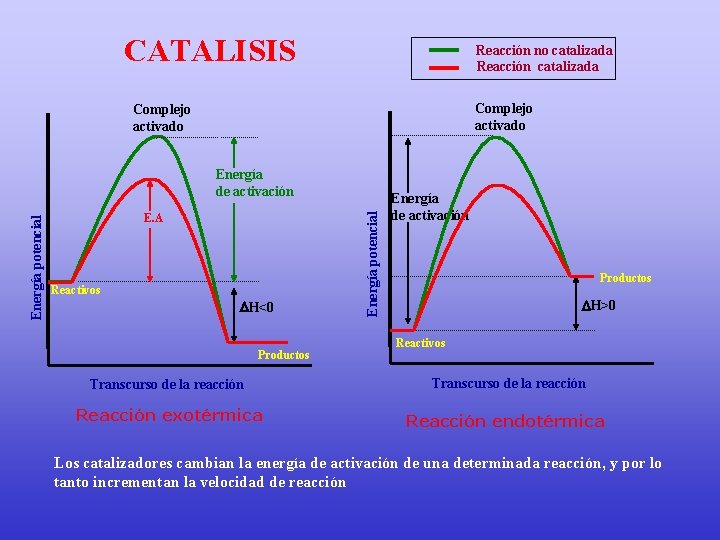
CATALISIS Reacción no catalizada Reacción catalizada Complejo activado E. A Reactivos H<0 Productos Energía potencial Energía de activación Productos H>0 Reactivos Transcurso de la reacción Reacción exotérmica Reacción endotérmica Los catalizadores cambian la energía de activación de una determinada reacción, y por lo tanto incrementan la velocidad de reacción

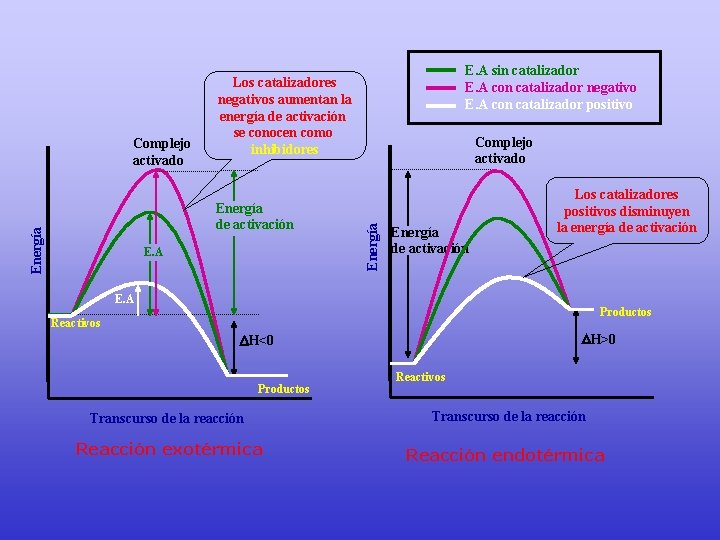
Energía de activación E. A Complejo activado Energía Complejo activado E. A sin catalizador E. A con catalizador negativo E. A con catalizador positivo Los catalizadores negativos aumentan la energía de activación se conocen como inhibidores Energía de activación Los catalizadores positivos disminuyen la energía de activación E. A Productos Reactivos H>0 H<0 Productos Reactivos Transcurso de la reacción Reacción exotérmica Reacción endotérmica

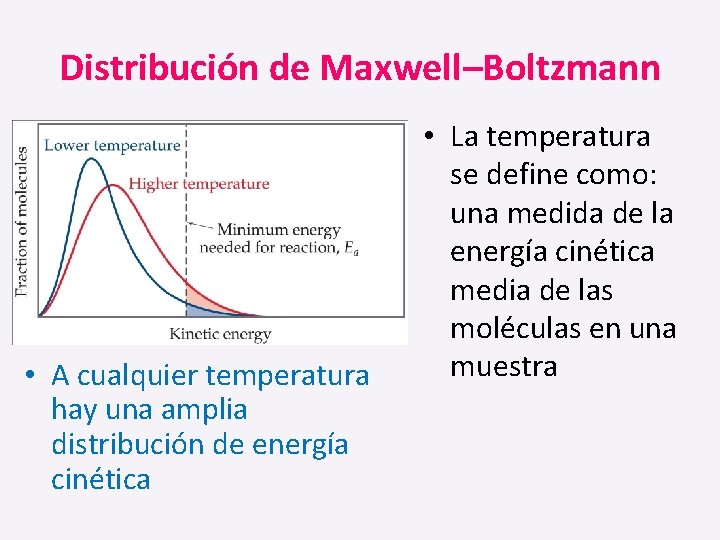
Distribución de Maxwell–Boltzmann • A cualquier temperatura hay una amplia distribución de energía cinética • La temperatura se define como: una medida de la energía cinética media de las moléculas en una muestra

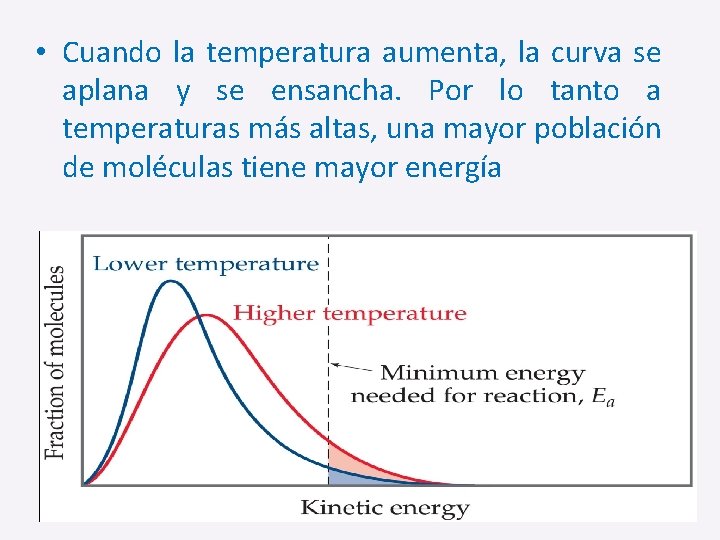
• Cuando la temperatura aumenta, la curva se aplana y se ensancha. Por lo tanto a temperaturas más altas, una mayor población de moléculas tiene mayor energía

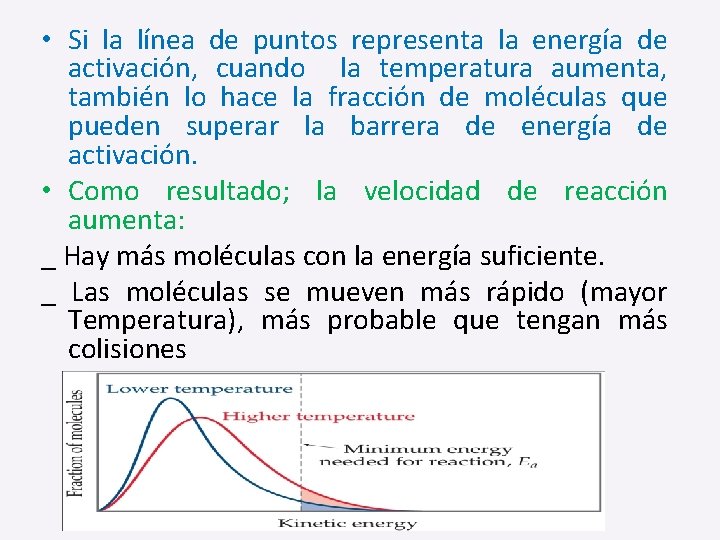
• Si la línea de puntos representa la energía de activación, cuando la temperatura aumenta, también lo hace la fracción de moléculas que pueden superar la barrera de energía de activación. • Como resultado; la velocidad de reacción aumenta: _ Hay más moléculas con la energía suficiente. _ Las moléculas se mueven más rápido (mayor Temperatura), más probable que tengan más colisiones

• Al elevar la temperatura de una reacción química entre gases, aumenta la velocidad de reacción, debido que aumenta la fracción de moléculas que tienen la energía necesaria para reaccionar

FACTORES QUE AFECTAN LA VELOCIDAD DE REACCIÓN • Temperatura: Aumenta el número de moléculas con la Ea necesaria • Concentración: Aumenta el número de moléculas disponibles para colisionar • Tamaño de las partículas: La disminución del tamaño, manteniendo la masa, implica más superficie para reaccionar. • Presión (en gases): El aumento de presión puede resultar en mayores colisiones • Catalizador: disminuye la energía de activación de una reacción. Puede aumentar el número de moléculas con la correcta Ea.

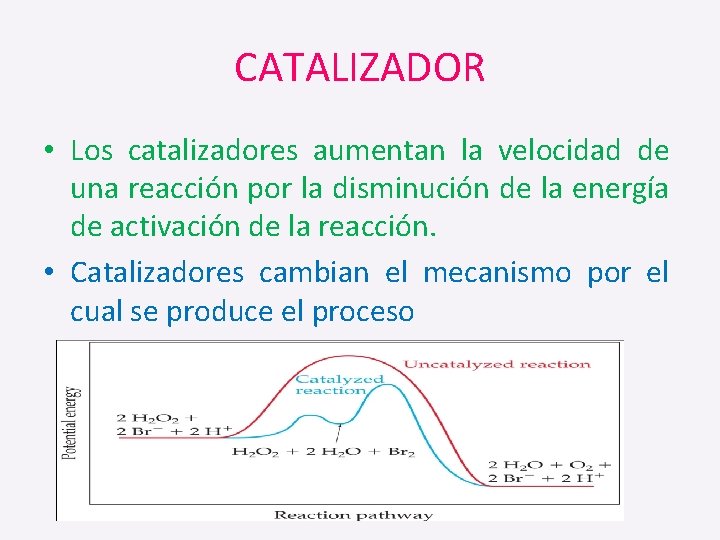
CATALIZADOR • Los catalizadores aumentan la velocidad de una reacción por la disminución de la energía de activación de la reacción. • Catalizadores cambian el mecanismo por el cual se produce el proceso

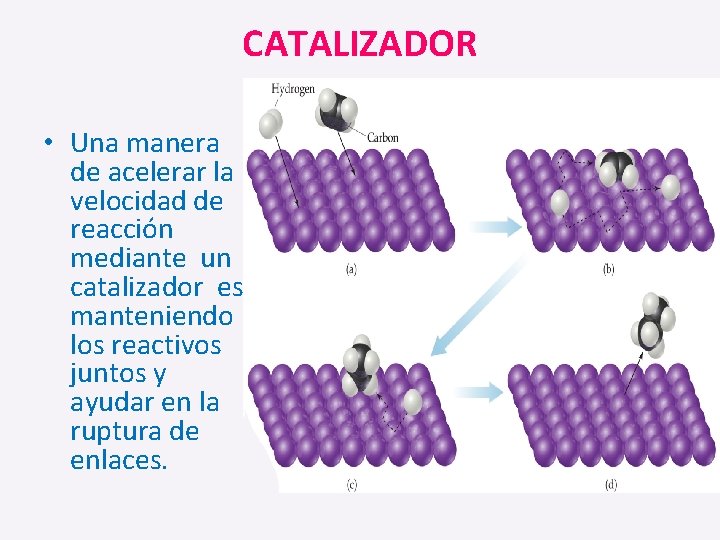
CATALIZADOR • Una manera de acelerar la velocidad de reacción mediante un catalizador es manteniendo los reactivos juntos y ayudar en la ruptura de enlaces.

• Un catalizador aumenta la velocidad de reacción, pero NO aumenta la cantidad de productos formados, ya que ello depende de la estequiometría de la reacción y de la pureza de los reactivos. • La colisión de partículas que chocan con la orientación necesaria deben tener una energía cinética mayor que la energía de activación, para formar productos

• Los catalizadores afectan la energía de activación, disminuyéndola. Otros factores como la temperatura NO afectan la energía de activación. • La entalpía de una reacción NO se ve afectada con la presencia de un catalizador. Los catalizadores (positivos) solo disminuyen la energía de activación, aumentando la velocidad con que ocurre el proceso.

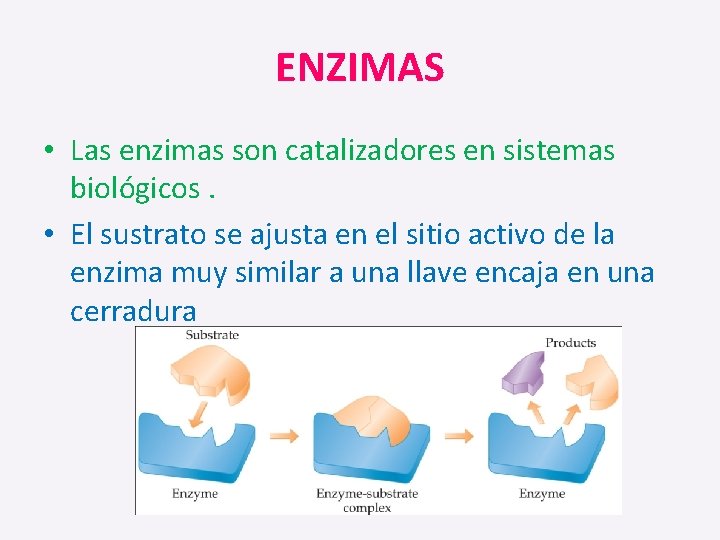
ENZIMAS • Las enzimas son catalizadores en sistemas biológicos. • El sustrato se ajusta en el sitio activo de la enzima muy similar a una llave encaja en una cerradura