Modalit de ralisation et dinterprtation du scanner ralis
























- Slides: 39

Modalité de réalisation et d'interprétation du scanner réalisé dans le cadre du dépistage du cancer bronchique Gilbert Ferretti MD-Ph. D INSERM U 823 CHU Grenoble

Liens d’intérêt • Aucun avec le sujet traité

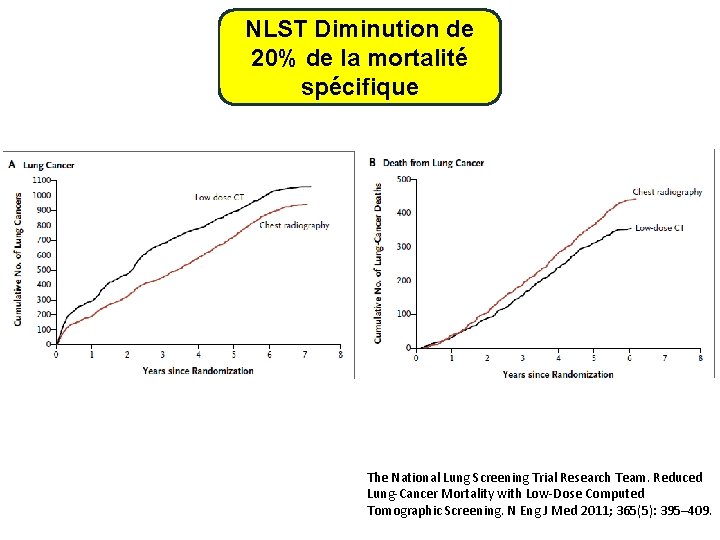
NLST Diminution de 20% de la mortalité spécifique The National Lung Screening Trial Research Team. Reduced Lung-Cancer Mortality with Low-Dose Computed Tomographic Screening. N Eng J Med 2011; 365(5): 395– 409.


Dépistage : Bénéfices / Risques Bénéfices Risques • Améliorer la survie • Faux positifs – Stade précoce • Améliorer la qualité de vie – Réduction morbidité liée à la maladie – Réduction morbidité liée aux traitements • Améliorer la santé par arrêt du tabac – Procédures invasives inutiles • Faux négatifs – Retard diagnostic • Sur diagnostic • Exposition aux RX • Complications liés aux procédures diagnostiques • réassurance suite test Wood DE JNCCN 2012

Recommandations de l’IASLC 1. Optimisation de l’identification des sujets à haut risque 2. Développement de recommandations radiologiques 3. Développement de recommandations pour le suivi clinique des nodules intermédiaires 4. Développement de recommandations pour le CR anatomopathologique 5. Définition de critères pour les interventions chirurgicales et thérapeutiques pour les nodules suspects 6. Développement de recommandations pour intégrer l’arrêt du tabagisme dans les programme de dépistage Field JK JTO 2012; 7: 10 -19

Qui dépister? • 55 – 74 ans • ≥ 30 PA • Fumeur actif ou sevré <15 ans • Pas de maladie évolutive grave • Pas d’infection pulmonaire < 3 mois • Acceptation de la répétition TDM et éventuels examens complémentaires • Démarche sevrage • Information bénéfices risques

Risques Relatifs lié à différents Facteurs de Risque • Tabagisme actif : RR 20 • Tabagisme passif : RR 1. 24 • Exposition professionnelle aux 8 principaux (arsenic, chrome, amiante, nickel, cadnium, berrylium, silice, fumées de diesel) : RR 1. 59 • Exposition au radon : RR 1. 14 • Histoire familiale de cancer : RR 3. 5 • Emphysème : RR 1. 8 • Fibrose pulmonaire : RR 8. 25 • Irradiation thérapeutique thoracique : RR 13 Wood DE JNCCN 2012 Cassidy A Br J Cancer 2008 Wille MMW Eur Radiol 2016

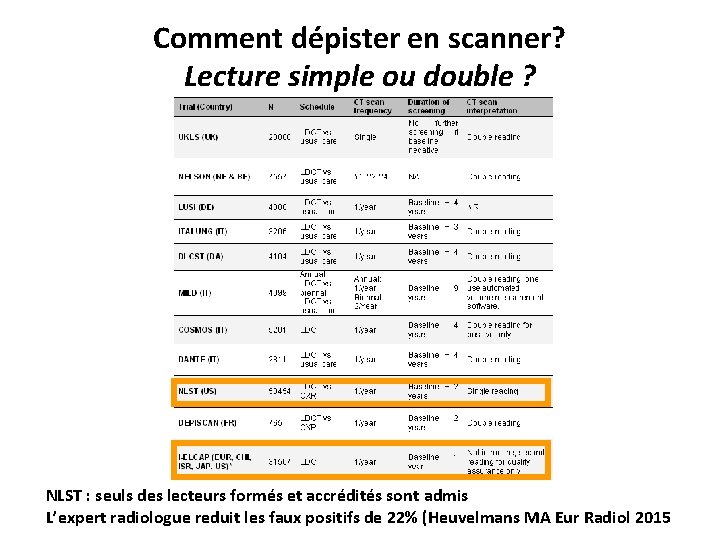
Comment dépister en scanner? Acquisition Appareil multibarrette (≥ 16) • Thorax acquis en une apnée • Epaisseur de coupes < 1. 5 mm • mode « basse dose » sans injection – – – NLST : 20 à 40 m. As (effective) I-ELCAP : 120 k. V, 40 m. As ou moins NELSON : adaptation des k. V au poids UKLS : CTDI< 4 m. Gy NLST low-dose CT dose effective < 1. 5 m. Sv (équivalent ~~ 5 mois d’irradiation naturelle) vs. 7 m. Sv pour TDM dg (-70%) • Revue coupes axiales, MIP, rôle CAD ? Couraud S Annals Oncology 2013 Field JK Thorax 2016

Comment dépister en scanner? Lecture simple ou double ? NLST : seuls des lecteurs formés et accrédités sont admis L’expert radiologue reduit les faux positifs de 22% (Heuvelmans MA Eur Radiol 2015

Nodule pulmonaire • Opacité focale arrondie de 3 (15 mm 3) à 30 mm (14130 mm 3 ) • Étiologies multiples – Bénignes : granulomes, ganglions, hamartochondrome – Malignes : • • Cancer primitif à croissance rapide Cancer primitif à croissance lente ou très lente Métastases Lymphome • Prévalence de TDM 45% dans une population à risque de cancer … problème très courant Blanchon T. Lung Cancer 2007: 58

Nodule mixte Nodule solide >90% N non solide Mc. Williams A NEJM 2013 <10% Nodule dépoli pur

Augmentation du nombre de nodules détectés en TDM La majorité des nodules sont bénins Faire la preuve de la bénignité Aspect typiquement bénin Calcification / graisse Biopsie Résection chirurgicale Évolution dans le temps Arenberg DA CHEST 2014; 145(3): 440– 442

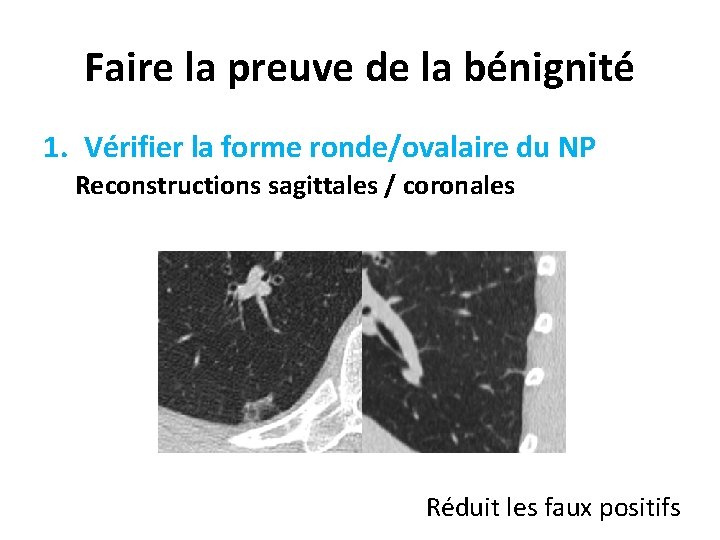
Faire la preuve de la bénignité 1. Vérifier la forme ronde/ovalaire du NP Reconstructions sagittales / coronales Réduit les faux positifs

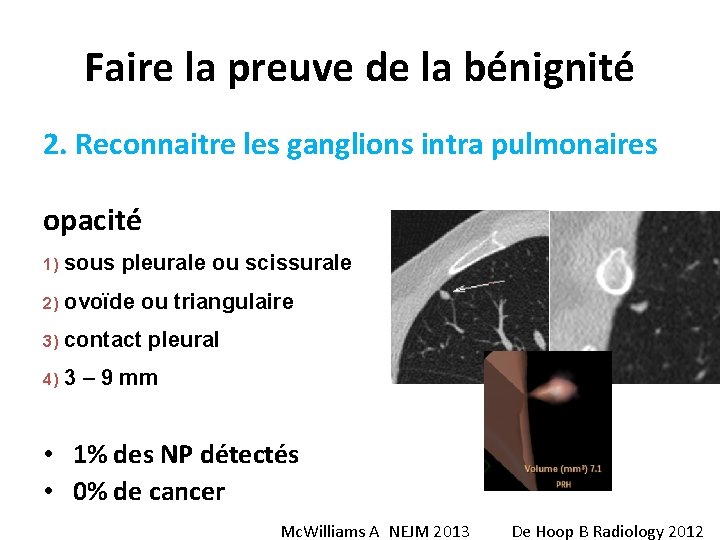
Faire la preuve de la bénignité 2. Reconnaitre les ganglions intra pulmonaires opacité 1) sous pleurale ou scissurale 2) ovoïde ou triangulaire 3) contact pleural 4) 3 – 9 mm • 1% des NP détectés • 0% de cancer Mc. Williams A NEJM 2013 De Hoop B Radiology 2012

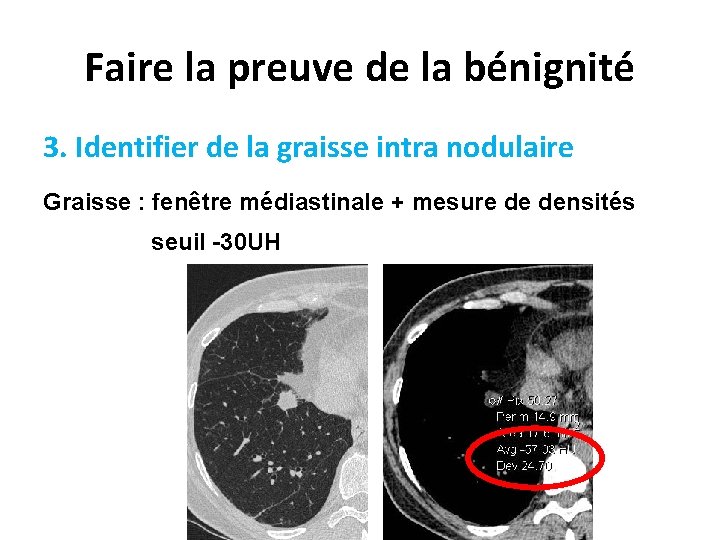
Faire la preuve de la bénignité 3. Identifier de la graisse intra nodulaire Graisse : fenêtre médiastinale + mesure de densités seuil -30 UH

Faire la preuve de la bénignité 4. Reconnaitre les calcifications bénignes Calcifications ü Complète ü Centrale ü périphérique ü Concentrique ü Pop-corn

Faire la preuve de la bénignité 5 - Pas d’exploration agressive des nodules en verre dépoli ou mixtes avant affirmation de la persistance à 3 mois Disparition spontanée des NP NS Ø 38% des nodules en verre dépoli pur (26/69) Ø 49% (57/117) des nodules mixtes Ø 44 % des nodules non solides (33/75) Oh Lung Cancer 2006 ØFacteurs de disparitions : lobulaire, NP mixte, de grande taille (p<0. 006) Felix L Eur J Radiol 2011

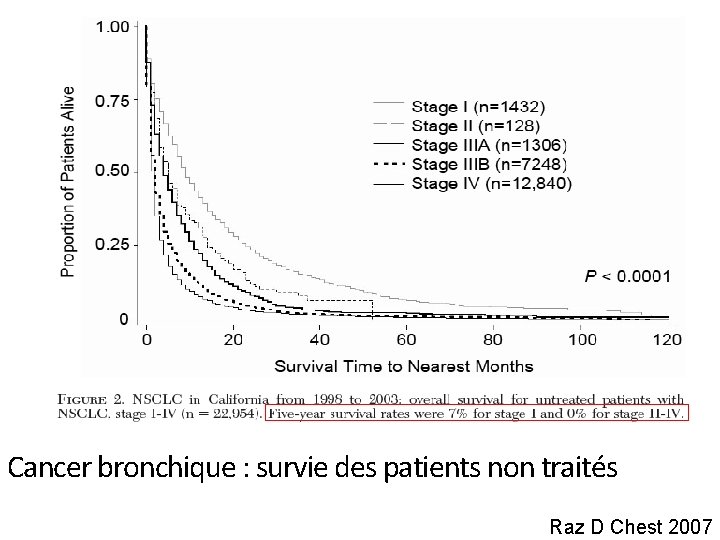
Cancer bronchique : survie des patients non traités Raz D Chest 2007

Prise en charge des nodules non bénins Gouvernée par 2 objectifs • Ne pas laisser évoluer un cancer primitif opérable (survie à 5 ans stade IA > 70% ) (faux négatif) • Ne pas opérer les lésions bénignes compte tenu des risques opératoires (faux positif)

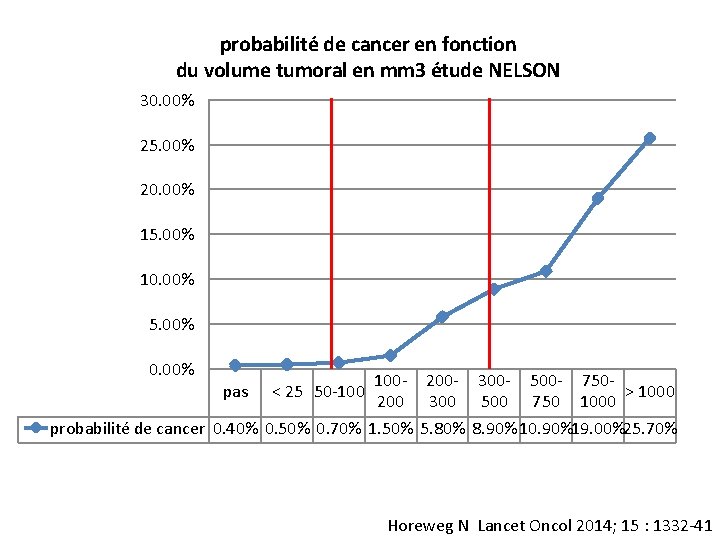
probabilité de cancer en fonction du volume tumoral en mm 3 étude NELSON 30. 00% 25. 00% 20. 00% 15. 00% 10. 00% 5. 00% 0. 00% 100 - 200 - 300 - 500 - 750> 1000 200 300 500 750 1000 probabilité de cancer 0. 40% 0. 50% 0. 70% 1. 50% 5. 80% 8. 90% 10. 90%19. 00%25. 70% pas < 25 50 -100 Horeweg N Lancet Oncol 2014; 15 : 1332 -41

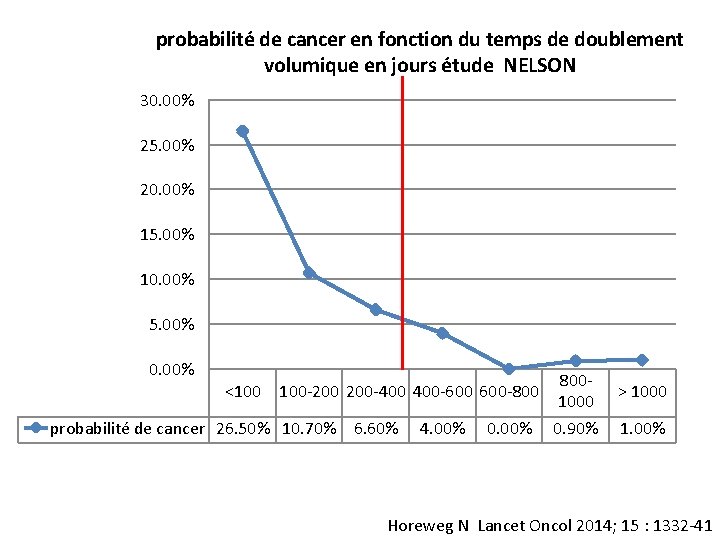
probabilité de cancer en fonction du temps de doublement volumique en jours étude NELSON 30. 00% 25. 00% 20. 00% 15. 00% 10. 00% 5. 00% 0. 00% <100 100 -200 200 -400 400 -600 600 -800 probabilité de cancer 26. 50% 10. 70% 6. 60% 4. 00% 0. 00% 8001000 0. 90% > 1000 1. 00% Horeweg N Lancet Oncol 2014; 15 : 1332 -41

Réduction des suivis inutiles Augmentation des diagnostics précoces de cancer Probabilité de cancer du NP < 0, 5% – V < 50 mm 3 – D < 5 mm Probabilité de cancer du NP > 15, 2% – V > 500 mm 3 : 16, 9% – D > 10 mm : 15, 2% Probabilité de cancer du NP – 100 < V < 200 mm 3 : 1, 5% – 200 < V < 300 mm 3 : 5, 8% – 300 < V < 500 mm 3 : 8, 9% Horeweg N Lancet Oncol 2014; 15 : 1332 -41

NLST vs. NELSON Nair & Hansell Eur Radiol 2011; 21: 2445– 2454

Nodules indéterminées 5 -10 mm évaluation morphologique Croissance : limite des mesures 2 D – Croissance asymétrique non détectée – Erreurs de mesure : +/- 1, 7 mm Seuil significatif permettant d’affirmer la croissance : 2 mm Besoin mesure automatique du volume Revel MP Radiology 2004 Chang B Chest 2013

Rapidité de croissance V = 4/3 r 3 Volume x 2 = diamètre x 1, 26 • • • TDM volumique coupes 1 mm Reproductibilité de mesure faible Extraction informatique du nodule

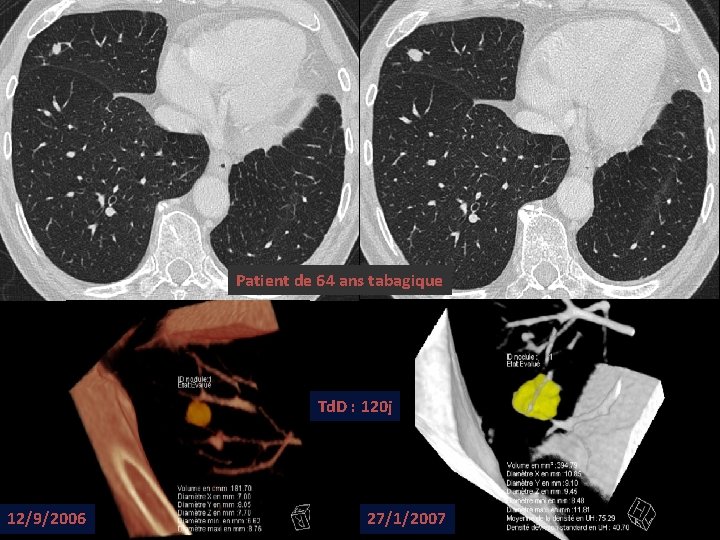
Patient de 64 ans tabagique Td. D : 120 j 12/9/2006 27/1/2007

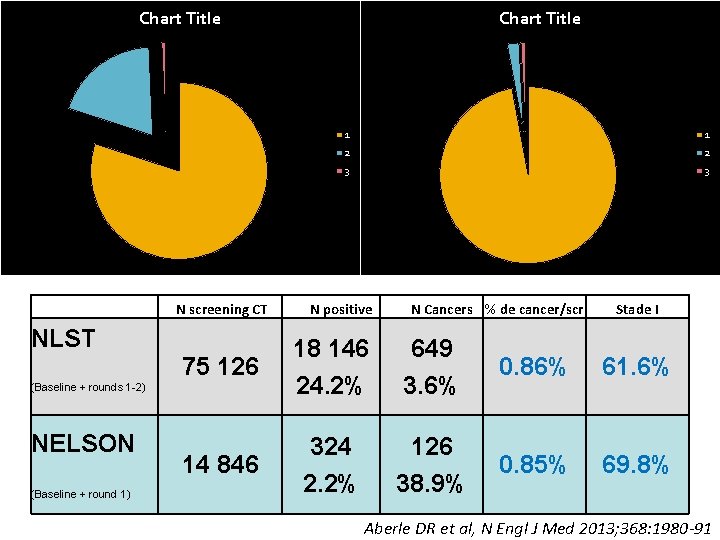
Chart Title N screening CT NLST (Baseline + rounds 1 -2) NELSON (Baseline + round 1) Chart Title 1 1 2 2 3 3 N positive N Cancers % de cancer/scr Stade I 75 126 18 146 24. 2% 24. 1% 649 3. 6% 0. 86% 61. 6% 14 846 324 2. 2% 126 38. 9% 0. 85% 69. 8% Aberle DR et al, N Engl J Med 2013; 368: 1980 -91

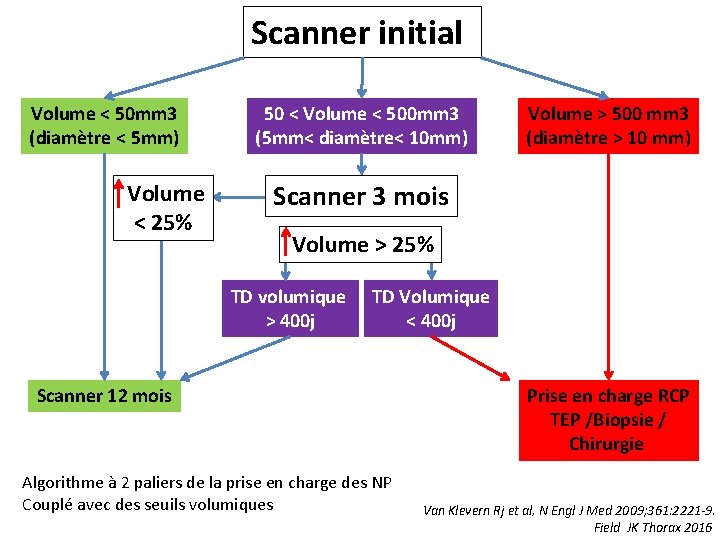
Test positif NELSON Originalité Le volume nodulaire initial puis son évolution à 3 mois (400 j < TDD < 400 j) est à la base de la prise en charge dans Nelson pour les nodules 50 – 500 mm 3 Ø La répétition des scanners est limitée Ø Les tests invasifs sont limités Ø La TEP n’a pas sa place Ø Propositions pour les positifs DM Xu Lung Cancer 2006, 54, 177

Scanner initial Volume < 50 mm 3 (diamètre < 5 mm) Volume < 25% 50 < Volume < 500 mm 3 (5 mm< diamètre< 10 mm) Volume > 500 mm 3 (diamètre > 10 mm) Scanner 3 mois Volume > 25% TD volumique > 400 j TD Volumique < 400 j Scanner 12 mois Algorithme à 2 paliers de la prise en charge des NP Couplé avec des seuils volumiques Prise en charge RCP TEP /Biopsie / Chirurgie Van Klevern Rj et al, N Engl J Med 2009; 361: 2221 -9. Field JK Thorax 2016

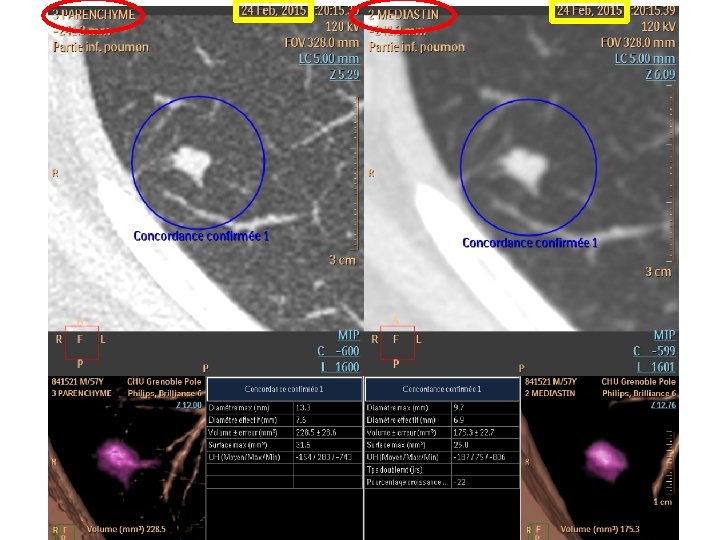
Avantage de la gestion informatique des nodules Couple détection automatique et caractérisation – Seuil de 5 mm pour la détection automatique : réduit les faux positifs sans perte de chance – Caractérisation : calcul du TDD tumoral • • • Réduction du taux de positif Majoration du taux de vrai positif Sélection des cancer à croissance rapide Réduction des « sur diagnostic » Pas de perte de chance Horenweg N Eur Respir J 2013

Limites de l’évaluation 3 D • Acquisition scanner doit être identique++++ – Épaisseur de coupe – Paramètres d’irradiation – Volume d’inspiration – Filtrage de de reconstruction des images – Absence d’injection de contraste • Augmentation significative V si > 20% • Non adapté aux NP non solide … Xie X. Eur Radiol 2013 Brown MS Eur Radiol 2016


Options diagnostiques des nodules en verre dépoli (NPVD) • 79% de ces nodules seraient des sur-diagnostics (Patz EF JAMA 2014 ) • Pour les NVDP indéterminés la probabilité d’AIS ou MIA est forte >75%, mais ne peut pas être affirmée en TDM : 2 options peuvent être discutées – Résection chirurgicale – Suivi par TDM annuelle pendant au moins 5 ans Godoy Radiology. 2009 253: 606– 22 • Limites imposées par les NPVD – le diagnostic par biopsie n’est pas recommandé lié à la structure hétérogène des NPVD. Travis WD et al. JTO 2011 ; 6: 244– 85 • La stratégie repose sur la résection chirurgicale Rami-Porta R Eur. Respir. J. 2009 ; 33: 426– 35

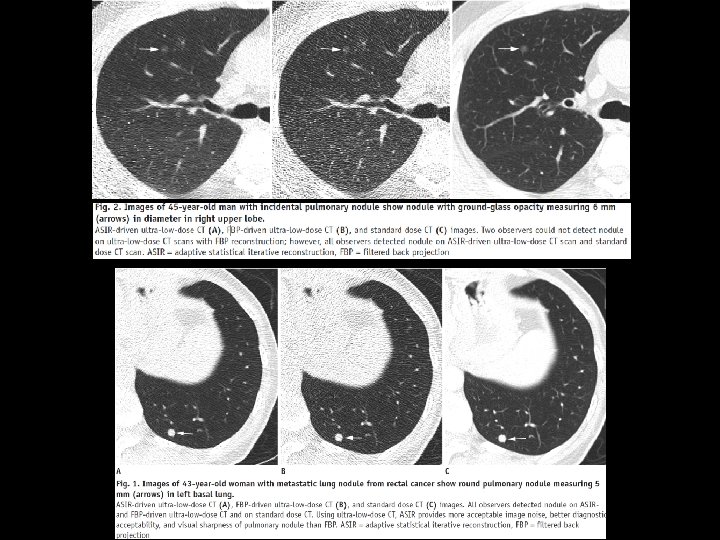
Scanner ultra low dose et dépistage 1 mort évitée pour 320 dépistages (NLST) Un cancer radio induit / 2500 dépistages (Bach PB JAMA 2012; 307) DLP x 0, 017 = DE ü TDM NRD < 425 m. Gy. cm (7, 2 m. Sv) ü TDM Low dose NLST < 90 m. Gy. cm (1. 5 m. Sv) ü TDM Ultra low dose < 10 mgy. cm (0, 17 m. Sv) üDose proche de celle de 1 RXT F+P üReconstruction itérative dernière génération üInfluence sur la détection, la volumétrie, la densitométrie : en cours d’évaluation Kim Y AJR 2015; 204 Yoon HJ KJR 2015; 16


Faux négatifs • VPN du scanner de dépistage > 99% (van Klaveren NEJM 2009; 361) • Question peu étudiée – 22 cas NELSON • • • 5 cancers endobronchiques 3 adénopathie 5 épaississement paroi de bulle 2 erreur observationnelle 7 autre – 7 cas Biomarkscan Scholten ET Eur Radiol 2015 Lecourtois 2012 J Radiol

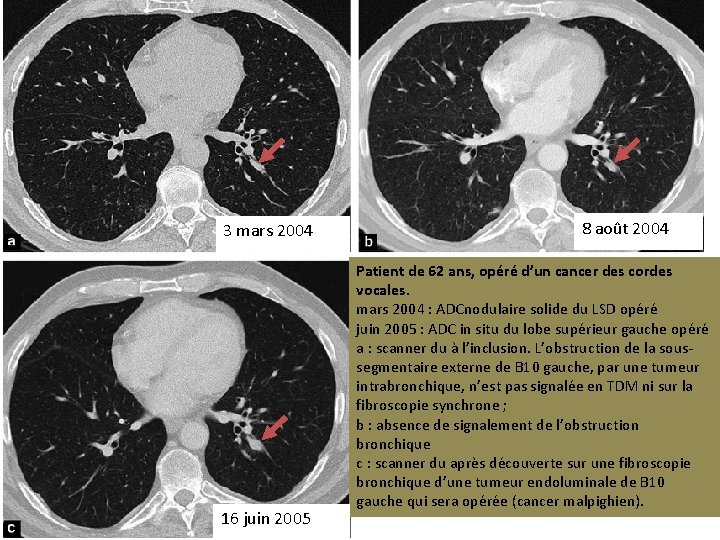
3 mars 2004 16 juin 2005 8 août 2004 Patient de 62 ans, opéré d’un cancer des cordes vocales. mars 2004 : ADCnodulaire solide du LSD opéré juin 2005 : ADC in situ du lobe supérieur gauche opéré a : scanner du à l’inclusion. L’obstruction de la soussegmentaire externe de B 10 gauche, par une tumeur intrabronchique, n’est pas signalée en TDM ni sur la fibroscopie synchrone ; b : absence de signalement de l’obstruction bronchique c : scanner du après découverte sur une fibroscopie bronchique d’une tumeur endoluminale de B 10 gauche qui sera opérée (cancer malpighien).

Conclusion • Précautions techniques d’acquisition, de lecture, d’évaluation des scanners : Formation des radiologues • La volumétrie et le temps sont deux paramètres à intégrer dans la gestion des NP 5 -10 mm • En cours d’évaluation : – Meilleure sélection des sujets à risque (emphysème RR 1. 8 ; histoire familiale) – Périodicité / période de dépistage – Ultra basse dose < 10 m. Gy. cm – Volumétrie des nodules en verre dépoli – Modélisation de la croissance – Couplage ADN circulant, micro ARN Tanoue LT AJRCCM 2015