Mitochondrium Peroxisoma kls membrn bels membrn lemezek crista

Mitochondrium - Peroxisoma külső membrán belső membrán lemezek / crista matrix Dr. habil. Kőhidai László egytemi docens Semmelweis Egyetem, Genetikai, Sejt- és Immunbiológiai Intézet 2008.

Tudomány-történet v Altmann - a Mch. első megfigyelője és leírója v Benda - a „Mitochondrium” név adója v Warburg - respirációs enzimek vizsgálata v Lehninger - az oxidatív foszforilációs rendszer leírója
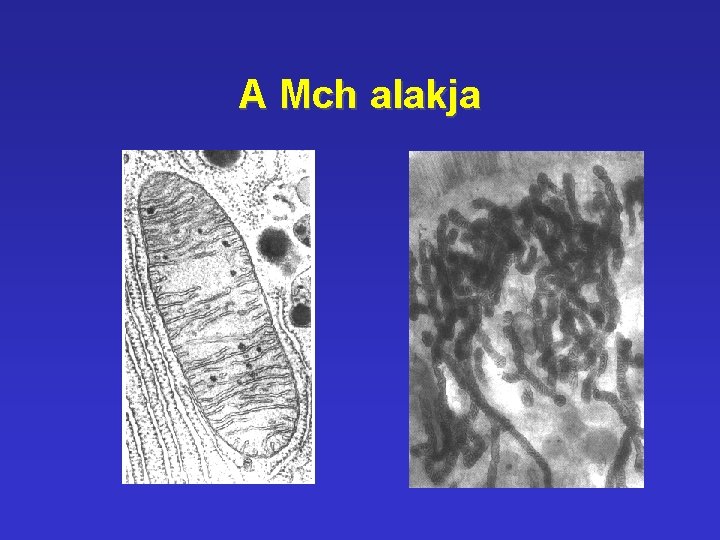
A Mch alakja
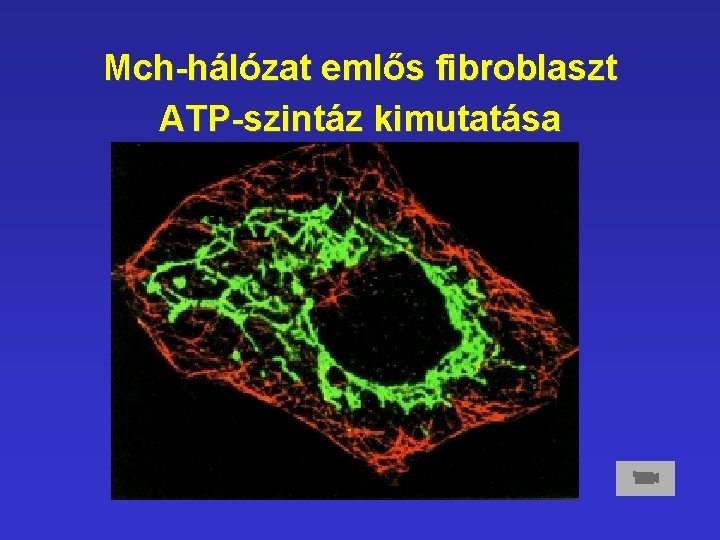
Mch-hálózat emlős fibroblaszt ATP-szintáz kimutatása

Jellemző adatok • Méret: 7 x 0. 5 mm DE: sejttípusonként igen változó ! • Szám: az adott sejt energia forgalmátólszükségletétől függően változó sperimum - 24 fvs. 300 májsejt - 500 -2500 Chaos-Chaos - 500. 000 !

Felépítés kompartmentalizáció Külső membrán • fehérjékben szegény • jellemző fehérje: porin • (b-redő – b-lemezes szerkezet, • trimerjei csatornát képeznek) • permeabilitás 5000 daltonig Belső membrán • 70% fehérje • e- - szállító lánc fehérjéi • ATP szintézis • egyébként impermeábilis – 20% cardiolipin

Felépítés 2. Matrix • Piroszőlősav dehidrogenáz komplex • Citromsav-ciklus enzimei • Zsírsav b-oxidáció enzimei • Aminosav oxidáció enzimei • DNS, riboszómák • ATP, ADP, Pi • Mg 2+, Ca 2+, K+

Mch belső membránja lemezes csöves ujjlenyomat-szerű bogyós

Mch elhelyezkedése a sejtben Bazális csíkolat
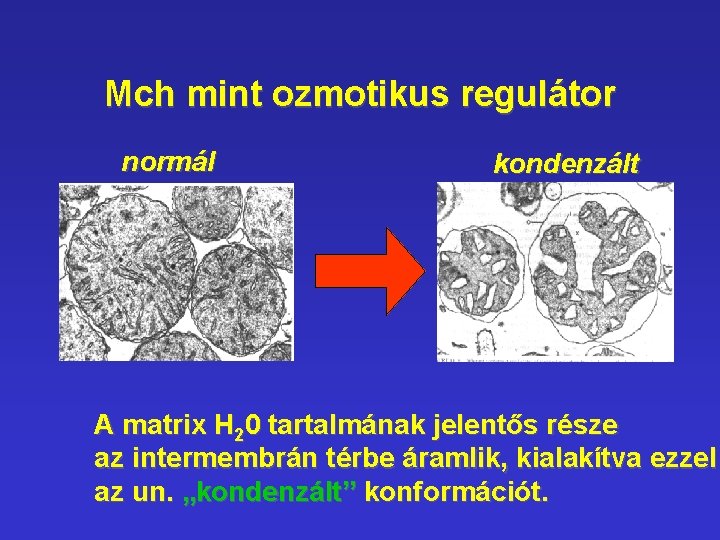
Mch mint ozmotikus regulátor normál kondenzált A matrix H 20 tartalmának jelentős része az intermembrán térbe áramlik, kialakítva ezzel az un. „kondenzált” konformációt.
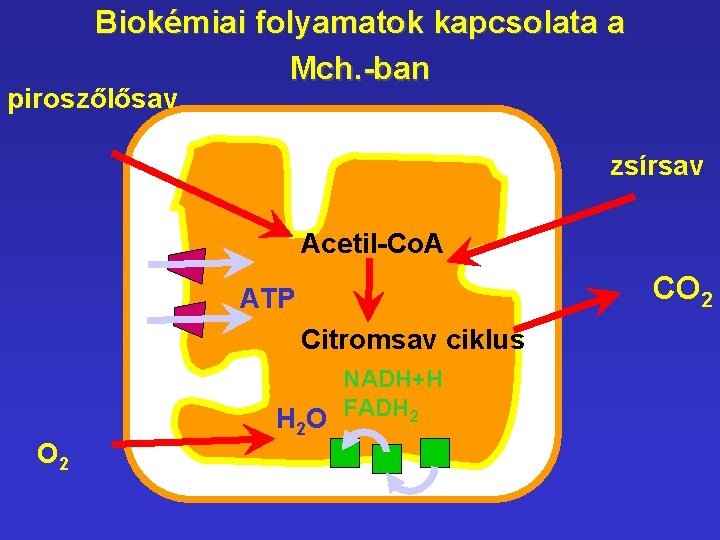
Biokémiai folyamatok kapcsolata a Mch. -ban piroszőlősav zsírsav Acetil-Co. A CO 2 ATP Citromsav ciklus O 2 H 2 O NADH+H FADH 2

Kemiozmotikus teória megvalósulásának feltételei • • • Mch. légzési lánc - elektronokat mozgat - H+-t pumpál az intermembrán térbe Mch. ATP szintáz szintén proton pumpaként reverzibilis mechanizmus: H+ be H+ ki működik. ATP szintézis ATP bontás • A Mch. belső membránban számos carrier molekula található metabolitok, inorg. Ionok számára • A Mch. belső membránja egyéb helyeken inpermeábilis H+ és OH- ra.
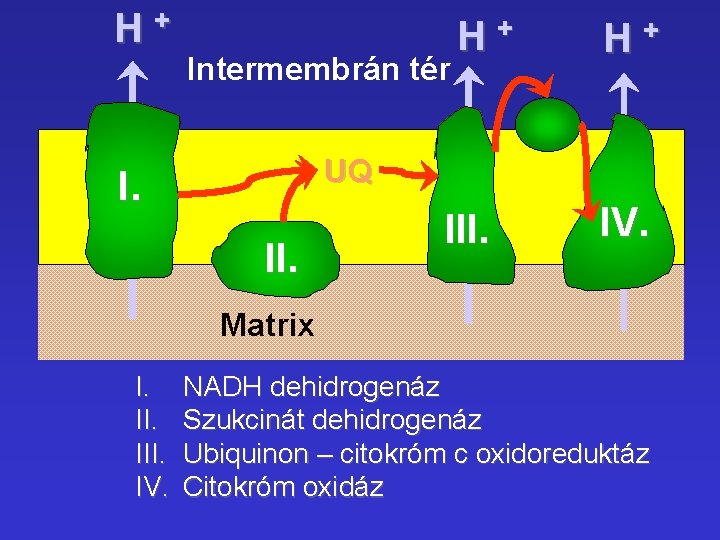
H+ Intermembrán tér H+ H+ UQ I. II. IV. Matrix I. III. IV. NADH dehidrogenáz Szukcinát dehidrogenáz Ubiquinon – citokróm c oxidoreduktáz Citokróm oxidáz
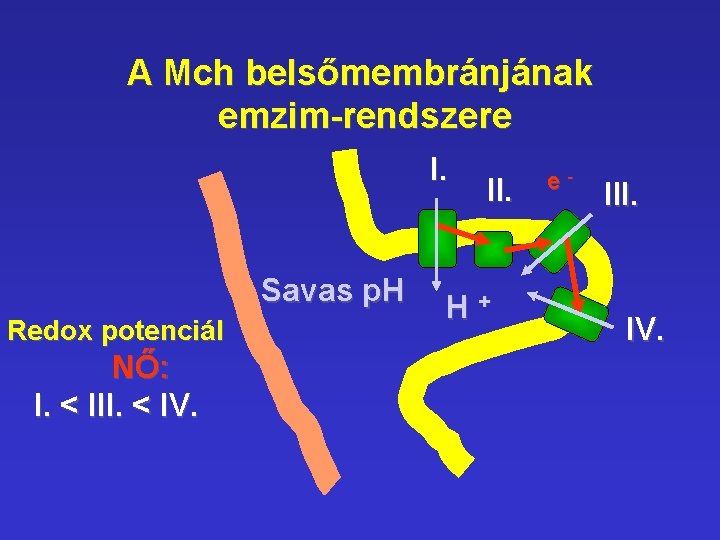
A Mch belsőmembránjának emzim-rendszere I. Savas p. H Redox potenciál NŐ: I. < III. < IV. II. H+ e- III. IV.
![Nyugvó állapot Matrix [H+]=10 -9 M [K+] = [Cl-] = 0. 1 M [H+]=10 Nyugvó állapot Matrix [H+]=10 -9 M [K+] = [Cl-] = 0. 1 M [H+]=10](http://slidetodoc.com/presentation_image/3ddb5853c1e7d5301d01b1d2c6ef3238/image-15.jpg)
Nyugvó állapot Matrix [H+]=10 -9 M [K+] = [Cl-] = 0. 1 M [H+]=10 -9 M Intermembrán tér Matrix [K+]<[Cl-] [H+]=10 -9 Intermembrán tér M ATP H+ K+ K+ [H+]=10 -7 M Ionofórral kezelt (Valinomycin)
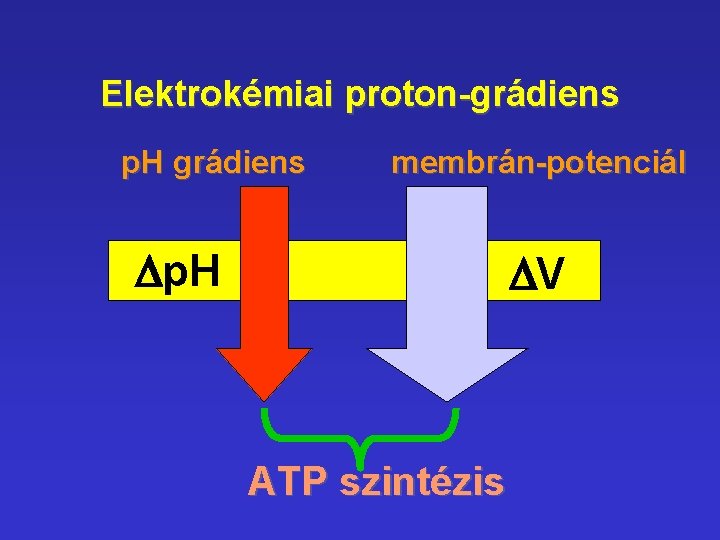
Elektrokémiai proton-grádiens p. H grádiens membrán-potenciál Dp. H DV ATP szintézis
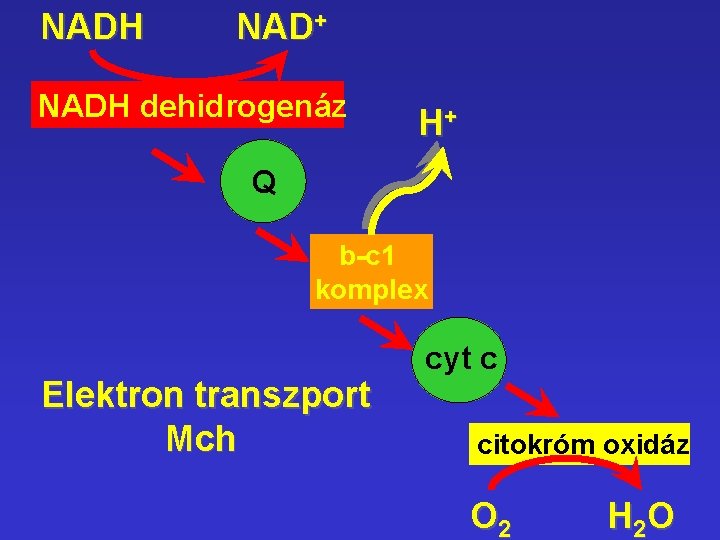
NADH NAD+ NADH dehidrogenáz H+ Q b-c 1 komplex Elektron transzport Mch cyt c citokróm oxidáz O 2 H 2 O
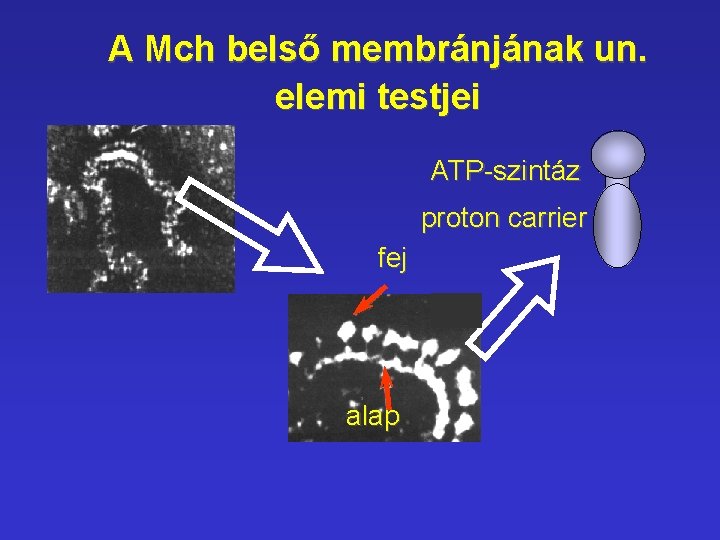
A Mch belső membránjának un. elemi testjei ATP-szintáz proton carrier fej alap
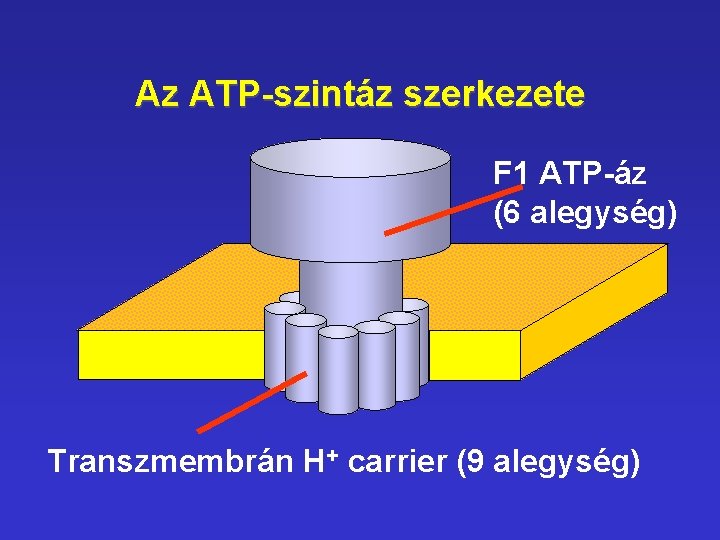
Az ATP-szintáz szerkezete F 1 ATP-áz (6 alegység) Transzmembrán H+ carrier (9 alegység)
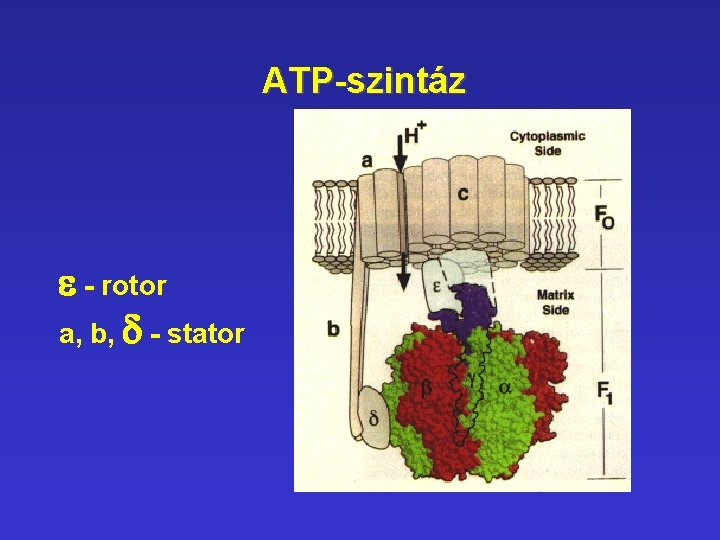
ATP-szintáz e - rotor a, b, d - stator
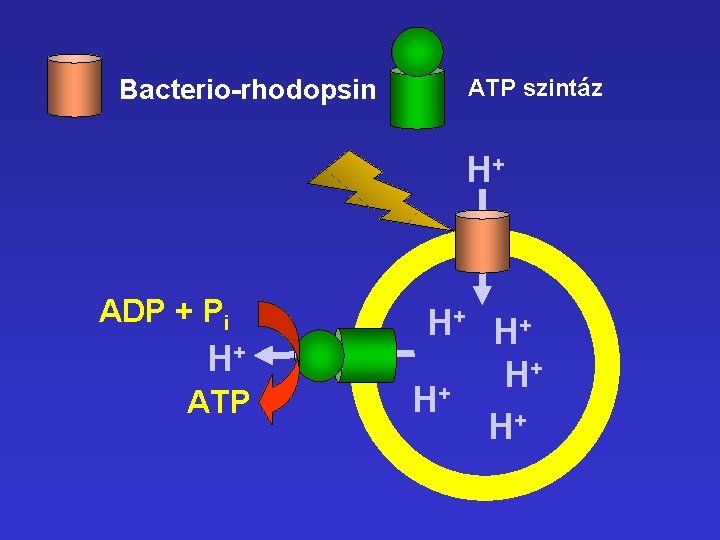
Bacterio-rhodopsin ATP szintáz H+ ADP + Pi H+ ATP H+ H+ + H H+ H+
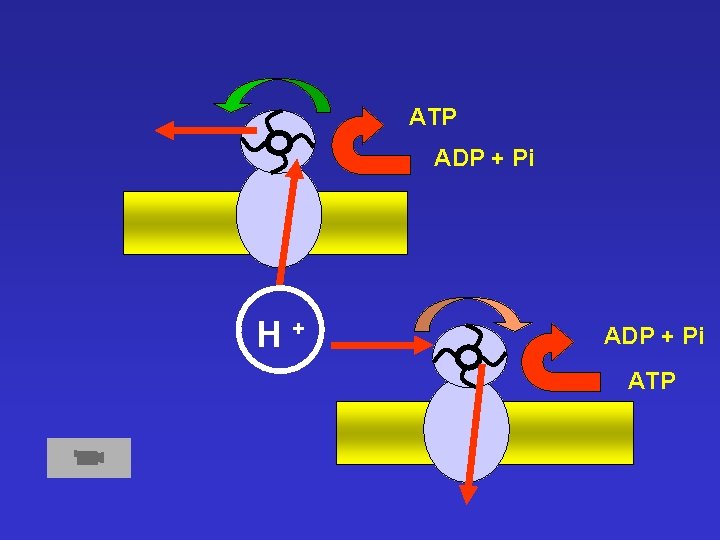
ATP ADP + Pi H+ ADP + Pi ATP
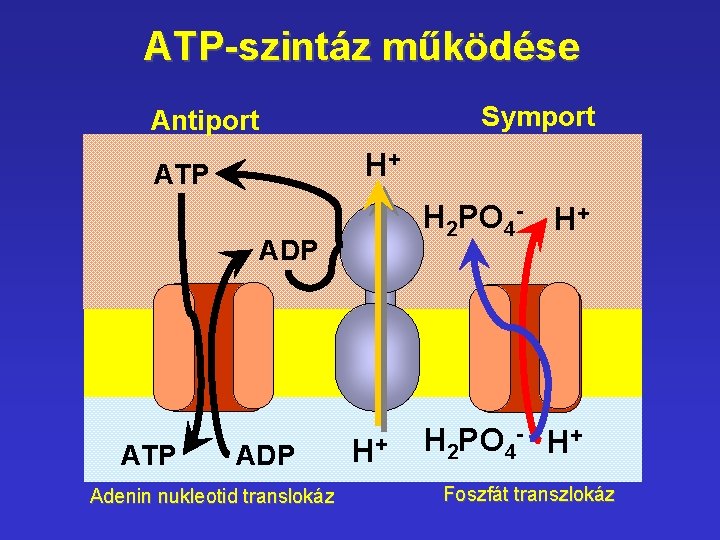
ATP-szintáz működése Symport Antiport H+ ATP H 2 PO 4 - H+ ADP ATP ADP Adenin nukleotid translokáz H+ H 2 PO 4 - H+ Foszfát transzlokáz
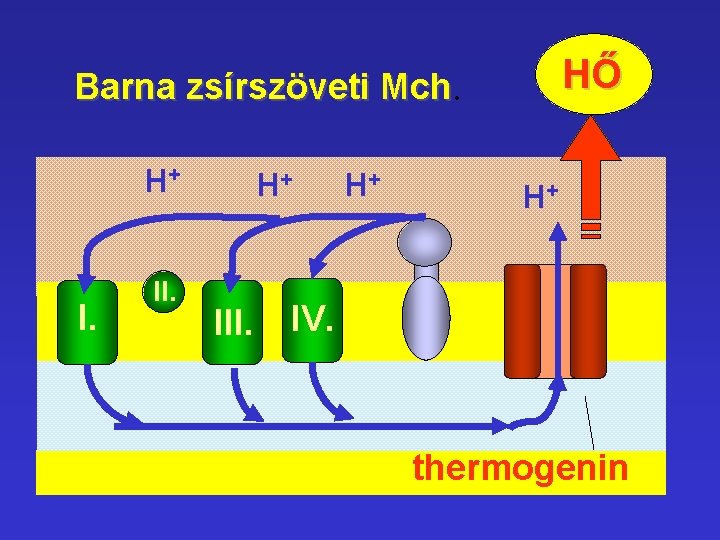
HŐ Barna zsírszöveti Mch. H+ I. II. H+ III. H+ H+ IV. thermogenin
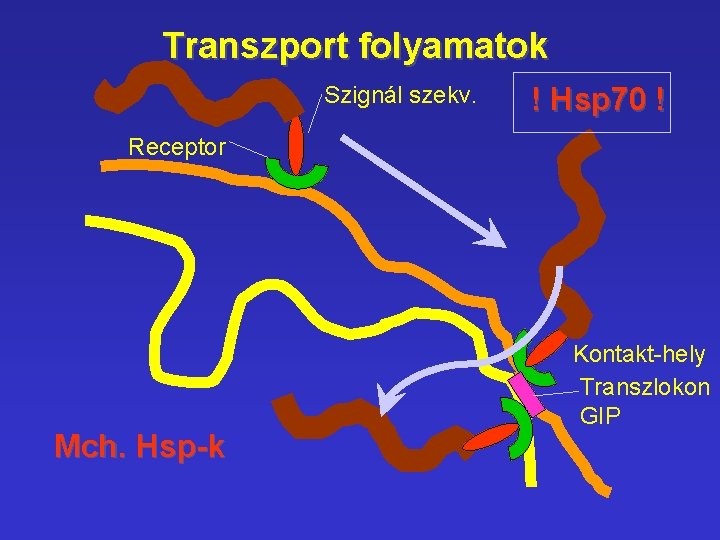
Transzport folyamatok Szignál szekv. ! Hsp 70 ! Receptor Mch. Hsp-k Kontakt-hely Transzlokon GIP

Mitochondrium eredete • De novo szintézis • Osztódás • Endoszimbiózis elmélete Ősi bíbor baktériumok – 1. 5 x 109 évvel ezelőtt § porin (Gram (-) baktériumok) § elektron szállító rendszer § ATP szintáz § mt DNS § riboszóma DE: Giardia-ban nincs Mch (anaerob)

Mch eredete - További adatok - • Külső membrán összetétele eukaryota jellegű, míg a belső membrán jellemzően prokaryota komponensekből áll • Van saját fehérjeszintézise, melynek kezdő aminosava mindig formil-Met • A fehérjeszintézis olyan antibiotikumokkal gátolhatók, melyek a bakteriális fehérjeszintézist is gátolják

Saccharomyces cerevisiae • Csupán glukózt tartalmazó táptalajon is tenyészhető, (glikolízis), működő Mch-ok nélkül is életben tartható. • Egyébként letális mutációkkal is életben tartható sejtek. • Aszexuális úton (bimbózással) és szexuálisan (meiózissal) is szaporodhatnak. Chloramphenicol rezisztens Mch. Vad típus
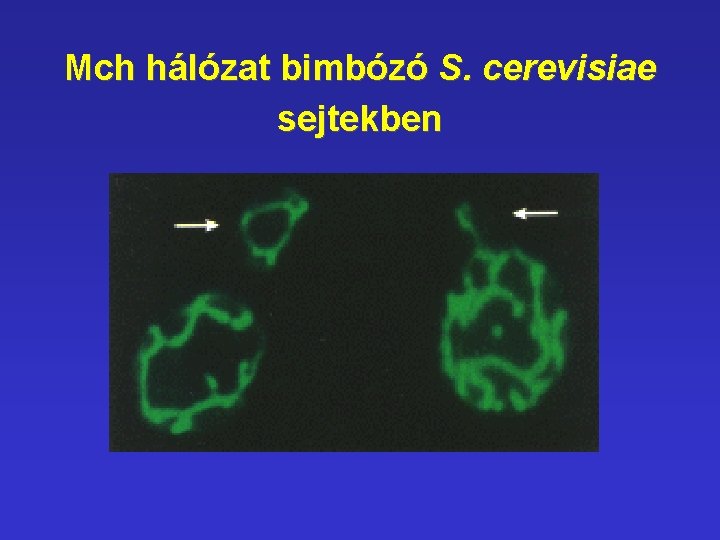
Mch hálózat bimbózó S. cerevisiae sejtekben
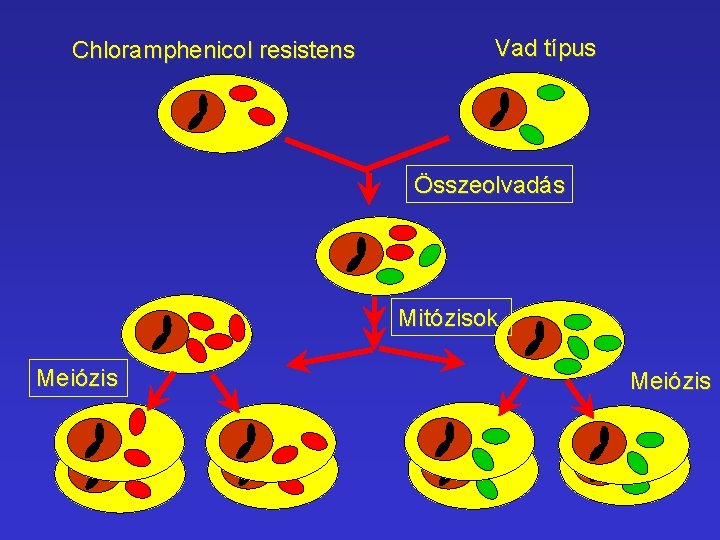
Chloramphenicol resistens Vad típus Összeolvadás Mitózisok Meiózis
OSZTÓDÁSOK JELÖLÉS izotóppal

mt-DNS • Gyűrű alakú , 5 – 10 kópia/Mch. • 20 Mch gén ismert, mely Mch fehérjéket kódol • Nincsenek intronok • Kevés szabályozó génje van • Nincsenek hisztonok • Replikáció, transzkripció, transzláció megtalálható • 22 t. RNS, 2 r. RNS

Az emberi mt-NDS r. RNS Cyt b ND 1; 2 ND 3 -6 I. III. ATP-syntase
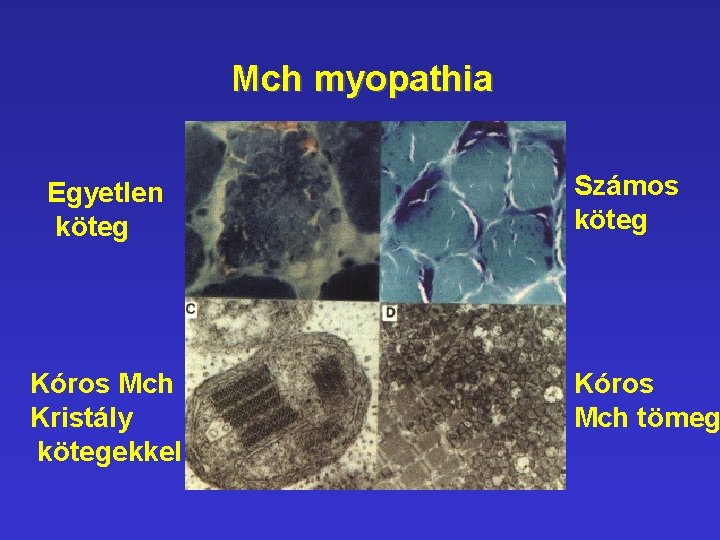
Mch myopathia Egyetlen köteg Kóros Mch Kristály kötegekkel Számos köteg Kóros Mch tömeg

Peroxiszóma • Egyszeres membrán-burok • Szelektív protein import • Nincs genomja • Oxydatív enzimei: kataláz urát oxidáz (krisztalloid)

Peroxiszóma eredete • A korai evolúció során O 2 termelő baktériumok jelentek meg. • Az O 2 mérgező hatású volt a többi sejtre / élőlényre • Ennek az O 2 -nek intracelluláris semlegesítését végezte el a peroxiszóma
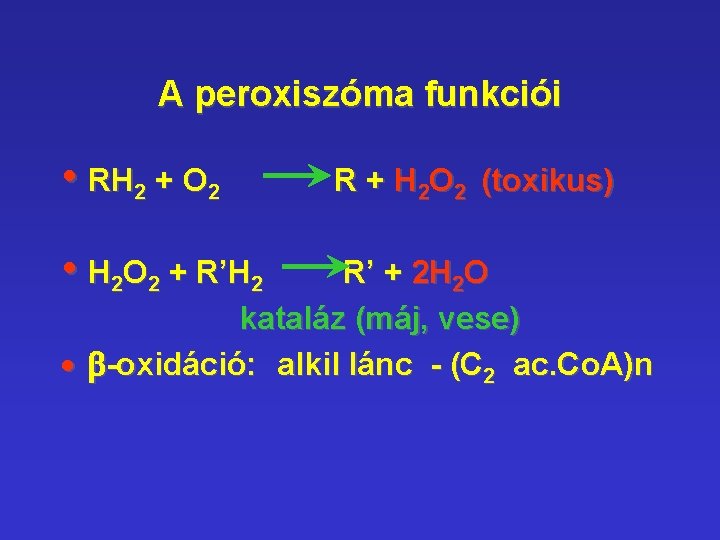
A peroxiszóma funkciói • RH 2 + O 2 • H 2 O 2 + R’H 2 R + H 2 O 2 (toxikus) R’ + 2 H 2 O kataláz (máj, vese) · b-oxidáció: alkil lánc - (C 2 ac. Co. A)n

Peroxiszóma növényekben • Növényekben levelek: fotorespiráció - O 2 felhasználás; CO 2 csírázó magvak: glyoxylate ciklus (glyoxyszóma) zsírsav ac. Co. A succinat glukóz
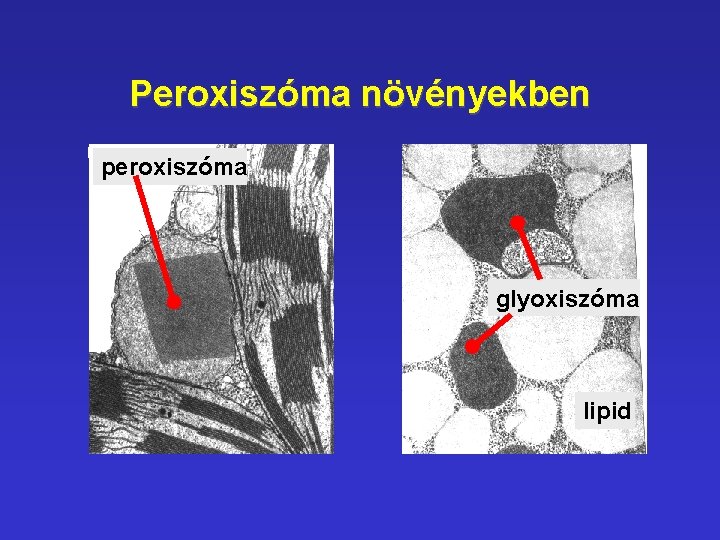
Peroxiszóma növényekben peroxiszóma glyoxiszóma lipid
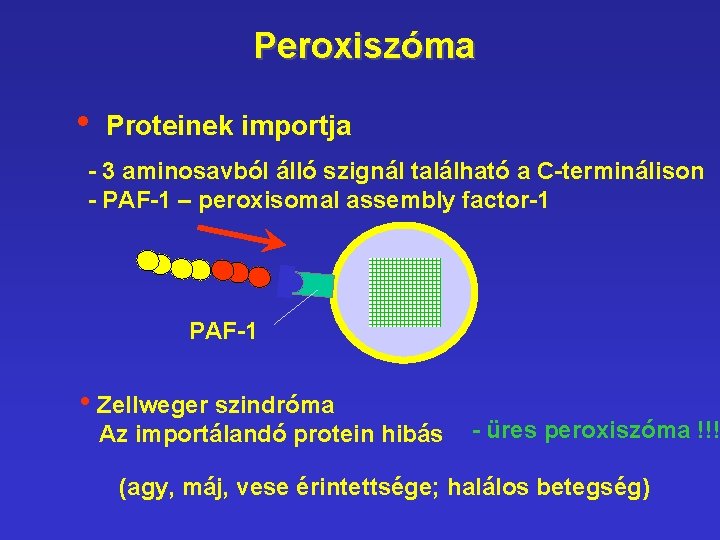
Peroxiszóma • Proteinek importja - 3 aminosavból álló szignál található a C-terminálison - PAF-1 – peroxisomal assembly factor-1 PAF-1 • Zellweger szindróma Az importálandó protein hibás - üres peroxiszóma !!! (agy, máj, vese érintettsége; halálos betegség)
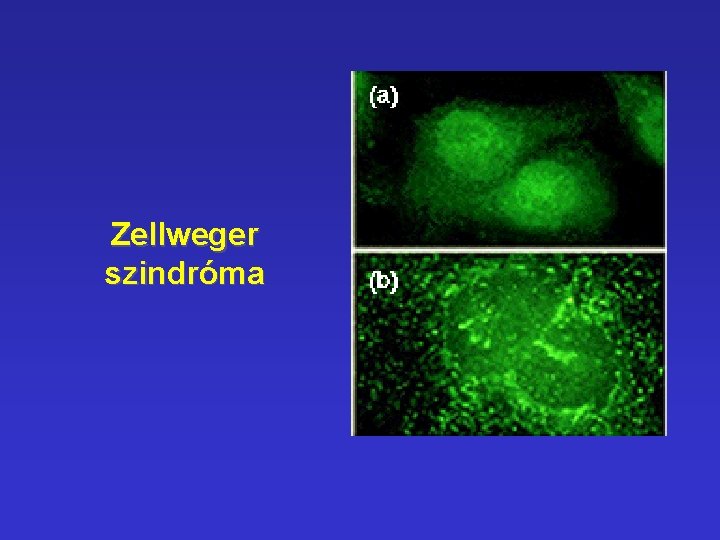
Zellweger szindróma
- Slides: 42