mija 8 klase dens cilvka dzv 6 2












- Slides: 17

Ķīmija 8. klase Ūdens cilvēka dzīvē 6. 2. Šķīdumi. Aprēķina uzdevumi. 1

Kas notiks ar cukuru, ja to iebērs ūdenī? Kas notiks ar eļļu, ja to ielies ūdenī? Cukurs nogrims trauka dibenā, izšķīdīs. Eļļa nostāsies ūdens virspusē. 2

Šķīdumi ir viendabīgi maisījumi, kas sastāv no šķīdinātāja un izšķīdušās vielas. Šķīduma sasalšanas temperatūra ir zemāka nekā šķīdinātājam. Šķīduma viršanas temperatūra ir augstāka nekā šķīdinātājam. 3 http: //www. tutorbene. com/Images/inner-page/product_image-2. jpg

Šķīšana ir fizikāli ķīmisks process. • Fizikālā daba – Šķīdināmās vielas izkliedēšanās starp šķīdinātāja daļiņām • Ķīmiskā daba – Šķīdināmās vielas un šķīdinātāja ķīmiskā iedarbība 4

Šķīdība ir vielu spēja šķīst un veidot šķīdumus • Šķīstošas vielas • Mazšķīstošas vielas • Praktiski nešķīstošas vielas • Šķīdību izsaka ar vielas masu gramos, kas spēj izšķīst 100 g šķīdinātāja 5

Šķīdumi • Piesātināti – Viela dotajos apstākļos vairs nešķīst • Nepiesātināti – Viela dotajos apstākļos vēl var izšķīst Šķīdības atkarību no temperatūras, spiediena attēlo ar šķīdības līknēm. 6

Gāzveida vielu šķīdība ir atkarīga no spiediena un temperatūras • Paaugstinoties temperatūrai, gāzu šķīdība samazinās. šķīdība • Paaugstinoties spiedienam, gāzu šķīdība palielinās. spiediens temperatūra 7

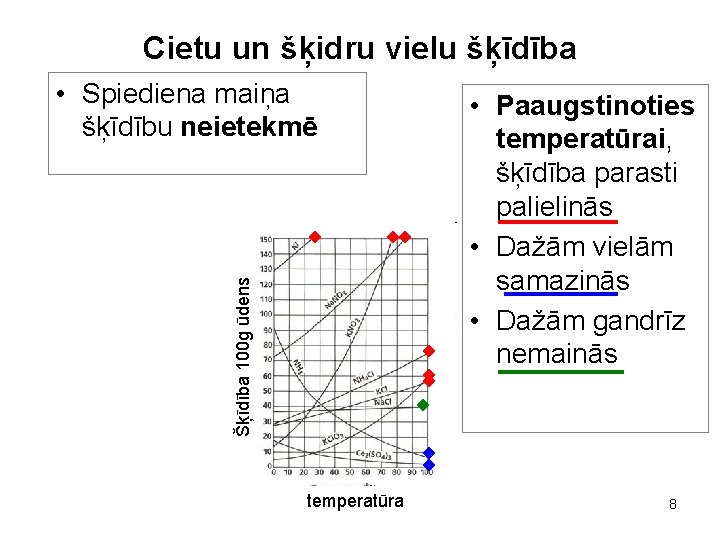
Cietu un šķidru vielu šķīdība Šķīdība 100 g ūdens • Spiediena maiņa šķīdību neietekmē temperatūra • Paaugstinoties temperatūrai, šķīdība parasti palielinās • Dažām vielām samazinās • Dažām gandrīz nemainās 8

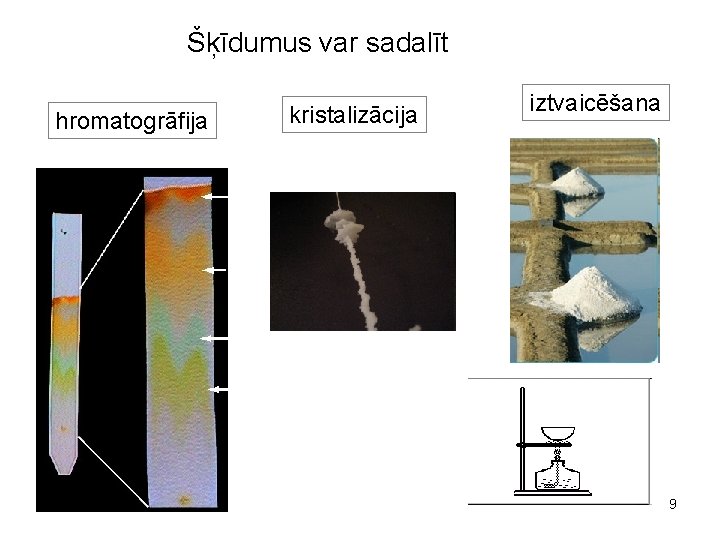
Šķīdumus var sadalīt hromatogrāfija kristalizācija iztvaicēšana 9

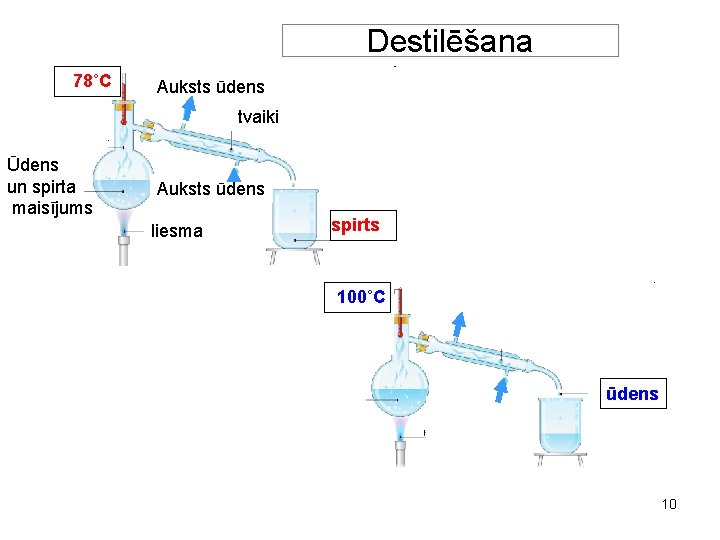
Destilēšana 78˚C Auksts ūdens tvaiki Ūdens un spirta maisījums Auksts ūdens liesma spirts 100˚C ūdens 10

Vielu šķīdības atkarība no temperatūras Vielas Šķīdība (g/100 g ūdens) 10˚C 50 ˚C KCl. O 3 6 20 Na. Cl 38 39 KCl 30 40 NH 4 Cl 32 50 KNO 3 22 80 11

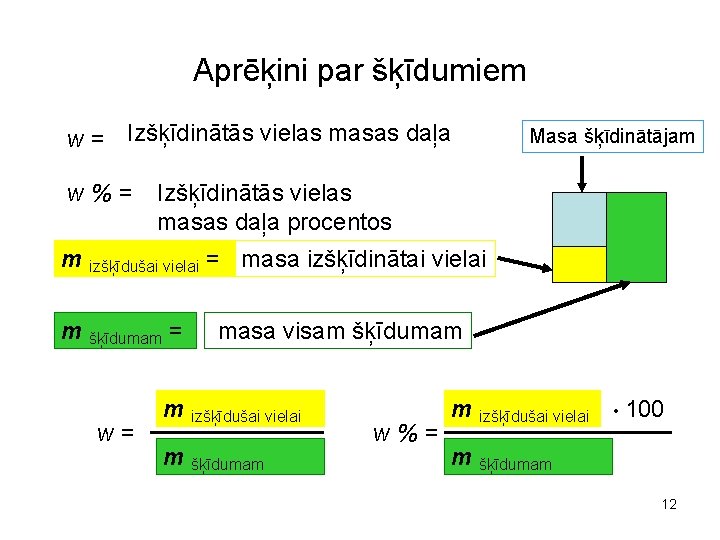
Aprēķini par šķīdumiem w = Izšķīdinātās vielas masas daļa w%= Masa šķīdinātājam Izšķīdinātās vielas masas daļa procentos m izšķīdušai vielai = masa izšķīdinātai vielai m šķīdumam = w= masa visam šķīdumam m izšķīdušai vielai m šķīdumam w%= m izšķīdušai vielai • 100 m šķīdumam 12

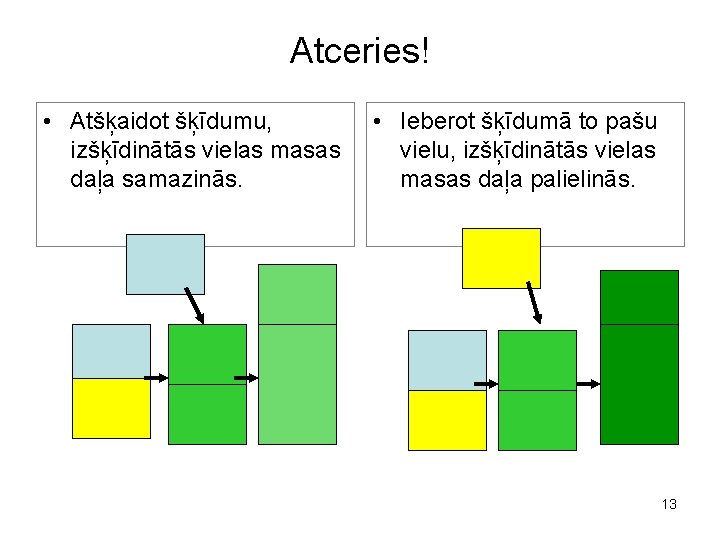
Atceries! • Atšķaidot šķīdumu, izšķīdinātās vielas masas daļa samazinās. • Ieberot šķīdumā to pašu vielu, izšķīdinātās vielas masas daļa palielinās. 13

Ja ūdenī šķīdina kādu vielu, tad iegūtā šķīduma blīvums kļūst vai nu mazāks, vai lielāks par ūdens blīvumu. m = ρ • V m = masa ρ = blīvums V = tilpums Šķīduma blīvuma noteikšanai izmanto areometru. 14

Cik gramu Na. Cl un cik gramu ūdens jāņem, lai pagatavotu 280 g nātrija hlorīda 5% šķīdumu? Dots w%= 5 mšķīd. = 280 g Jāaprēķina m(Na. Cl) =? m(H 2 O) =? w% = m izšķīdušai vielai • 100 m šķīdumam m izšķīdušai vielai = w% • m šķīdumam m(Na. Cl) = 5 • 280 100 = 14 g 100 m(H 2 O) = 280 – 14 = 266 g 15

Cik gramu Na. Cl un cik gramu ūdens vajadzīgs, lai pagatavotu 800 g 20% nātrija hlorīda šķīdumu? . m(Na. Cl) = 0, 2 • 800 = 160 g m(H 2 O) = 800 – 160 = 640 g 16

Paldies! 17
 Mija van der wege
Mija van der wege Bzes
Bzes Mija kalija
Mija kalija Innovacell
Innovacell Hematoxilina eozina
Hematoxilina eozina Tesut conjunctiv reticulat
Tesut conjunctiv reticulat Dens supplementarius
Dens supplementarius Pdg dens
Pdg dens Dens in dentis
Dens in dentis Gcmi pantone
Gcmi pantone Dens invaginatus
Dens invaginatus Atlanto dens interval
Atlanto dens interval Proc palatinus
Proc palatinus Burst fractuur
Burst fractuur Dens incisivus lateralis superior
Dens incisivus lateralis superior Kas buvo didieji lietuvos valdovai 3 klasė
Kas buvo didieji lietuvos valdovai 3 klasė įvardžiuotiniai būdvardžiai linksniavimas
įvardžiuotiniai būdvardžiai linksniavimas Tema kas tai
Tema kas tai