Metody otrzymywanie wybranych zwizkw organicznych cz IV otrzymywanie

Metody otrzymywanie wybranych związków organicznych (cz. IV) Ø Ø Ø otrzymywanie alkanów, otrzymywanie cykloalkanów, otrzymywanie alkenów, otrzymywanie alkinów, otrzymywanie związków aromatycznych, otrzymywanie halogenowęglowodorów
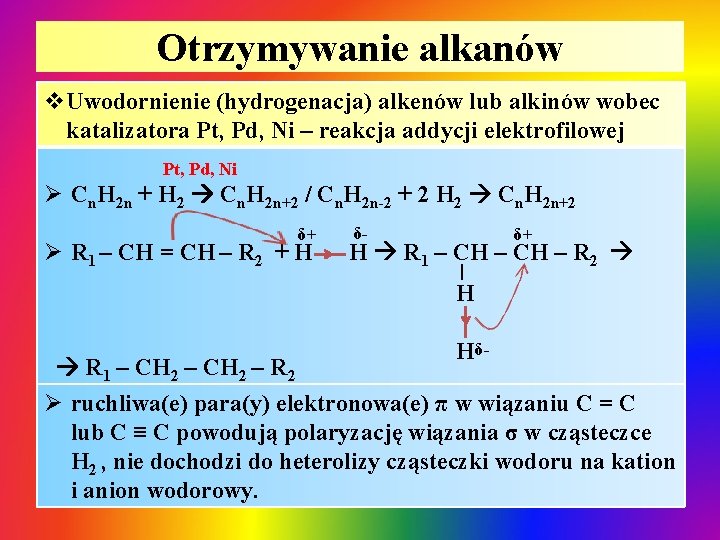
Otrzymywanie alkanów v. Uwodornienie (hydrogenacja) alkenów lub alkinów wobec katalizatora Pt, Pd, Ni – reakcja addycji elektrofilowej Pt, Pd, Ni Ø Cn. H 2 n + H 2 Cn. H 2 n+2 / Cn. H 2 n-2 + 2 H 2 Cn. H 2 n+2 δ+ Ø R 1 – CH = CH – R 2 + H δ- δ+ H R 1 – CH – R 2 | H R 1 – CH 2 – R 2 Hδ- Ø ruchliwa(e) para(y) elektronowa(e) π w wiązaniu C = C lub C ≡ C powodują polaryzację wiązania σ w cząsteczce H 2 , nie dochodzi do heterolizy cząsteczki wodoru na kation i anion wodorowy.
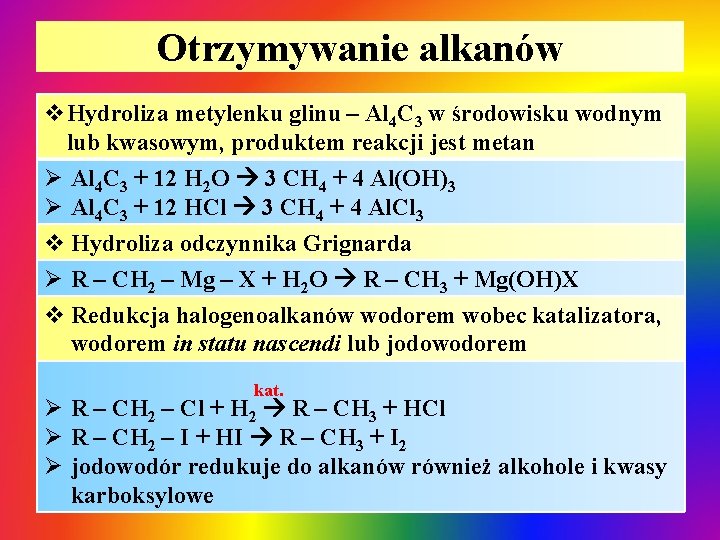
Otrzymywanie alkanów v. Hydroliza metylenku glinu – Al 4 C 3 w środowisku wodnym lub kwasowym, produktem reakcji jest metan Ø Al 4 C 3 + 12 H 2 O 3 CH 4 + 4 Al(OH)3 Ø Al 4 C 3 + 12 HCl 3 CH 4 + 4 Al. Cl 3 v Hydroliza odczynnika Grignarda Ø R – CH 2 – Mg – X + H 2 O R – CH 3 + Mg(OH)X v Redukcja halogenoalkanów wodorem wobec katalizatora, wodorem in statu nascendi lub jodowodorem kat. Ø R – CH 2 – Cl + H 2 R – CH 3 + HCl Ø R – CH 2 – I + HI R – CH 3 + I 2 Ø jodowodór redukuje do alkanów również alkohole i kwasy karboksylowe
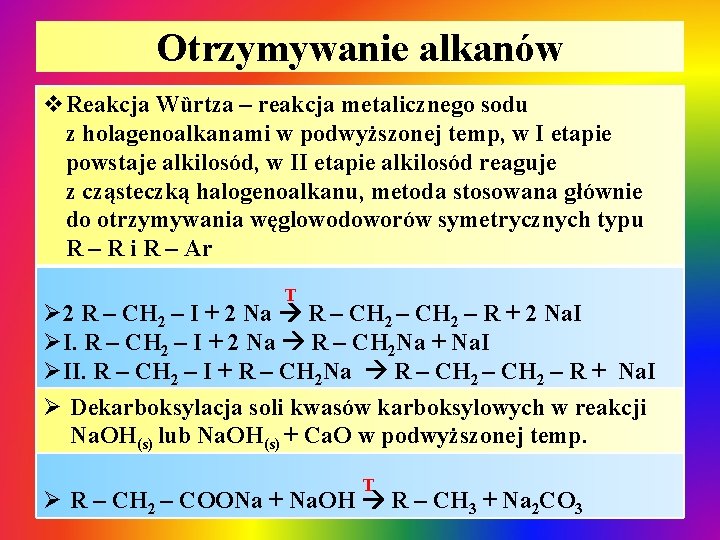
Otrzymywanie alkanów v. Reakcja Wȕrtza – reakcja metalicznego sodu z holagenoalkanami w podwyższonej temp, w I etapie powstaje alkilosód, w II etapie alkilosód reaguje z cząsteczką halogenoalkanu, metoda stosowana głównie do otrzymywania węglowodoworów symetrycznych typu R – R i R – Ar T Ø 2 R – CH 2 – I + 2 Na R – CH 2 – R + 2 Na. I ØI. R – CH 2 – I + 2 Na R – CH 2 Na + Na. I ØII. R – CH 2 – I + R – CH 2 Na R – CH 2 – R + Na. I Ø Dekarboksylacja soli kwasów karboksylowych w reakcji Na. OH(s) lub Na. OH(s) + Ca. O w podwyższonej temp. T Ø R – CH 2 – COONa + Na. OH R – CH 3 + Na 2 CO 3

Otrzymywanie alkanów v. Elektroliza soli kwasów karboksylowych: Ø aniony soli w procesie anodowym oddają elektrony, powstają rodniki, które łatwo ulegają dekarboksylacji i powstają rodniki alkilowe, Ø rodniki alkilowe ulegają dimeryzacji i powstają alkany Ø R – CH 2 – COO- R – CH 2 – CO – O* + 1 eØ R – CH 2 – CO* R – CH 2* + CO 2 Ø R – CH 2* + * H 2 C – R R – CH 2 – R v Reakcja tlenku węgla(II) z wodorem wobec katalizatorów Co lub Ni i w podwyższonej temperaturze Co, Ni/ T Ø n CO + (2 n +1) H 2 Cn. H 2 n+2 + n H 2 O
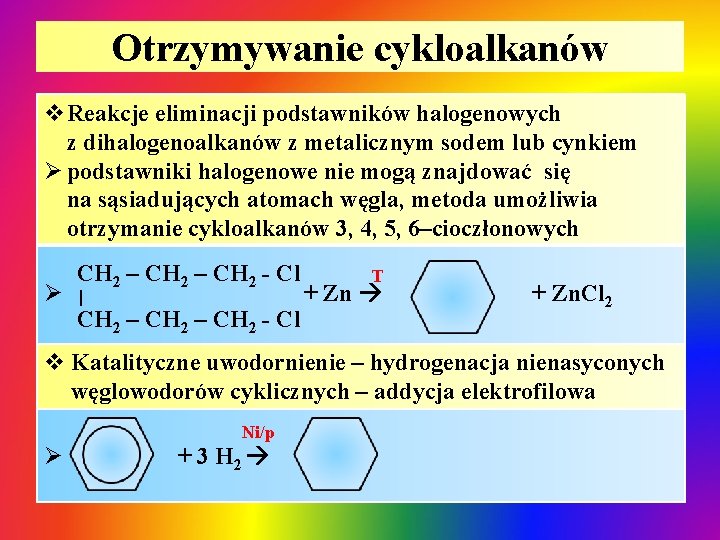
Otrzymywanie cykloalkanów v. Reakcje eliminacji podstawników halogenowych z dihalogenoalkanów z metalicznym sodem lub cynkiem Ø podstawniki halogenowe nie mogą znajdować się na sąsiadujących atomach węgla, metoda umożliwia otrzymanie cykloalkanów 3, 4, 5, 6–cioczłonowych Ø CH 2 – CH 2 - Cl | CH 2 – CH 2 - Cl T + Zn. Cl 2 v Katalityczne uwodornienie – hydrogenacja nienasyconych węglowodorów cyklicznych – addycja elektrofilowa Ø Ni/p + 3 H 2
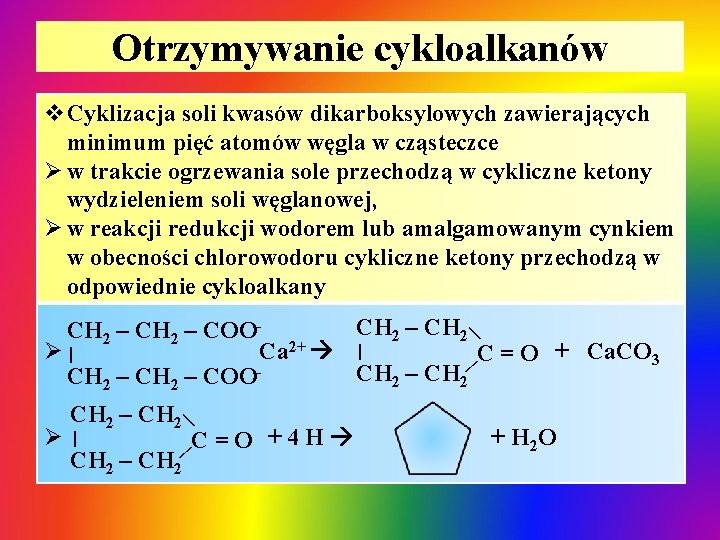
Otrzymywanie cykloalkanów v. Cyklizacja soli kwasów dikarboksylowych zawierających minimum pięć atomów węgla w cząsteczce Ø w trakcie ogrzewania sole przechodzą w cykliczne ketony wydzieleniem soli węglanowej, Ø w reakcji redukcji wodorem lub amalgamowanym cynkiem w obecności chlorowodoru cykliczne ketony przechodzą w odpowiednie cykloalkany | CH 2 – COOØ| Ca 2+ | C = O + Ca. CO 3 CH 2 – COO| | CH 2 – CH 2 | Ø| C=O +4 H CH 2 – CH 2 + H 2 O
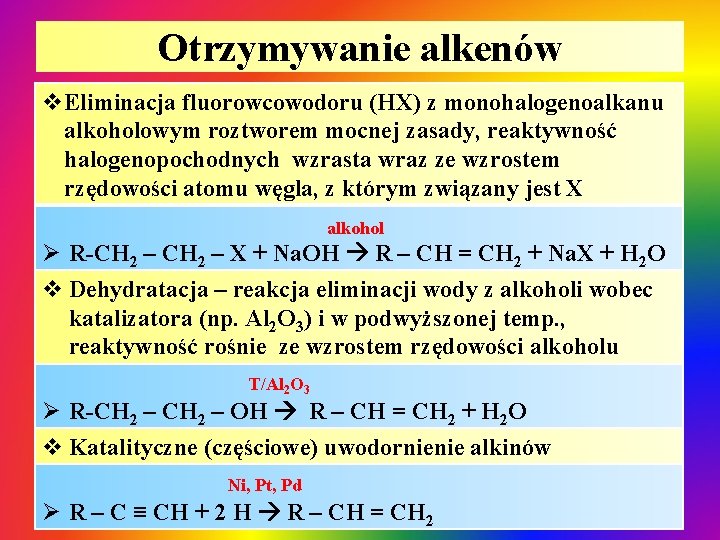
Otrzymywanie alkenów v. Eliminacja fluorowcowodoru (HX) z monohalogenoalkanu alkoholowym roztworem mocnej zasady, reaktywność halogenopochodnych wzrasta wraz ze wzrostem rzędowości atomu węgla, z którym związany jest X alkohol Ø R-CH 2 – X + Na. OH R – CH = CH 2 + Na. X + H 2 O v Dehydratacja – reakcja eliminacji wody z alkoholi wobec katalizatora (np. Al 2 O 3) i w podwyższonej temp. , reaktywność rośnie ze wzrostem rzędowości alkoholu T/Al 2 O 3 Ø R-CH 2 – OH R – CH = CH 2 + H 2 O v Katalityczne (częściowe) uwodornienie alkinów Ni, Pt, Pd Ø R – C ≡ CH + 2 H R – CH = CH 2

Otrzymywanie alkenów v. Reakcja eliminacji X 2 z dihalogenoalkanów, w cząsteczkach których podstawniki X znajdują się na sąsiadujących atomach węgla (wicynalne difluorowcopochodne) T Ø R – CH 2 – X + Zn R – CH = CH 2 + Zn. X 2 | X v Eliminacja wody z alkoholi (dehydratacja) mocnym kwasem (H 2 SO 4) w podwyższonej temp. , w I etapie powstaje ester kwasu siarkowego, który w podwyższonej temp. ulega rozkładowi do alkenu i kwasu Ø R - CH 2 - OH + HO - SO 3 H R - CH 2 - O - SO 3 H + H 2 O T Ø R - CH 2 - O - SO 3 H R – CH = CH 2 + H 2 SO 4
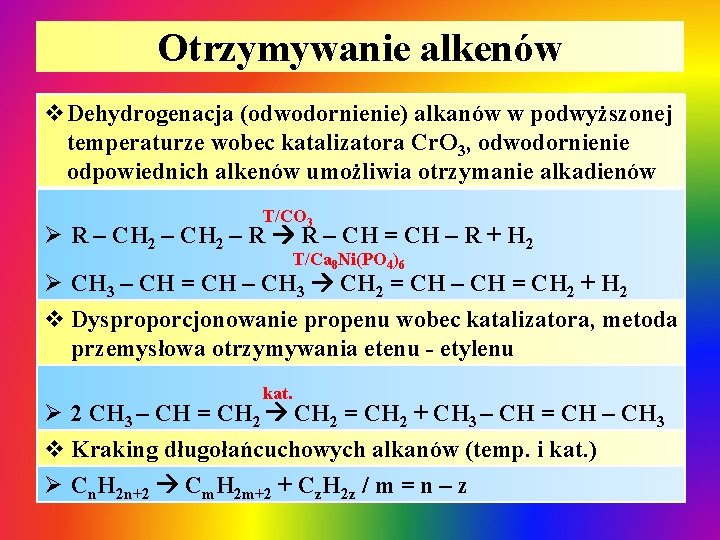
Otrzymywanie alkenów v. Dehydrogenacja (odwodornienie) alkanów w podwyższonej temperaturze wobec katalizatora Cr. O 3, odwodornienie odpowiednich alkenów umożliwia otrzymanie alkadienów T/CO 3 Ø R – CH 2 – R R – CH = CH – R + H 2 T/Ca 8 Ni(PO 4)6 Ø CH 3 – CH = CH – CH 3 CH 2 = CH – CH = CH 2 + H 2 v Dysproporcjonowanie propenu wobec katalizatora, metoda przemysłowa otrzymywania etenu - etylenu kat. Ø 2 CH 3 – CH = CH 2 + CH 3 – CH = CH – CH 3 v Kraking długołańcuchowych alkanów (temp. i kat. ) Ø Cn. H 2 n+2 Cm. H 2 m+2 + Cz. H 2 z / m = n – z
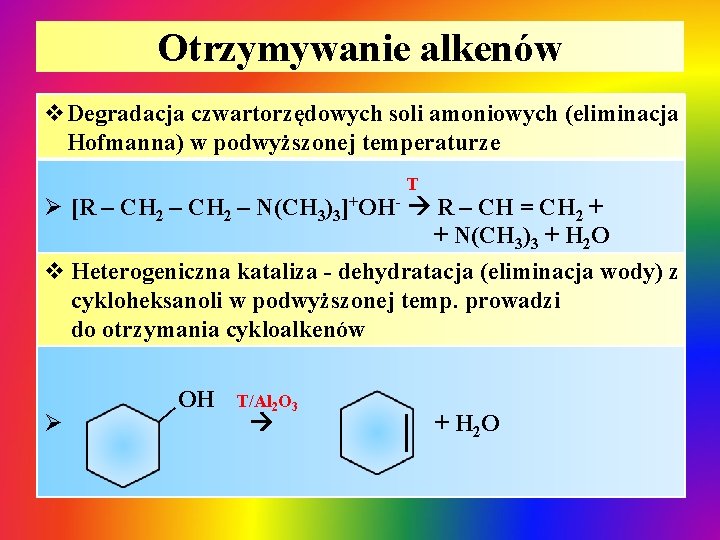
Otrzymywanie alkenów v. Degradacja czwartorzędowych soli amoniowych (eliminacja Hofmanna) w podwyższonej temperaturze T Ø [R – CH 2 – N(CH 3)3]+OH- R – CH = CH 2 + + N(CH 3)3 + H 2 O v Heterogeniczna kataliza - dehydratacja (eliminacja wody) z cykloheksanoli w podwyższonej temp. prowadzi do otrzymania cykloalkenów | Ø OH T/Al 2 O 3 + H 2 O
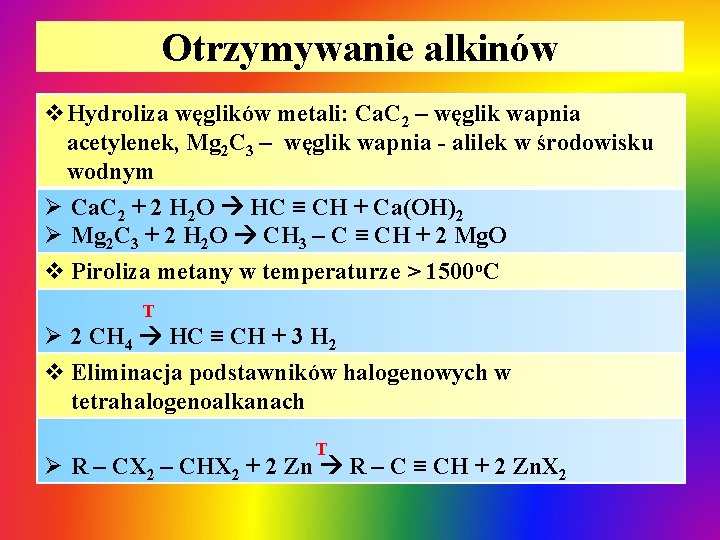
Otrzymywanie alkinów v. Hydroliza węglików metali: Ca. C 2 – węglik wapnia acetylenek, Mg 2 C 3 – węglik wapnia - alilek w środowisku wodnym Ø Ca. C 2 + 2 H 2 O HC ≡ CH + Ca(OH)2 Ø Mg 2 C 3 + 2 H 2 O CH 3 – C ≡ CH + 2 Mg. O v Piroliza metany w temperaturze > 1500 o. C T Ø 2 CH 4 HC ≡ CH + 3 H 2 v Eliminacja podstawników halogenowych w tetrahalogenoalkanach T Ø R – CX 2 – CHX 2 + 2 Zn R – C ≡ CH + 2 Zn. X 2
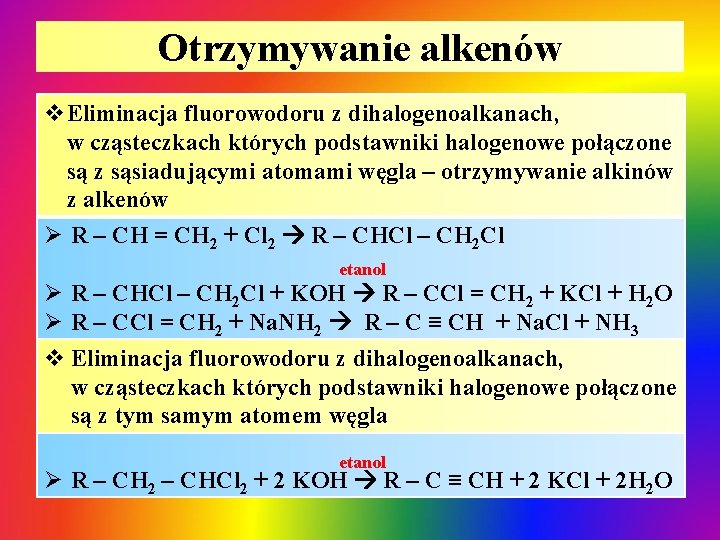
Otrzymywanie alkenów v. Eliminacja fluorowodoru z dihalogenoalkanach, w cząsteczkach których podstawniki halogenowe połączone są z sąsiadującymi atomami węgla – otrzymywanie alkinów z alkenów Ø R – CH = CH 2 + Cl 2 R – CHCl – CH 2 Cl etanol Ø R – CHCl – CH 2 Cl + KOH R – CCl = CH 2 + KCl + H 2 O Ø R – CCl = CH 2 + Na. NH 2 R – C ≡ CH + Na. Cl + NH 3 v Eliminacja fluorowodoru z dihalogenoalkanach, w cząsteczkach których podstawniki halogenowe połączone są z tym samym atomem węgla etanol Ø R – CH 2 – CHCl 2 + 2 KOH R – C ≡ CH + 2 KCl + 2 H 2 O
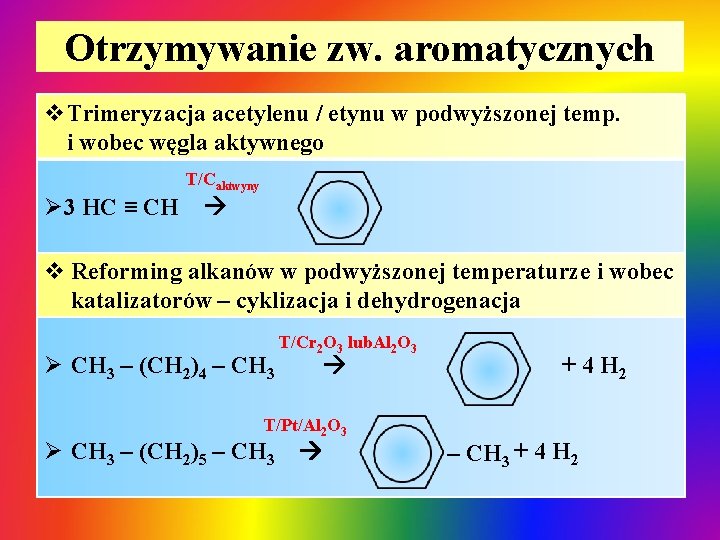
Otrzymywanie zw. aromatycznych v. Trimeryzacja acetylenu / etynu w podwyższonej temp. i wobec węgla aktywnego T/Caktwyny Ø 3 HC ≡ CH v Reforming alkanów w podwyższonej temperaturze i wobec katalizatorów – cyklizacja i dehydrogenacja Ø CH 3 – (CH 2)4 – CH 3 T/Cr 2 O 3 lub. Al 2 O 3 T/Pt/Al 2 O 3 Ø CH 3 – (CH 2)5 – CH 3 + 4 H 2 – CH 3 + 4 H 2
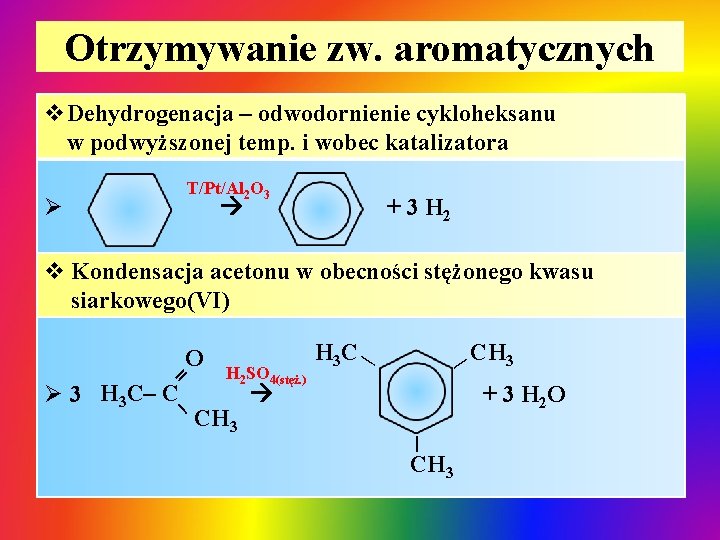
Otrzymywanie zw. aromatycznych v. Dehydrogenacja – odwodornienie cykloheksanu w podwyższonej temp. i wobec katalizatora T/Pt/Al 2 O 3 Ø + 3 H 2 v Kondensacja acetonu w obecności stężonego kwasu siarkowego(VI) = _ Ø 3 H 3 C– C CH 3 | H 2 SO 4(stęż. ) CH 3 H 3 C | O + 3 H 2 O | CH 3
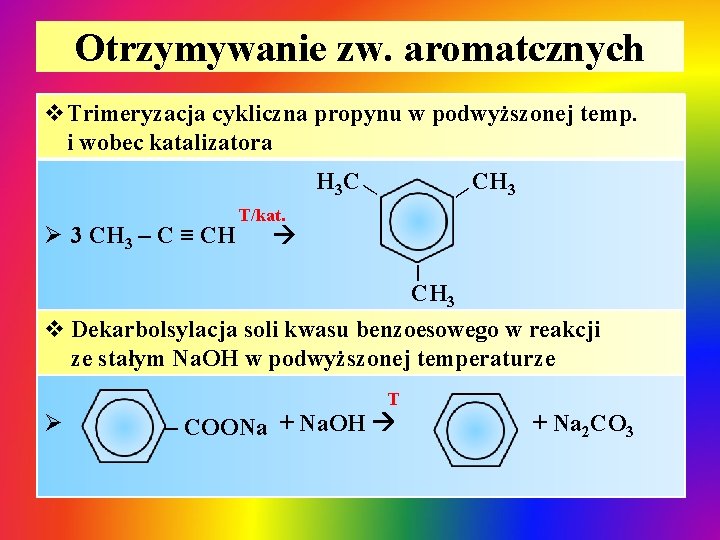
Otrzymywanie zw. aromatcznych v. Trimeryzacja cykliczna propynu w podwyższonej temp. i wobec katalizatora CH 3 Ø 3 CH 3 – C ≡ CH | | H 3 C T/kat. | CH 3 v Dekarbolsylacja soli kwasu benzoesowego w reakcji ze stałym Na. OH w podwyższonej temperaturze Ø T – COONa + Na. OH + Na 2 CO 3
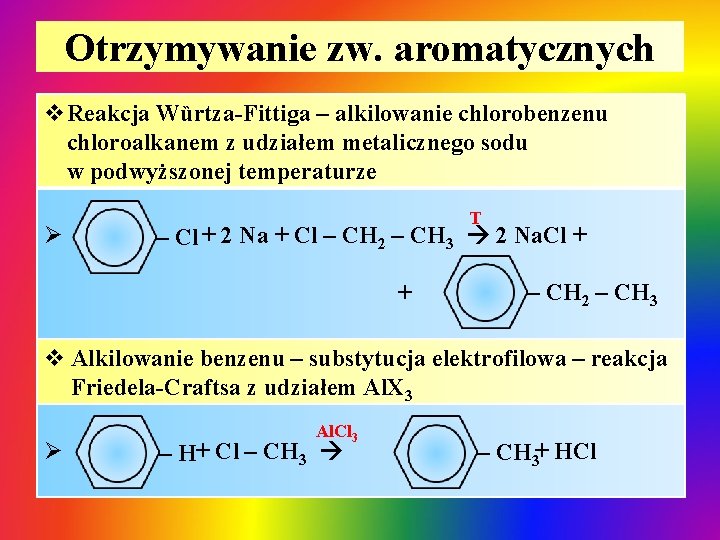
Otrzymywanie zw. aromatycznych v. Reakcja Wȕrtza-Fittiga – alkilowanie chlorobenzenu chloroalkanem z udziałem metalicznego sodu w podwyższonej temperaturze Ø T – Cl + 2 Na + Cl – CH 2 – CH 3 2 Na. Cl + + – CH 2 – CH 3 v Alkilowanie benzenu – substytucja elektrofilowa – reakcja Friedela-Craftsa z udziałem Al. X 3 Ø Al. Cl 3 – H+ Cl – CH 3+ HCl
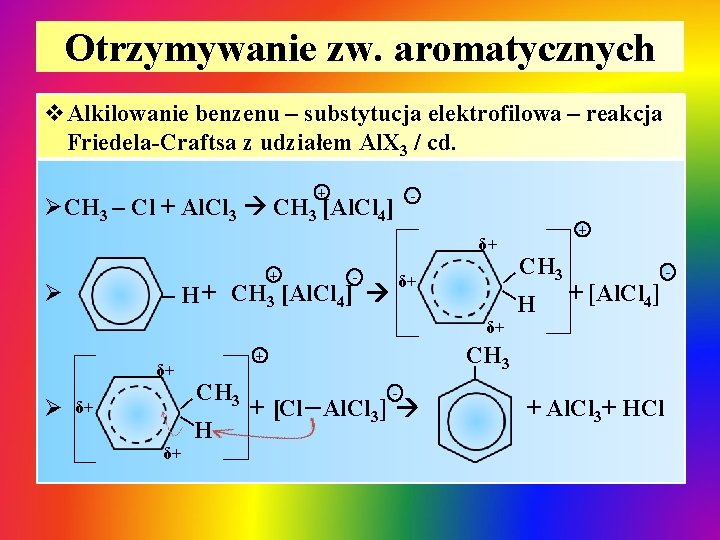
Otrzymywanie zw. aromatycznych v. Alkilowanie benzenu – substytucja elektrofilowa – reakcja Friedela-Craftsa z udziałem Al. X 3 / cd. + ØCH 3 – Cl + Al. Cl 3 CH 3 [Al. Cl 4] + δ+ Ø - – H + CH 3 [Al. Cl 4] δ+ δ+ δ+ || Ø CH 3 δ+ H + [Al. Cl 4] _ [Cl Al. Cl ] 3 – CH 3 + δ+ CH 3 || + + Al. Cl 3+ HCl -

Otrzymywanie halogenowęglowodorów v. Halogenowanie alkanów – substytucja rodnikowa, uv Ø Cl – Cl *Cl + *Cl / CH 4 + *Cl *CH 3 + HCl Ø *CH 3 + Cl 2 CH 3 – Cl + *Cl Ø reaktywność fluorowców maleje w szeregu: F > Cl > Br > I, Ø fluorowanie zachodzi w temp. pokojowej natomiast chlorowanie w obecności światła, bromowanie w podwyższonej temp. lub naświetleniu mieszaniny, Ø jodowanie zachodzi najtrudniej, ponieważ powstający HI wykazuje silne właściwości redukujące, Ø reakcja substytucji może zachodzić z udziałem katalizatora, np. Al. X 3 wg mechanizmu substytucji elektrofilowej: Al. Cl 3 + + Cl 2 Al. Cl 4 + Cl Ø CH 4 + +Cl +CH 3 + HCl / +CH 3 + Cl 2 CH 3 Cl +
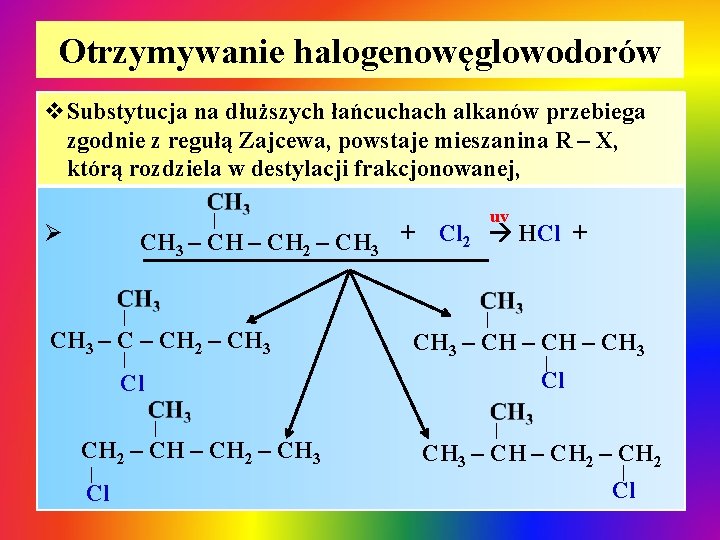
Otrzymywanie halogenowęglowodorów v. Substytucja na dłuższych łańcuchach alkanów przebiega zgodnie z regułą Zajcewa, powstaje mieszanina R – X, którą rozdziela w destylacji frakcjonowanej, | Ø CH 3 – CH 2 – CH 3 + | CH 3 – CH 2 – CH 3 | uv Cl 2 HCl + | CH 3 – CH 3 | Cl Cl | CH 2 – CH 3 | Cl | CH 3 – CH 2 | Cl
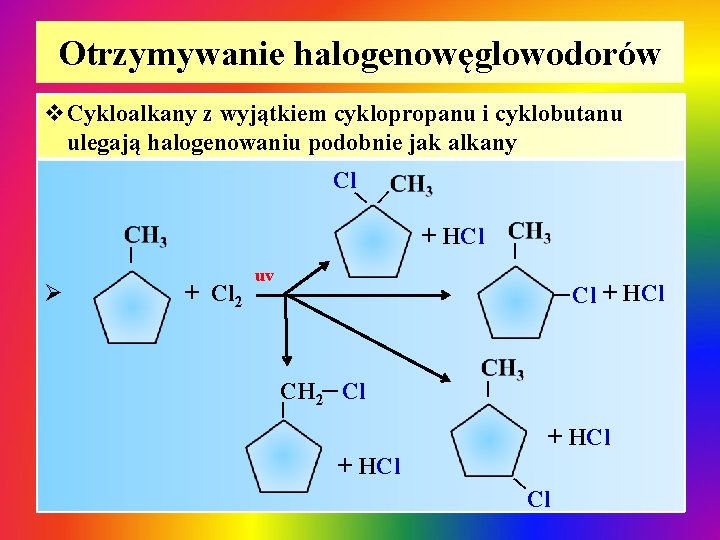
Otrzymywanie halogenowęglowodorów v. Cykloalkany z wyjątkiem cyklopropanu i cyklobutanu ulegają halogenowaniu podobnie jak alkany | Cl | + HCl | | CH 2 Cl | Cl + HCl | + Cl 2 uv | Ø | Cl
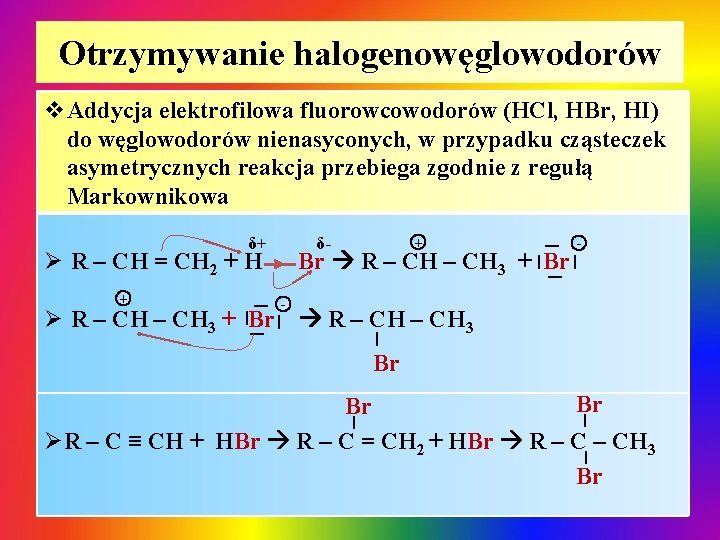
Otrzymywanie halogenowęglowodorów v. Addycja elektrofilowa fluorowcowodorów (HCl, HBr, HI) do węglowodorów nienasyconych, w przypadku cząsteczek asymetrycznych reakcja przebiega zgodnie z regułą Markownikowa Ø R – CH = CH 2 + H - | Br R – CH 3 + | Br| - |Br| | Ø R – CH 3 + | + + δ- | δ+ R – CH 3 | Br Br Br | | ØR – C ≡ CH + HBr R – C = CH 2 + HBr R – CH 3 | Br
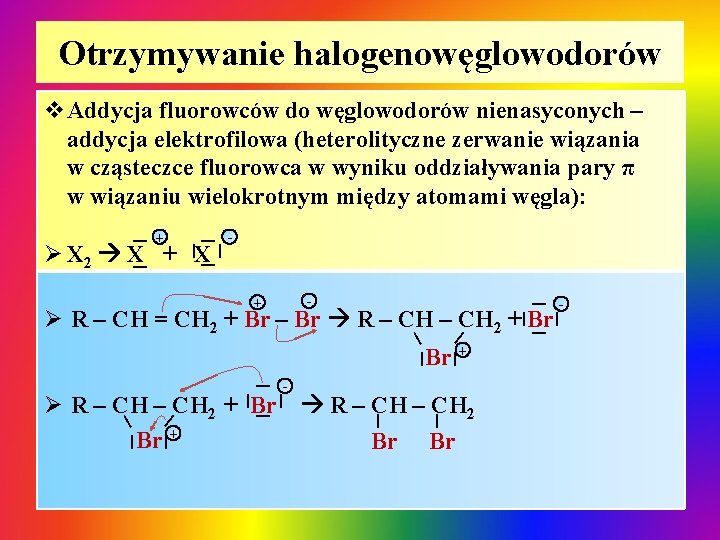
Otrzymywanie halogenowęglowodorów v. Addycja fluorowców do węglowodorów nienasyconych – addycja elektrofilowa (heterolityczne zerwanie wiązania w cząsteczce fluorowca w wyniku oddziaływania pary π w wiązaniu wielokrotnym między atomami węgla): | - + | | | Ø X 2 X + X | | + Ø R – CH = CH 2 + Br – Br R – CH 2 + Br | | | Ø R – CH 2 + Br R – CH 2 Br + Br Br | | | | - | Br + - | |
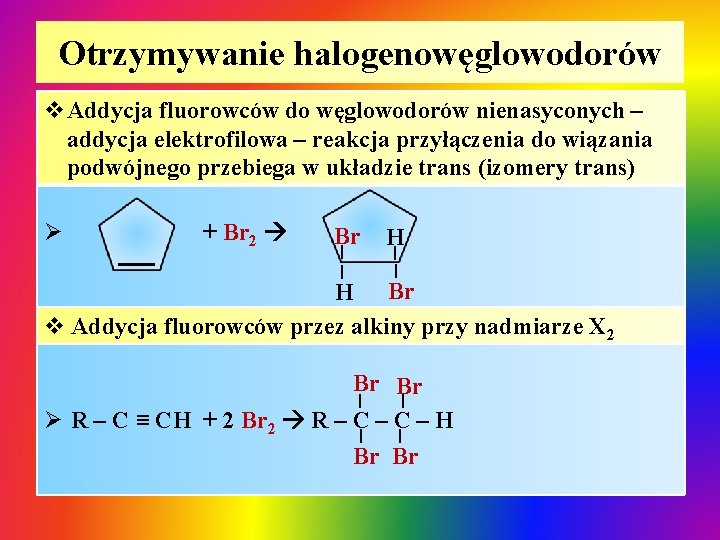
Otrzymywanie halogenowęglowodorów v. Addycja fluorowców do węglowodorów nienasyconych – addycja elektrofilowa – reakcja przyłączenia do wiązania podwójnego przebiega w układzie trans (izomery trans) Br | | + Br 2 H | | Ø H Br v Addycja fluorowców przez alkiny przy nadmiarze X 2 Br Br Ø R – C ≡ CH + 2 Br 2 R – C – H | | Br Br
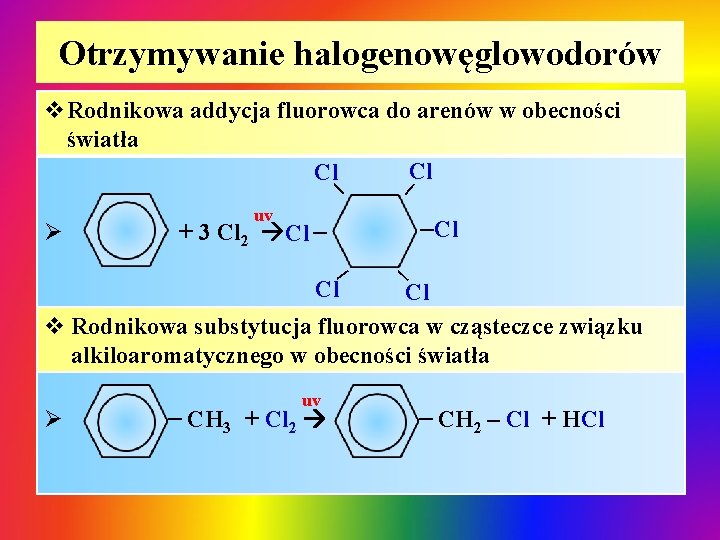
Otrzymywanie halogenowęglowodorów | v. Rodnikowa addycja fluorowca do arenów w obecności światła Cl Cl | + 3 Cl 2 Cl | Ø uv | | Cl Cl v Rodnikowa substytucja fluorowca w cząsteczce związku alkiloaromatycznego w obecności światła CH 3 + Cl 2 | | Ø uv CH 2 – Cl + HCl
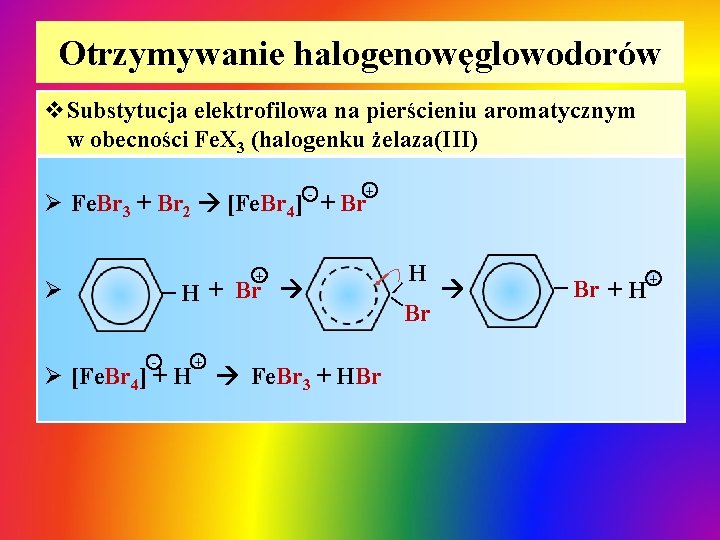
Otrzymywanie halogenowęglowodorów v. Substytucja elektrofilowa na pierścieniu aromatycznym w obecności Fe. X 3 (halogenku żelaza(III) - + Ø Fe. Br 3 + Br 2 [Fe. Br 4] + Br - H + Br + Ø [Fe. Br 4] + H Fe. Br 3 + HBr H | | Ø | Br | + Br + H +
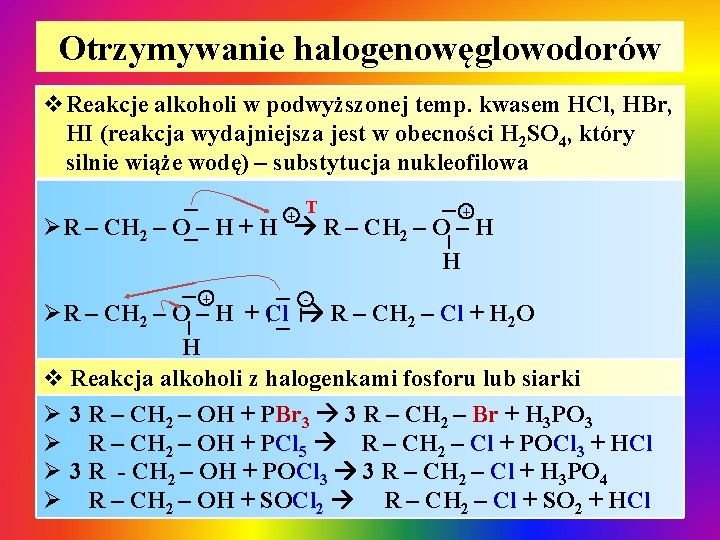
Otrzymywanie halogenowęglowodorów | + T | v. Reakcje alkoholi w podwyższonej temp. kwasem HCl, HBr, HI (reakcja wydajniejsza jest w obecności H 2 SO 4, który silnie wiąże wodę) – substytucja nukleofilowa + ØR – CH 2 – O – H + H R – CH 2 – O – H H | | + - ØR – CH 2 – O – H + Cl R – CH 2 – Cl + H 2 O H v Reakcja alkoholi z halogenkami fosforu lub siarki Ø 3 R – CH 2 – OH + PBr 3 3 R – CH 2 – Br + H 3 PO 3 Ø R – CH 2 – OH + PCl 5 R – CH 2 – Cl + POCl 3 + HCl Ø 3 R - CH 2 – OH + POCl 3 3 R – CH 2 – Cl + H 3 PO 4 Ø R – CH 2 – OH + SOCl 2 R – CH 2 – Cl + SO 2 + HCl | |
- Slides: 27