MENU UTAMA STANDAR KOMPETENSI DAN KOMPETENSI DASAR INDIKATOR



















- Slides: 23


MENU UTAMA STANDAR KOMPETENSI DAN KOMPETENSI DASAR INDIKATOR MATERI UJI KOMPETENSI

v Standar kompetensi: 2. Menerapkan konsep reaksi redoks dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam industri Y Kompetensi dasar : 2. 1 Menerapkan konsep reaksi redoks dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam industri. Menu utama

INDIKATOR : ØMenjelaskan bagaimana energi listrik dihasilkan dari reaksi redoks dalam sel volta. ØMenjelaskan prinsip sel–sel volta yang banyak digunakan dalam kehidupan. Menu utama

MATERI SEL ELEKTROKIMIA SEL VOLTA SEL ELEKTROLISIS Terus

SEL VOLTA Sel Volta adalah : rangkaian sel yang dapat menghasilkan arus listrik. Dalam sel tersebut terjadi perubahan dari reaksi redoks menghasilkan arus listrik Terus

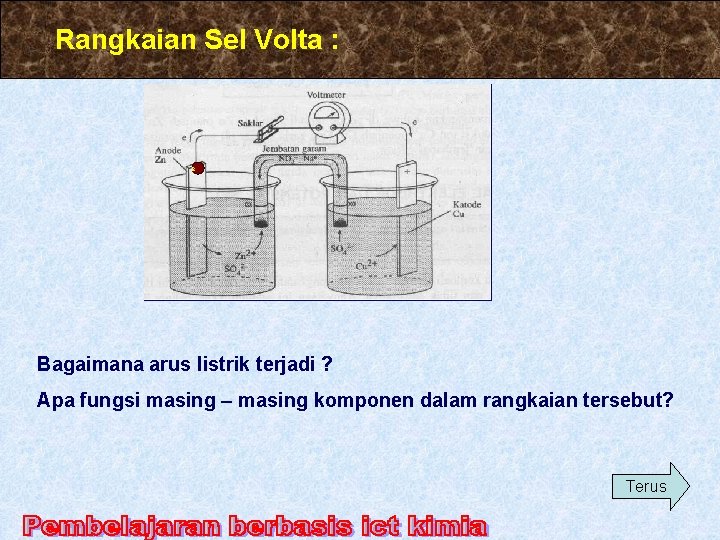
Rangkaian Sel Volta : e Bagaimana arus listrik terjadi ? Apa fungsi masing – masing komponen dalam rangkaian tersebut? Terus

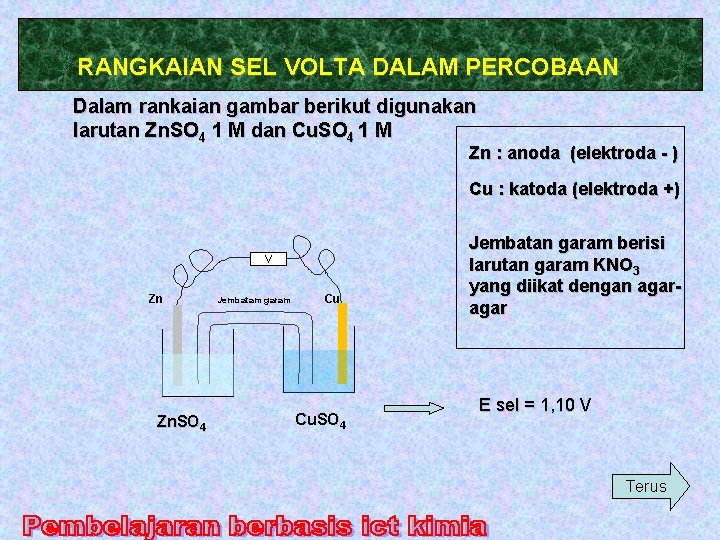
RANGKAIAN SEL VOLTA DALAM PERCOBAAN Dalam rankaian gambar berikut digunakan larutan Zn. SO 4 1 M dan Cu. SO 4 1 M Zn : anoda (elektroda - ) Cu : katoda (elektroda +) V Zn Zn. SO 4 Jembatam garam Cu Cu. SO 4 Jembatan garam berisi larutan garam KNO 3 yang diikat dengan agar E sel = 1, 10 V Terus

Persamaan reaksi redoks pada sel : Oksidasi : Zn (s) Zn 2+ (aq) + 2 e Reduksi : Cu 2+ (aq) + 2 e Cu (s) E = +0, 76 V E = + 0, 34 V Reaksi Sel : Zn (s) + Cu 2+ (aq) Zn 2+ (aq) + Cu (s) Notasi sel : Zn / Zn 2+ // Cu 2+ / Cu (Anode , Oksidasi) ( katode , reduksi ) Terus

Sel Volta dalam kehidupan sehari – hari : 1. Sel Kering (Sel Leclanche) 2. Sel Aki 3. Sel Perak Oksida 4. Sel Nikel Cadmium (Nikad) 5. Sel Bahan Bakar Terus

1. Sel Kering (Sel Leclanche) ØDikenal sebagai batu baterai ØTerdiri dari katode yang berasal dari karbon(grafit) dan anode logam zink ØElektrolit yang dipakai berupa pasta campuran Mn. O 2, serbuk karbon dan NH 4 Cl Persamaan reaksinya : Katode : 2 Mn. O 2 + 2 H+ + 2 e Mn 2 O 3 + H 2 O Anode : Zn 2+ + 2 e Reaksi sel : 2 Mn. O 2 + 2 H+ + Zn Mn 2 O 3 + H 2 O + Zn 2+ Terus

2. Sel Aki Sel aki disebut juga sebagai sel penyimpan, karena dapat berfungsi penyimpan listrik dan pada setiap saat dapat dikeluarkan. Anodenya terbuat dari logam timbal (Pb) dan katodenya terbuat dari logam timbal yang dilapisi Pb. O 2. Reaksi penggunaan aki : Anode : Pb + SO 4 2 - Pb. SO 4 + 2 e Katode : Pb. O 2 + SO 42 -+ 4 H++ 2 e Pb. SO 4 + 2 H 2 O Reaksi sel : Pb + 2 SO 4 2 - + Pb. O 2 + 4 H+ 2 Pb. SO 4 + 2 H 2 O Reaksi Pengisian aki : 2 Pb. SO 4 + 2 H 2 O Pb + 2 SO 4 2 - + Pb. O 2 + 4 H+ ACCU Terus

3. Sel Perak Oksida Sel ini banyak digunakan untuk alroji, kalkulator dan alat elektronik. Reaksi yang terjadi : Anoda : Zn(s) + 2 OH-(l) Zn(OH)2(s) + 2 e Katoda : Ag 2 O(s) + H 2 O(l) + 2 e 2 Ag(s) + 2 OH-(aq) Reaksi Sel : Zn(s) + Ag 2 O(s) + H 2 O(l) Zn(OH)2(s) + 2 Ag(s) Potensial sel yang dihasilkan adalah 1, 34 V Terus

4. Sel Nikel Cadmium (Nikad) Sel Nicad merupakan sel kering yang dapat diisi kembali (rechargable). Anodenya terbuat dari Cd dan katodenya berupa Ni 2 O 3 (pasta). Beda potensial yang dihasilkan sebesar 1, 29 V. Reaksinya dapat balik : Ni. O(OH). x. H 2 O + Cd + 2 H 2 O 2 Ni(OH)2. y. H 2 O + Cd(OH)2 Terus

5. Sel Bahan Bakar Sel Bahan bakar merupakan sel Galvani dengan pereaksi – pereaksinya (oksigen dan hidrogen) dialirkan secara kontinyu ke dalam elektrode berpori. Sel ini terdiri atas anode dari nikel, katode dari nikel oksida dan elektrolit KOH. Reaksi yang terjadi : Anode : 2 H 2(g) + 4 OH-(aq) Katode : O 2(g) + 2 H 2 O(l) + 4 e Reaksi sel : 2 H 2(g) + O 2 Menu utama 4 H 2 O(l) + 4 e 4 OH-(aq) 2 H 2 O(l)

Uji Kompetensi Sel Volta 1

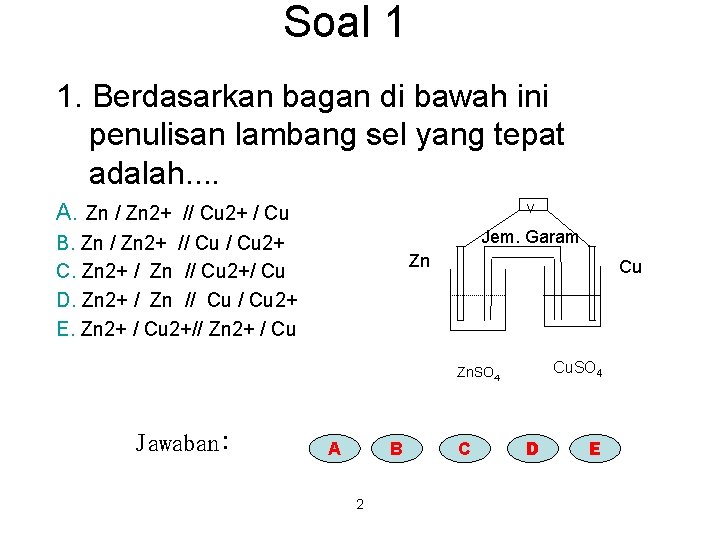
Soal 1 1. Berdasarkan bagan di bawah ini penulisan lambang sel yang tepat adalah. . A. Zn / Zn 2+ // Cu 2+ / Cu V Jem. Garam B. Zn / Zn 2+ // Cu 2+ C. Zn 2+ / Zn // Cu 2+/ Cu D. Zn 2+ / Zn // Cu 2+ E. Zn 2+ / Cu 2+// Zn 2+ / Cu Zn Cu Cu. SO 4 Zn. SO 4 Jawaban: A B 2 C D E

Selamat jawaban anda benar Ke soal berikutnya 3

Jawaban salah Anda belum beruntung Ulangi lagi 4

Soal 2 Sel Volta berikut ini yang sering disebut dengan sel Sel Leclanche A. Aki B. Batu baterai C. Sel perak oksida D. Sel nikel cadium E. Sel bahan bakar Jawab : A B C D E

Selamat jawaban anda benar Sukses 3

Jawaban salah Anda belum beruntung Ulangi lagi 4

keluar