Mengapa orang mencari ikan di sungai dengan accustrum




































- Slides: 45


Mengapa orang mencari ikan di sungai dengan accu/strum ? Mengapa pada saat hujan tidak boleh berada di bawah pohon ? Mengapa larutan garam dapat menghantarkan arus listrik sedangkan larutan gula tidak dapat menghantarkan listrik

Larutan Elektrolit dan Larutan Non Elektrolit Berdasarkan daya hantarnya listrik, larutan dibedakan menjadi 2: 1. Larutan elektrolit / dapat menghantarkan listrik. 2. Larutan non elektrolit / tidak dapat menghantarkan listrik

Larutan elektrolit zat yang jika dilarutkan ke dalam air akan terurai menjadi ion-ion (terionisasi), sehingga dapat menghantarkan listrik.

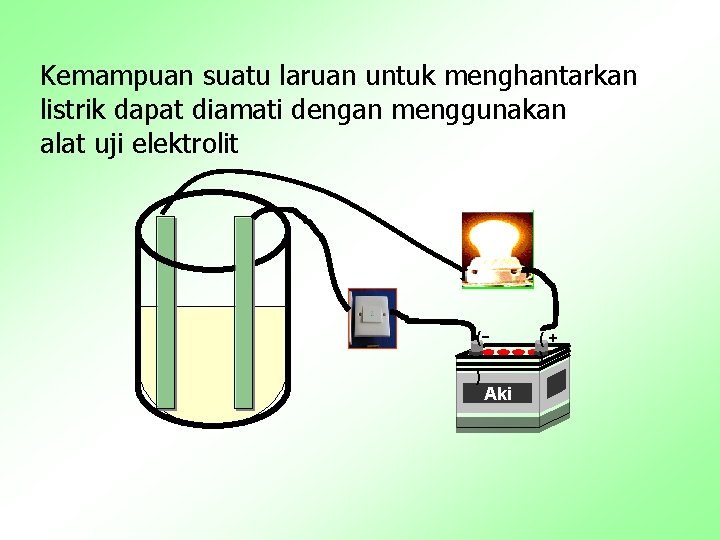
Kemampuan suatu laruan untuk menghantarkan listrik dapat diamati dengan menggunakan alat uji elektrolit () Aki (+ )

Berdasarkan kekuatan daya hantar listriknya, larutan elektrolit dibedakan atas: 1. larutan elektrolit kuat /daya hantar listriknya kuat 2. larutan elektrolit lemah/daya hantar listriknya lemah

Elektrolit kuat : zat yang dalam air akan terurai seluruhnya menjadi ion-ion (terionisasi sempurna) Elektrolit lemah : zat yang dalam air tidak seluruhnya terurai menjadi ion-ion (terionisasi sebagian)

ELEKTROLIT KUAT : ELEKTROLIT LEMAH : 1. Asam-asam kuat ( asam halogen, HNO 3, H 2 SO 4 ) 2. Basa-basa kuat ( Basa alkali, Sr(OH)2, Ba(OH)2 ) 3. Hampir semua garam adalah elektrolit kuat 4. Reaksinya berkesudahan (berlangsung sempurna ke arah kanan) 1. Asam –asam lainnya adalah asam-asam lemah. 2. Basa-basa lainnya adalah basa-basa lemah. 3. Garam yang tergolong elektrolit lemah adalah garam merkuri (II) 4. Reaksinya kesetimbangan (elektrolit hanya terionisasi sebagian).


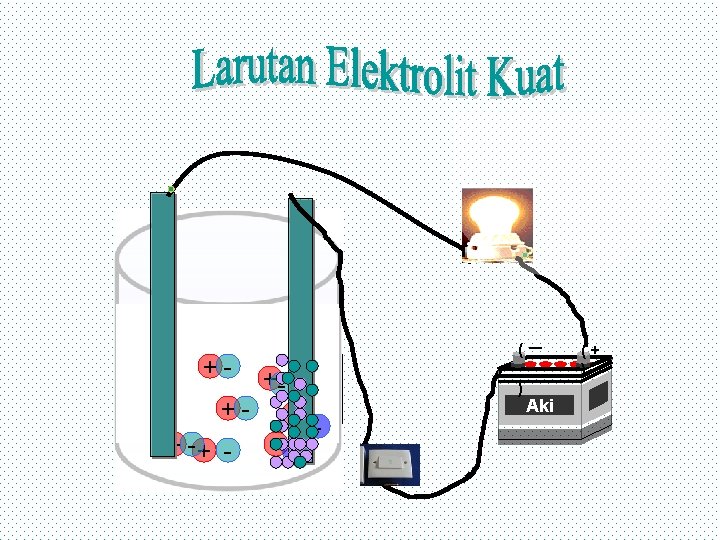
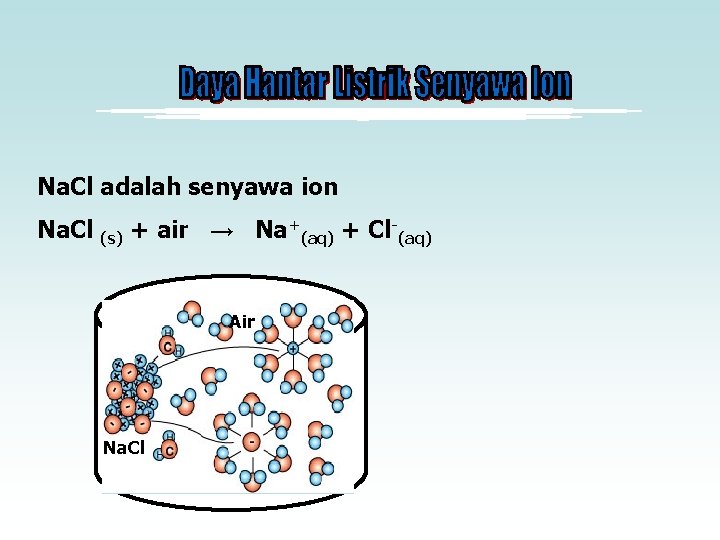
Adanya gelembung gas dan nyala lampu yang terang merupakan gejala larutan tersebut mempunyai daya hantar yang kuat disebut juga larutan elektrolit kuat. Mengapa? ? Pada larutan elektrolit kuat, seluruh molekulnya terurai menjadi ion (terionisasi sempurna) yang ditandai satu arah pada persamaan reaksinya. Karena banyak ion yang menghantarkan arus listrik maka daya hantarnya kuat. Contoh : Na. Cl(s) → Na+ + Cl-

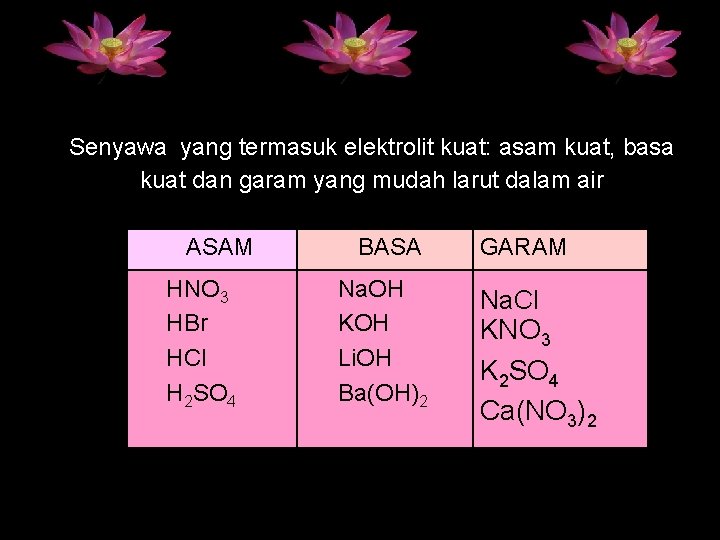
Senyawa yang termasuk elektrolit kuat: asam kuat, basa kuat dan garam yang mudah larut dalam air ASAM HNO 3 HBr HCl H 2 SO 4 BASA Na. OH KOH Li. OH Ba(OH)2 GARAM Na. Cl KNO 3 K 2 SO 4 Ca(NO 3)2


Jika muncul gelembung gas sedikit dan nyala lampu yang redup/mati berarti daya hantar listrik tersebut lemah disebut juga larutan elektrolit lemah. Mengapa? ? Pada laruan elektrolit lemah, sebagian molekulnya terurai menjadi ion (terionisasi tidak sempurna) yang ditandai dua arah panah pada persamaan reaksinya. Karena sedikit ion yang menghantarkan arus listrik Maka daya hantarnya lemah Contoh : CH 3 COOH(aq) ↔ H+ + CH 3 COO-

Senyawa yang termasuk elektrolit lemah: asam lemah, basa lemah dan garam yang sukar larut dalam air ASAM H 2 CO 3 HF CH 3 COOH HCOOH BASA NH 4 OH Al(OH)3 Zn(OH)3 GARAM


Gelembung gas tidak muncul dan lampu tidak menyala, Berarati larutan tersebut tidak dapat menghantarkan listrik yang disebut larutan non elektrolit Pada larutan non elektrolit, molekulnya tidak terurai menjadi ion (tidak terionisasi) , sehingga tidak ada ion yang bermuatan yang menghantarkan listrik Contoh larutan non elektrolit: larutan gula, urea, alkohol, air murni

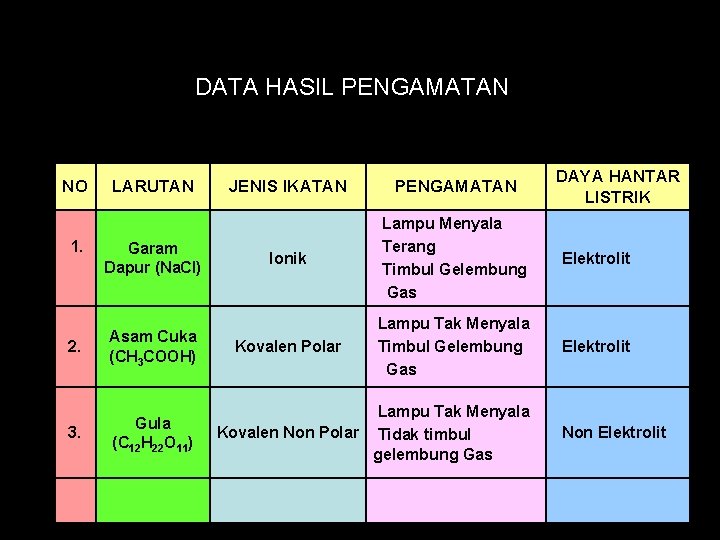
DATA HASIL PENGAMATAN NO 1. LARUTAN Garam Dapur (Na. Cl) 2. Asam Cuka (CH 3 COOH) 3. Gula (C 12 H 22 O 11) DAYA HANTAR LISTRIK JENIS IKATAN PENGAMATAN Ionik Lampu Menyala Terang Timbul Gelembung Gas Elektrolit Kovalen Polar Lampu Tak Menyala Timbul Gelembung Gas Elektrolit Lampu Tak Menyala Kovalen Non Polar Tidak timbul gelembung Gas Non Elektrolit

PEREDAAN LARUTAN BERDASARKAN DAYA HANTAR LISTRIK ELEKTROLIT 1. Dapat menghantarkan listrik 2. Terjadi proses ionisasi (terurai menjadi ion-ion) 3. Lampu dapat menyala terang atau redup dan ada gelembung gas NON ELEKTROLIT 1. 2 3. Tidak dapat menghantarkan listrik Tidak terjadi proses ionisasi Lampu tidak menyala dan tidak ada gelembung gas

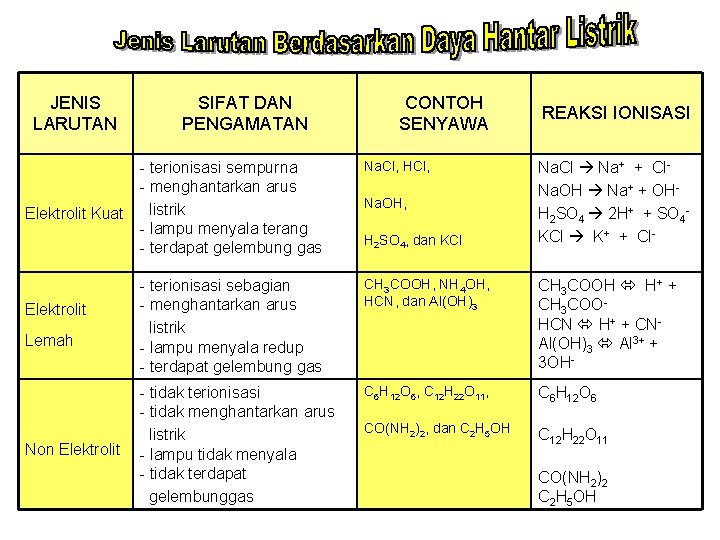
JENIS LARUTAN Elektrolit Kuat Elektrolit Lemah Non Elektrolit SIFAT DAN PENGAMATAN CONTOH SENYAWA REAKSI IONISASI - terionisasi sempurna - menghantarkan arus listrik - lampu menyala terang - terdapat gelembung gas Na. Cl, HCl, - terionisasi sebagian - menghantarkan arus listrik - lampu menyala redup - terdapat gelembung gas CH 3 COOH, NH 4 OH, HCN, dan Al(OH)3 CH 3 COOH H+ + CH 3 COOHCN H+ + CNAl(OH)3 Al 3+ + 3 OH- - tidak terionisasi - tidak menghantarkan arus listrik - lampu tidak menyala - tidak terdapat gelembunggas C 6 H 12 O 6, C 12 H 22 O 11, C 6 H 12 O 6 CO(NH 2)2, dan C 2 H 5 OH C 12 H 22 O 11 Na. OH, H 2 SO 4, dan KCl Na. Cl Na+ + Cl. Na. OH Na+ + OHH 2 SO 4 2 H+ + SO 4 KCl K+ + Cl- CO(NH 2)2 C 2 H 5 OH

Elektrolit dapat berupa: 1. Senyawa ion (antara atom logam dengan non logam) Contoh: Na. Cl, Na. OH, Mg. Br 2, KF 2. Senyawa kovalen polar (antara atom non logam dengan non logam Contoh: HCl, HF, NH 4 OH, CH 3 COOH

Na. Cl adalah senyawa ion Na. Cl (s) + air → Na+(aq) + Cl-(aq) Air Na. Cl

Daya Hantar Listrik Senyawa Kovalen CH 3 COOH merupakan senyawa kovalen polar - CH 3 COOH CH 3 COO + + H

Molaritas (M) : banyaknya 1 mol zat dalam 1 liter larutan M = mol / liter Molaritas : menyatakan banyaknya konsentrasi suatu larutan ( pekat atau encer suatu larutan) Contoh: Larutan H 2 SO 4 2 M lebih pekat dibanding larutan H 2 SO 4 1 M Makin pekat larutan, partikelnya makin banyak

Contoh Soal 1. Diantara larutan berikut, manakah yang menimbulkan nyala lampu paling terang jika diperiksa dengan alat penguji hantaran listrik? a. CH 3 COOH b. NH 4 OH c. CO(NH 2)2 d. HCl e. C 2 H 5 OH

Jawaban : • Dari beberapa larutan yang ada, yang menimbulkan nyala lampu paling terang jika diperiksa dengan alat penguji hantaran listrik adalah HCl ( c ), karena HCl merupakan senyawa kovalen polar, yang mampu terurai dengan sempurna menghasilkan H+ dan Cl-

2. Pernyataan yang benar tentang elektrolit. . a. zat-zat yang jika dilarutkan dengan air akan terurai menjadi ion negatif dan ion positif b. zat-zat yang jika dilarutkan dalam air akan terurai menjadi molekul-molekul c. zat-zat yang jika dilarutkan dalam air tidak akan terurai menjadi atom-atom d. zat-zat yang jika dilarutkan dalam air tidak akan terurai menjadi ion-ion e. zat-zat yang dilarutkan dalam air akan terurai menjadi gas-gas tertentu

Jawaban : elektrolit merupakan zat-zat yang jika dilarutkan dengan air akan terurai menjadi ion negatif dan ion positif (a)

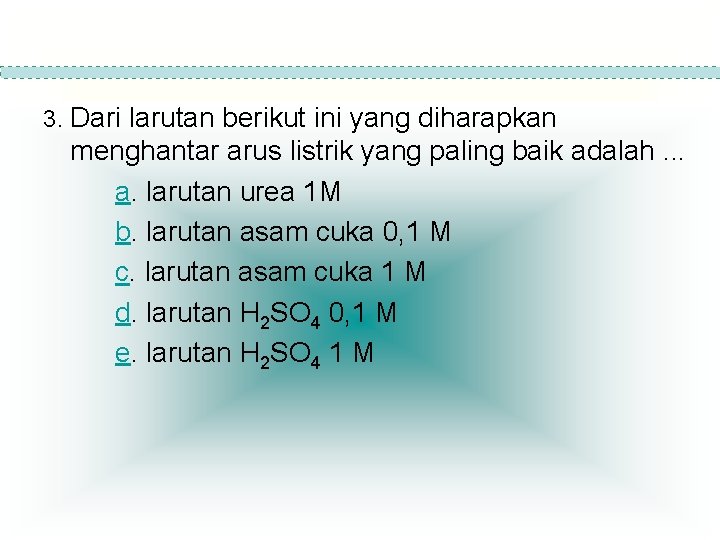
3. Dari larutan berikut ini yang diharapkan menghantar arus listrik yang paling baik adalah. . . a. larutan urea 1 M b. larutan asam cuka 0, 1 M c. larutan asam cuka 1 M d. larutan H 2 SO 4 0, 1 M e. larutan H 2 SO 4 1 M

Jawaban : Dari larutan berikut ini yang diharapkan menghantar arus listrik yang paling baik adalah larutan H 2 SO 4 1 M ( e ) karena dia merupakan larutan elektrolit yang paling kuat

LATIHAN SOAL 1. Beberapa senyawa berikut: 1. Na. Cl 4. Na. OH 2. HCl 5. C 2 H 5 OH 3. CH 3 COOH Senyawa kovalen yang dapat menghantarkan listrik adalah: a. 1 dan 2 b. 2 dan 3 c. 1 dan 4 d. 3 dan 5 e. 2 dan 5

Benar, silahkan mengerjakan soal berikutnya

Jawaban anda masih salah. Coba lagi ya!

2. Larutan H 2 SO 4 dapat menghantarkan listrik karena …. a. H 2 SO 4 dapat terionisasi sempurna dengan adanya arus listrik b. H 2 SO 4 larut dalam air dengan melepaskan elektron c. H 2 SO 4 dapat larut dalam air d. H 2 SO 4 merupakan senyawa ion e. H 2 SO 4 dalam air terionisasi sebelum dihubungkan dengan baterai

Benar, silahkan mengerjakan soal berikutnya

Jawaban anda masih salah. Coba lagi ya!

3. Kelompok manakah yang merupakan elektrolit dan berikatan ion …. a. H 2 SO 4, KCl, Na. OH b. Na. Cl, KBr, Mg. Cl 2 c. CH 3 COOH, CO(NH 2)2 , Na. Cl d. KCl, Mg. Br 2, H 2 SO 4 e. H 2 SO 4 , CO(NH 2)2 , Na. Cl

Benar, silahkan mengerjakan soal berikutnya

Jawaban anda masih salah. Coba lagi ya!

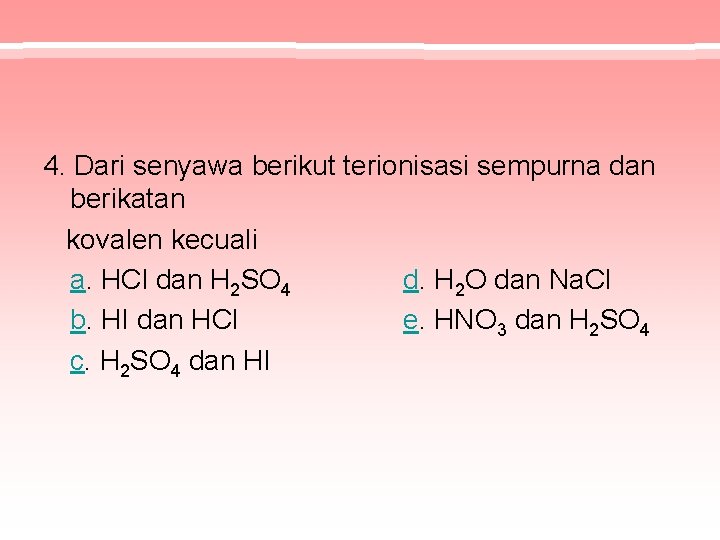
4. Dari senyawa berikut terionisasi sempurna dan berikatan kovalen kecuali a. HCl dan H 2 SO 4 d. H 2 O dan Na. Cl b. HI dan HCl e. HNO 3 dan H 2 SO 4 c. H 2 SO 4 dan HI

Benar, silahkan mengerjakan soal berikutnya

Jawaban anda masih salah. Coba lagi ya!

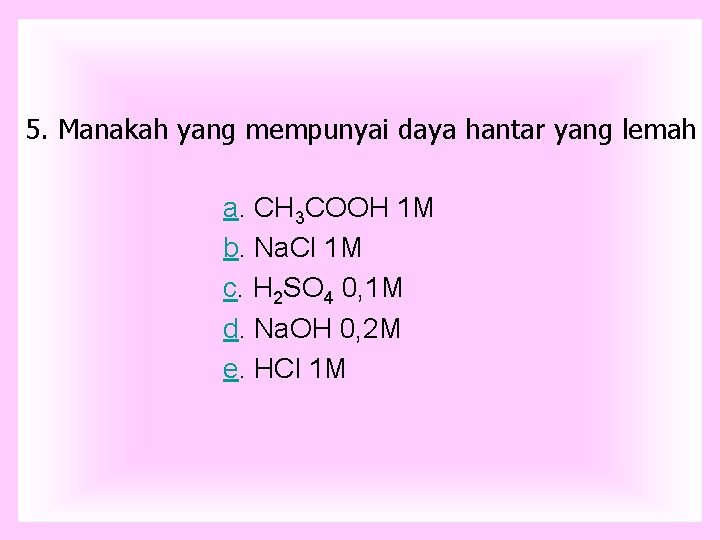
5. Manakah yang mempunyai daya hantar yang lemah a. CH 3 COOH 1 M b. Na. Cl 1 M c. H 2 SO 4 0, 1 M d. Na. OH 0, 2 M e. HCl 1 M

Anda Hebat

Jawaban anda masih salah. Coba lagi ya!

REFERENSI • Purba, Michael, 2002, Kimia 1 B SMU , Jakarta , erlangga. • Sutresna Nana, 1994, Kimia 1 untuk SMU kelas 1, cetakan I, Ganesa Exact. • Sutresna Nana, 2004, Kimia untuk SMA kelas 1, cetakan II, grafindo. • Sri Wahyuni, 2004, Master Kimia SMA, Erlangga. • Program Televisi Pendidikan Sekolah, Reaksi Elektrolisis, DIKMENUM, Kepala pusat pengembangan kurikulum, Disiarkan oleh TPI • Pustekom 2003. • www. animationlibrary. com • www. e-dukasi. net
 Mengapa orang mencari ikan di sungai dengan accu/setrum
Mengapa orang mencari ikan di sungai dengan accu/setrum Sungai tigris dan sungai eufrat
Sungai tigris dan sungai eufrat Pendukung peradaban mesopotamia
Pendukung peradaban mesopotamia Ziggurat fungsi
Ziggurat fungsi Sebutkan strategi mencari teman dan disenangi teman
Sebutkan strategi mencari teman dan disenangi teman Mengapa ikan harus disortir sebelum dilelang
Mengapa ikan harus disortir sebelum dilelang Mengapa orang berhasrat untuk berwirausaha
Mengapa orang berhasrat untuk berwirausaha Mengapa manusia selalu membutuhkan orang lain
Mengapa manusia selalu membutuhkan orang lain Ikan berbadan pipih dan berenang secara berkelompok adalah
Ikan berbadan pipih dan berenang secara berkelompok adalah Penataan peredaran pakan ikan dan obat ikan
Penataan peredaran pakan ikan dan obat ikan Dari 60 orang siswa ternyata 36 orang gemar membaca
Dari 60 orang siswa ternyata 36 orang gemar membaca Dari 40 orang anak ternyata 24 anak gemar minum teh
Dari 40 orang anak ternyata 24 anak gemar minum teh Ppt perlawanan pangeran mangkubumi dan mas said
Ppt perlawanan pangeran mangkubumi dan mas said Apa arti keluarga yang kuat melahirkan pribadi yang kuat
Apa arti keluarga yang kuat melahirkan pribadi yang kuat Dari 60 orang siswa ternyata 36 orang gemar membaca
Dari 60 orang siswa ternyata 36 orang gemar membaca Perumpamaan nafkah yang dikeluarkan oleh orang-orang yang
Perumpamaan nafkah yang dikeluarkan oleh orang-orang yang Dari 40 orang anak ternyata 24 anak gemar minum teh
Dari 40 orang anak ternyata 24 anak gemar minum teh Dari 40 siswa ternyata 17 anak gemar matematika
Dari 40 siswa ternyata 17 anak gemar matematika Bagaimana mencari data hashing dengan kunci modulus n?
Bagaimana mencari data hashing dengan kunci modulus n? Cara hitung validitas di excel
Cara hitung validitas di excel Metode hashing
Metode hashing Kebenaran non ilmiah adalah
Kebenaran non ilmiah adalah Mengapa kelenjar endokrin disebut juga kelenjar buntu
Mengapa kelenjar endokrin disebut juga kelenjar buntu Contoh opini ilmiah
Contoh opini ilmiah Contoh ikan sisik placoid
Contoh ikan sisik placoid Apa nama ilmiah dari ikan guppy...
Apa nama ilmiah dari ikan guppy... Ikan pari berkembang biak dengan cara
Ikan pari berkembang biak dengan cara Apa itu komoditas ikan konsumsi
Apa itu komoditas ikan konsumsi Sisik stenoid
Sisik stenoid Contoh syirkah al wujuh
Contoh syirkah al wujuh Perangkat lunak komputer disebut juga ?
Perangkat lunak komputer disebut juga ? Indeks nama sekolah
Indeks nama sekolah Diketahui 5 orang bersaudara dengan selisih umur yang sama
Diketahui 5 orang bersaudara dengan selisih umur yang sama Sungai superposed
Sungai superposed Peta konsep peradaban sungai indus
Peta konsep peradaban sungai indus Sungai bayayo
Sungai bayayo Kuala sungai telor
Kuala sungai telor Pengenalan sabah dan sarawak
Pengenalan sabah dan sarawak Peta daerah batang padang
Peta daerah batang padang Konsep dasar hidrologi
Konsep dasar hidrologi Mita mempunyai 7 tangkai bunga yang be
Mita mempunyai 7 tangkai bunga yang be Daerah negeri perlis
Daerah negeri perlis Lembah sungai mekong
Lembah sungai mekong Peninggalan sungai huang ho
Peninggalan sungai huang ho Dari manakah asal persediaan air sungai di daratan
Dari manakah asal persediaan air sungai di daratan Sungai tangkak
Sungai tangkak