Mechanizmy reakcji organicznych Reakcje polarne zachodzce w warunkach




- Slides: 81

Mechanizmy reakcji organicznych Reakcje polarne zachodzące w warunkach zasadowych

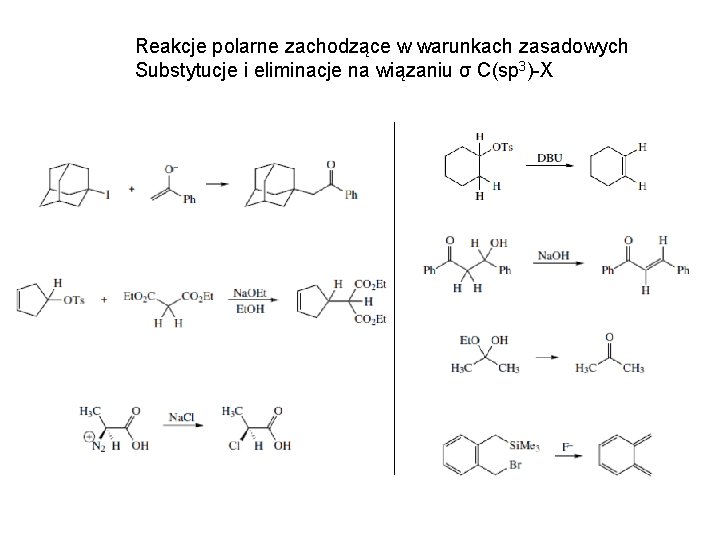
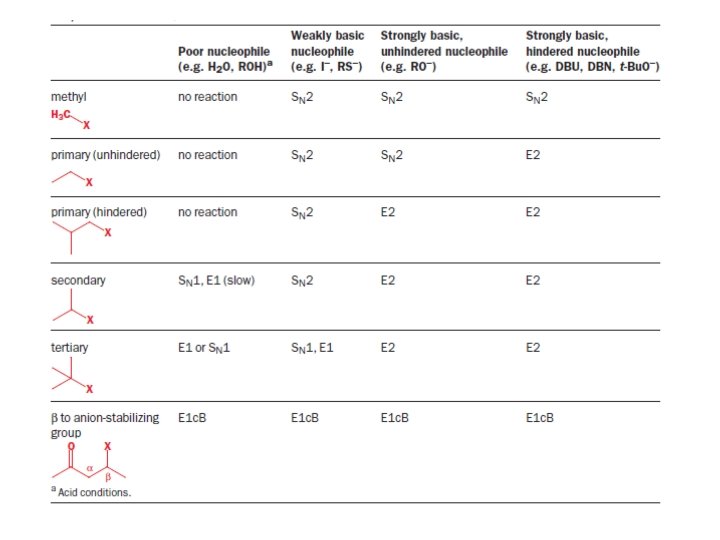
Reakcje polarne zachodzące w warunkach zasadowych Substytucje i eliminacje na wiązaniu σ C(sp 3)-X


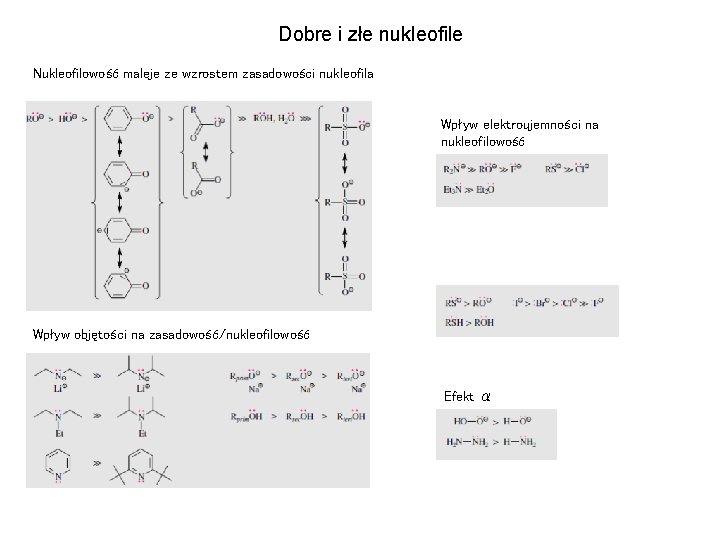
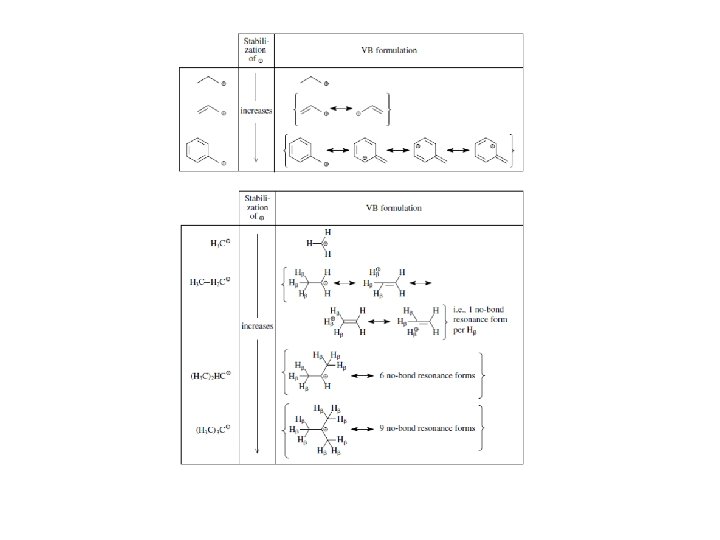
Dobre i złe nukleofile Nukleofilowość maleje ze wzrostem zasadowości nukleofila Wpływ elektroujemności na nukleofilowość Wpływ objętości na zasadowość/nukleofilowość Efekt α

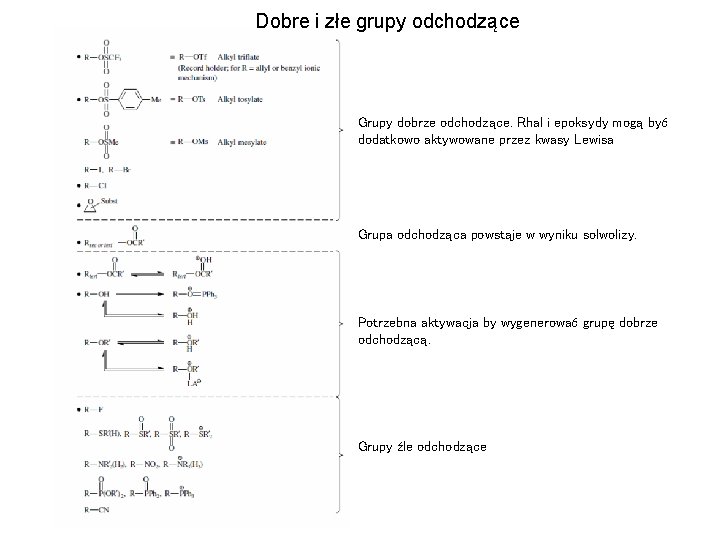
Dobre i złe grupy odchodzące Grupy dobrze odchodzące. Rhal i epoksydy mogą być dodatkowo aktywowane przez kwasy Lewisa Grupa odchodząca powstaje w wyniku solwolizy. Potrzebna aktywacja by wygenerować grupę dobrze odchodzącą. Grupy źle odchodzące

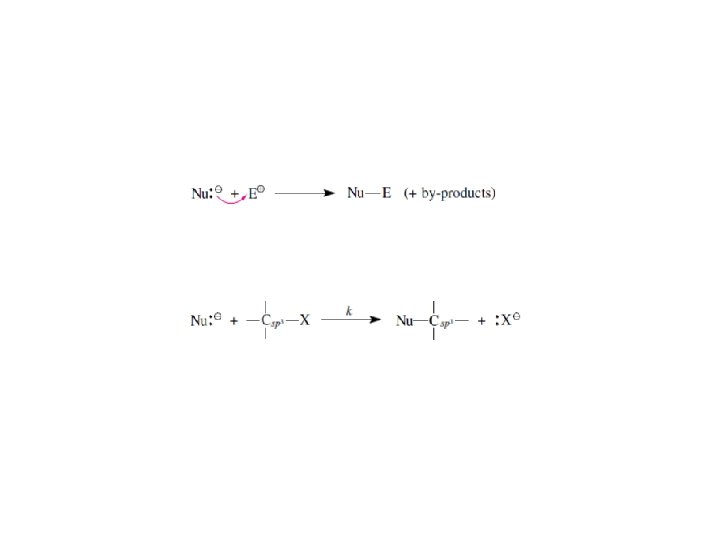
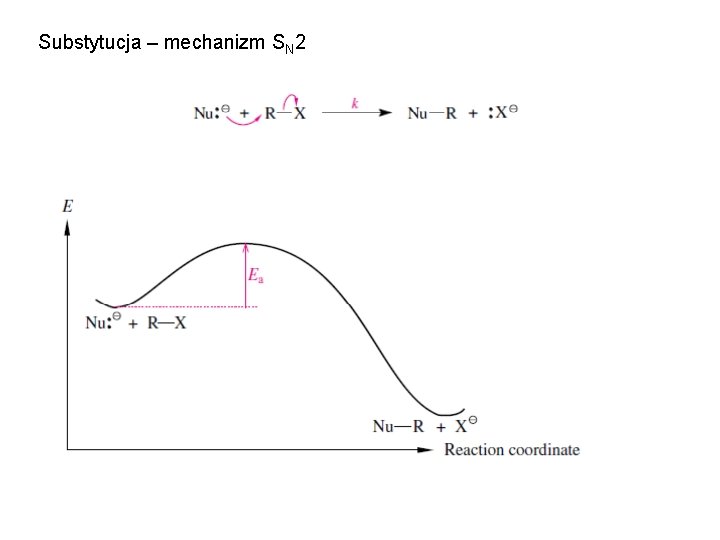
Substytucja – mechanizm SN 2

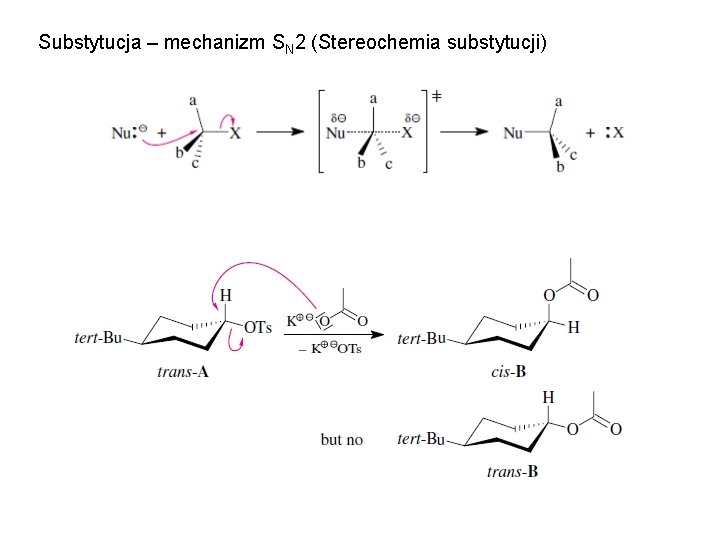
Substytucja – mechanizm SN 2 (Stereochemia substytucji)

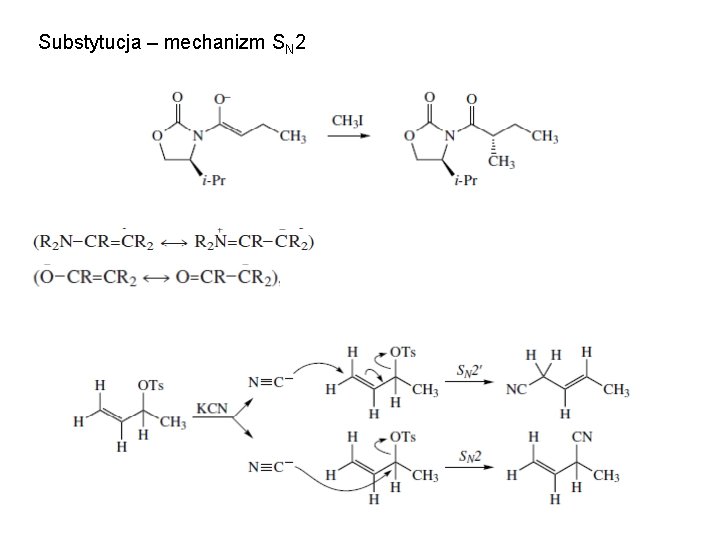
Substytucja – mechanizm SN 2

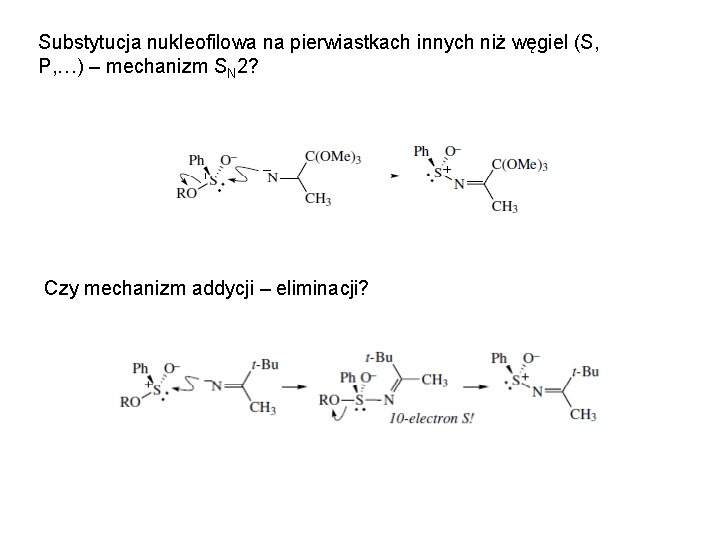
Substytucja nukleofilowa na pierwiastkach innych niż węgiel (S, P, …) – mechanizm SN 2? Czy mechanizm addycji – eliminacji?

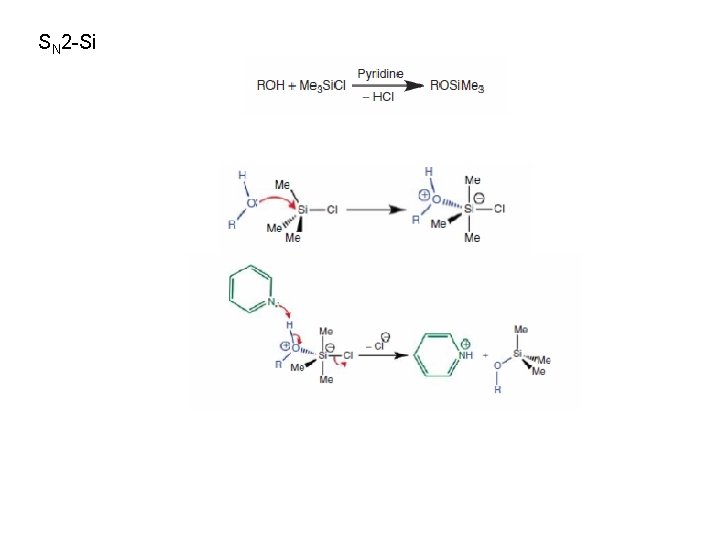
SN 2 -Si

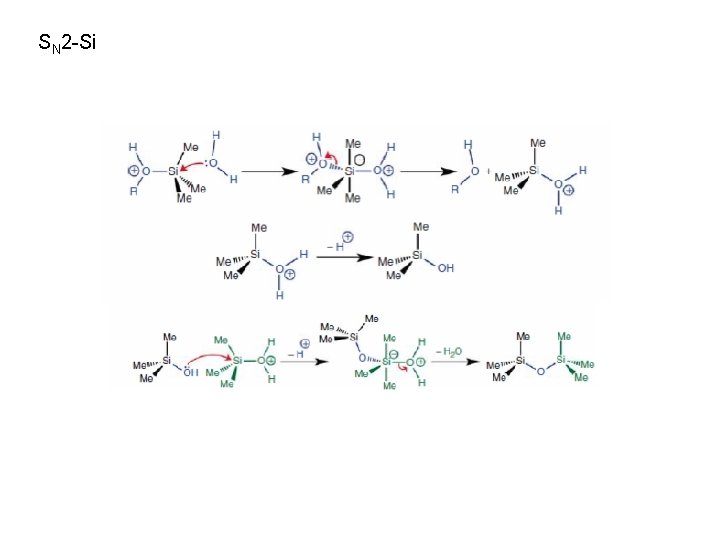
SN 2 -Si

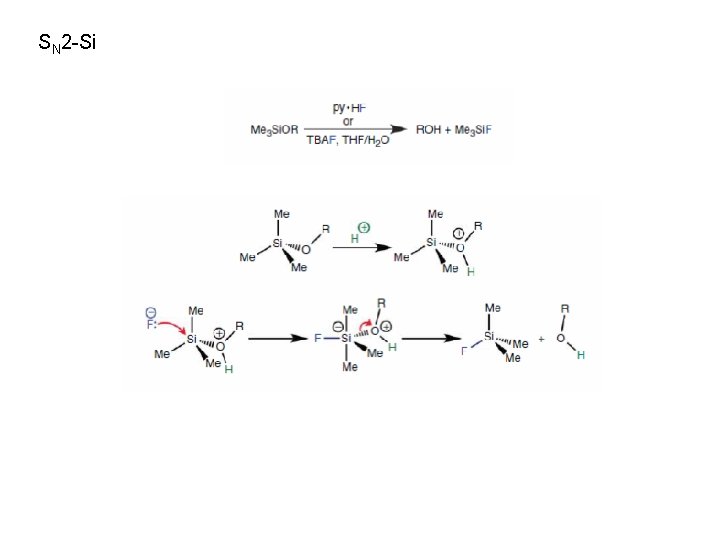
SN 2 -Si

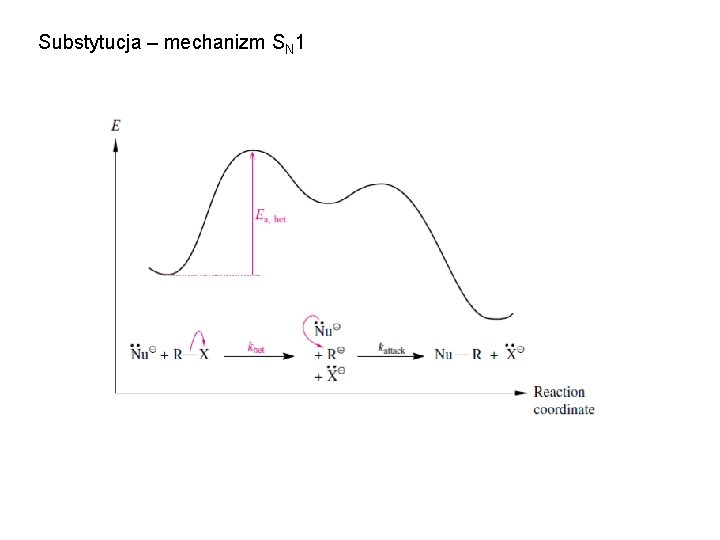
Substytucja – mechanizm SN 1

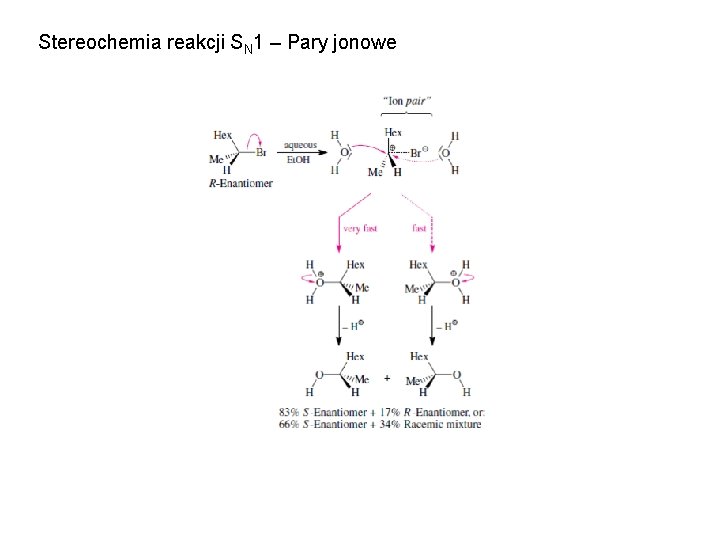
Stereochemia reakcji SN 1 – Pary jonowe

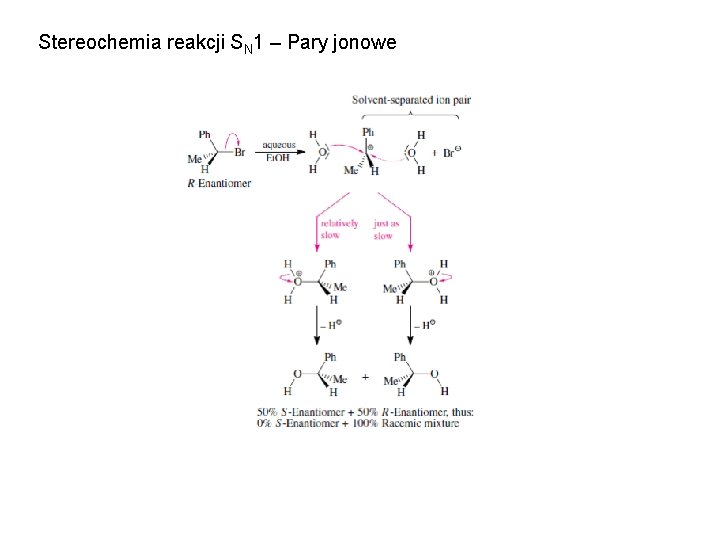
Stereochemia reakcji SN 1 – Pary jonowe


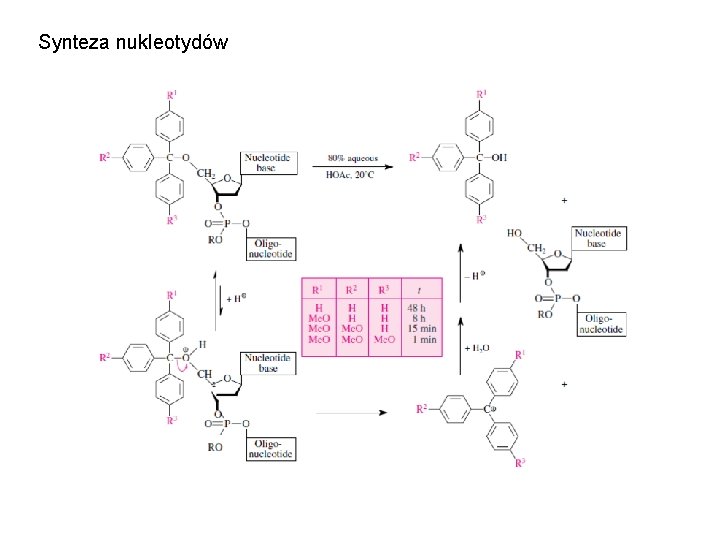
Synteza nukleotydów

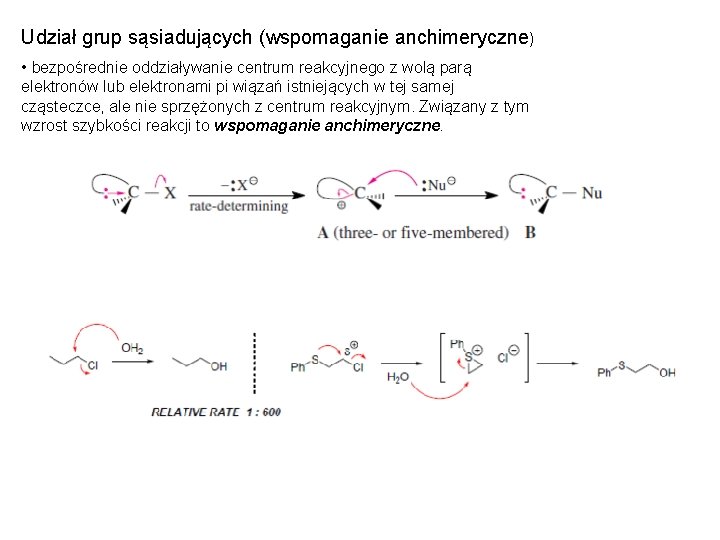
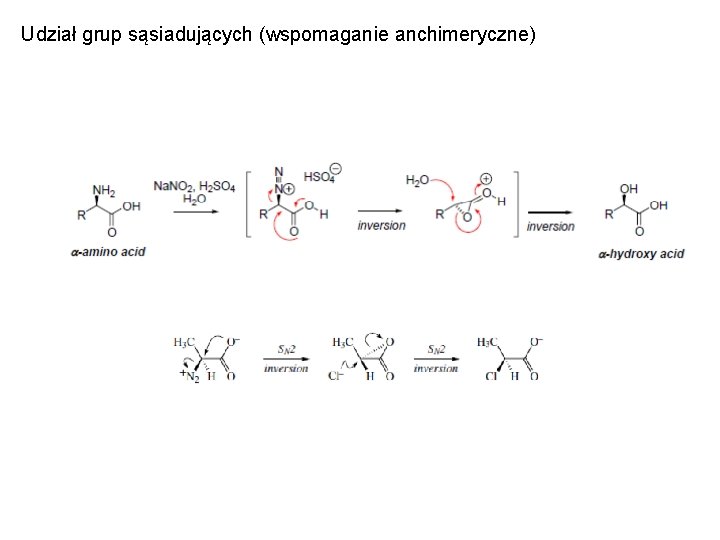
Udział grup sąsiadujących (wspomaganie anchimeryczne) • bezpośrednie oddziaływanie centrum reakcyjnego z wolą parą elektronów lub elektronami pi wiązań istniejących w tej samej cząsteczce, ale nie sprzężonych z centrum reakcyjnym. Związany z tym wzrost szybkości reakcji to wspomaganie anchimeryczne.

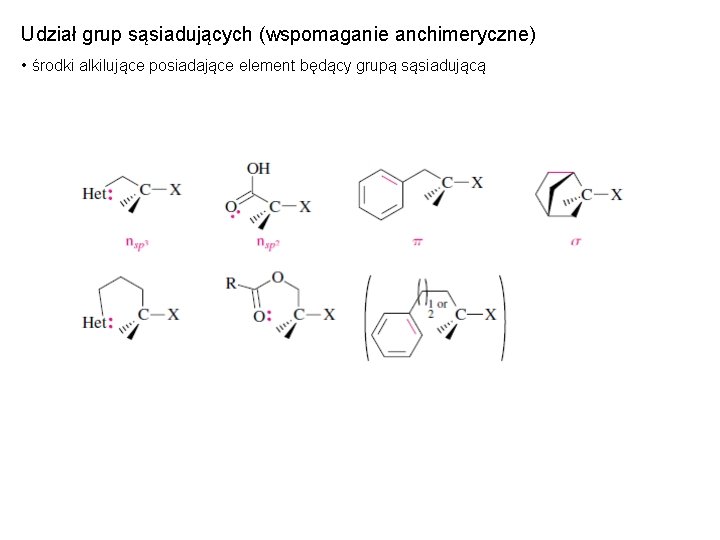
Udział grup sąsiadujących (wspomaganie anchimeryczne) • środki alkilujące posiadające element będący grupą sąsiadującą

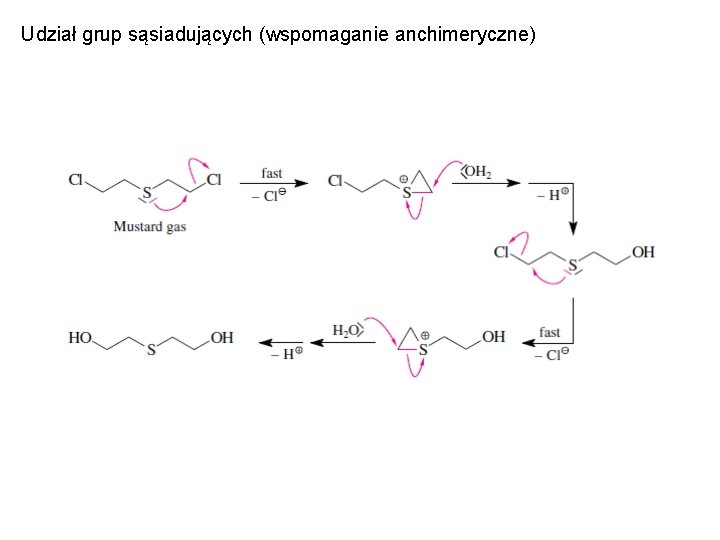
Udział grup sąsiadujących (wspomaganie anchimeryczne)

Udział grup sąsiadujących (wspomaganie anchimeryczne)

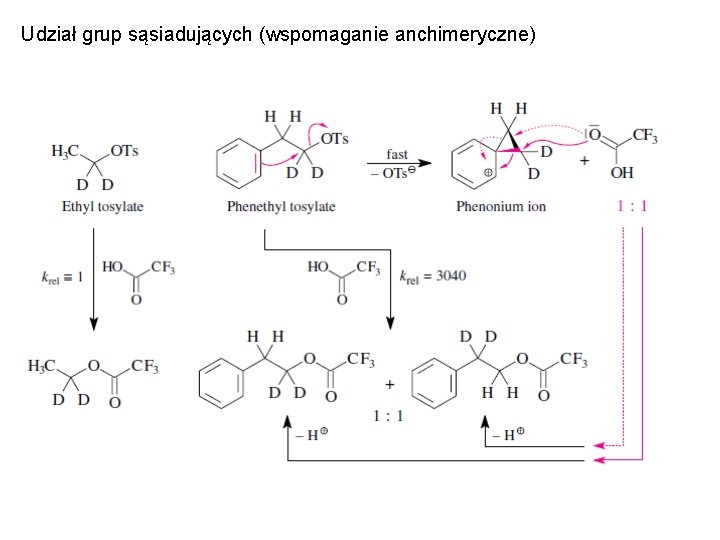
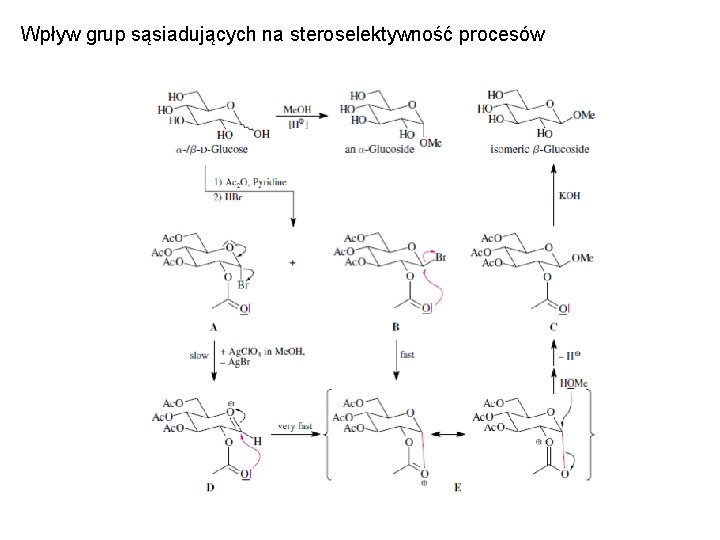
Wpływ grup sąsiadujących na steroselektywność procesów

Udział grup sąsiadujących (wspomaganie anchimeryczne)

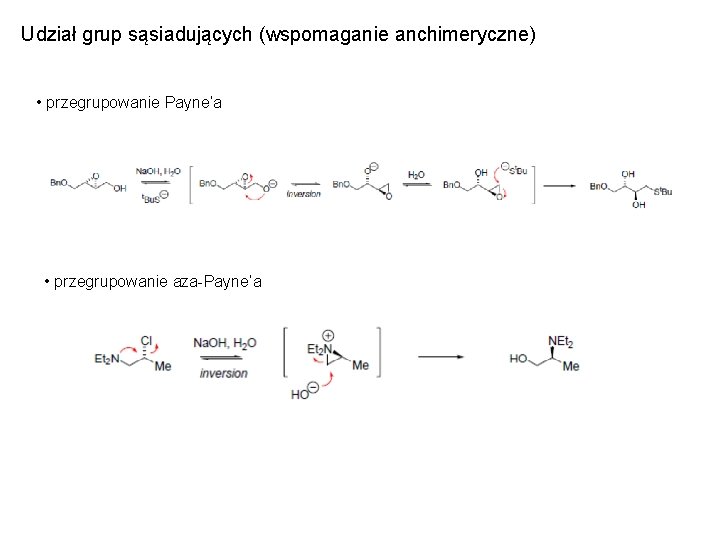
Udział grup sąsiadujących (wspomaganie anchimeryczne) • przegrupowanie Payne’a • przegrupowanie aza-Payne’a

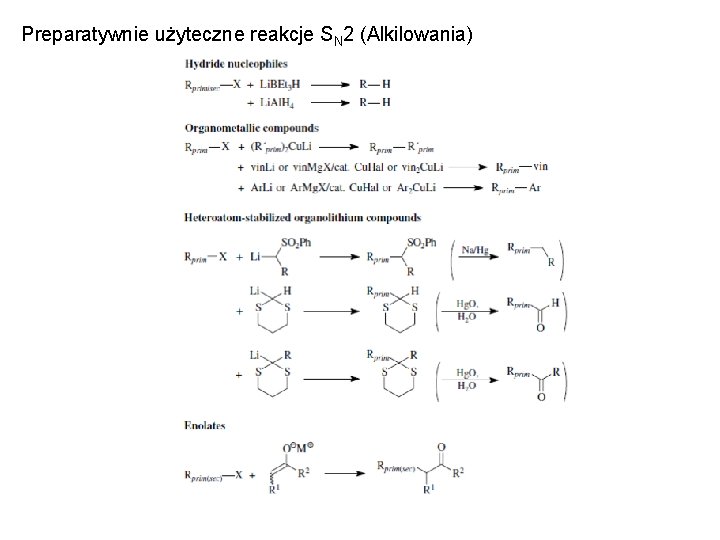
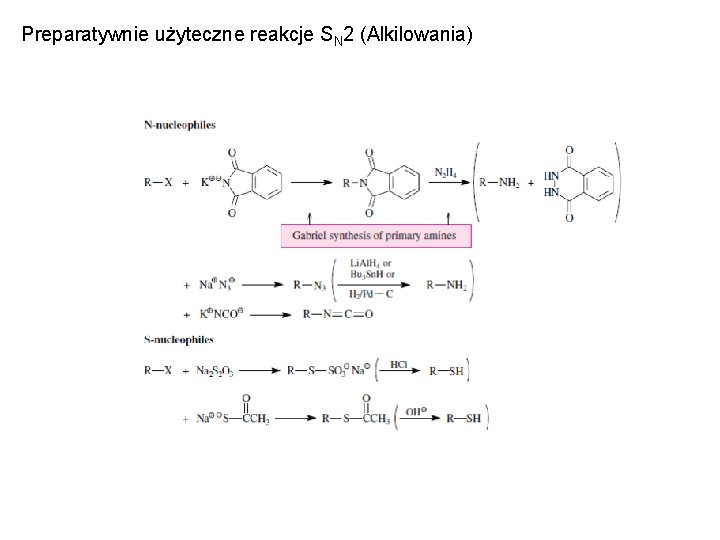
Preparatywnie użyteczne reakcje SN 2 (Alkilowania)

Preparatywnie użyteczne reakcje SN 2 (Alkilowania)

Preparatywnie użyteczne reakcje SN 2 (Alkilowania)

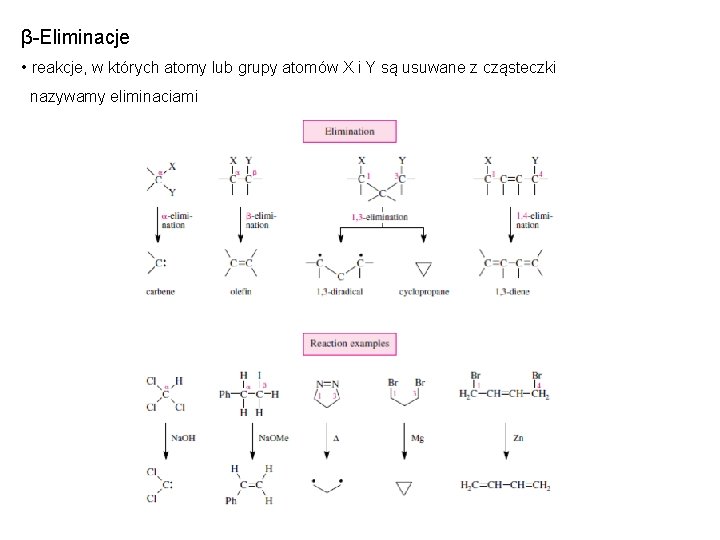
β-Eliminacje • reakcje, w których atomy lub grupy atomów X i Y są usuwane z cząsteczki nazywamy eliminacjami

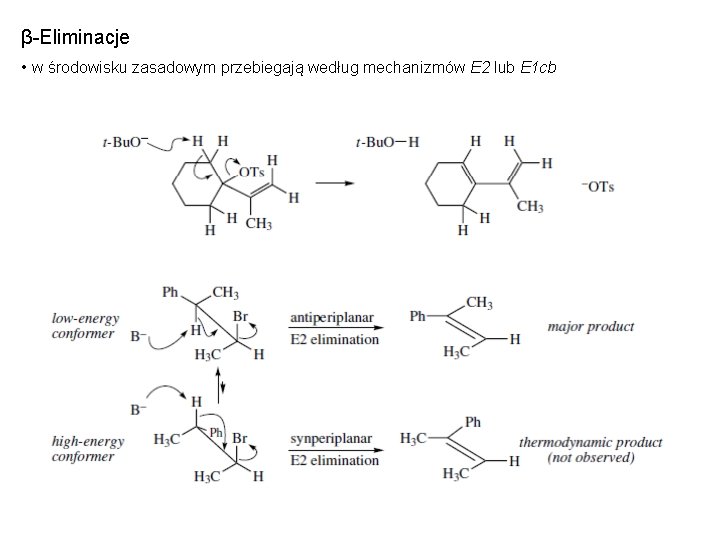
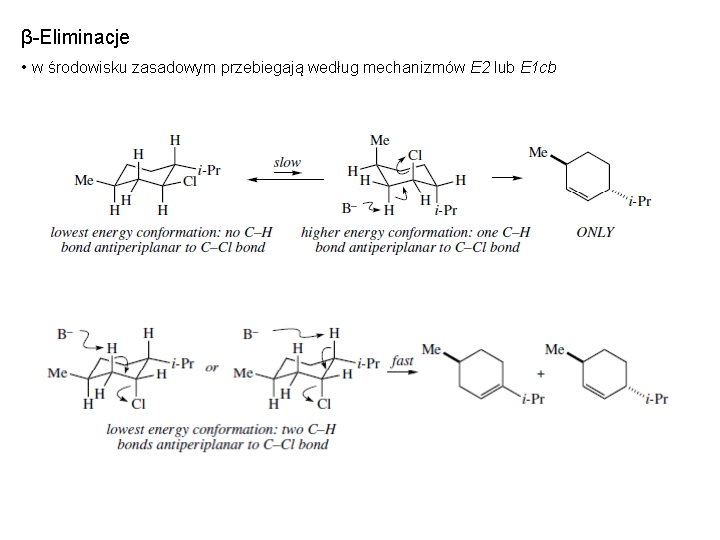
β-Eliminacje • w środowisku zasadowym przebiegają według mechanizmów E 2 lub E 1 cb

β-Eliminacje • w środowisku zasadowym przebiegają według mechanizmów E 2 lub E 1 cb

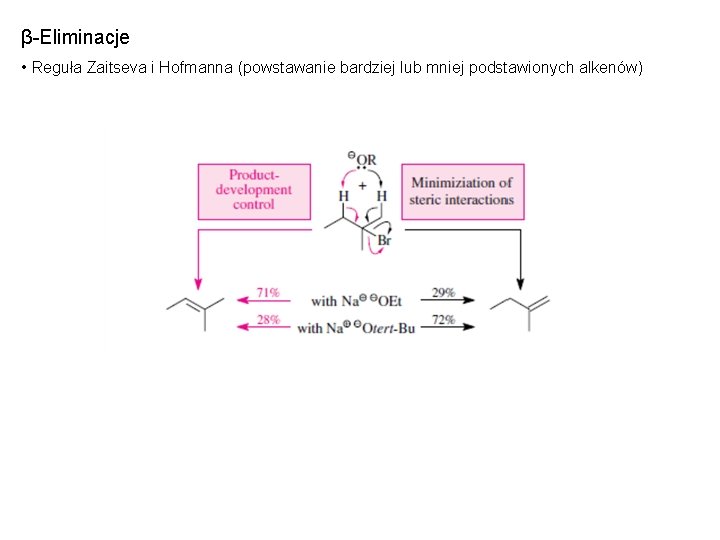
β-Eliminacje • Reguła Zaitseva i Hofmanna (powstawanie bardziej lub mniej podstawionych alkenów)

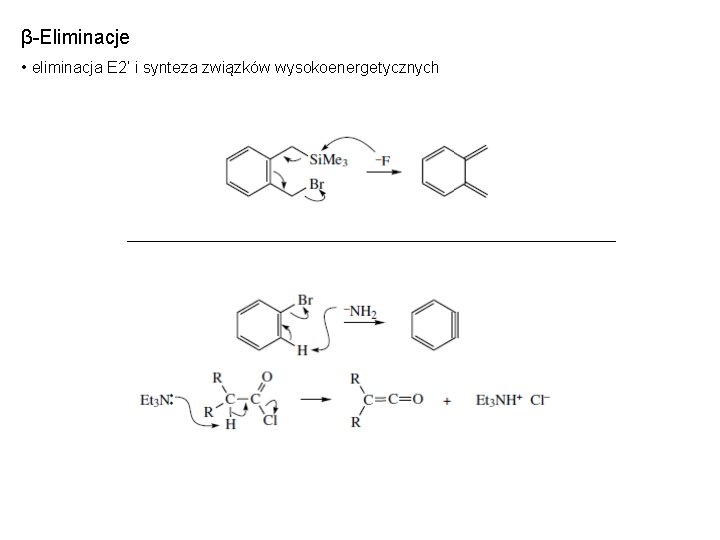
β-Eliminacje • eliminacja E 2’ i synteza związków wysokoenergetycznych

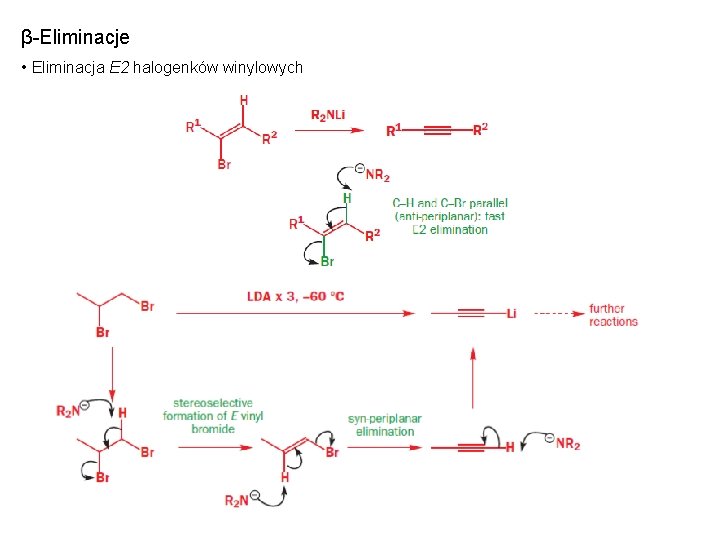
β-Eliminacje • Eliminacja E 2 halogenków winylowych

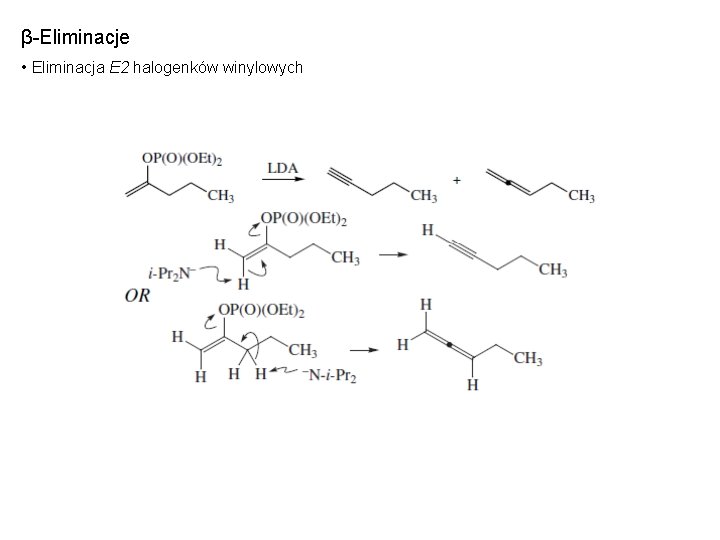
β-Eliminacje • Eliminacja E 2 halogenków winylowych

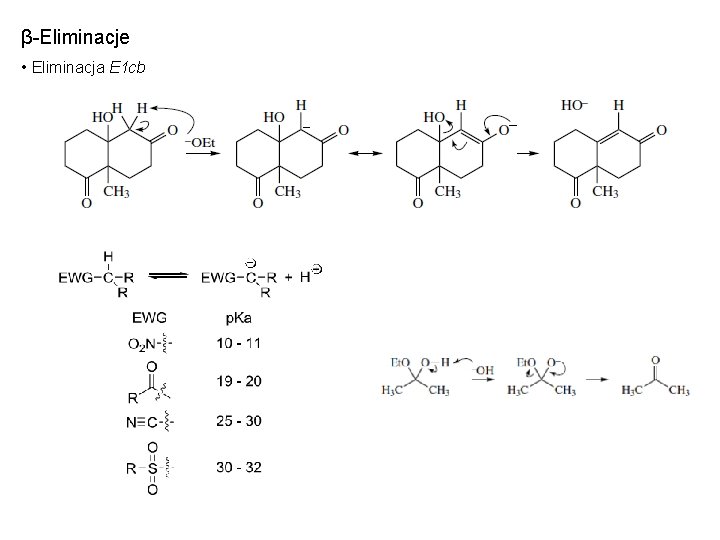
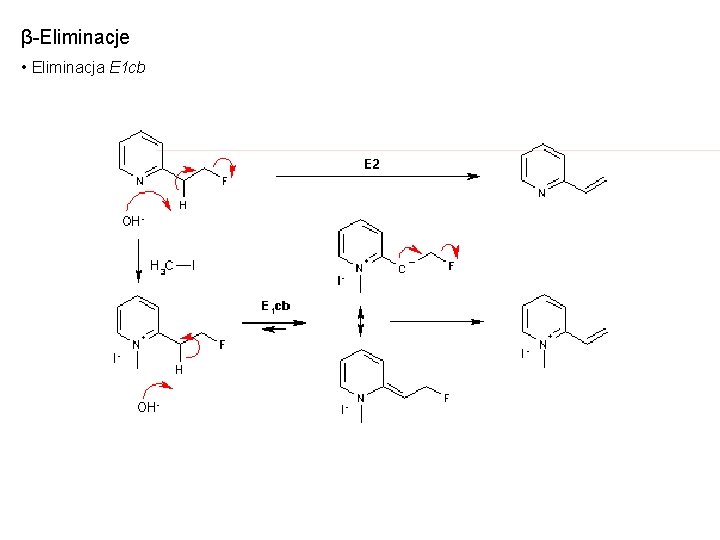
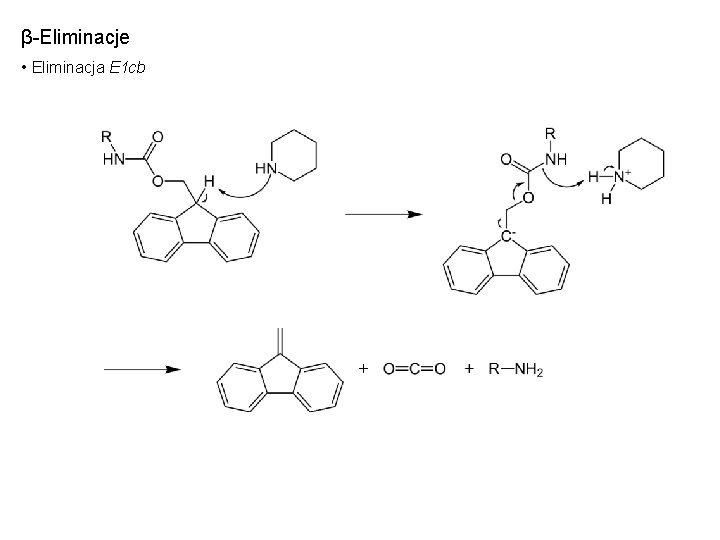
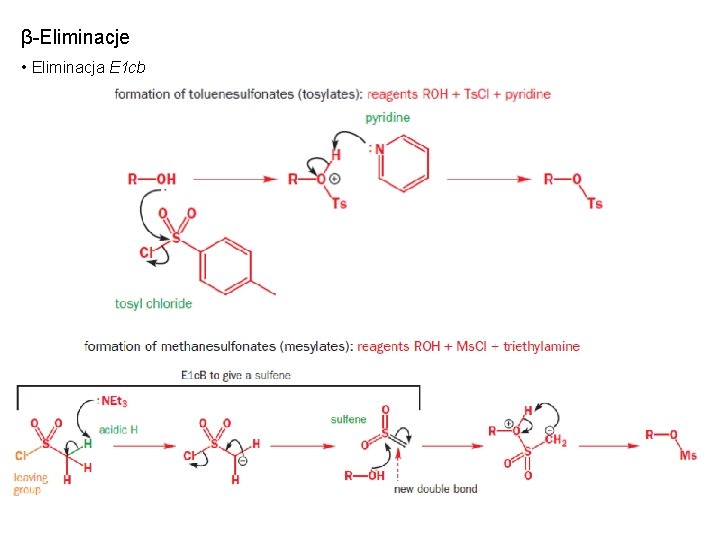
β-Eliminacje • Eliminacja E 1 cb

β-Eliminacje • Eliminacja E 1 cb

β-Eliminacje • Eliminacja E 1 cb

β-Eliminacje • Eliminacja E 1 cb

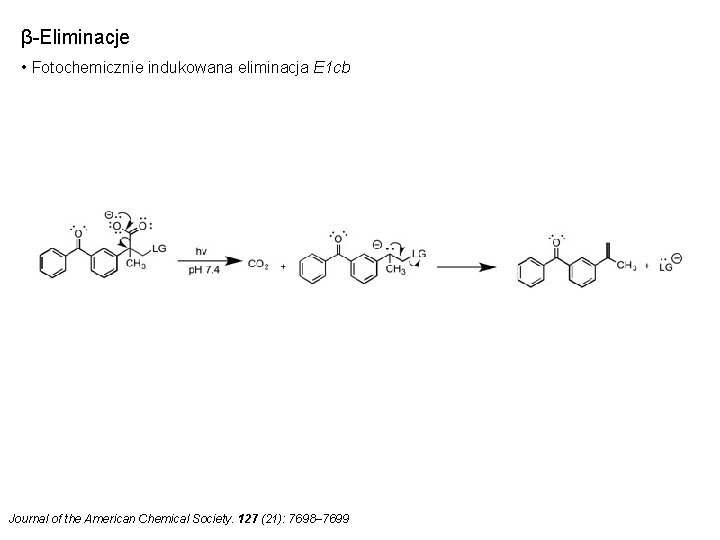
β-Eliminacje • Fotochemicznie indukowana eliminacja E 1 cb Journal of the American Chemical Society. 127 (21): 7698– 7699

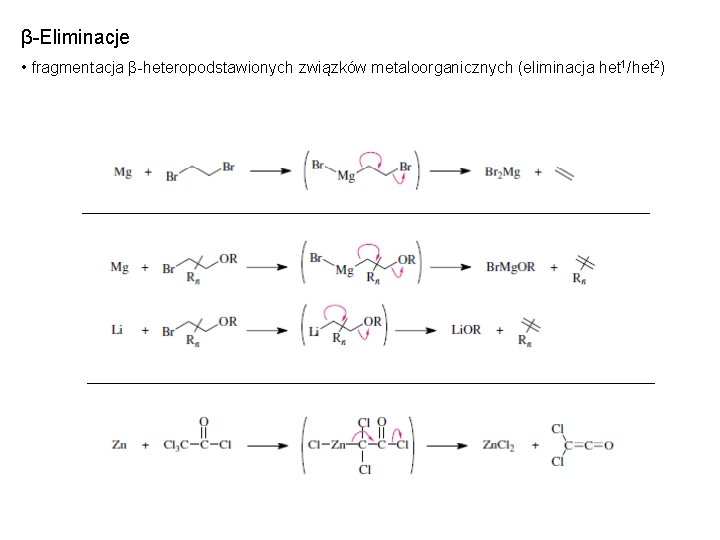
β-Eliminacje • fragmentacja β-heteropodstawionych związków metaloorganicznych (eliminacja het 1/het 2)

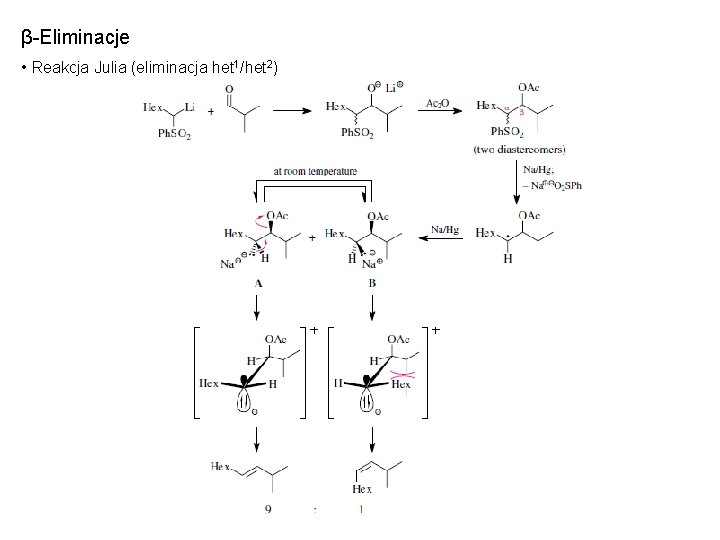
β-Eliminacje • Reakcja Julia (eliminacja het 1/het 2)

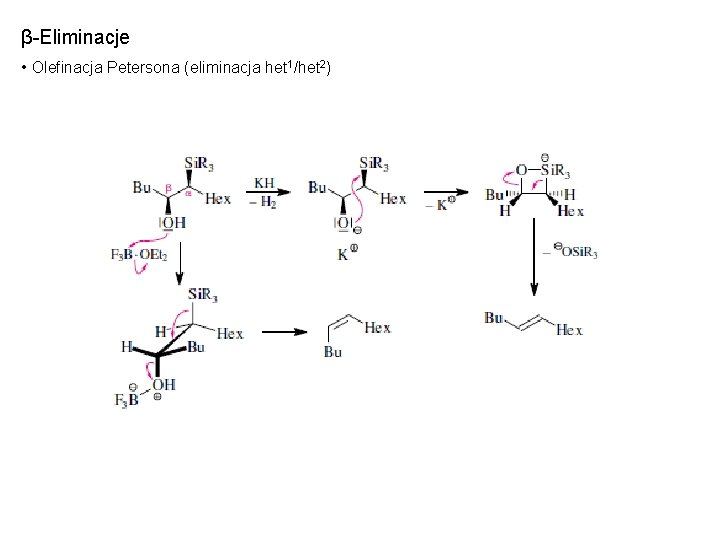
β-Eliminacje • Olefinacja Petersona (eliminacja het 1/het 2)


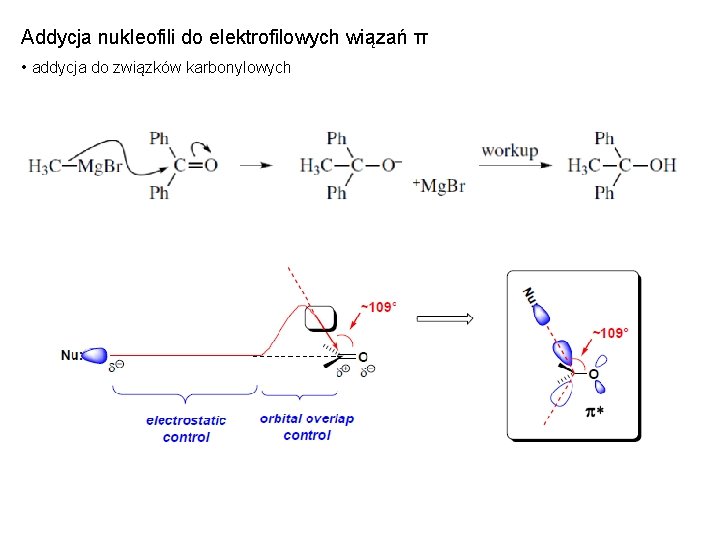
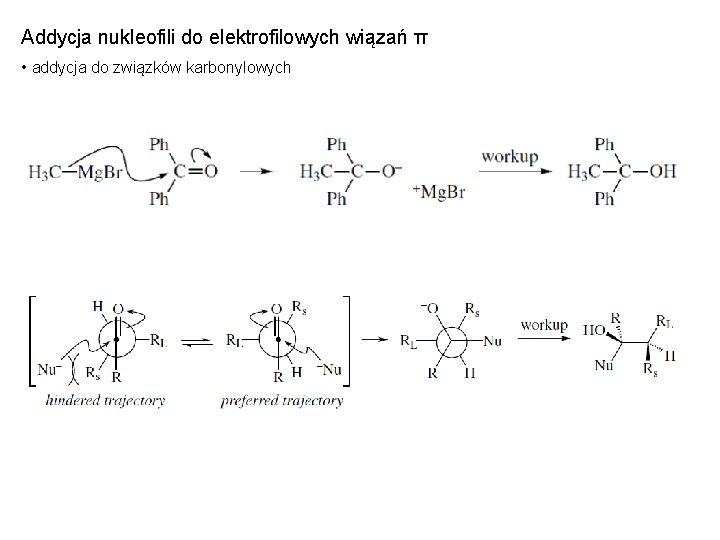
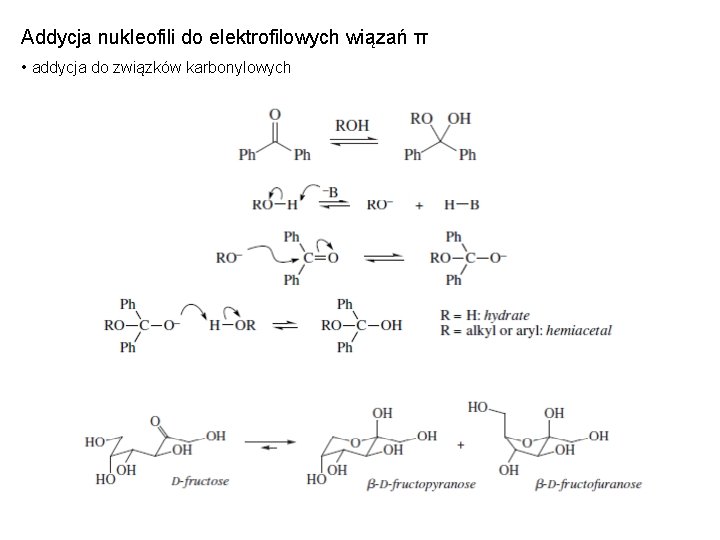
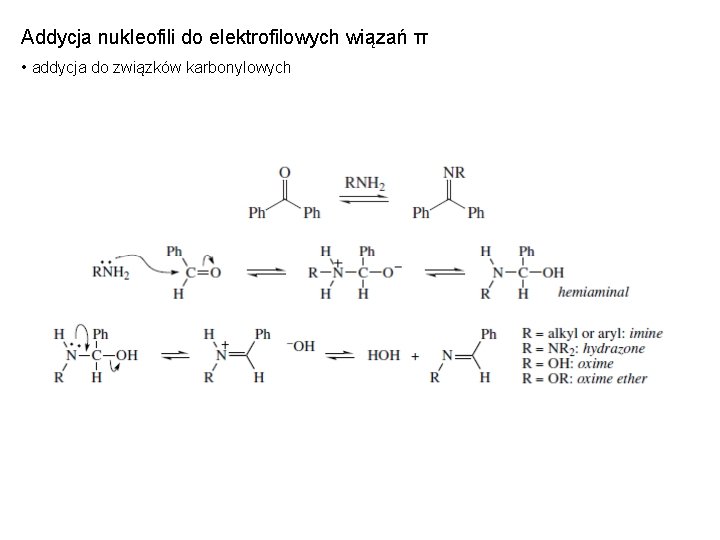
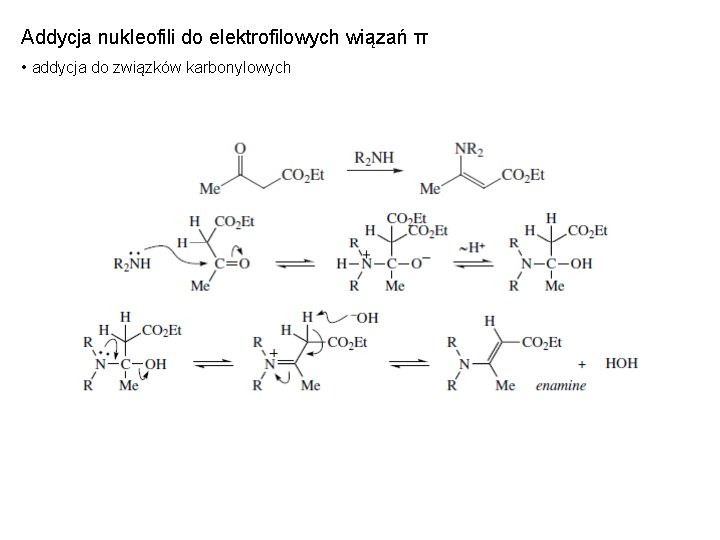
Addycja nukleofili do elektrofilowych wiązań π • addycja do związków karbonylowych

Addycja nukleofili do elektrofilowych wiązań π • addycja do związków karbonylowych

Addycja nukleofili do elektrofilowych wiązań π • addycja do związków karbonylowych

Addycja nukleofili do elektrofilowych wiązań π • addycja do związków karbonylowych

Addycja nukleofili do elektrofilowych wiązań π • addycja do związków karbonylowych

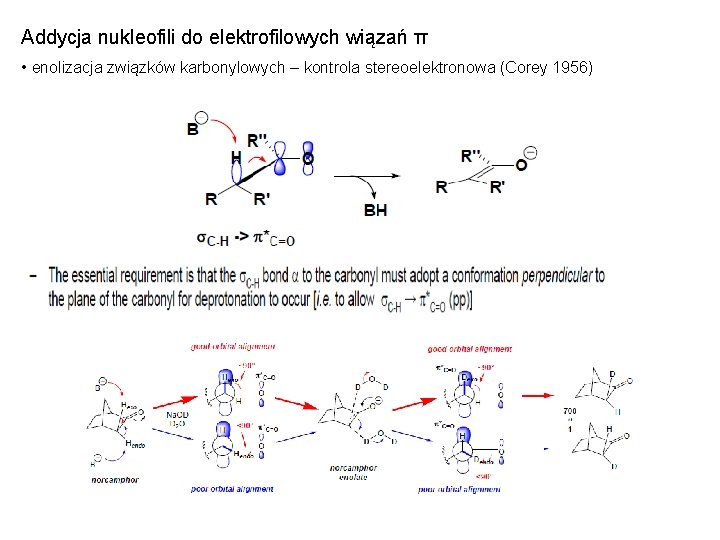
Addycja nukleofili do elektrofilowych wiązań π • enolizacja związków karbonylowych – kontrola stereoelektronowa (Corey 1956)

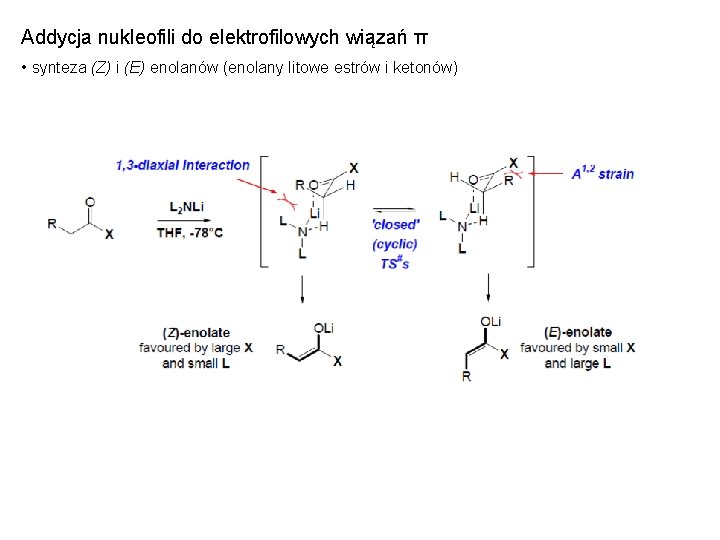
Addycja nukleofili do elektrofilowych wiązań π • synteza (Z) i (E) enolanów (enolany litowe estrów i ketonów)

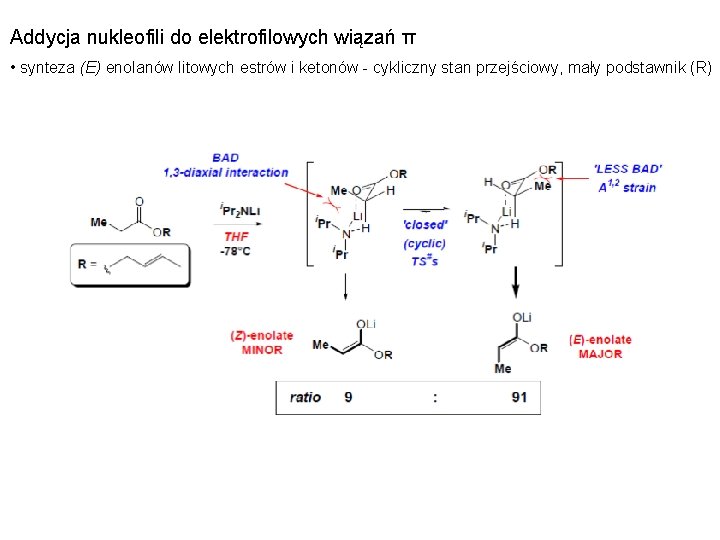
Addycja nukleofili do elektrofilowych wiązań π • synteza (E) enolanów litowych estrów i ketonów - cykliczny stan przejściowy, mały podstawnik (R)

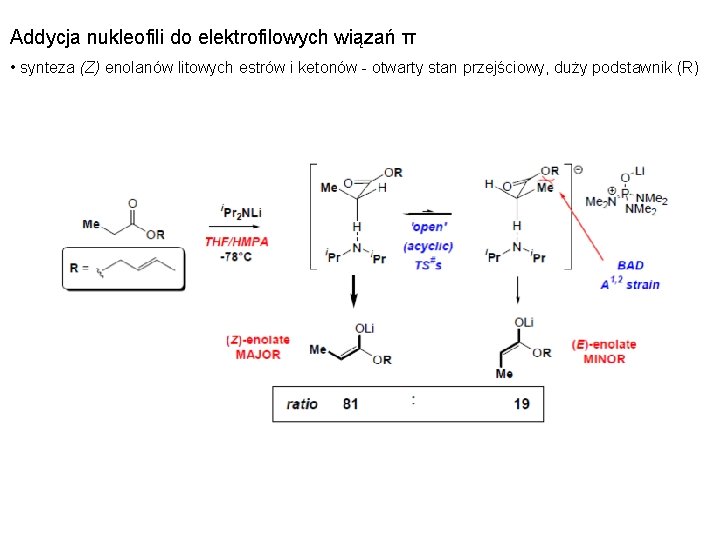
Addycja nukleofili do elektrofilowych wiązań π • synteza (Z) enolanów litowych estrów i ketonów - otwarty stan przejściowy, duży podstawnik (R)

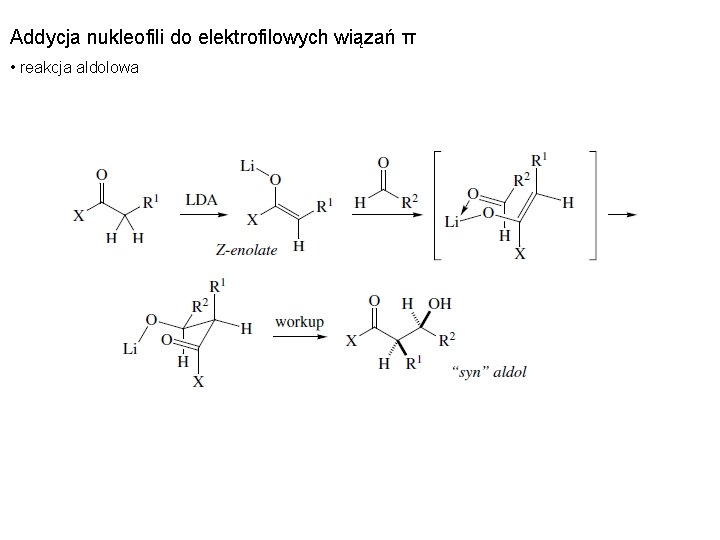
Addycja nukleofili do elektrofilowych wiązań π • reakcja aldolowa

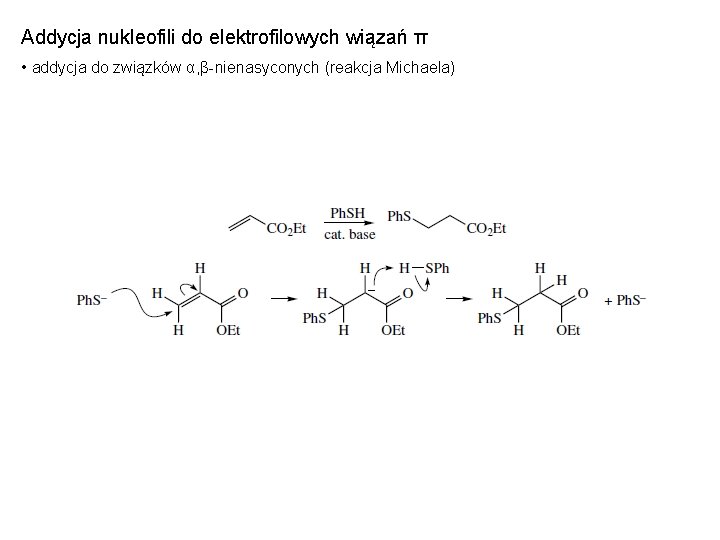
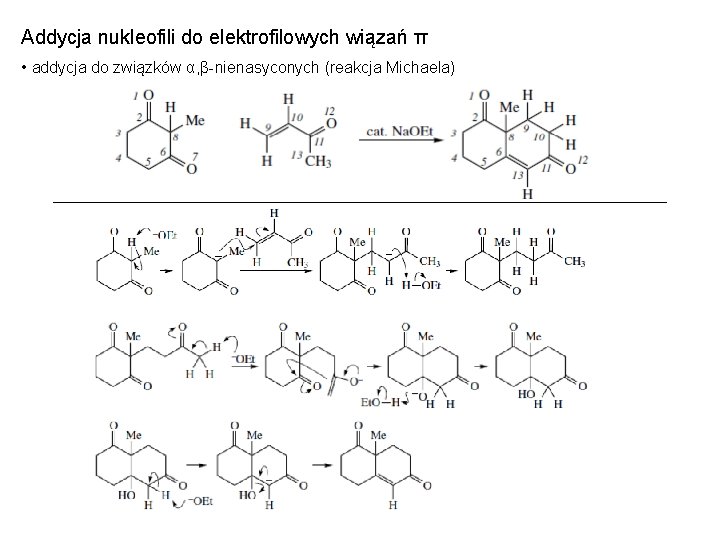
Addycja nukleofili do elektrofilowych wiązań π • addycja do związków α, β-nienasyconych (reakcja Michaela)

Addycja nukleofili do elektrofilowych wiązań π • addycja do związków α, β-nienasyconych (reakcja Michaela)

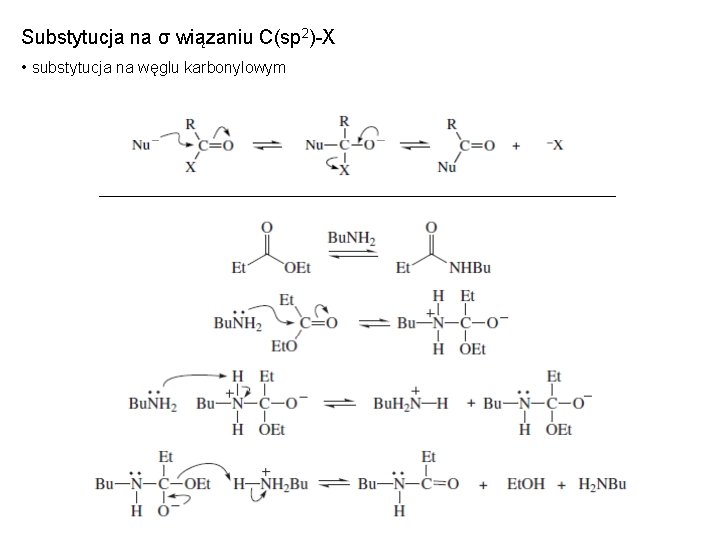
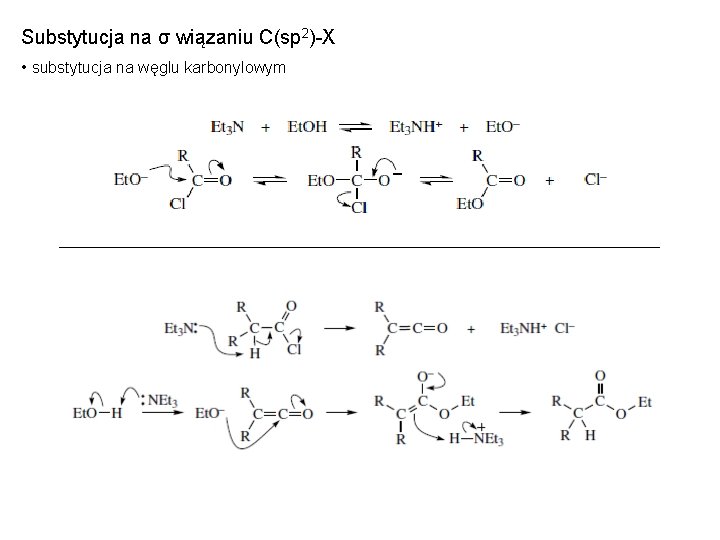
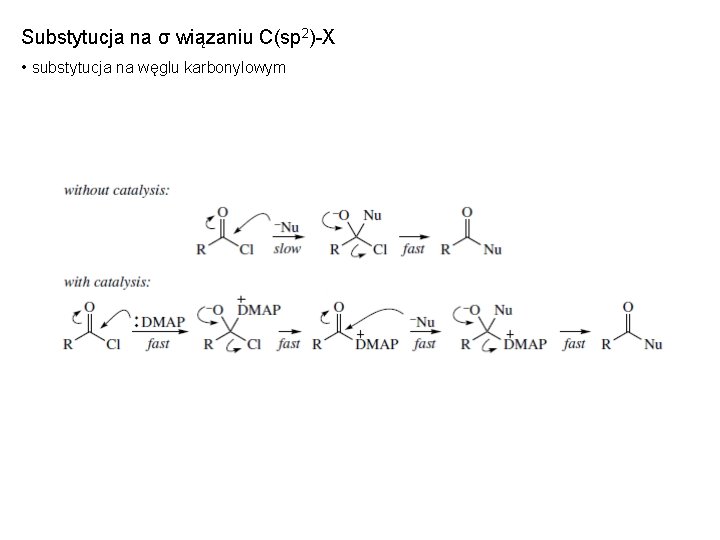
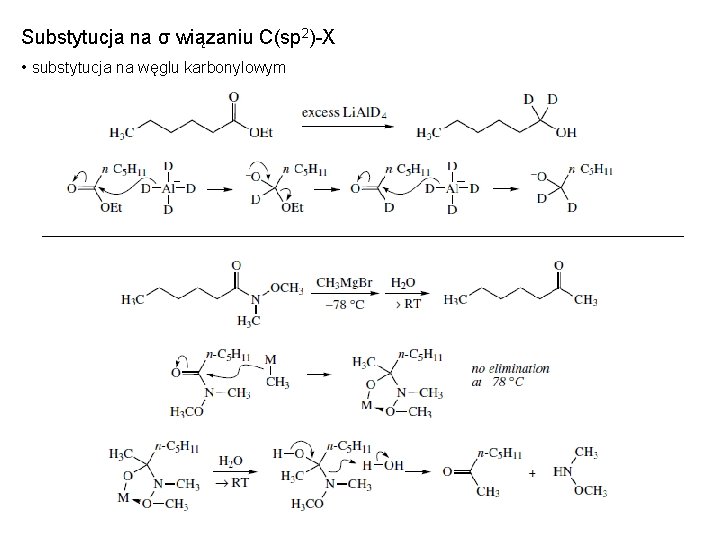
Substytucja na σ wiązaniu C(sp 2)-X • substytucja na węglu karbonylowym

Substytucja na σ wiązaniu C(sp 2)-X • substytucja na węglu karbonylowym

Substytucja na σ wiązaniu C(sp 2)-X • substytucja na węglu karbonylowym

Substytucja na σ wiązaniu C(sp 2)-X • substytucja na węglu karbonylowym

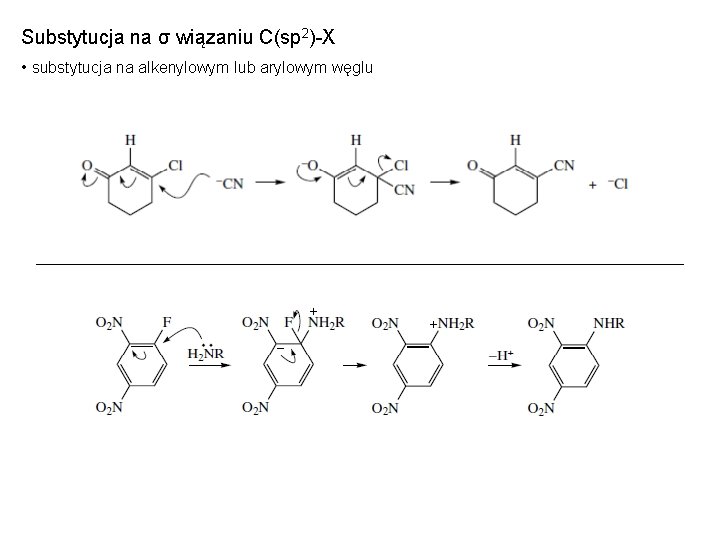
Substytucja na σ wiązaniu C(sp 2)-X • substytucja na alkenylowym lub arylowym węglu

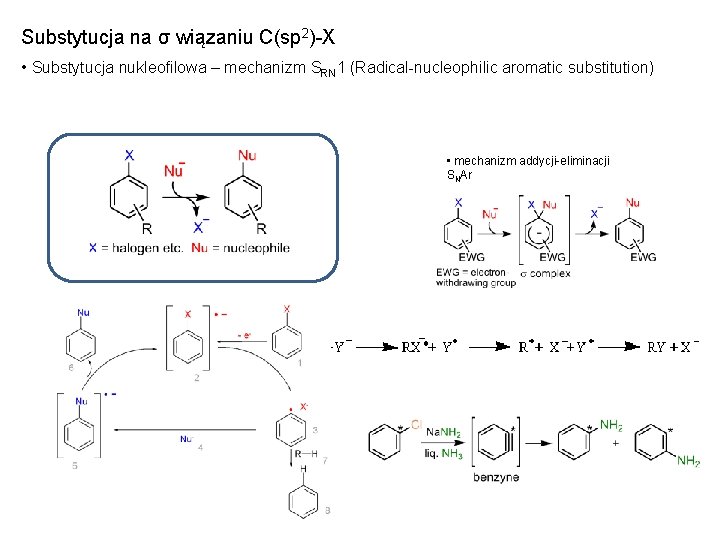
Substytucja na σ wiązaniu C(sp 2)-X • Substytucja nukleofilowa – mechanizm SRN 1 (Radical-nucleophilic aromatic substitution) • mechanizm addycji-eliminacji SNAr

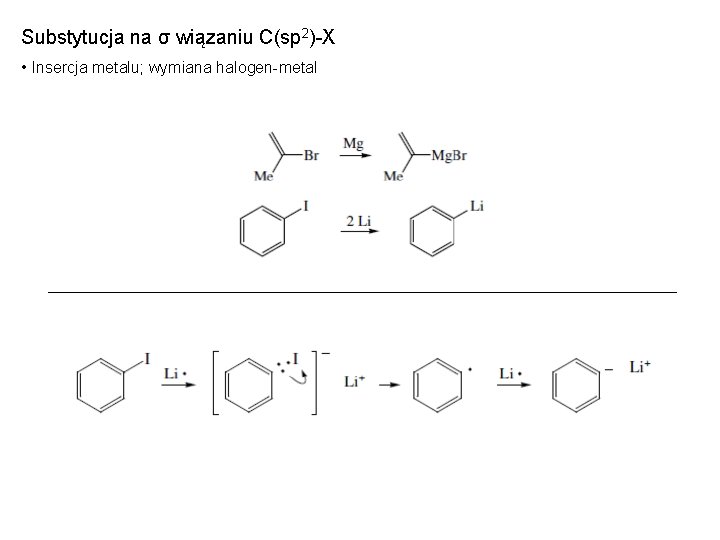
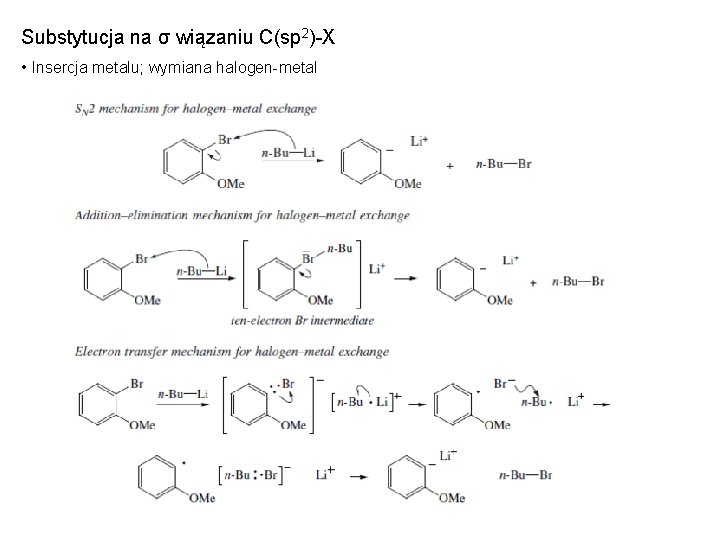
Substytucja na σ wiązaniu C(sp 2)-X • Insercja metalu; wymiana halogen-metal

Substytucja na σ wiązaniu C(sp 2)-X • Insercja metalu; wymiana halogen-metal

Substytucja i eliminacja na σ wiązaniu C(sp 3)-X • Mechanizm SN 2 • Mechanizm E 2 lub E 1 CB • Substytucja mechanizm SRN 1 • Mechanizm eliminacji-addycji • Mechanizm z przeniesieniem pojedynczego elektronu • Insercji metalu i wymiany halogen-metal • α-eliminacja prowadząca do karbenów

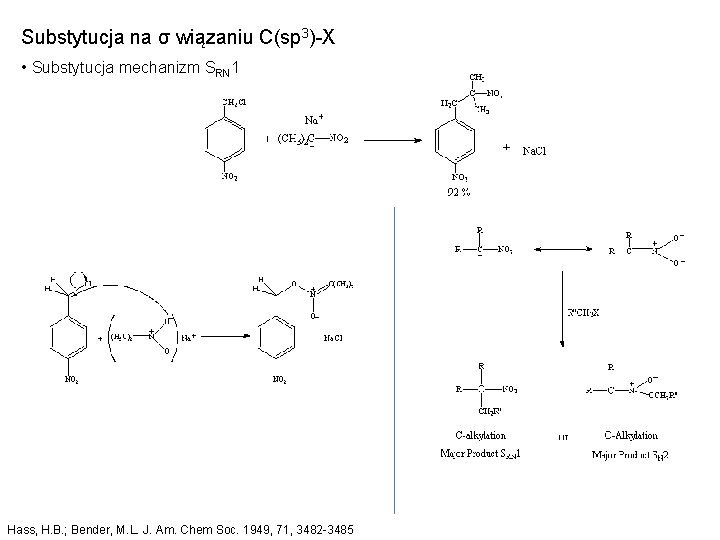
Substytucja na σ wiązaniu C(sp 3)-X • Substytucja mechanizm SRN 1 Hass, H. B. ; Bender, M. L. J. Am. Chem Soc. 1949, 71, 3482 -3485

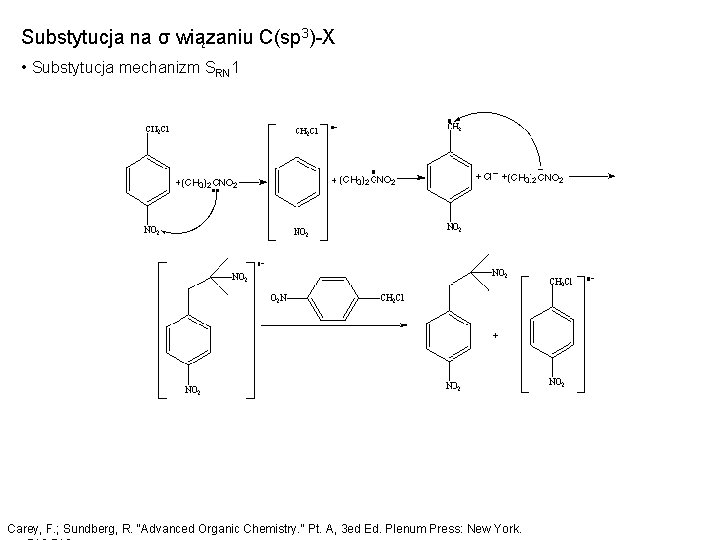
Substytucja na σ wiązaniu C(sp 3)-X • Substytucja mechanizm SRN 1 Carey, F. ; Sundberg, R. "Advanced Organic Chemistry. " Pt. A, 3 ed Ed. Plenum Press: New York.

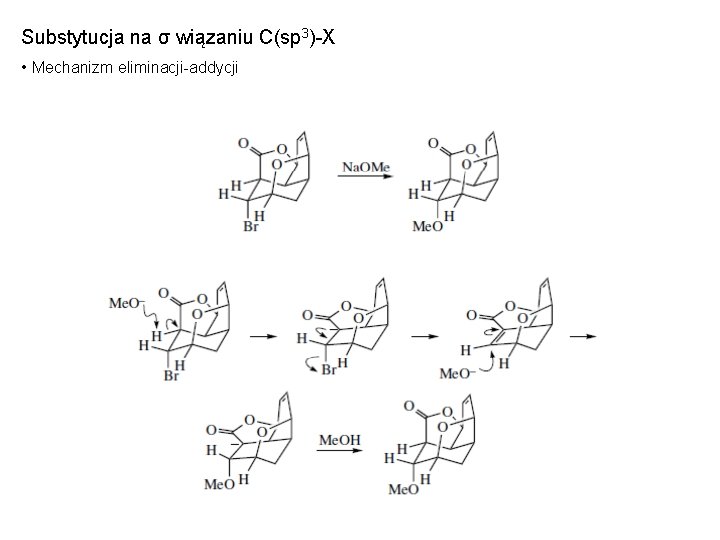
Substytucja na σ wiązaniu C(sp 3)-X • Mechanizm eliminacji-addycji

Substytucja na σ wiązaniu C(sp 3)-X • mechanizm z przeniesieniem pojedynczego elektronu

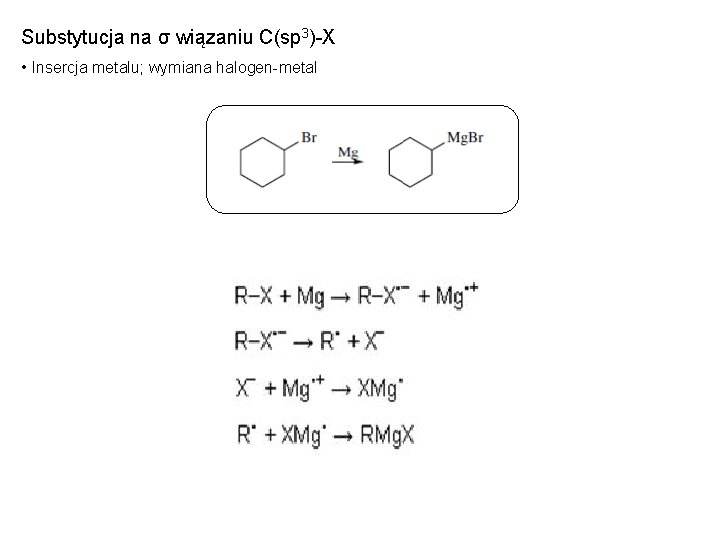
Substytucja na σ wiązaniu C(sp 3)-X • Insercja metalu; wymiana halogen-metal

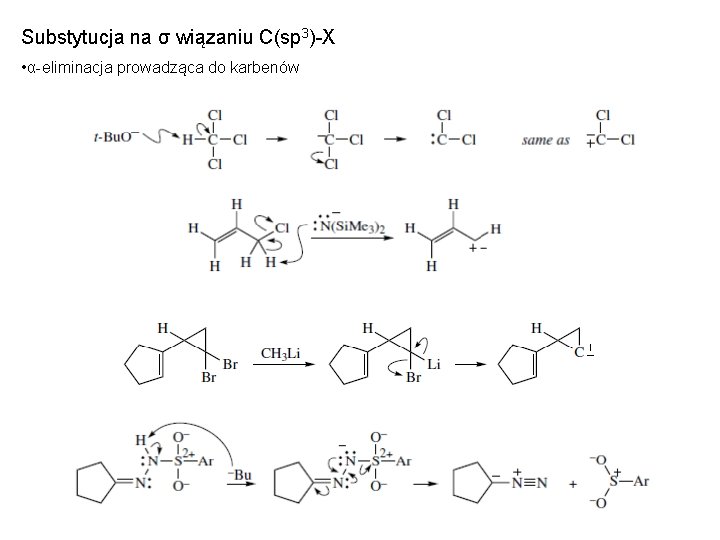
Substytucja na σ wiązaniu C(sp 3)-X • α-eliminacja prowadząca do karbenów

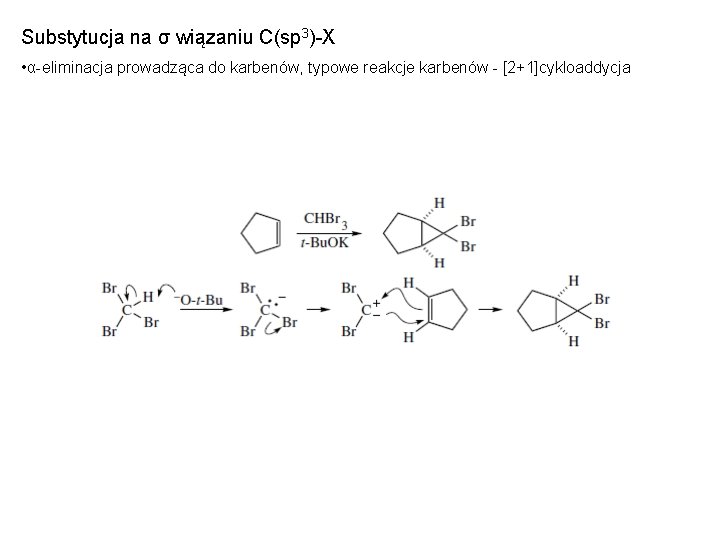
Substytucja na σ wiązaniu C(sp 3)-X • α-eliminacja prowadząca do karbenów, typowe reakcje karbenów - [2+1]cykloaddycja

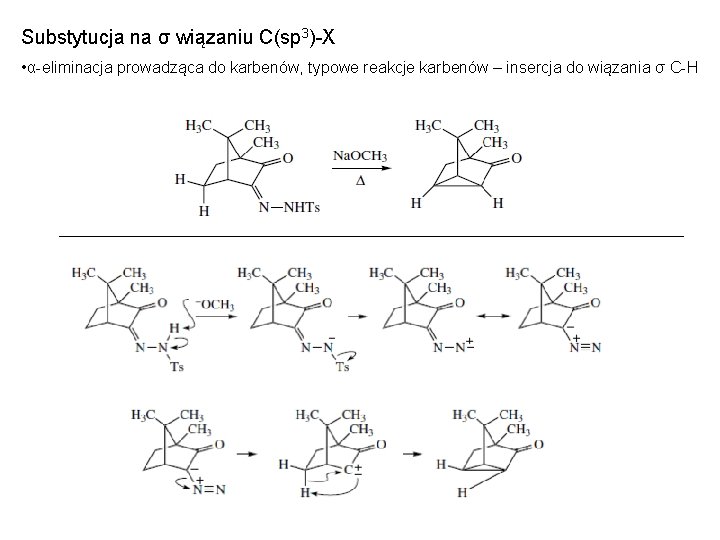
Substytucja na σ wiązaniu C(sp 3)-X • α-eliminacja prowadząca do karbenów, typowe reakcje karbenów – insercja do wiązania σ C-H

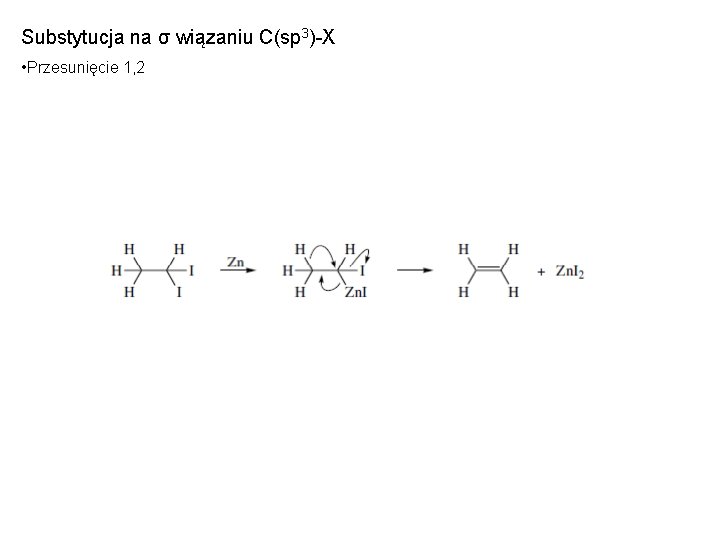
Substytucja na σ wiązaniu C(sp 3)-X • Przesunięcie 1, 2

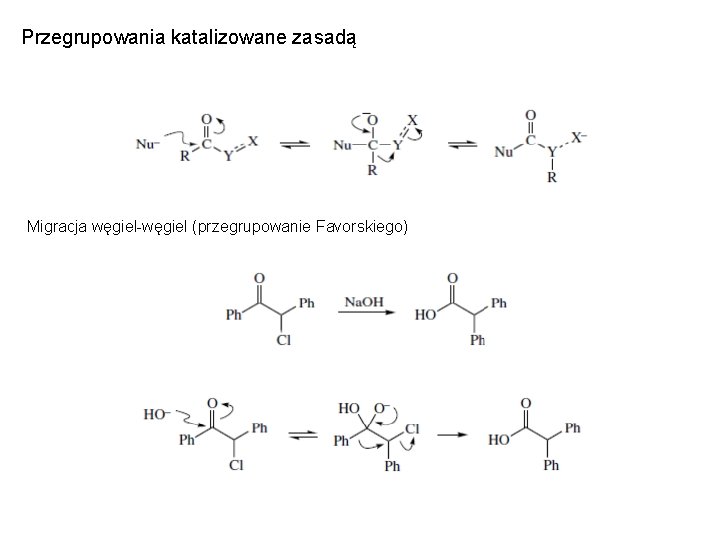
Przegrupowania katalizowane zasadą Migracja węgiel-węgiel (przegrupowanie Favorskiego)

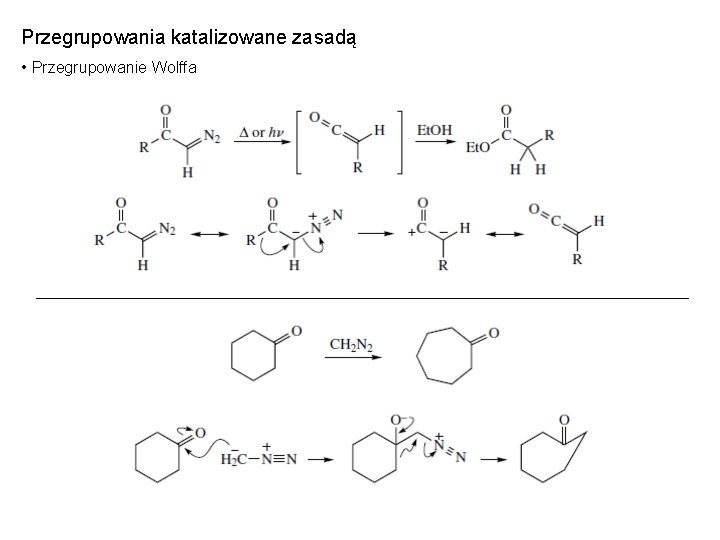
Przegrupowania katalizowane zasadą • Przegrupowanie Wolffa

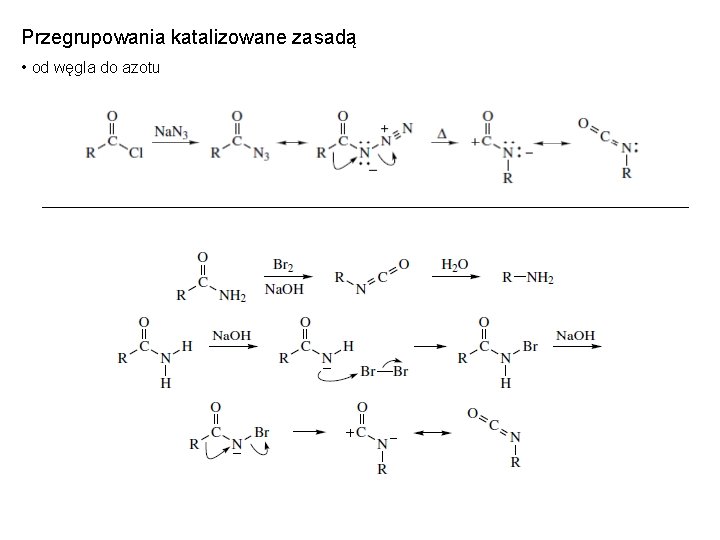
Przegrupowania katalizowane zasadą • od węgla do azotu

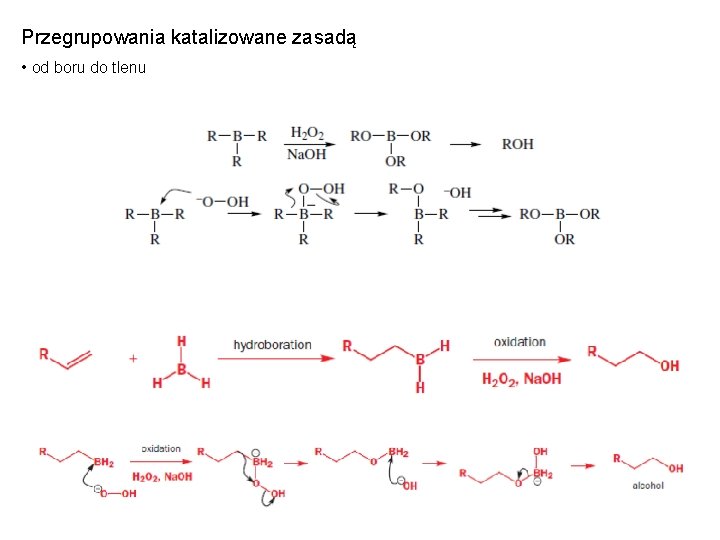
Przegrupowania katalizowane zasadą • od boru do tlenu

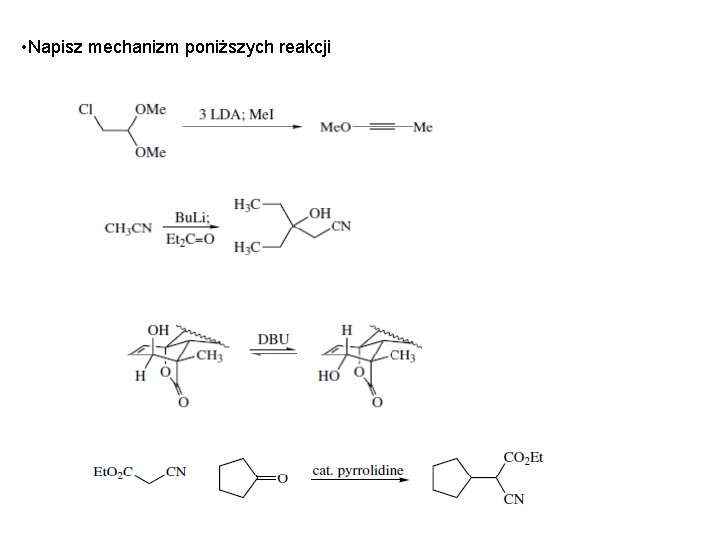
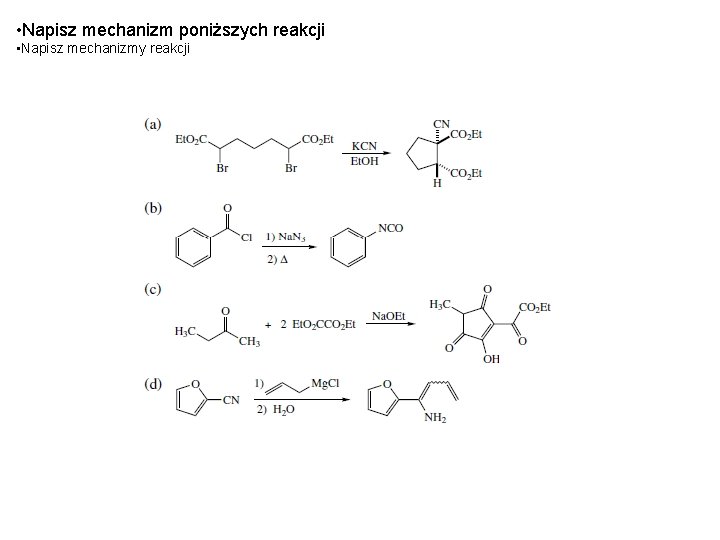
• Napisz mechanizm poniższych reakcji

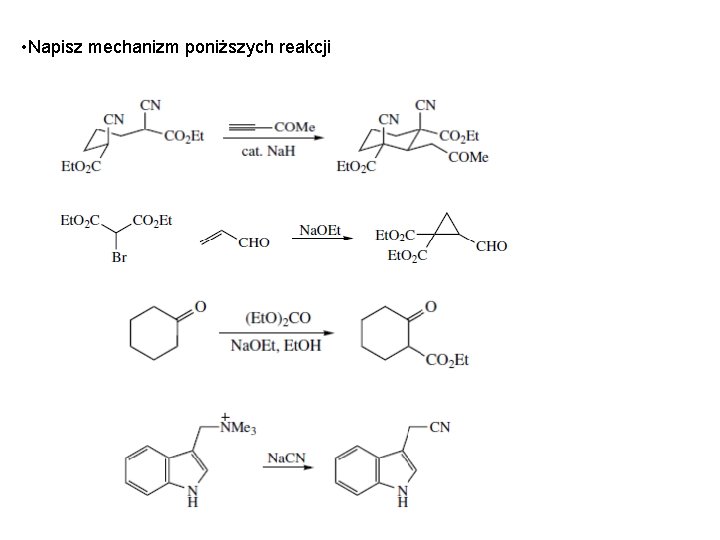
• Napisz mechanizm poniższych reakcji

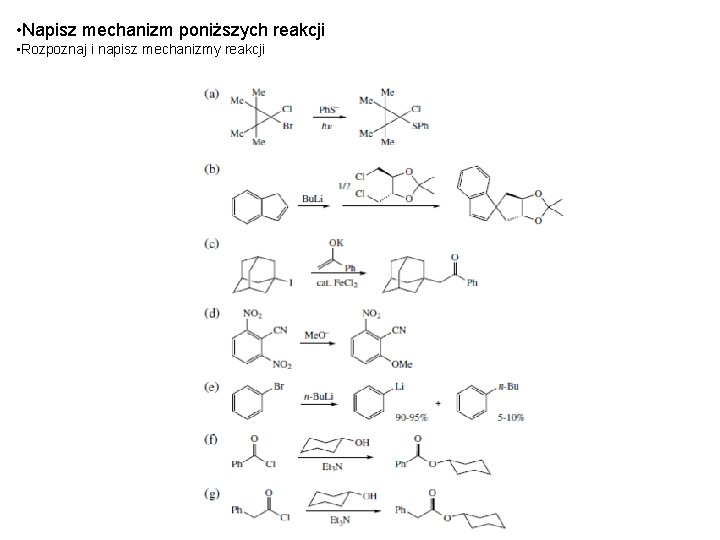
• Napisz mechanizm poniższych reakcji • Rozpoznaj i napisz mechanizmy reakcji

• Napisz mechanizm poniższych reakcji • Napisz mechanizmy reakcji