Mecanismos de Reaes Orgnicas 2 Aula on line











- Slides: 51

Mecanismos de Reações Orgânicas 2 Aula on line 27/08/2020

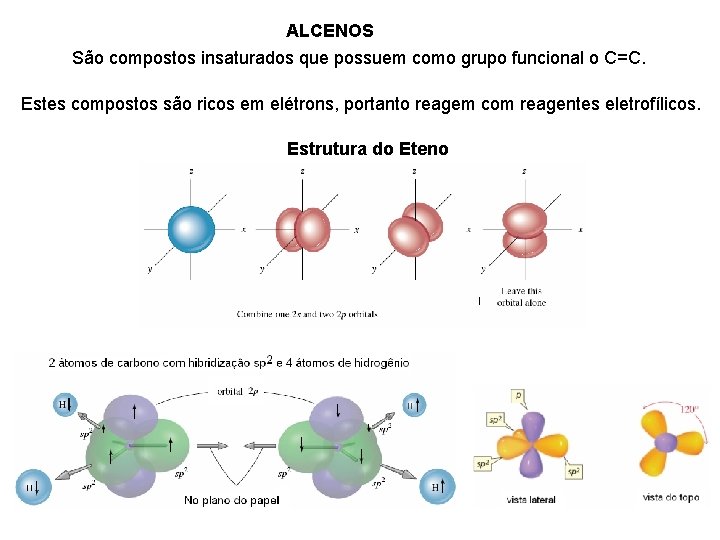
ALCENOS São compostos insaturados que possuem como grupo funcional o C=C. Estes compostos são ricos em elétrons, portanto reagem com reagentes eletrofílicos. Estrutura do Eteno

Observações: ØA Formação do Eteno (etileno) consiste na combinação dos orbitais sp 2 do carbono com os orbitais 1 s dos hidrogênios. ØO carbono com hibridização sp 2 possui 33% de caráter s e 66% de caráter p. Entre as ligações sigma ( ) e pi ( ), qual é a mais forte? A ligação sigma ( ) é mais forte (108 kcal/mol) do que a ligação pi ( , 65 kcal/mol), porque a sobreposição frontal dos orbitais gera uma ligação mais forte do que a sobreposição lateral dos orbitais.

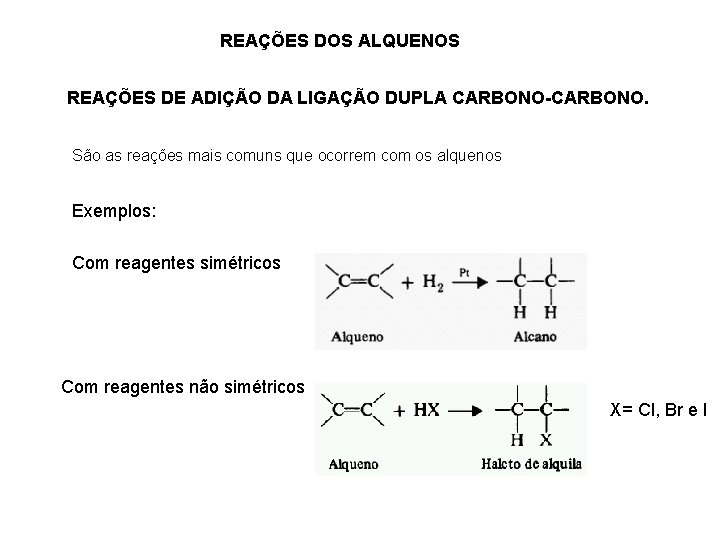
REAÇÕES DOS ALQUENOS REAÇÕES DE ADIÇÃO DA LIGAÇÃO DUPLA CARBONO-CARBONO. São as reações mais comuns que ocorrem com os alquenos Exemplos: Com reagentes simétricos Com reagentes não simétricos X= Cl, Br e I

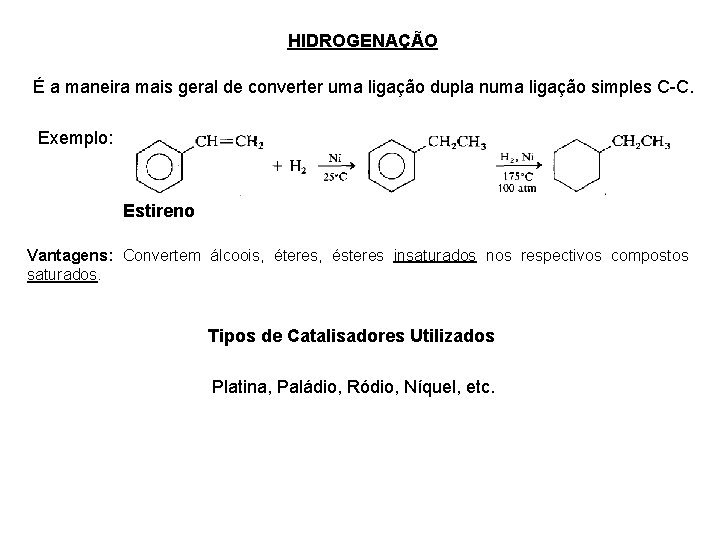
HIDROGENAÇÃO É a maneira mais geral de converter uma ligação dupla numa ligação simples C-C. Exemplo: Estireno Vantagens: Convertem álcoois, éteres, ésteres insaturados nos respectivos compostos saturados. Tipos de Catalisadores Utilizados Platina, Paládio, Ródio, Níquel, etc.

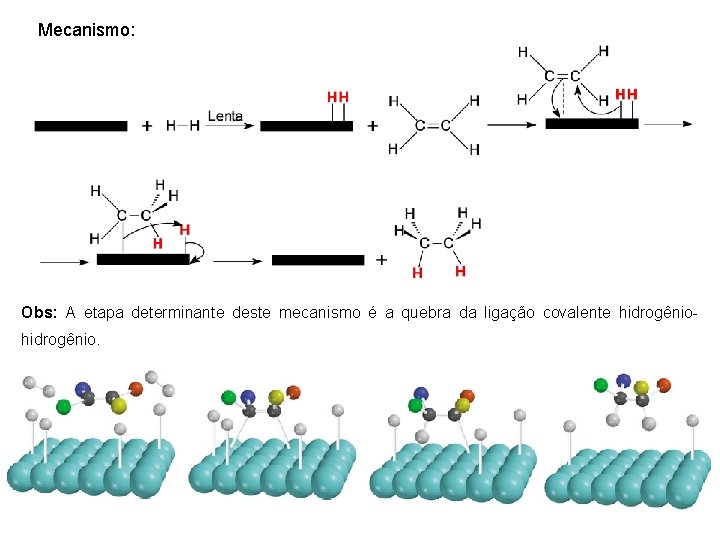
Mecanismo: Obs: A etapa determinante deste mecanismo é a quebra da ligação covalente hidrogênio.

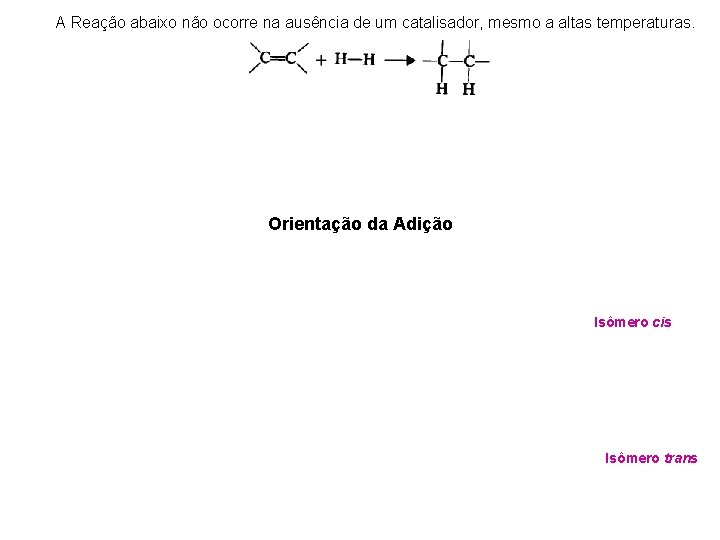
A Reação abaixo não ocorre na ausência de um catalisador, mesmo a altas temperaturas. Orientação da Adição Isômero cis Isômero trans

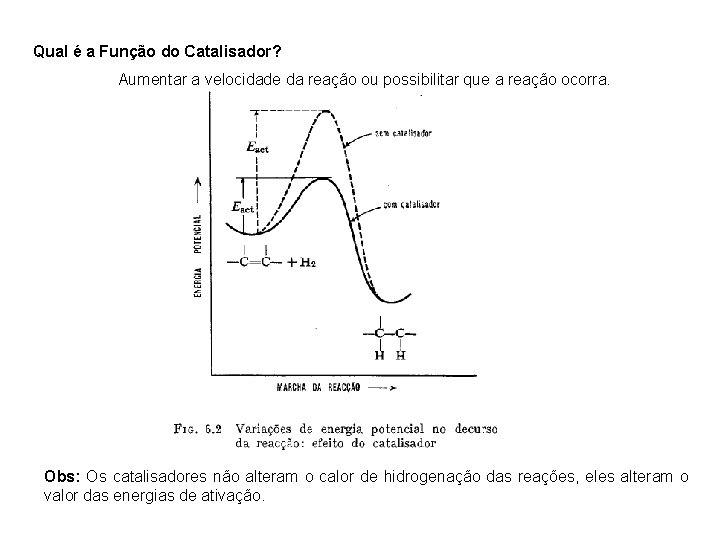
Qual é a Função do Catalisador? Aumentar a velocidade da reação ou possibilitar que a reação ocorra. Obs: Os catalisadores não alteram o calor de hidrogenação das reações, eles alteram o valor das energias de ativação.

Diferença de H entre cis e trans Efeito Estérico Diferença de H entre 1 -buteno e 2 -buteno Quanto mais substituído for à ligação dupla maior é a estabilidade do alqueno. Isto se deve ao efeito eletro-doador (indutivo) e as interações de orbital (hiperconjugações) dos grupos alquila que estabilizam a molécula, já que os carbonos sp 2 são mais eletronegativos que os sp 3. Porque?

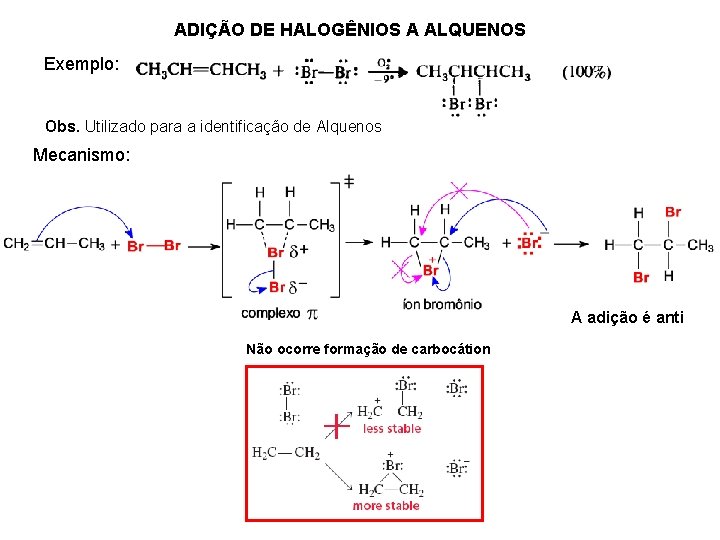
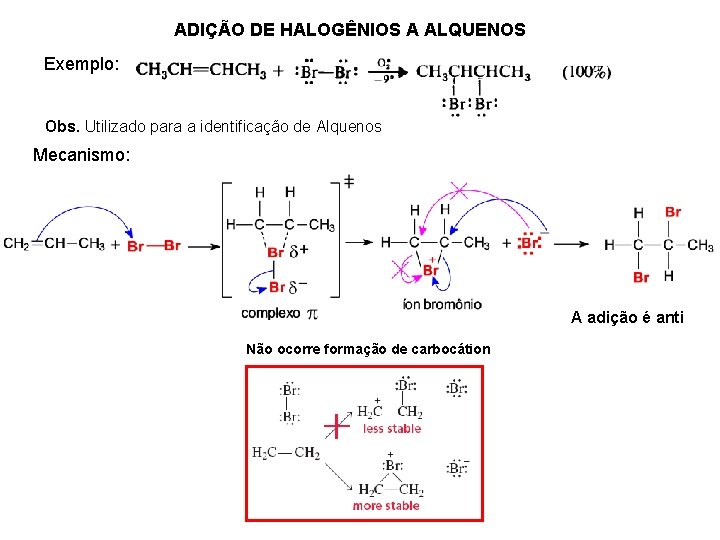
ADIÇÃO DE HALOGÊNIOS A ALQUENOS Exemplo: Obs. Utilizado para a identificação de Alquenos Mecanismo: A adição é anti Não ocorre formação de carbocátion

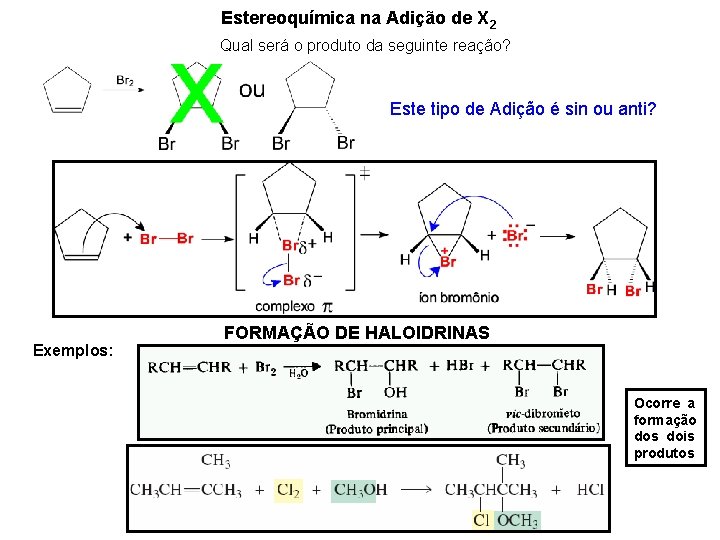
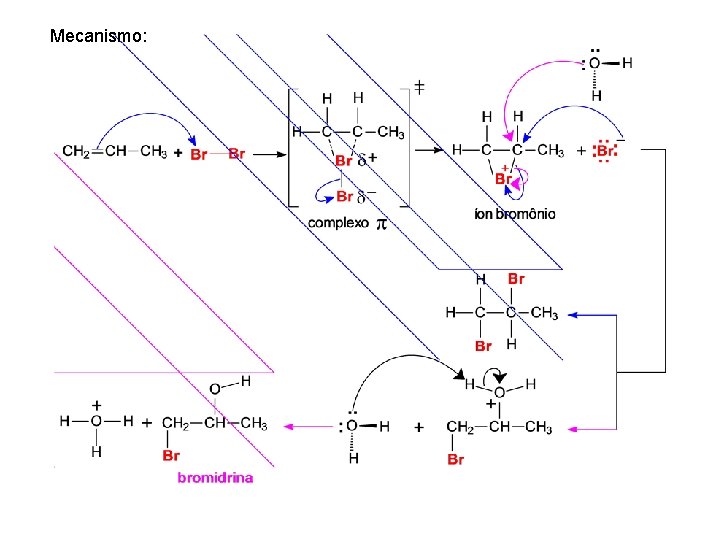
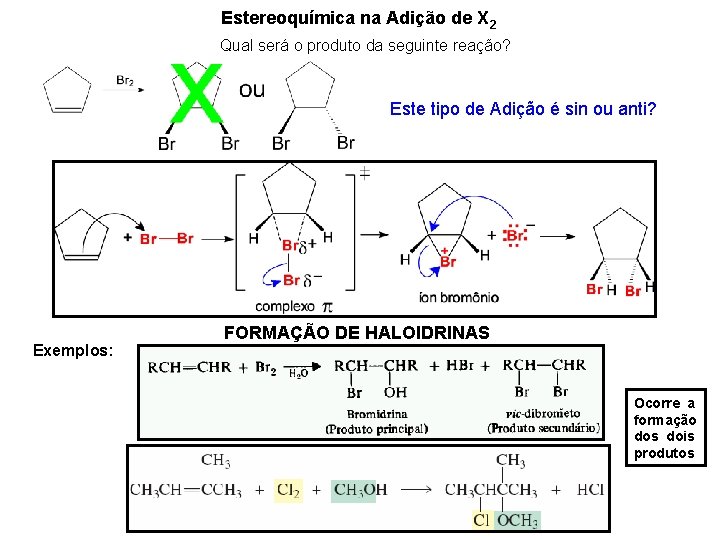
Estereoquímica na Adição de X 2 Qual será o produto da seguinte reação? Este tipo de Adição é sin ou anti? Exemplos: FORMAÇÃO DE HALOIDRINAS Ocorre a formação dos dois produtos

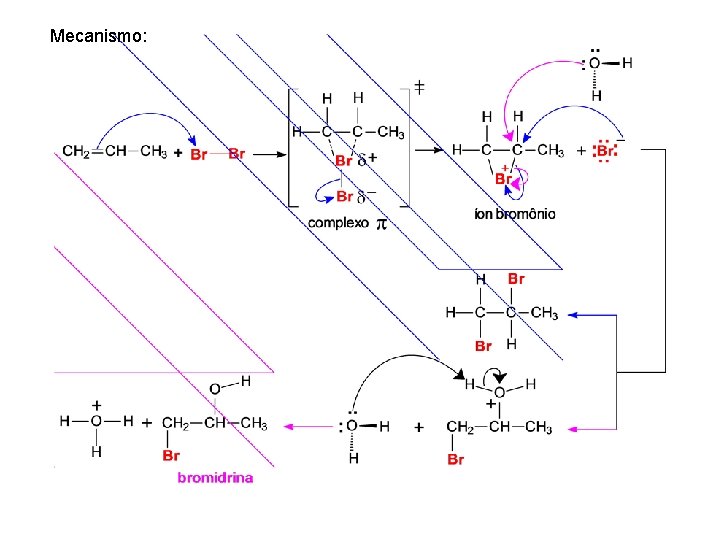
Mecanismo:

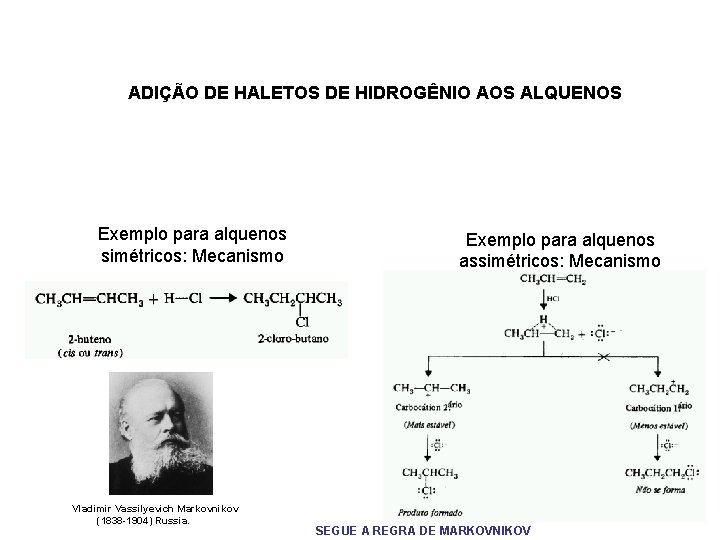
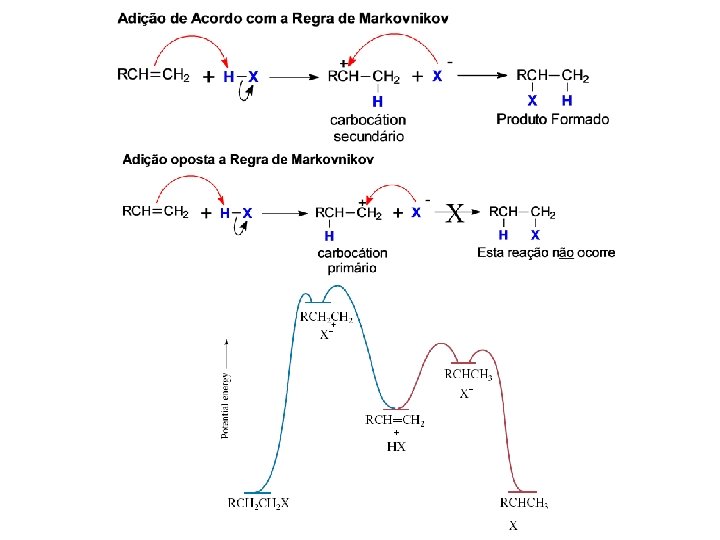
ADIÇÃO DE HALETOS DE HIDROGÊNIO AOS ALQUENOS Exemplo para alquenos simétricos: Mecanismo Vladimir Vassilyevich Markovnikov (1838 -1904) Russia. Exemplo para alquenos assimétricos: Mecanismo SEGUE A REGRA DE MARKOVNIKOV


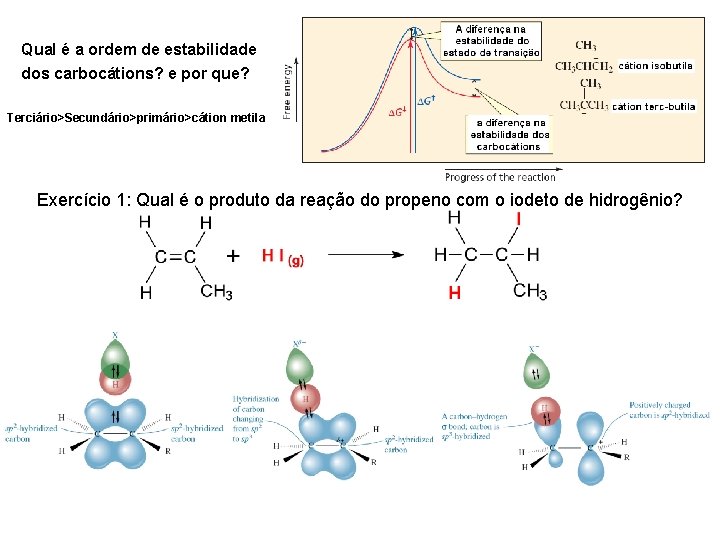
Qual é a ordem de estabilidade dos carbocátions? e por que? Terciário>Secundário>primário>cátion metila Exercício 1: Qual é o produto da reação do propeno com o iodeto de hidrogênio?

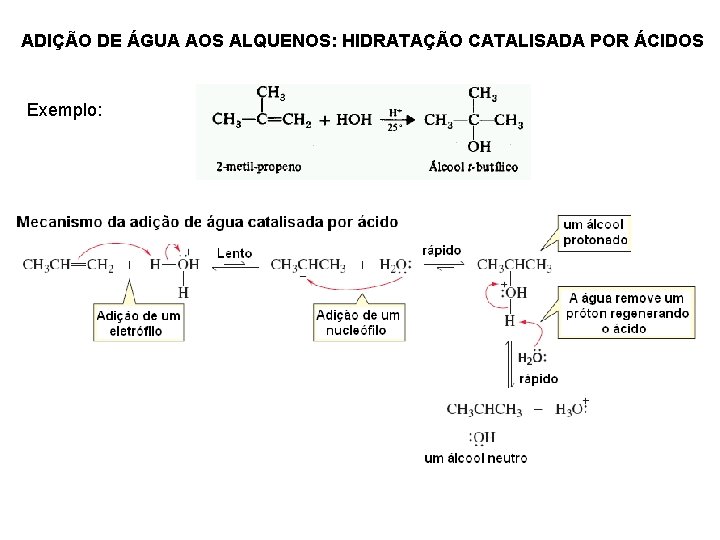
ADIÇÃO DE ÁGUA AOS ALQUENOS: HIDRATAÇÃO CATALISADA POR ÁCIDOS Exemplo:

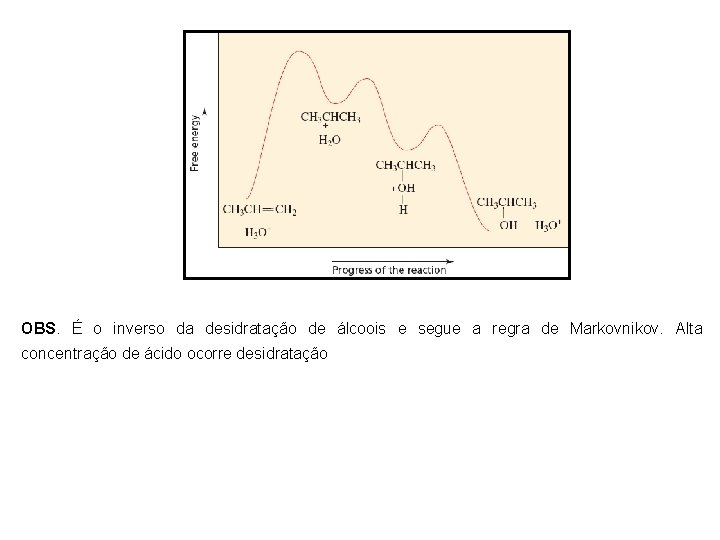
OBS. É o inverso da desidratação de álcoois e segue a regra de Markovnikov. Alta concentração de ácido ocorre desidratação

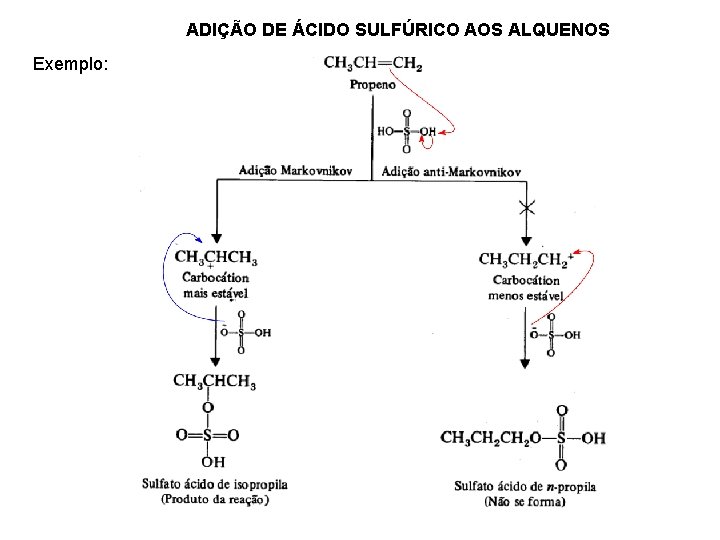
ADIÇÃO DE ÁCIDO SULFÚRICO AOS ALQUENOS Exemplo: Segue a regra de Markovnikov

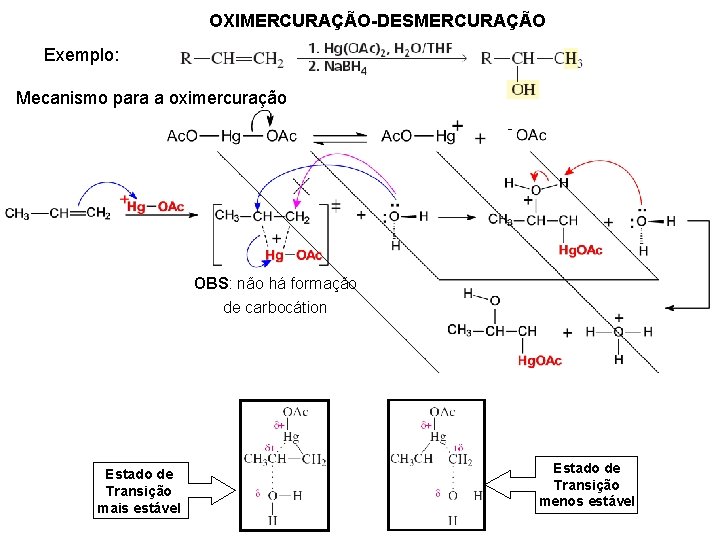
OXIMERCURAÇÃO-DESMERCURAÇÃO Exemplo: Mecanismo para a oximercuração OBS: não há formação de carbocátion Estado de Transição mais estável Estado de Transição menos estável

Mecanismo da Redução do Mercúrio - Desmercuração Vantagem: Durante a reação de Oximercuração-Desmercuração não ocorre rearranjos.

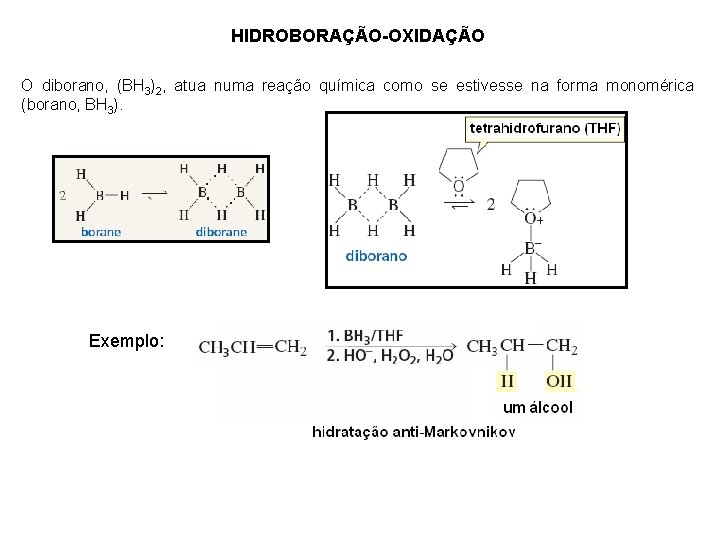
HIDROBORAÇÃO-OXIDAÇÃO O diborano, (BH 3)2, atua numa reação química como se estivesse na forma monomérica (borano, BH 3). Exemplo:

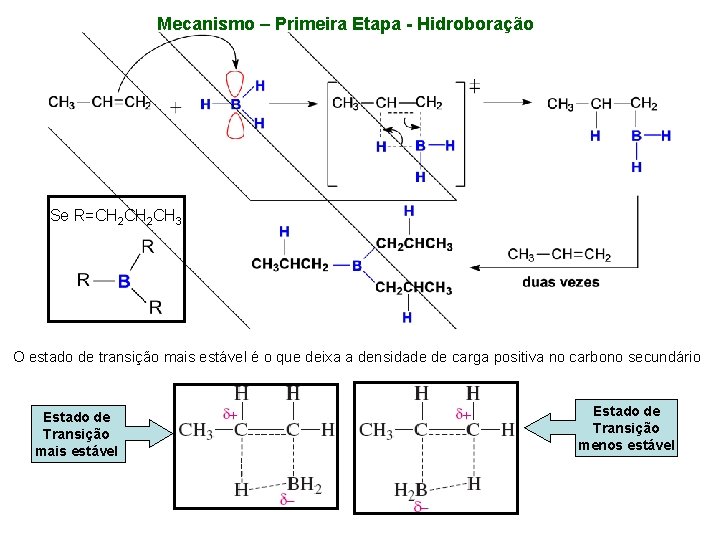
Mecanismo – Primeira Etapa - Hidroboração Se R=CH 2 CH 3 O estado de transição mais estável é o que deixa a densidade de carga positiva no carbono secundário Estado de Transição mais estável Estado de Transição menos estável

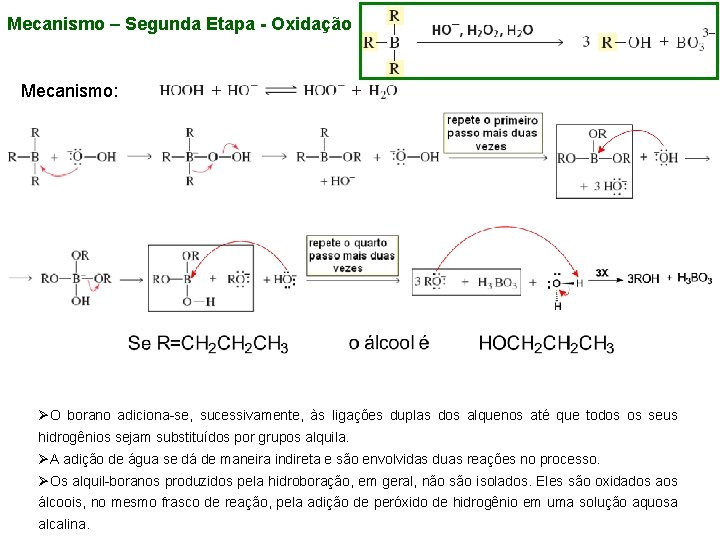
Mecanismo – Segunda Etapa - Oxidação Mecanismo: ØO borano adiciona-se, sucessivamente, às ligações duplas dos alquenos até que todos os seus hidrogênios sejam substituídos por grupos alquila. ØA adição de água se dá de maneira indireta e são envolvidas duas reações no processo. ØOs alquil-boranos produzidos pela hidroboração, em geral, não são isolados. Eles são oxidados aos álcoois, no mesmo frasco de reação, pela adição de peróxido de hidrogênio em uma solução aquosa alcalina.

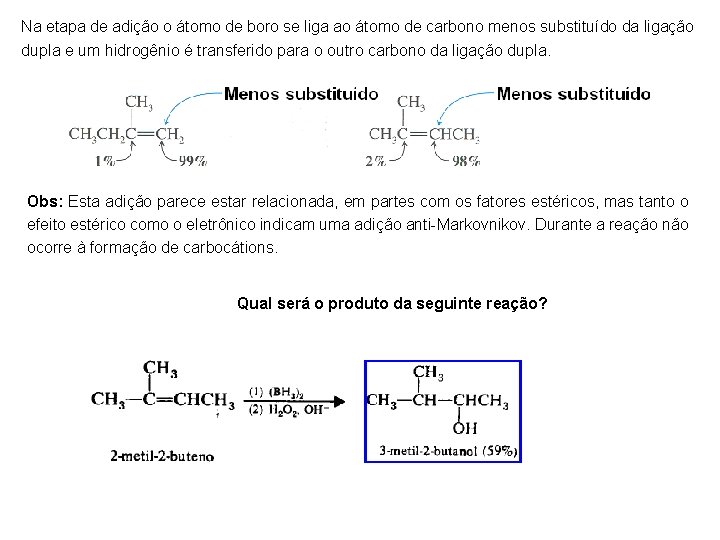
Na etapa de adição o átomo de boro se liga ao átomo de carbono menos substituído da ligação dupla e um hidrogênio é transferido para o outro carbono da ligação dupla. Obs: Esta adição parece estar relacionada, em partes com os fatores estéricos, mas tanto o efeito estérico como o eletrônico indicam uma adição anti-Markovnikov. Durante a reação não ocorre à formação de carbocátions. Qual será o produto da seguinte reação?

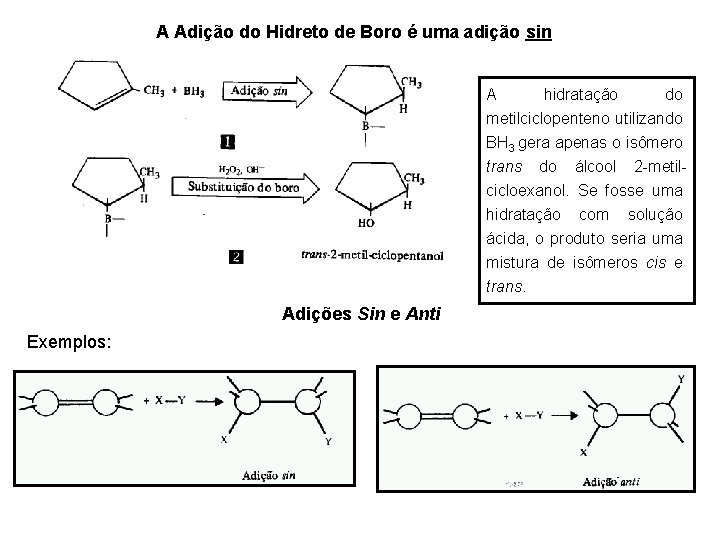
A Adição do Hidreto de Boro é uma adição sin A hidratação do metilciclopenteno utilizando BH 3 gera apenas o isômero trans do álcool 2 -metilcicloexanol. Se fosse uma hidratação com solução ácida, o produto seria uma mistura de isômeros cis e trans. Adições Sin e Anti Exemplos:

ADIÇÃO DE HALOGÊNIOS A ALQUENOS Exemplo: Obs. Utilizado para a identificação de Alquenos Mecanismo: A adição é anti Não ocorre formação de carbocátion

Estereoquímica na Adição de X 2 Qual será o produto da seguinte reação? Este tipo de Adição é sin ou anti? Exemplos: FORMAÇÃO DE HALOIDRINAS Ocorre a formação dos dois produtos

Mecanismo:

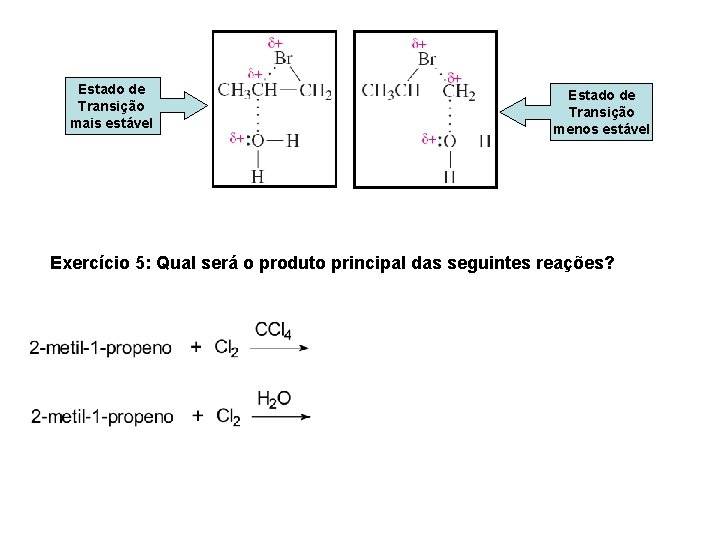
Estado de Transição mais estável Estado de Transição menos estável Exercício 5: Qual será o produto principal das seguintes reações?

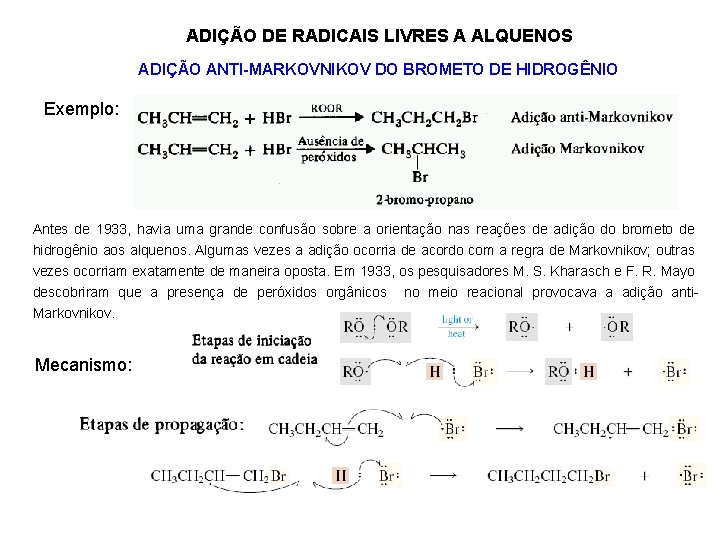
ADIÇÃO DE RADICAIS LIVRES A ALQUENOS ADIÇÃO ANTI-MARKOVNIKOV DO BROMETO DE HIDROGÊNIO Exemplo: Antes de 1933, havia uma grande confusão sobre a orientação nas reações de adição do brometo de hidrogênio aos alquenos. Algumas vezes a adição ocorria de acordo com a regra de Markovnikov; outras vezes ocorriam exatamente de maneira oposta. Em 1933, os pesquisadores M. S. Kharasch e F. R. Mayo descobriram que a presença de peróxidos orgânicos no meio reacional provocava a adição anti. Markovnikov. Mecanismo:

Observações: Ø A estabilidade dos radicais é semelhante à apresentada para os carbocátions. Ø Nas reações radicalares, representa-se apenas meia seta. Ø Na etapa inicial ocorre uma quebra homolítica da molécula do peróxido. Ø Na etapa de propagação ocorre a formação do radical mais estável. Não ocorre

ADIÇÃO DE RADICAIS LIVRES A ALQUENOS COM HCl e HI ADIÇÃO MARKOVNIKOV Somente o HBr gera uma adição Anti-Markovnikov. HCl e HI seguem a regra de Markovnikov. Estes últimos sofreriam reações endotérmicas. Portanto com HCl e HI a reação não é via radicalar.

TIPOS DE OXIDAÇÃO DOS ALQUENOS Ø Com superácidos (epoxidação) Ø Com KMn. O 4 Ø Com Os. O 4 (Tetróxido de Ósmio) Ø Com Ozônio O 3 (ozonização) A oxidação é a reação que aumenta o número de átomos de oxigênios na molécula inicial. EPOXIDAÇÃO DOS ALQUENOS Os epóxidos são éteres cíclicos com anéis de três membros. Pela nomenclatura da IUPAC, os epóxidos são denominados oxiranos. Mais comumente, no entanto, são chamados de óxidos de alquenos.

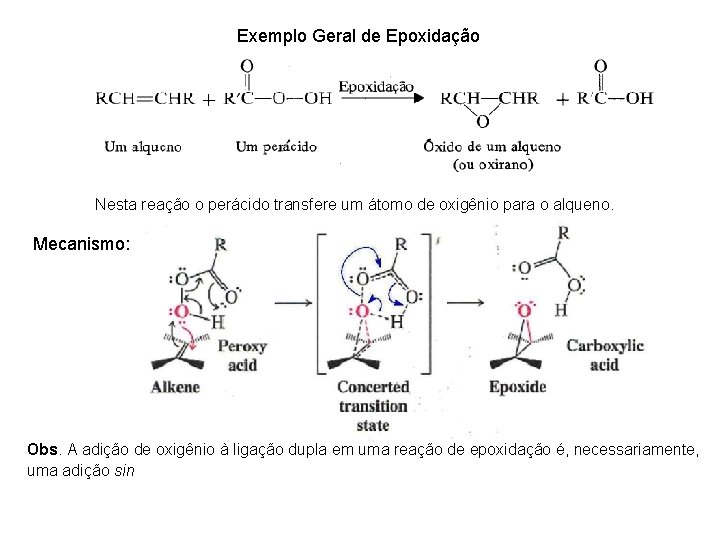
Exemplo Geral de Epoxidação Nesta reação o perácido transfere um átomo de oxigênio para o alqueno. Mecanismo: Obs. A adição de oxigênio à ligação dupla em uma reação de epoxidação é, necessariamente, uma adição sin

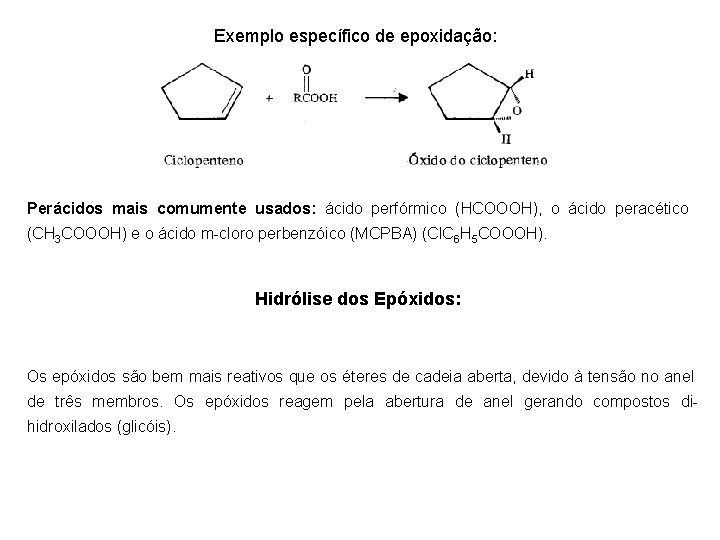
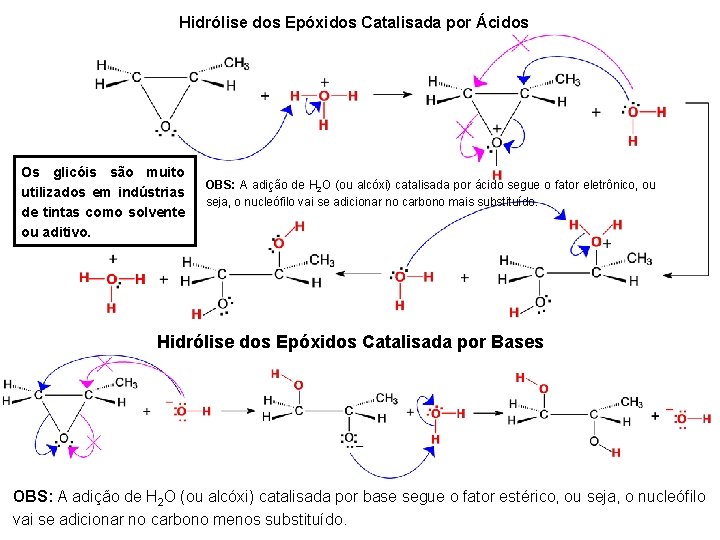
Exemplo específico de epoxidação: Perácidos mais comumente usados: ácido perfórmico (HCOOOH), o ácido peracético (CH 3 COOOH) e o ácido m-cloro perbenzóico (MCPBA) (Cl. C 6 H 5 COOOH). Hidrólise dos Epóxidos: Os epóxidos são bem mais reativos que os éteres de cadeia aberta, devido à tensão no anel de três membros. Os epóxidos reagem pela abertura de anel gerando compostos dihidroxilados (glicóis).

Hidrólise dos Epóxidos Catalisada por Ácidos Os glicóis são muito utilizados em indústrias de tintas como solvente ou aditivo. OBS: A adição de H 2 O (ou alcóxi) catalisada por ácido segue o fator eletrônico, ou seja, o nucleófilo vai se adicionar no carbono mais substituído. Hidrólise dos Epóxidos Catalisada por Bases OBS: A adição de H 2 O (ou alcóxi) catalisada por base segue o fator estérico, ou seja, o nucleófilo vai se adicionar no carbono menos substituído.

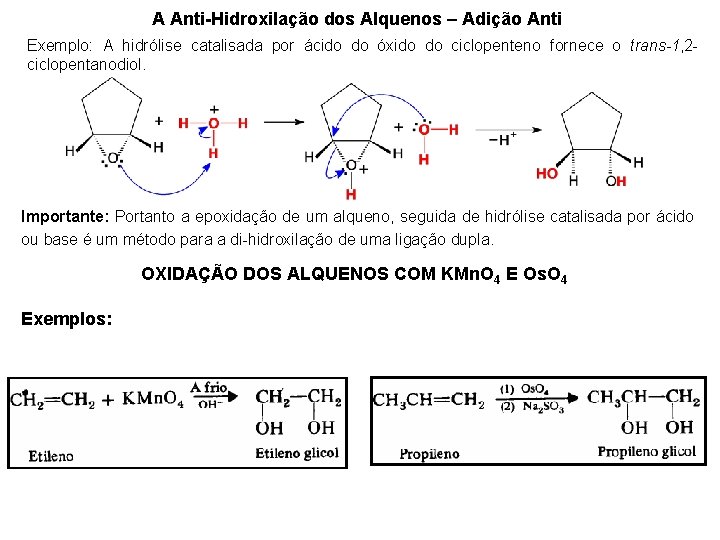
A Anti-Hidroxilação dos Alquenos – Adição Anti Exemplo: A hidrólise catalisada por ácido do óxido do ciclopenteno fornece o trans-1, 2 ciclopentanodiol. Importante: Portanto a epoxidação de um alqueno, seguida de hidrólise catalisada por ácido ou base é um método para a di-hidroxilação de uma ligação dupla. OXIDAÇÃO DOS ALQUENOS COM KMn. O 4 E Os. O 4 Exemplos:

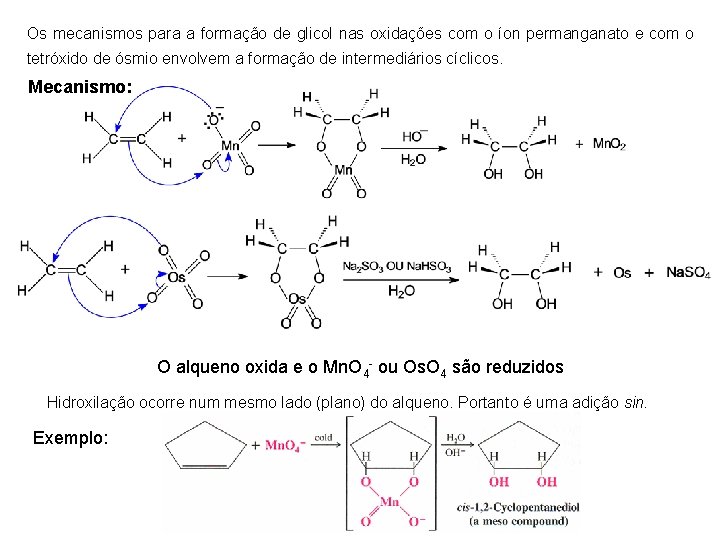
Os mecanismos para a formação de glicol nas oxidações com o íon permanganato e com o tetróxido de ósmio envolvem a formação de intermediários cíclicos. Mecanismo: O alqueno oxida e o Mn. O 4 - ou Os. O 4 são reduzidos Hidroxilação ocorre num mesmo lado (plano) do alqueno. Portanto é uma adição sin. Exemplo:

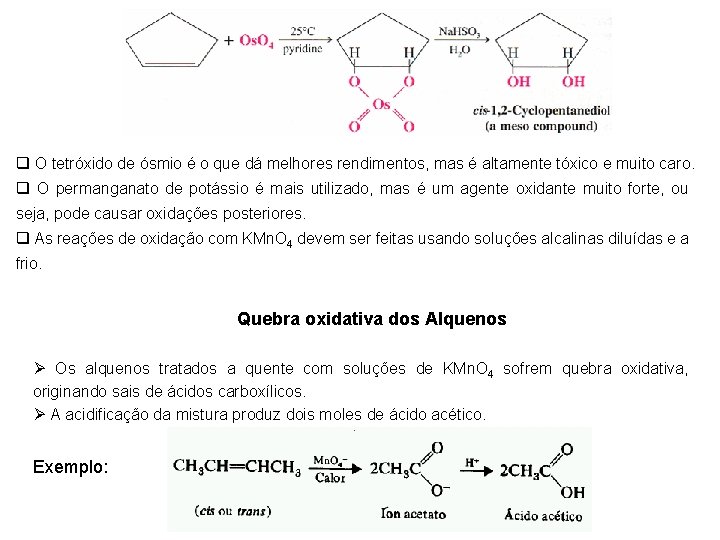
q O tetróxido de ósmio é o que dá melhores rendimentos, mas é altamente tóxico e muito caro. q O permanganato de potássio é mais utilizado, mas é um agente oxidante muito forte, ou seja, pode causar oxidações posteriores. q As reações de oxidação com KMn. O 4 devem ser feitas usando soluções alcalinas diluídas e a frio. Quebra oxidativa dos Alquenos Ø Os alquenos tratados a quente com soluções de KMn. O 4 sofrem quebra oxidativa, originando sais de ácidos carboxílicos. Ø A acidificação da mistura produz dois moles de ácido acético. Exemplo:

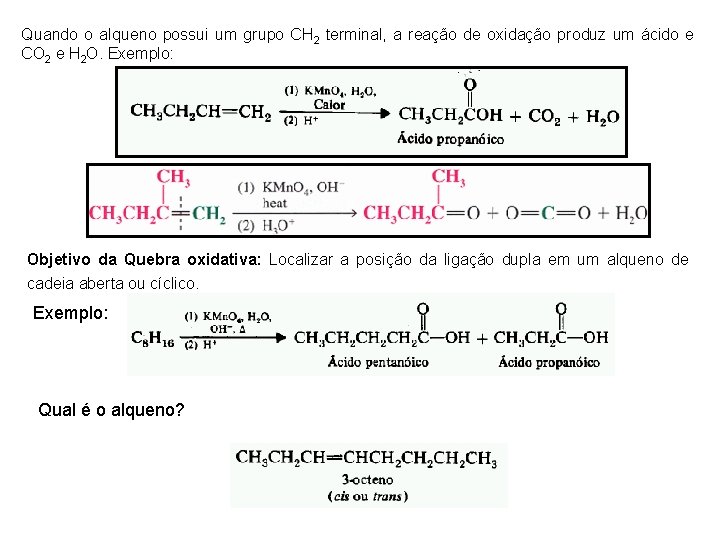
Quando o alqueno possui um grupo CH 2 terminal, a reação de oxidação produz um ácido e CO 2 e H 2 O. Exemplo: Objetivo da Quebra oxidativa: Localizar a posição da ligação dupla em um alqueno de cadeia aberta ou cíclico. Exemplo: Qual é o alqueno?

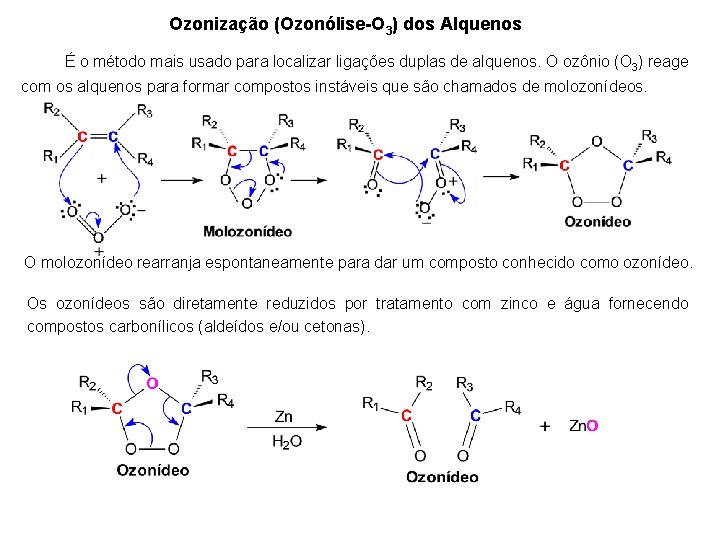
Ozonização (Ozonólise-O 3) dos Alquenos É o método mais usado para localizar ligações duplas de alquenos. O ozônio (O 3) reage com os alquenos para formar compostos instáveis que são chamados de molozonídeos. O molozonídeo rearranja espontaneamente para dar um composto conhecido como ozonídeo. Os ozonídeos são diretamente reduzidos por tratamento com zinco e água fornecendo compostos carbonílicos (aldeídos e/ou cetonas).

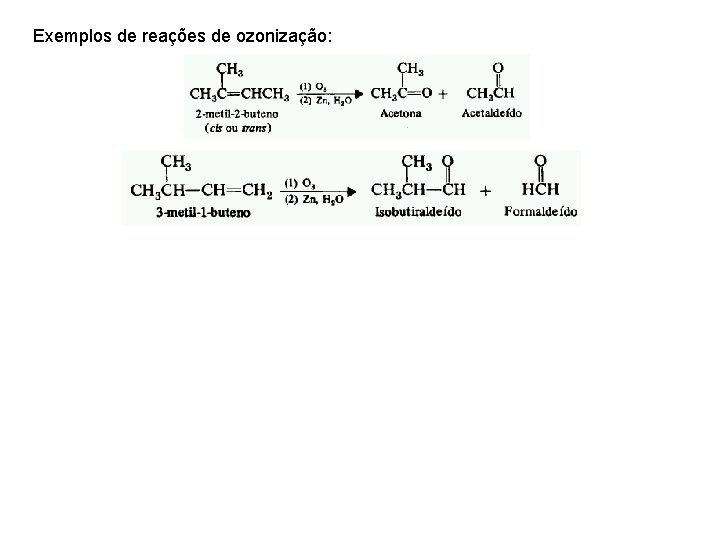
Exemplos de reações de ozonização:

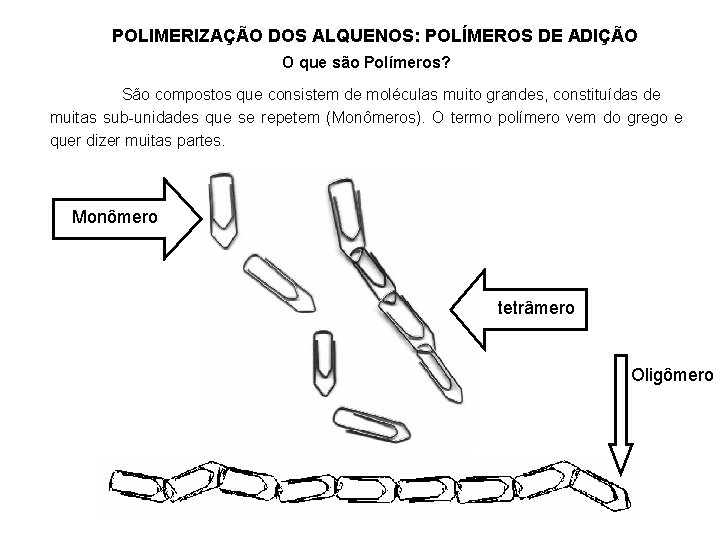
POLIMERIZAÇÃO DOS ALQUENOS: POLÍMEROS DE ADIÇÃO O que são Polímeros? São compostos que consistem de moléculas muito grandes, constituídas de muitas sub-unidades que se repetem (Monômeros). O termo polímero vem do grego e quer dizer muitas partes. Monômero tetrâmero Oligômero

O que são Homopolímeros? São Polímeros que possuem somente um tipo de monômero na composição do polímero. Cloreto de Polivinila (Via reação radicalar) O que são Copolímero? São polímeros que possuem tipos diferentes de monômeros na composição do polímero.

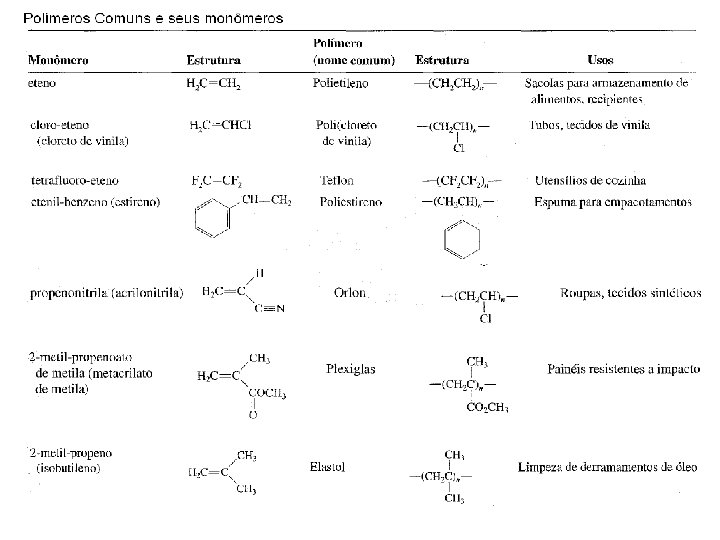
POLÍMEROS q São usados na fabricação de muitos objetos que nos rodeiam: Exemplos: roupa, tubos de caneta, garrafas de refrigerantes, sacolas plásticas, etc. q Eram desconhecidos até meados de 1950. q Foram responsáveis pelo crescimento da indústria química no século passado. q Existe uma grande preocupação do impacto dos plásticos com a natureza. "Plásticos biodegradáveis“ é uma das saídas para estes problemas. q Alguns polímeros não sintéticos. Exemplos: A seda, A lã, O amido, a celulose de algodão e da madeira, a borracha natural, etc. NOMENCLATURA: Homopolímeros Admitindo o monômero como base, basta acrescentar o prefixo ‘poli’. No caso do monômero ter nome composto, este deverá vir entre parênteses.

NOMENCLATURA: Copolímeros No caso de uma distribuição ao acaso, emprega-se co entre o nome dos monômeros: poli(indeno-co-metacrilato de metila), devendo ser escrito em primeiro lugar o constituinte mais abundante. PROCESSO DE POLIMERIZAÇÃO Polimerização é o processo de transformação química de um ou mais monômeros em polímeros. Reações de Polimerização Reações de Adição: também conhecida como polimerização em cadeia, ocorre através de uma adição simples de uma molécula a outra através da utilização de ligações insaturadas, sem formação de subprodutos. Exemplo:

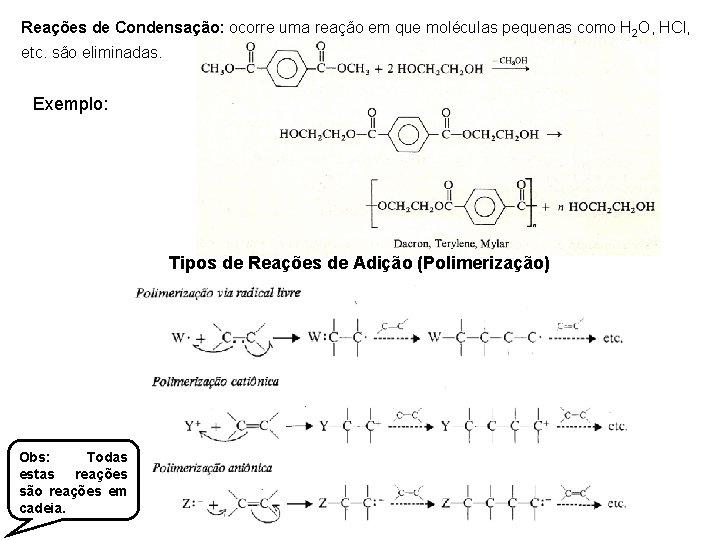
Reações de Condensação: ocorre uma reação em que moléculas pequenas como H 2 O, HCl, etc. são eliminadas. Exemplo: Tipos de Reações de Adição (Polimerização) Obs: Todas estas reações são reações em cadeia.

Polimerização na presença de Ácidos Fortes Exemplo: Polimerização do isobuteno. (Com formação de carbocátions) § As cadeias em crescimento, nas polimerizações catalisadas por ácidos, são cátions em vez de radicais livres. § Os catalisadores empregados nas polimerizações catiônicas são, geralmente, ácidos de Lewis contendo uma pequena quantidade de água.

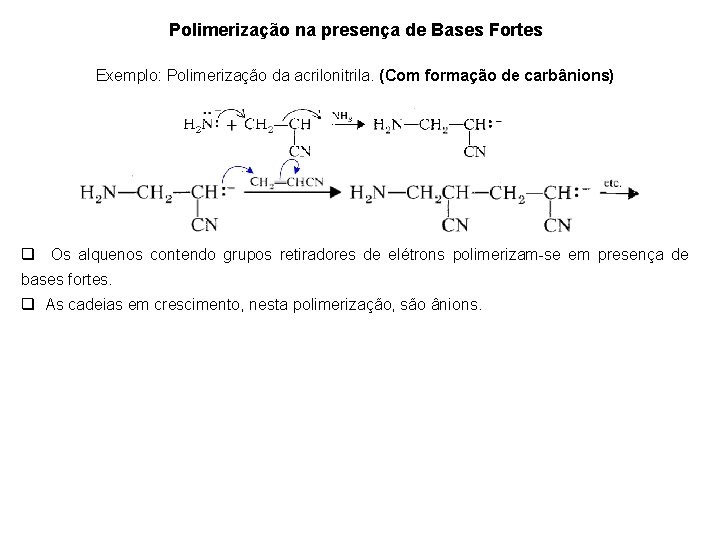
Polimerização na presença de Bases Fortes Exemplo: Polimerização da acrilonitrila. (Com formação de carbânions) q Os alquenos contendo grupos retiradores de elétrons polimerizam-se em presença de bases fortes. q As cadeias em crescimento, nesta polimerização, são ânions.


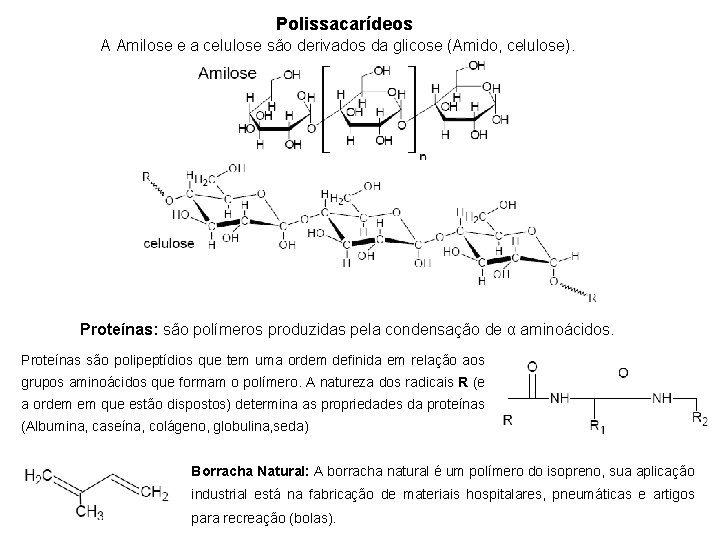
Polissacarídeos A Amilose e a celulose são derivados da glicose (Amido, celulose). Proteínas: são polímeros produzidas pela condensação de α aminoácidos. Proteínas são polipeptídios que tem uma ordem definida em relação aos grupos aminoácidos que formam o polímero. A natureza dos radicais R (e a ordem em que estão dispostos) determina as propriedades da proteínas (Albumina, caseína, colágeno, globulina, seda) Borracha Natural: A borracha natural é um polímero do isopreno, sua aplicação industrial está na fabricação de materiais hospitalares, pneumáticas e artigos para recreação (bolas).