MDULO III MDULO ELECTRICIDAD Y ELECTROFORESIS II Repasemos





![Ecuación de Henderson Hasselbach [H+] [A-] K A= [HA] Tomando el log negativo de Ecuación de Henderson Hasselbach [H+] [A-] K A= [HA] Tomando el log negativo de](https://slidetodoc.com/presentation_image_h/f91e300eebab74bc9761a2b8dbd60021/image-9.jpg)













- Slides: 35

MÓDULO III MÓDULO ELECTRICIDAD Y ELECTROFORESIS II

Repasemos: = v / E = q / kf Entonces, la movilidad electroforética depende de: • carga de la partícula (p. H) • fuerza iónica del medio • tamaño (radio) y forma de la partícula • viscosidad del medio • temperatura

Discutamos los resultados obtenidos en el T. P. = v / E = d. L / t. Vab ¿Qué ocurre con la movilidad electroforética si. . . • se modifica la caída de potencial aplicada? • se modifica la longitud del soporte? • se modifica el tiempo de corrida?

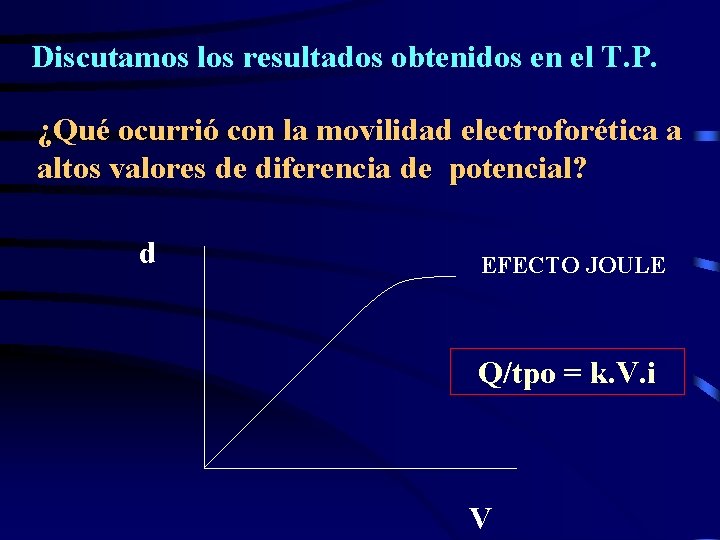
Discutamos los resultados obtenidos en el T. P. ¿Qué ocurrió con la movilidad electroforética a altos valores de diferencia de potencial? d EFECTO JOULE Q/tpo = k. V. i V

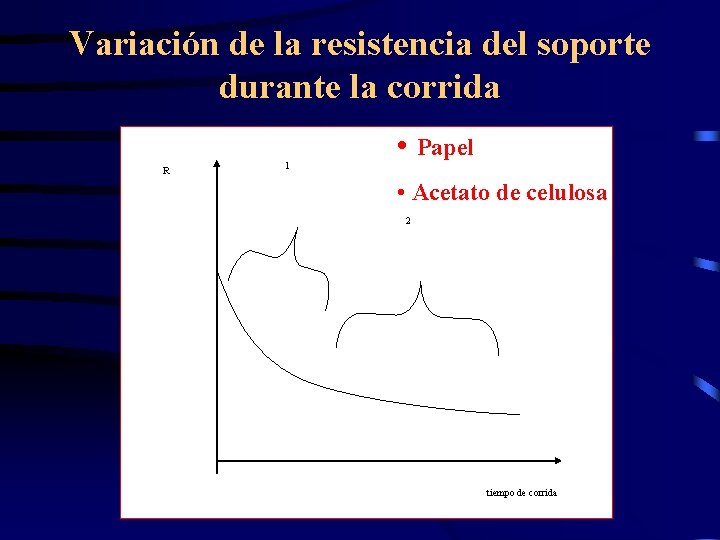
Variación de la resistencia del soporte durante la corrida R 1 • Papel • Acetato de celulosa 2 tiempo de corrida

Voltaje constante vs Intensidad constante Voltaje constante V = R. i = constante Q/t = k. V. i = k. R. i 2 Al transcurrir la corrida: R i Q/t evaporación de solvente Fuerza iónica Refrigerar

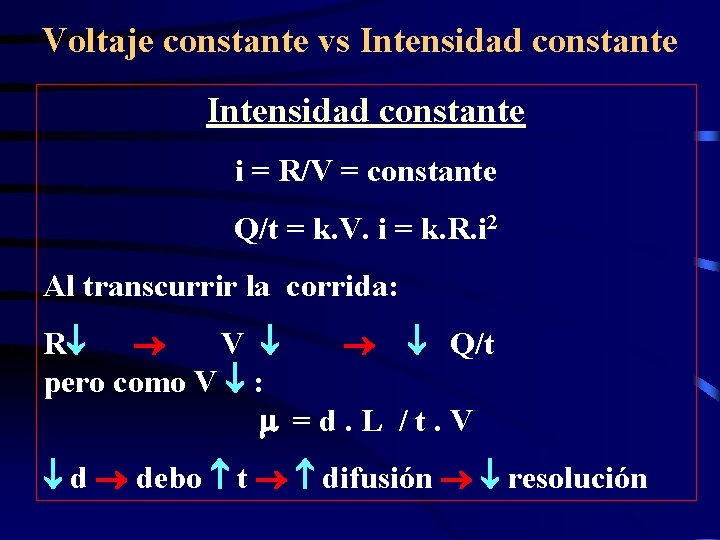
Voltaje constante vs Intensidad constante i = R/V = constante Q/t = k. V. i = k. R. i 2 Al transcurrir la corrida: R V Q/t pero como V : = d. L / t. V d debo t difusión resolución

Equilibrio de disociación o ionización de un ácido débil en solución acuosa HA H+ + AConstante de disociación [H+] [A-] K A= [HA]
![Ecuación de Henderson Hasselbach H A K A HA Tomando el log negativo de Ecuación de Henderson Hasselbach [H+] [A-] K A= [HA] Tomando el log negativo de](https://slidetodoc.com/presentation_image_h/f91e300eebab74bc9761a2b8dbd60021/image-9.jpg)
Ecuación de Henderson Hasselbach [H+] [A-] K A= [HA] Tomando el log negativo de ambos miembros y sustituyendo - log [H+] por p. H y - log Ka por p. KA y ordenando: [A-] p. H = p. KA + log [HA]

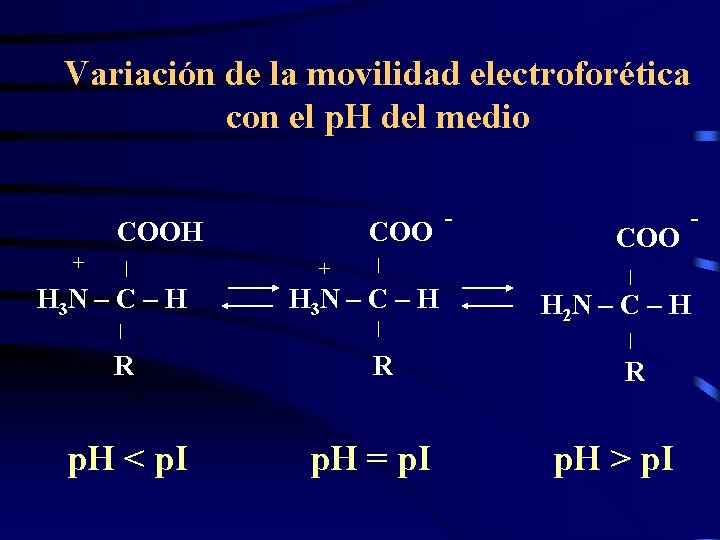
Entonces. . . - - COOH + COO H 3 N – C – H H 2 N – C – H R R COO +

Variación de la movilidad electroforética con el p. H del medio - COOH + COO H 3 N – C – H H 2 N – C – H R R p. H < p. I COO + p. H = p. I p. H > p. I -

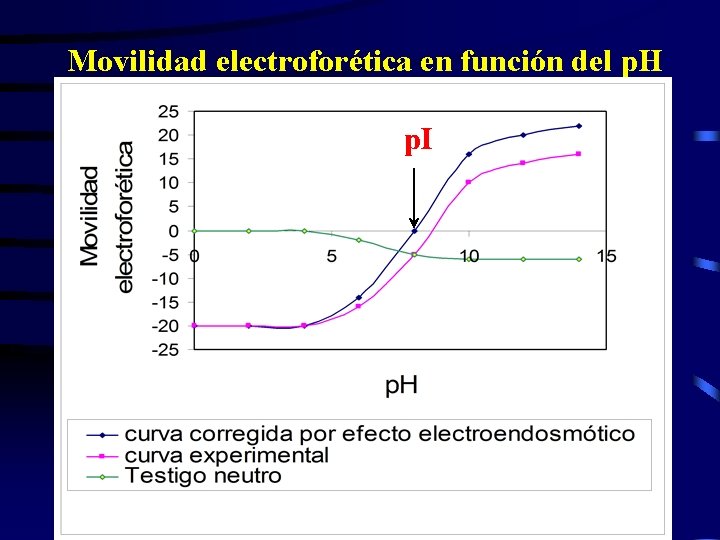
Movilidad electroforética en función del p. H p. I

Se dispone de un aminoácido que posee los siguientes grupos ionizables: COOH p. Ka = 2. 0 H 2 N – C – H p. Ka = 10. 0 R (NH 2) p. Ka = 12. 0 a) Esquematice las estructuras predominantes a p. H: 2, 5, 7, 8, 10, 12, 14. b) Calcule carga neta exacta a cada p. H. c) Estime el p. I aproximado a partir de los p. Ka.

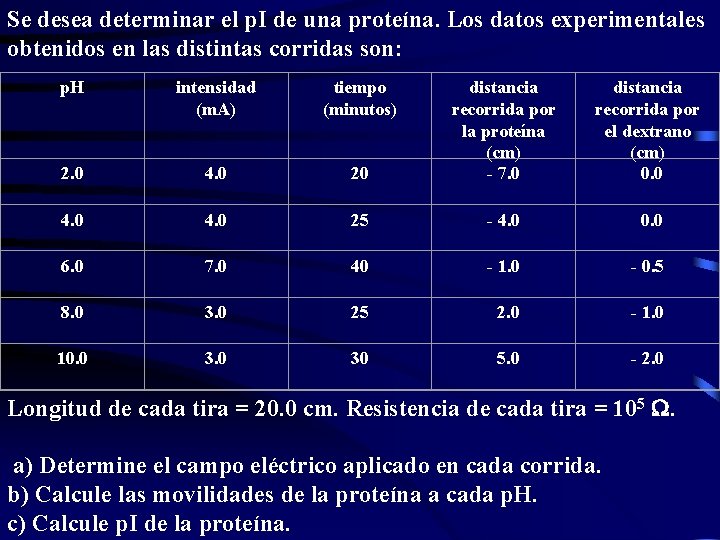
Se desea determinar el p. I de una proteína. Los datos experimentales obtenidos en las distintas corridas son: p. H intensidad (m. A) tiempo (minutos) 20 distancia recorrida por la proteína (cm) - 7. 0 distancia recorrida por el dextrano (cm) 0. 0 2. 0 4. 0 25 - 4. 0 0. 0 6. 0 7. 0 40 - 1. 0 - 0. 5 8. 0 3. 0 25 2. 0 - 1. 0 10. 0 30 5. 0 - 2. 0 Longitud de cada tira = 20. 0 cm. Resistencia de cada tira = 105 . a) Determine el campo eléctrico aplicado en cada corrida. b) Calcule las movilidades de la proteína a cada p. H. c) Calcule p. I de la proteína.

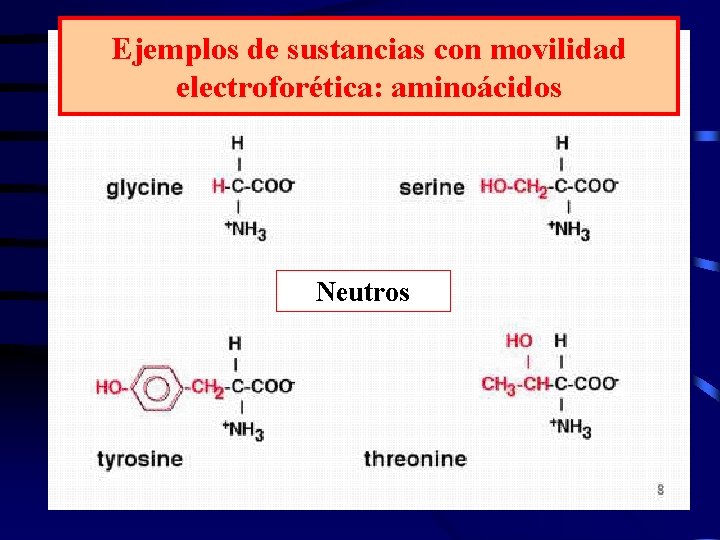
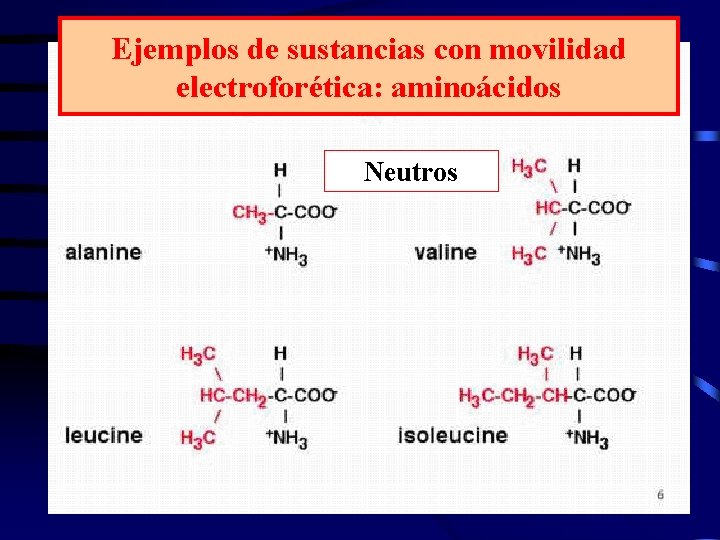
Ejemplos de sustancias con movilidad electroforética: aminoácidos Neutros

Ejemplos de sustancias con movilidad electroforética: aminoácidos Neutros

Ejemplos de sustancias con movilidad electroforética: aminoácidos Ácidos

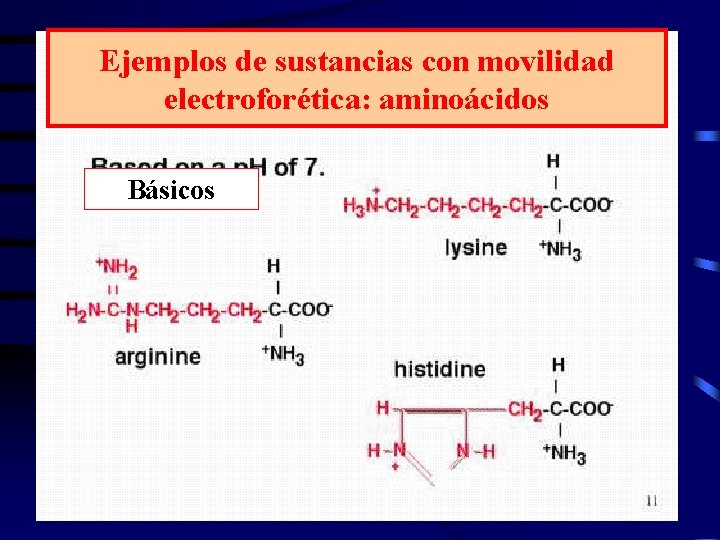
Ejemplos de sustancias con movilidad electroforética: aminoácidos Básicos

Ejemplos de sustancias con movilidad electroforética: polipéptidos y proteínas Son polímeros de aminoácidos unidos por uniones peptídicas Polipéptidos: 10 -100 aminoácidos Proteínas: más de 100 aminoácidos

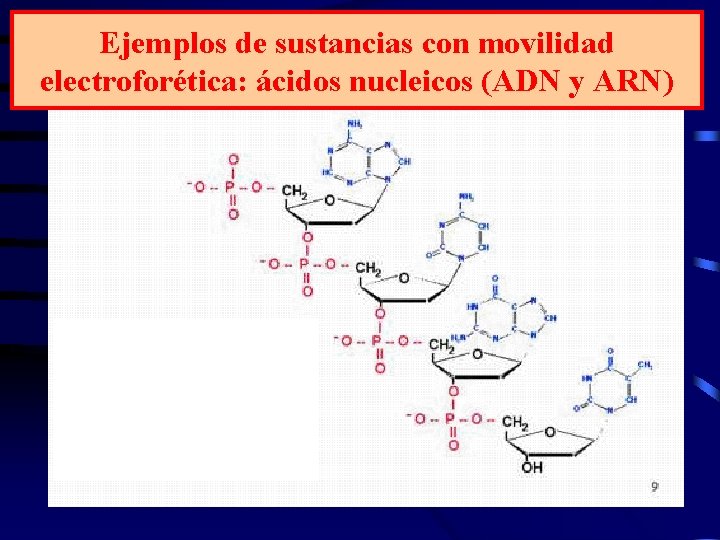
Ejemplos de sustancias con movilidad electroforética: ácidos nucleicos (ADN y ARN)

Según su objetivo, la electroforesis puede ser: • Analítica: ANÁLISIS de las bandas obtenidas (utiliza poca muestra) • Preparativa: AISLAMIENTO de las distintas fracciones (utiliza mayor cantidad de muestra)

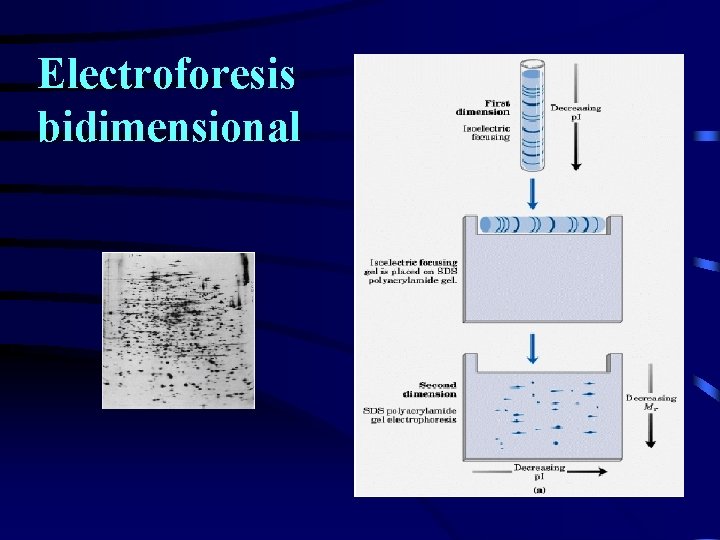
La electroforesis puede realizarse en forma: • Vertical • Unidireccional • Horizontal • Bidireccional

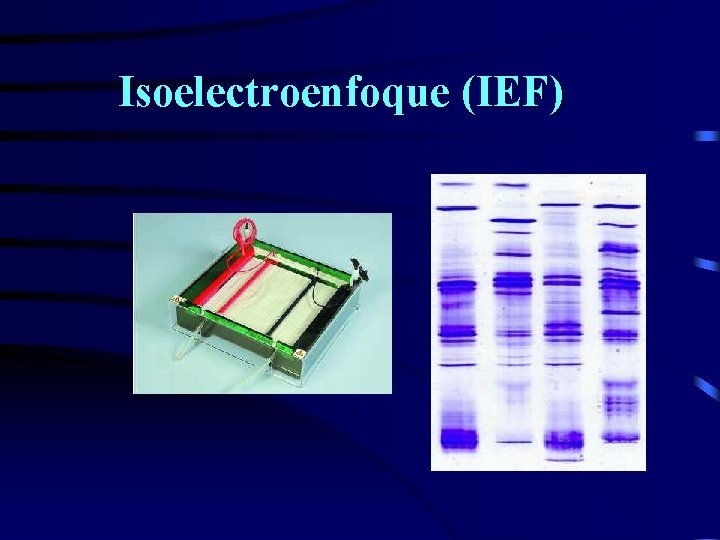
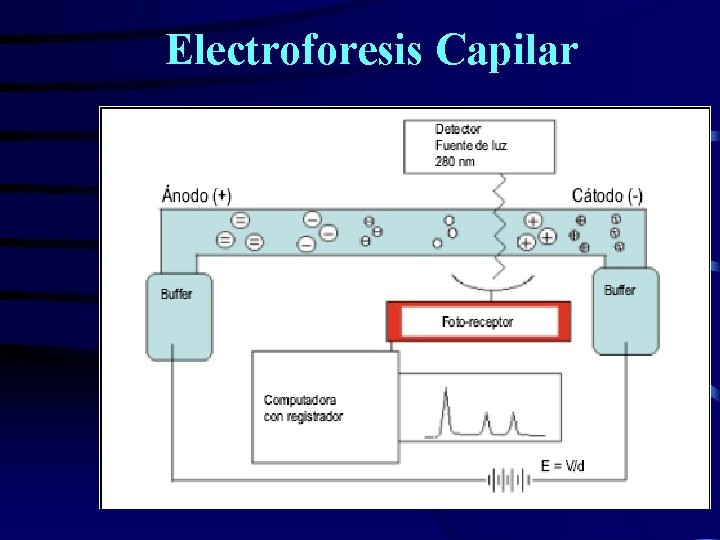
Tipos de electroforesis de uso más frecuente en la actualidad • Electroforesis en medio soporte: - convencional - SDS-PAGE: densidad de carga uniforme separación de proteínas por pesos moleculares - isoelectronfoque: gradiente de p. H alta resolución • Electroforesis capilar

Al realizar una electroforesis debe tenerse en cuenta la selección de: 1) Objetivo de la electroforesis: tipo de electroforesis. 2) Soporte y buffer de corrida. 3) Modo y lugar de siembra de la muestra.

Al realizar una electroforesis debe tenerse en cuenta la selección de: 4) Condiciones de corrida: voltaje (bajo, mediano o alto) e intensidad. Si se trabaja con voltajes medianos y altos debe refrigerarse la corrida para evitar el efecto Joule. Puede trabajarse a voltaje o intensidad constante. 5) Tiempo de corrida

Al realizar una electroforesis debe tenerse en cuenta la selección de: 6) Revelado: • colorantes • inmunofijación • enzimático • transferencia a una membrana de nitrocelulosa y posterior revelado (inmunoblot) : Westernblot (proteínas), Southernblot (ADN), Northenblot (ARN)

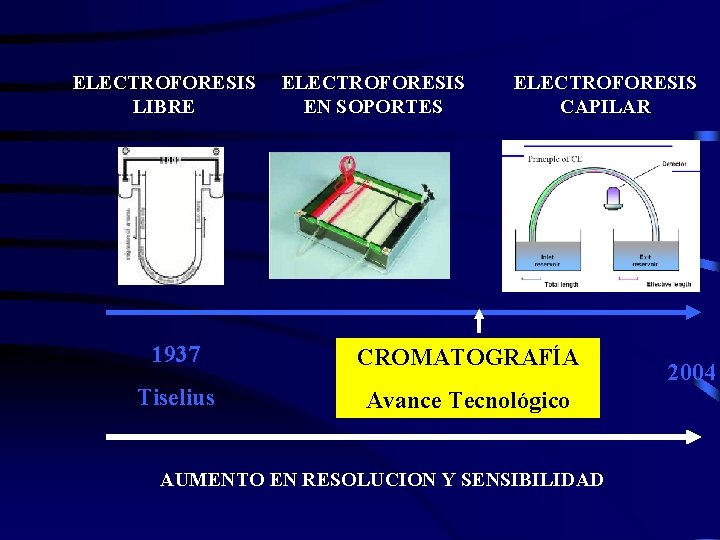
ELECTROFORESIS LIBRE ELECTROFORESIS EN SOPORTES ELECTROFORESIS CAPILAR 1937 CROMATOGRAFÍA Tiselius Avance Tecnológico AUMENTO EN RESOLUCION Y SENSIBILIDAD 2004

Electroforesis en acetato de Electroforesis en a celulosa Proteinograma de suero

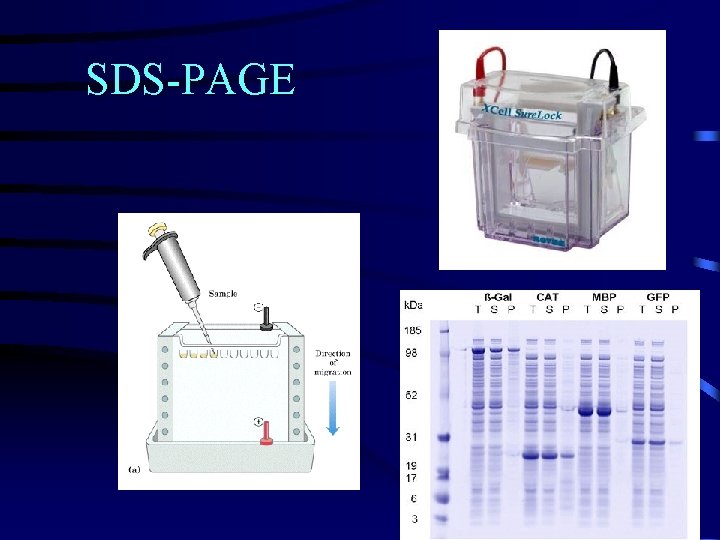
SDS-PAGE

Isoelectroenfoque (IEF)

Electroforesis bidimensional

Electroforesis Capilar

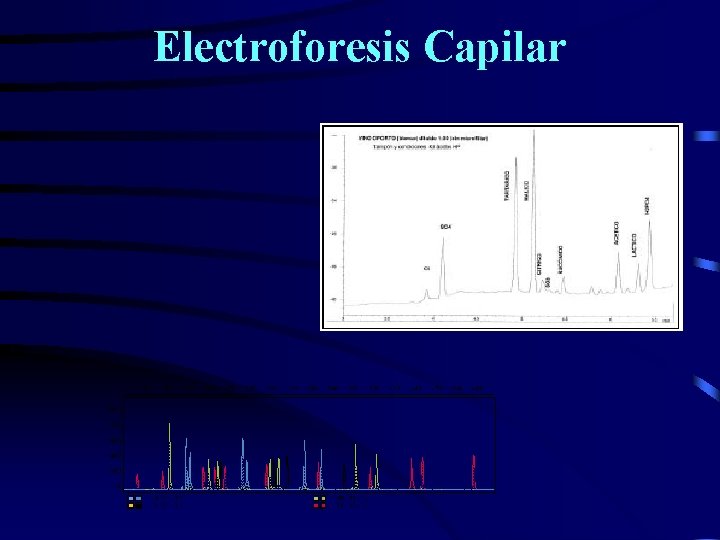
Electroforesis Capilar

Páginas a consultar: 1)http: //www. rit. edu/~pac 8612/electro/Electro _Sim. html 2)http: //micro. magnet. fsu. edu/electromag/java/ electrophoresis/ 3)http: //www 2. uah. es/biomodelmisc/anim/elfo/electrof 2. html

FIN