MAVZU Kislotalar va ularning turlariga id kimyoviy eksperimentlar














- Slides: 15

MAVZU: Kislotalar va ularning turlariga оid kimyoviy eksperimentlar o`tkazish. Yaxshilik qilayotganday ko`rinma, yaxshilik qil KO`RINMA. (aforizm)

REJA: 1. Kislotalar tarkibi, tuzilishi va nomlanishi 2. Kislorodli va kislorodsiz kislotalar. 3. Bir negizli va ko`p negizli kislotalar. 4. Kislotalarning оlinishi, fizik vа kimyoviy хоssаlаrigа

Kislotalar deb - tarkibida metall atomlariga almashina oluvchi vodorod atomlari hamda kislota qoldig‘idan iborat bo‘lgan murakkab moddalarga aytiladi. • Kislotalar tarkibidagi vodorod atomlari soni kislorodsiz kislota qoldig‘ining valentligiga son jihatdan teng bo‘ladi, chunki vodorod bir valentlidir. • Kislotalarning umumiy formulasi Hn. K tarzida ifodalanadi: bu yerda, К - kislota qoldig‘i; n - kislota qoldig‘ining valentligi.

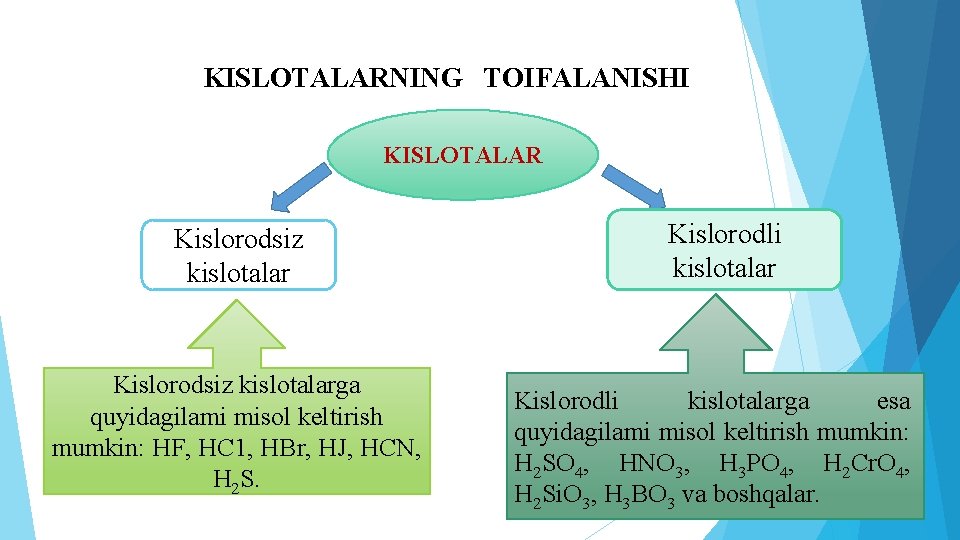
KISLOTALARNING TOIFALANISHI KISLOTALAR Kislorodsiz kislotalarga quyidagilami misol keltirish mumkin: HF, HC 1, HBr, HJ, HCN, H 2 S. Kislorodli kislotalarga esa quyidagilami misol keltirish mumkin: H 2 SO 4, HNO 3, H 3 PO 4, H 2 Cr. O 4, H 2 Si. O 3, H 3 BO 3 va boshqalar.

Kislotalar tarkibidagi vodorod soniga qarab bir negizli, ikki negizli, uch negizli va ko‘p negizli kislotalarga toifalanadi. Bir asosli kislotalar – molekulasida bitta vodorod atomi saqlagan kislotalar. Masalan: HOCN – Sianat kislota, HMn. O 4 – Permanganat kislota, HIO 3 – Yodat kislota, HBr. O 4 – Perbromat kislota, HBr. O 2 – Bromit kislota, HBr – Bromid kislota, HI – Yodid kislota, HCl – Xlorid kislota, H 3 PO 2 – Gipofosfat kislota, HCOOH – Metan (Chumoli) kislota, CH 3 COOH – Etan (Sirka yoki atsetat) kislotalar kiradi. Ikki asosli kislotalar – molekulasida ikkita vodorod atomi saqlagan kislotalar. Masalan: H 2 SO 4 – Sulfat kislota, H 2 Cr. O 4 – Xromat kislota, H 2 Mn. O 4 – manganat kislotalar kiradi.

Uch asosli kislotalar – molekulasida uchta vodorod atomi saqlagan kislotalar. Masalan: H 3 As. O 4 – Arsenat kislota, H 3 PO 4 – Ortofosfat kislota, H 3 Al. O 3 – Alyuminat kislotalar misol bo‘ladi. To‘rt asosli kislotalar – molekulasida to‘rtta vodorod atomi saqlagan kislotalar. Masalan: H 4 P 2 O 7 – Difosfat (Bifosfat yoki pirofosfat) kislota, H 4 Si. O 4 – Ortosilikat kislota, H 4 Mn. O 4 – Ortomanganit kislotalar kiradi.

KISLOTALARNING NOMLANISHI. Kislotalar 1979 yilda IYUPAK qabul qilgan nomenklaturaga asosan nomlanadi. Quyida ularning nomlanishini misollar asosida keltiramiz: 1. Kislorodsiz kislotalar kislota hosil qilgan element nomiga “id” qo‘shimchasi qo‘shib nomlanadi: HF – ftorid, HCl – xlorid, HBr – bromid, H 2 S – sulfid, HCN – tsianid, HN 3 – azid, H 2 Se – selenid, H 2 Te – tellurid, HSCN – rodonid. 2. Kislorodli kislotalar kislota hosil qiluvchi elementning oksidlanish darajasiga (valentligiga) asoslanib nomlanadi: a) Eng past oksidlanish darajasida bo‘lsa “gipo” old qo‘shimchasi qo‘shiladi: HCl. O – gipoxlorit, HBr. O – gipobromit, HIO – gipoyodit va h. z. , b) O‘rtacha oksidlanish darajasida bo‘lsa “it” qo‘shimchasi qo‘shib nomlanadi: HNO 2 – nitrit, H 3 PO 3 – fosfit, H 3 As. O 3 – arsenit, H 2 SO 3 – sul’fit, H 2 Se. O 3 – selenit, HCl. O 2 – xlorit, HBr. O 2 – bromit va boshqalar. . . ,

v) Yuqori oksidlanish darajasida bo‘lsa “at” qo‘shimchasi qo‘shib nomlanadi: HNO 3 – nitrat, H 3 PO 4 – fosfat, H 3 As. O 4 – arsenat, H 2 SO 4 – sul’fat, H 2 Se. O 4 – selenat, HCl. O 3 – xlorat, HBr. O 3 – bromat, g) Bir element bir xil oksidlanish darajasida turli kislotalar hosil qilsa, vodorod atomlari kamiga “meta”, ko‘piga “orto” old qo‘shimchasi qo‘shib nomlanadi: HBO 2 – metaborat, H 3 BO 3 – ortoborat, H 2 Si. O 3 – metasilikat, H 4 Si. O 4 – ortosilikat, HPO 3 – metafosfat, H 3 PO 4 – ortofosfat va h. z. , d) Kislota hosil qiluvchi element juda yuqori oksidlanish darajasida bo‘lsa “per” old qo‘shimchasi qo‘shiladi: HCl. O 4 – Perxlorat kislota, HBr. O 4 – perbromat kislota, va h. z. e) Ikki molekula bir xil kislota birikib, bir molekula suv chiqib ketishidan hosil bo‘lsa, bunday kislotalar “piro” old qo‘shimchasi qo‘shib nomlanadi: H 4 P 2 O 7 - pirofosfat (Bifosfat) kislota, H 2 S 2 O 5 - pirosulfit (Karo) kislota, H 2 S 2 O 7 – pirosulfat (oleum) kislota.

KISLOTALARNING OLINISHI VA XOSSALARI. Olinishi. Kislotalar quyidagi usullar yordamida olinadi: 1. Kislorodli kislotalami kislotali oksidlar bilan suvning o ‘zaro ta’siri natijasida olish mumkin: P 2 O 5 + 3 H 2 O = 2 H 3 PO 4; SO 2 + H 2 O = H 2 SO 3. 2. Kislorodsiz kislotalami metallmaslaming vodorod bilan ta ’sirlashuvi mahsulotlarini suvda eritib olish mumkin: H 2 + Cl 2 = 2 HC 1 (suvdagi eritmasi - xlorid kislota); H 2 + S = H 2 S (suvdagi eritmasi - sulfid kislota). 3. Kislotalami ularning tuzlariga boshqa kislotalami ta’sir ettirib olish mumkin: Na 2 SO 3 + H 2 SO 4 = H 2 SO 3 + Na 2 SO 4; Fe. S + 2 HC 1 = Fe. Cl 2 + H 2 S↑ ; Na 2 Si. O 3 + 2 HC 1 = H 2 Si. O 3↓ + 2 Na. Cl.

Fizik xossalari. Kislotalar qattiq (borat, ortofosfat kislotalar), suyuq (sulfat, nitrat kislotalar) bo‘lishi mumkin. Ularning ko‘pchiligi suvda yaxshi eriydi va ayrim gazlaming (vodorod xlorid - HC 1, vodorod bromid - HBr, vodorod sulfid - H 2 S) suvdagi eritmalari ham kislotalar bo‘lib hisoblanadi. Kislota molekulalarida vodorod kislota qoldiqlari bilan bog‘langan holda bo‘ladi. Kimyoviy xossalari. Kislotalaming kimyoviy xossalari ularni ancha faol moddalar ekanligini ko‘rsatadi: 1. Kislotalar indikatr rangini o`zgartiradi.

2. Kislotalar asoslar bilan ta’sirlashib, tuz va suv hosil qiladi (bu reaksiya neytrallanish reaksiyasi deb ataladi) H 2 SO 4 + 2 Na. OH = Na 2 SO 4 + 2 H 2 O; HC 1 + Mg(OH)2 = Mg(OH)Cl + H 2 O; H 3 PO 4 + KOH = KH 2 PO 4 + H 2 O.

3. Kislotalar asosli oksidlar bilan ta’sirlashadi, tuz va suv hosil qiladi (bu reaksiya ham neytrallanish reaksiyasiga misol bo‘ladi): 2 HNO 3 + Ca. O = Ca(NO 3)2 + H 2 O. 4. Kislotalar metallar bilan ta’sirlashadi va tuz hamda sharoitga qarab vodorod ajralib chiqadi yoki boshqa mahsulotlar hosil bo‘ladi : Zn + H 2 SO 4 = Zn. SO 4 + H 2↑ Na + 2 HCl = Na. Cl + H 2↑

Metallaming faollik qatorida vodoroddan chapda turgan metallar uni kislotalardan siqib chiqaradi, o‘ngda turganlari esa siqib chiqara olmaydi va bunda boshqa mahsulotlar hosil boladi: Cu + 4 HNO 3 (kons. ) = Cu(NO 3)2 + 2 NO 2↑ + 2 H 2 O. 3 Cu + 8 HNO 3(suyul. ) = 3 Cu(NO 3)2 + 2 NO↑ + 4 H 2 O

UYGA VAZIFA: 1. Mavzuni konspekt qilish. 2. Mavzuga oid exsperemental tajribalar tayyorlash.

E`TIBORINGIZ UCHUN RAXMAT !!!