Matria e energia Turmas 101 e 102 Prof























- Slides: 32

Matéria e energia Turmas 101 e 102 Prof. Luiz Antônio Tomaz

O que é matéria? Fisicamente, podemos definir matéria como sendo tudo que possui. . . massa. . . e volume.

Massa é a medida da inércia. Podemos medi-la utilizando uma balança.

Intuitivamente, inércia é. . . No Brasil, o Gordo e o Magro

Volume é o espaço ocupado pela matéria. Provetas medem volumes líquidos.

O que é energia? Energia é a capacidade de realizar trabalho.

Mas essa definição não agrada nem mesmo aos físicos. Quando vemos uma lâmpada, ela está emitindo energia luminosa. É difícil imaginar como essa energia luminosa pode ser vista como uma "capacidade de realizar trabalho".

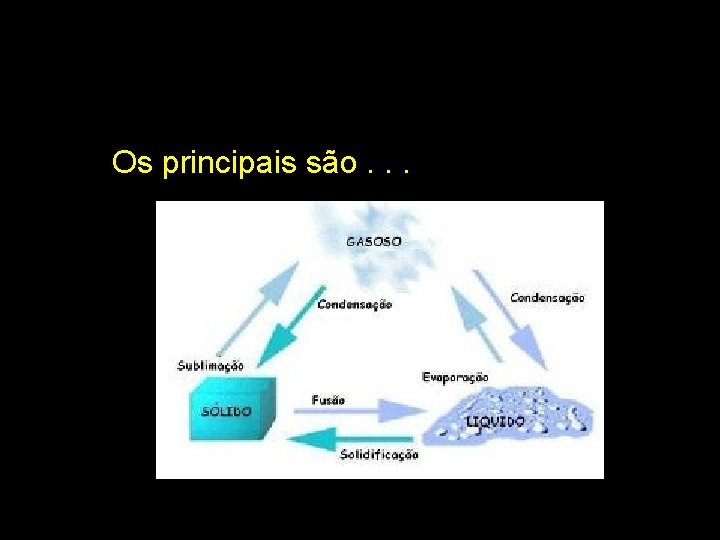
Estados físicos da matéria ou fases são as diferentes formas de como uma substância pode se apresentar no espaço.

Os principais são. . .

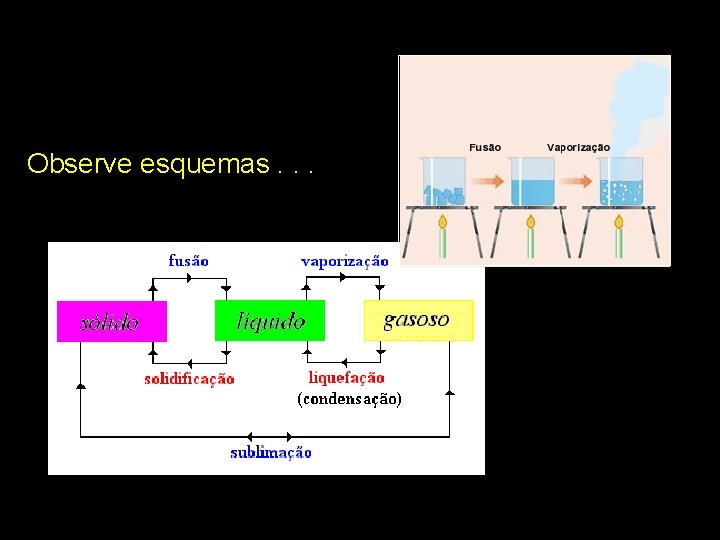
Mudanças de estados físicos A variação de temperatura provoca mudanças no estado físico. Isso porque o acréscimo de energia (calor) afasta as moléculas. Por outro lado, com resfriamento, ou seja, há retirada de energia do sistema, as moléculas se aproximam.

Observe esquemas. . .

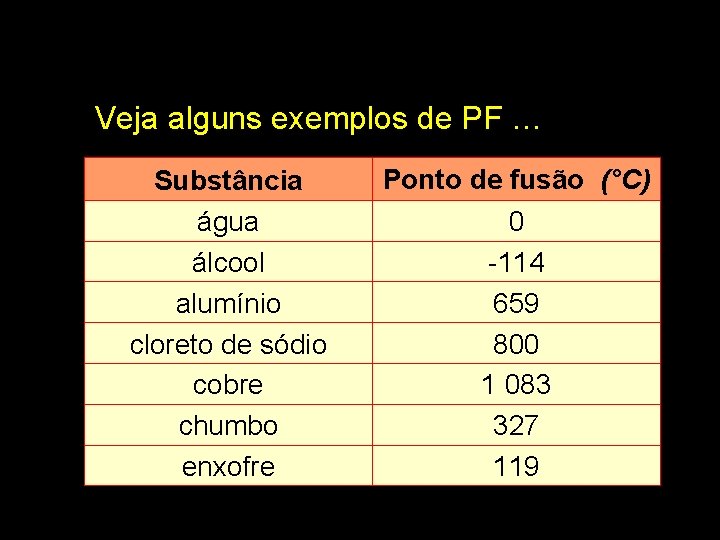
Ponto de fusão e de ebulição Ponto de fusão é a temperatura na qual a substância passa do estado sólido para o líquido e ponto de ebulição é a temperatura da passagem do líquido para o gasoso.

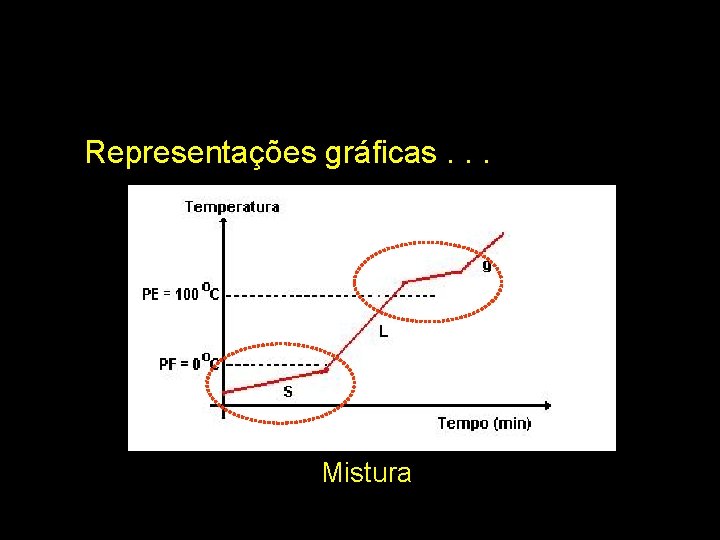
Pelo PF ou PE podemos avaliar a pureza de uma espécie química (substância). Substância pura tem PF ou PE bem definidos; caso contrário, temos mistura.

Veja alguns exemplos de PF … Substância água álcool alumínio cloreto de sódio cobre chumbo enxofre Ponto de fusão (°C) 0 -114 659 800 1 083 327 119

Um exemplo muito importante. . . Água pura(P*= 1 atm): PF = 0 o. C e PE = 100 o. C *Pressão atmosférica

Representações gráficas. . . Substância pura

Representações gráficas. . . Mistura

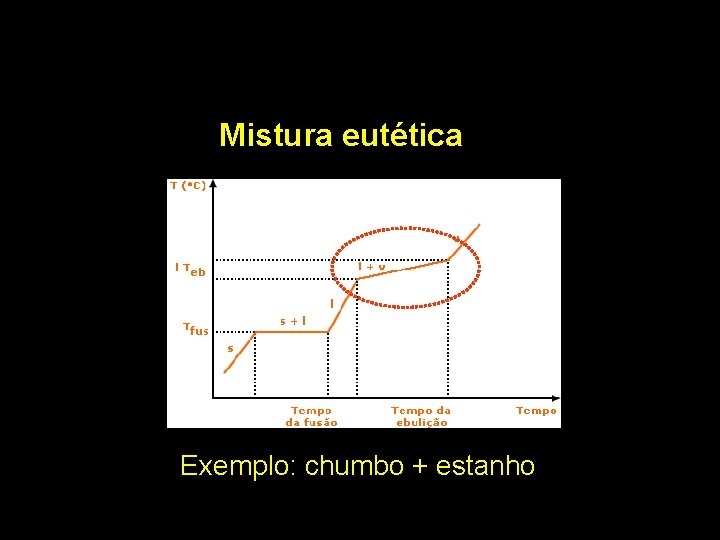
Mistura eutética Exemplo: chumbo + estanho

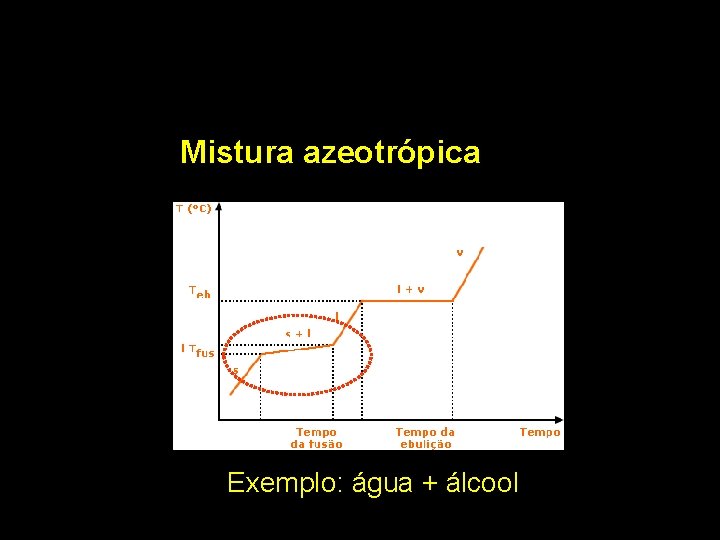
Mistura azeotrópica Exemplo: água + álcool

Pb + Sn Mistura eutética Álcool(92%) + Água(8%) Mistura azeotrópica

Ponto de fusão e de ebulição e a Tabela Periódica

Misturas Homogêneas São misturas com aspecto uniforme. Não é possível distinguir a olho nu, nem mesmo ao microscópio, os seus constituintes. Apresentam o mesmo aspecto em toda a sua extensão. São também ditas soluções ou misturas monofásicas.

Mistura homogênea

Misturas Heterogêneas São misturas em que é possível distinguir os diferentes constituintes a olho nu. Apresentam aspecto diferente ao longo da sua extensão. Podem ser bifásicas, trifásicas ou polifásicas.

Mistura heterogênea

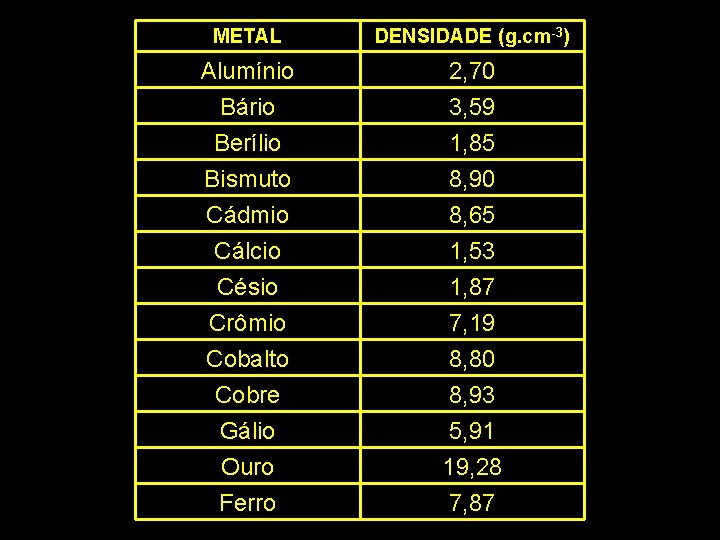
Densidade É a relação entre a massa e o volume de uma espécie química. Cada substância tem sua densidade; podemos, através dessa propriedade específica, identificar ou verificar a pureza de determinada substância.

METAL DENSIDADE (g. cm-3) Alumínio Bário Berílio 2, 70 3, 59 1, 85 Bismuto Cádmio Cálcio Césio Crômio Cobalto Cobre Gálio Ouro Ferro 8, 90 8, 65 1, 53 1, 87 7, 19 8, 80 8, 93 5, 91 19, 28 7, 87

Densidade e a Tabela Periódica

1. UFRGS 2007. Na temperatura de 595 o. C e na pressão de 43, 1 atm, o fósforo apresenta o seguinte equilíbrio: P(sólido, violeta) ↔ P(líquido) ↔ P(vapor) Esse sistema apresenta (A) 1 componente e 2 fases. (B) 1 componente e 3 fases. (C) 3 componentes e 1 fase. (D) 3 componentes e 2 fases. (E) 3 componentes e 3 fases.

2. UFRGS 2009. Considere as seguintes afirmações a respeito do processo de cozimento de alimentos em panela de pressão. I- Esse processo é mais eficiente porque os alimentos são submetidos a uma temperatura mais elevada do que aquela que é possível atingir numa panela convencional. II – o fornecimento de calor pode ser diminuído (o fogo pode ser abaixado) quando a panela de pressão começar a soltar vapor, porque, a partir desse ponto, a temperatura ficará aproximadamente constante, independentemente do calor fornecido. III – A panela de pressão começa a soltar vapor quando a pressão interna atinge valor igual ao da pressão ambiente, mantendo-se nesse patamar enquanto durar o processo.

Continuação. . . Quais estão corretas? (A) Apena I. (B) Apenas II. (C) Apenas I e II. (D) Apenas I e III. (E) I, III.

QUÍMICA 2010