Mat myter och molekyler Petr Dejmek Grundernakrafter Det
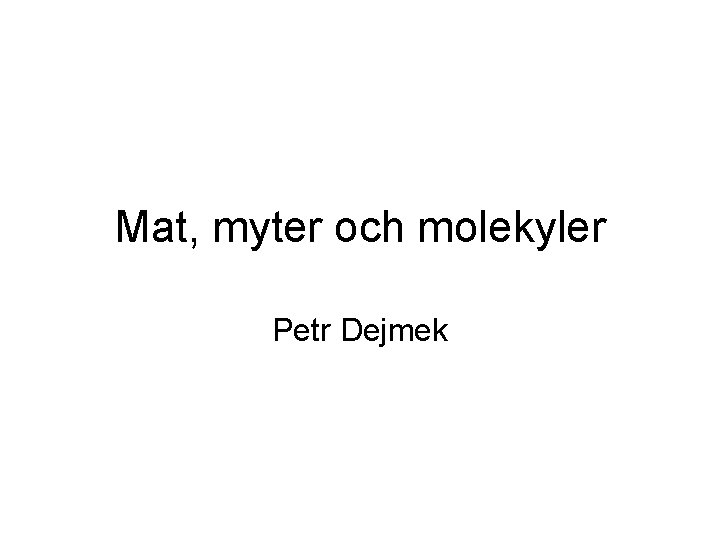













- Slides: 18
Mat, myter och molekyler Petr Dejmek

Grunderna-krafter • Det finns alltid kortverkande (nm) attraktiva krafter (Van der Waals krafter) mellan molekyler • Laddade molekyler attraherar eller stöter bort varandra, även på långt avstånd • I polära molekyler kan ett slags motladdning induceras av en laddning i närheten

Grunderna - entropi • =~ ”utrymme för rörelse” • Om molekylerna skall stanna ihop eller flyga isär beror på vad som överväger, attraktionskraften eller ”utrymme för rörelse” • I ekvationen multipliceras entropin med absolut temperatur

Vatten • Den mest polära av alla vanliga vätskor • Mycket liten del disocierad till H+ (H 3 O) och OH- (laddade ioner)

Salter och polära grupper Salter: laddade, ionerna attraherar varandra starkt i kristallen, i vatten kan de inducera motladdningar var som helst, och därmed skaffa sig rörelseutrymme Polära grupper • OH (tex i socker) • NH 3

Fett Mest kedja av CH 2 grupper, opolära, håller relativt svagt ihop I vatten – fettet drivs ihop eftersom det stör vattenmolekylernas rörelsefrihet (hydrofob effekt)

Protein • Veckad kedja av aminosyre-rester • Olika aminosyror positivt eller negativt laddade, polära eller opolära • Om en potentiellt laddad aminosyra är det eller inte, beror på hur många H+ det redan finns i lösningen dvs vilket p. H som råder

Isoelektrisk punkt • p. H som råder när antalet positiva laddningar och negativa laddningarär samma

Proteinernas löslighet • Varierar mycket beroende på antalet av de olika sorters aminosyror • sämst vid IP (men kan vara fullt lösliga)

Konfiguration av på proteiner Proteiner hålls ihop huvudsakligen av • laddningskrafter mellan olika polariserade delar (vätebryggor) • Vattnets entropivinst när ickepolära aminosyror håller sig undan Proteinet kan dras isär • För många av samma laddningar stöter ifrån varandra • Entropivinsten för proteinkedjan när den veckat ut sig blir stor vid hög temperatur

”denatureringstemperatur”

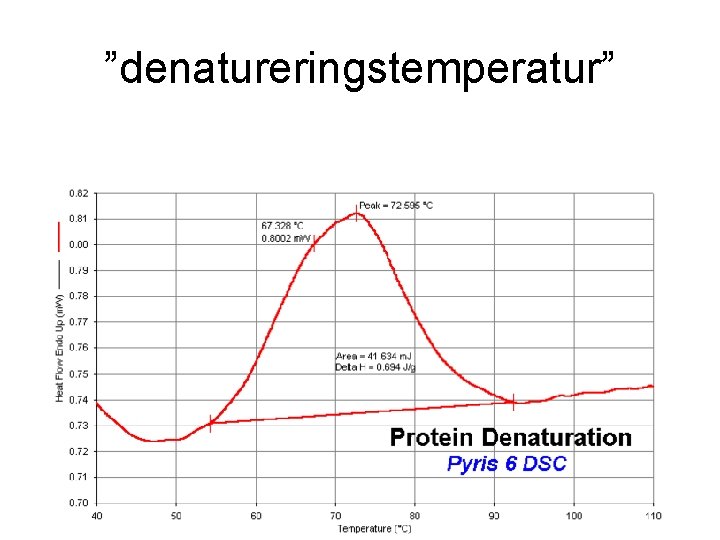
Aggregation I princip kan ett protein som vecklat ut sig veckla in sig igen om förhållanden ändras (och några gör det) Ofta sker dock andra reaktioner i det utvecklade tillståndet: • Onaturliga vätebindningar • Felaktiga svavelbryggor • Hydrofoba bindningar mellan olika molekyler=aggregat bildas

Gelning

Utfällning och gelning • Om aggregat som bildas är kompakta, sjunker dem som utfällning, om de är voluminösa bildar dem gel • Vid snabb aggregatbildning och låg koncentrationen blir det fällning

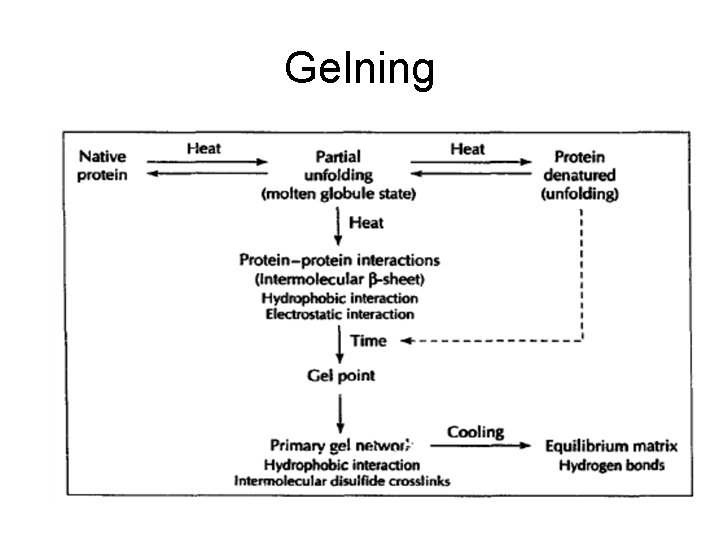
Protein i hönsäggvita



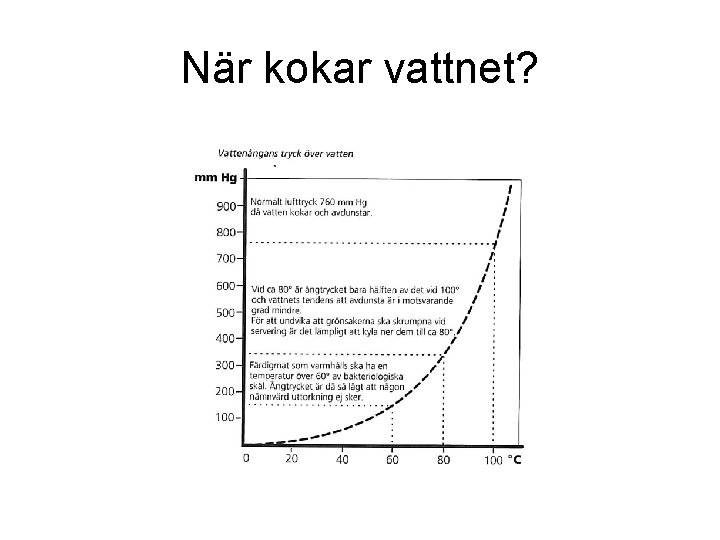
När kokar vattnet?