Master 1 Microbiologie applique ANALYSES MICROBIOLOGIQUES Contenu de

Master 1 Microbiologie appliquée ANALYSES MICROBIOLOGIQUES

Contenu de la matière v Chapitre 1 : Introduction v Chapitre 2 : Prélèvement, préparation des échantillons et transport Cas des aliments solides; Cas des liquides alimentaires; Echantillonnage en surface; Techniques de dilution. v Chapitre 3 : Les techniques classiques de numération Numération microscopique; Numération en milieu solide; Numération en milieu liquide. v. Chapitre 4 : Méthodes d’évaluation des différentes microflores La microflore aérobie mésophile totale; Les indices de contamination fécale; Les microorganismes pathogènes.

CHAPITRE 3 : Les techniques classiques de numération En microbiologie alimentaire l’intérêt de l’étude à la fois quantitative et qualitative de la flore présente dans un aliment est considérable. Bien que de nombreuses techniques de numération soient utilisables, il n’existe pas à l’heure actuelle de technique parfaite. § Certaines méthodes ne permettent pas de différentier les germes vivants des germes morts, § d’autres s’avèrent incapables de compter individuellement les cellules microbiennes lorsque celles-ci sont associées (Staphylococcus, Streptococcus , mycélium etc. . ) et permettent d’évaluer des unités formant colonies (UFC) ou des unités formant trouble (UFT).

Des méthodes directes Comptage directe Pour réaliser le dénombrement, on utilise un microscope optique en remplaçant la traditionnelle lame par une cellule de numération appelée également cellule de comptage. Il s’agit d’une lame quadrillée dans la masse, largement utilisée en biologie médicale (comptage des globules blancs et rouges dans le sang) et en microbiologie. Ce quadrillage facilite le comptage des cellules sous microscope. De nombreuses cellules de numération existent, présentant chacune un quadrillage différent. Chaque cellule de numération a donc son propre mode de calcul pour parvenir au résultat de dénombrement final. Il est donc très important d’adapter le mode de calcul à la cellule de comptage ; dans le cas contraire, les résultats seront totalement erronés. Nous présentons les deux cellules de comptage les plus utilisées pour la numération des germes : la cellule de Thoma et la cellule de Malassez.

Voici, le raisonnement détaillé, de façon à ce qu’il puisse être transférable à n’importe quel autre type de cellule de comptage : Étape 1 : Calcul du volume - d’un grand carré (cellule de Thoma) - ou d’un grand rectangle (cellule de Malassez), On utilise la formule générale de calcul du volume d’un parallélogramme : Volume = longueur × largeur × hauteur (ici, hauteur = épaisseur entre lame et lamelle ).

Exemple Ø pour une cellule de Thoma : chaque grand carré mesure 0, 2 mm de côté (longueur = largeur); l’épaisseur entre lame et lamelle est de 0, 1 mm ; Le volume d’un grand carré est donc égal à : 0, 2 mm × 0, 1 mm = 0, 004 mm 3. Ø Le résultat d’une numération de germes doit être donné en nombre de germes par millilitre. Ø Le volume calculé en mm 3 doit donc être converti en millilitre. Ø Conversion d’unités : on sait que 1 dm 3 = 1 l ; partant de cette relation, on réalise le tableau de correspondances.
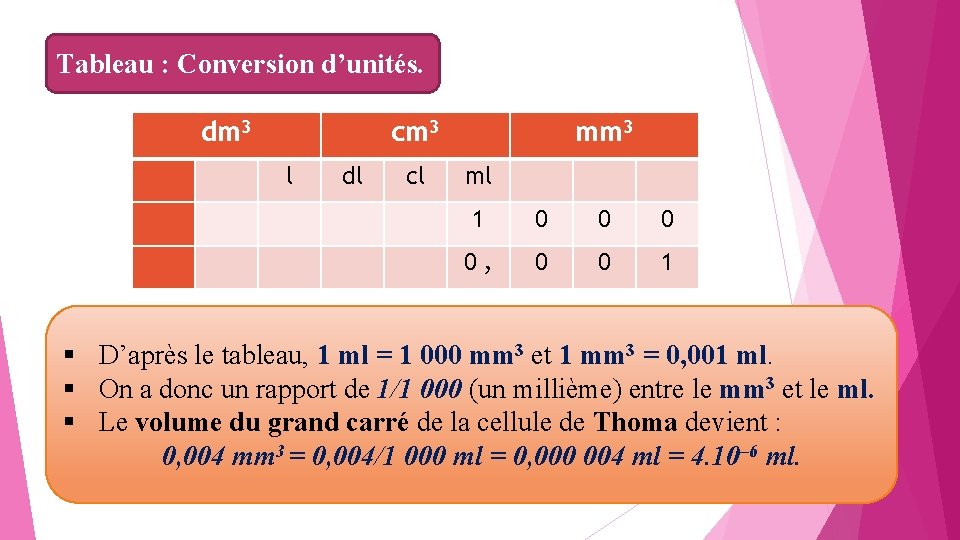
Tableau : Conversion d’unités. dm 3 cm 3 mm 3 1 0 0 0 0 , 0 0 1 l dl cl ml § D’après le tableau, 1 ml = 1 000 mm 3 et 1 mm 3 = 0, 001 ml. § On a donc un rapport de 1/1 000 (un millième) entre le mm 3 et le ml. § Le volume du grand carré de la cellule de Thoma devient : 0, 004 mm 3 = 0, 004/1 000 ml = 0, 000 004 ml = 4. 10– 6 ml.

• Étape 2 : calcul du nombre moyen de germes par grand carré ou par grand rectangle. § La numération de germes au microscope est réalisée sur un certain nombre de grands carrés du quadrillage de la cellule de Thoma ; § sur le même principe, il est réalisé sur un certain nombre de grands rectangles, sur la cellule de Malassez. Cela permet d’assurer une plus grande fiabilité du résultat. § Le nombre de répé-titions est laissé à l’appréciation de chacun (entre 3 et 5) et leur emplacement dans la cellule de comptage, choisi au hasard. Exemple: Ce qui donne sur une cellule de Thoma (n étant le nombre de germes dénombrés dans un carré) : n 1 sur le carré 1 ; n 4 sur le carré 4 ; n 7, sur le carré 7 ; n 10 sur le carré 10 ; n 15 sur le carré 15. Soit 5 comptages.

Tableau : Exemple de dénombrement sur cellule de Thoma (5 comptages). 1 (n 1) 2 3 4 (n 4) 5 6 7 (n 7) 8 9 10 (n 10) 11 12 13 14 15 (n 15) 16 À la fin de ce comptage, on fait donc le calcul de la moyenne des dénombrements (n moyen) par grand carré ou par grand rectangle. C’est la somme des dénombrements divisée par le nombre de comptages ; pour l’exemple traité, cela donne : n moyen = (n 1 + n 4 + n 7 + n 10 + n 15) ÷ 5

• Étape 3 : calcul du nombre de germes par millilitre, § Pour connaître le nombre de germes par millilitre, il faut rapporter le résultat du dénombrement moyen (précédemment calculé) au volume d’un grand carré (cellule de Thoma) ou au volume d’un grand rectangle (cellule de Malassez) : Pour la cellule de Thoma : Nbr. de germes/ml = n moyen/ volume d’un grand carré de la cellule de comptage (en ml) Pour la cellule de Malassez : Nbr. de germes/ml = n moyen / volume d’un grand rectangle de la cellule de comptage (en ml) Par exemple pour la cellule de Thoma : Nbr. de germes/ml = n moyen /4. 10 -6

Préparation d’une cellule de numération Etape 1 : Dilution au 1/5 Pipeter avec une pipette stérile, 10 ml de l’échantillon à contrôler, prélevé dans les conditions stériles Verser dans une fiole jaugée de 50 ml (stérile). Compléter jusqu’au trait de jauge avec de l’eau distillée stérile. Etape 2 : Coloration de la cellule de comptage. Verser 1 ml de l’échantillon mesuré avec une pipette stérile dans un petit bécher Ajouter 1 ml de bleu de méthylène mesuré avec une 2ème pipette stérile. Homogénéiser et attendre 10 minutes.

Etape 3 : Préparation de la cellule de comptage Déposer une goutte de l’échantillon coloré (prélevé avec une pipette stérile) au centre de la cellule de comptage (au niveau du quadrillage) Recouvrir d’une lamelle. Placer sur le microscope et observer au grossissement x 100. Effectuer la numération selon le protocole propre à la cellule utilisée. Remarque: • Veiller à ajouter le colorant « volume à volume » c’est-à-dire selon un volume rigoureusement identique à celui de l’échantillon (= dilution au 1/2). § Une seule goutte de l’échantillon coloré est nécessaire.

Caractéristiques techniques d’une cellule de numération La cellule de numération est une lame de microscope portant un quadrillage gravé qui facilite le comptage des cellules observées au microscope. Les plus utilisées pour la numération des microorganismes sont la cellule de Malassez et la cellule de Thoma. Précaution : D’un modèle de cellule à l’autre, bien que d’aspect extérieur similaire, le quadrillage diffère : il faut donc veiller à utiliser le mode opératoire et le mode de calcul qui se rapportent précisément au modèle de cellule utilisé.


Technique de comptage sur une cellule de numération Schématisation des cellules de levures ou de bactéries sur un quadrillage de cellule de numération (exemple de la cellule de Malassez) Les cellules à dénombrer : • Toutes les cellules à l’intérieur du grand rectangle : 14 • Pour les cellules positionnées sur la limite du grand rectangle, on comptabilise les cellules d’une seule longueur et d’une seule largeur (soit 2 côtés sur 4) : 4 ➜ Soit au total pour le grand rectangle : 18 cellules.

Différenciation des levures vivantes et des levures mortes par coloration au bleu de méthylène Remarque : • Les cellules qui semblent être plus petites sont en fait de la même taille : elles sont simplement dans un plan un peu plus reculé : en faisant avancer l’objectif du microscope très légèrement avec la vis micrométrique elles apparaissent du même format que les autres et leur coloration est plus distincte. • Au final, tout doit être comptabilisé : «petites » ou «grosses» , colorées ou non : la somme cellules vivantes + cellules mortes donne la population totale. • On peut aussi distinguer les levures en bourgeonnement car elles attestent d’une activité intense (jeunesse, croissance active de la population, présence de nutriments).

Détermination du nombre de grands carrés ou de grands rectangles à dénombrer • Dénombrer le nombre de cellules § dans plusieurs grands carrés (cellule de Thoma) § ou de plusieurs grands rectangles (cellule de Malassez). On en choisit en général 3 à 5. Exemple : on a choisi de dénombrer 5 grands carrés (ils apparaissent grisés). Calculs sur une cellule de numération : Etape 1 : calcul du nombre de germes moyen par grand carré (cellule de Thoma) ou grand rectangle (cellule de Malassez) • Reprendre les résultats de chaque dénombrement réalisé (entre 3 et 5 comptages). • Réaliser la moyenne (n moyen) du nombre de germes par grand carré (cellule de Thoma) ou par grand rectangle (cellule de Malassez) : n moyen = Somme des résultats de chaque comptage/Nombre de résultats

Étape 2 : calcul du nombre de germes par millilitre • Diviser le nombre de germes moyen (n moyen) par le volume du grand carré ou du grand rectangle calculé: Nombre de germes/ml d’échantillon dilué = n moyen volume du grand carré en ml • Ne pas oublier de multiplier le résultat précédent par le facteur de dilution (FD). * Dans le cas d’une dilution de l’échantillon au 1/5, FD = 5. Pour la cellule de Thoma* : germes/ml = (n moyen /4. 10 -6 ) x FD = (n moyen × 106 /4) x 5 = n moyen × 106 × 5/4 = n moyen × 106× 1, 25 = 125 × 104 × n moyen germes/ml Pour la cellule de Malassez* : germes/ml = (n moyen/ 10– 5) × FD = n moyen × 105 × 5 = 5 × 105 × n moyen germes/ml

Précaution : Si la préparation dénombrée a été colorée au bleu de méthylène, ne pas oublier de tenir compte de la dilution engendrée par la coloration : Coloration = Dilution au 1/2, soit FD = 2. Exemple : Un échantillon dilué au 1/5 puis coloré au bleu de méthylène est donc dilué au 1/10 (1/5 × 1/2) ; le facteur de dilution à appliquer est alors égal à 10. Comptage grand carré Levures mortes Levures totales (mortes+ Tableau de collecte des résultats (comptage et calculs) (Thoma) ou grand rectangle vivantes bourgeonnantes vivantes) (Malassez) Carré/ rectangle 1 Carré/ rectangle 2 Carré/ rectangle 3 Carré/rectangle 4 Carré/rectangle 5 Moyenne (total de la colonne /5) Nombre de levures par ml (levures. ml-1) Taux de viabilité (%) = %levures vivantes : (levures totales – levures mortes)/ levures totales x 100

Des méthodes générales indirectes Cette technique permet en principe la numération des germes vivants. La culture est réalisée soit en milieu liquide (1 germe ou un groupe de germes donne après inoculation et incubation 1 culture positive) soit en milieu solide (1 germe ou un groupe de germes donne naissance à une colonie). Dans ce dernier cas l’ensemencement peut se faire dans la masse de la gélose ou en surface.

1 - Numération à partir d’un milieu solide : UFC Cette méthodologie est le plus fréquemment réalisée dans des boîtes de Pétri. Elle repose sur le principe que toute bactérie vivante introduite dans la masse ou en surface d’un milieu gélosé favorable donne en principe naissance après incubation à une colonie macroscopique. Le nombre total de colonies correspond alors au nombre d’UFC présents dans l’inoculum.

1 - Numération à partir d’un milieu solide : UFC Ø Dans la masse: De nombreuses critiques à cette méthode peuvent être formulées. Ainsi, les bactéries aérobies strictes se développent mal dans la masse de la gélose, tandis que les bactéries anaérobies strictes ne s’y développeront que dans des conditions d’incubation appropriées (jarre anaérobie par exemple). Il peut aussi exister certains antagonismes bactériens (bactériocines etc. . . ). Par ailleurs si la température de mélange du milieu gélosé mélange à l’inoculum est supérieure à 45 - 47°C , il peut y avoir inactivation de microorganismes. v Cette méthode de culture dans la masse conduit néanmoins à des dispersions homogènes dans la gélose et donc à une distribution homogène des colonies. v Dans cette méthode des germes se trouveront dans la masse et d’autres en surface, les colonies formées étant, compte tenu des contraintes stériques imposées par le réseau gélifié, alors différentes pour un même micro-organisme. Cet inconvénient est éliminé par la technique de la double couche.

1 - Numération à partir d’un milieu solide : UFC Ø En surface: La numération en surface n’est réalisable que sur une surface de milieu parfaitement sèche. L’opération d’étalement au râteau reste à maîtriser (adsorption de germes sur le râteau) et le volume d’inoculum déposé ne peut en aucun cas excéder 0, 5 ml avec des boîtes de 9 cm de diamètre (des volumes supérieurs ne sont pas absorbés par le gel d’agar et l’eau qui reste en surface rend impossible toute numération en raison de la formation d’une nappe). Cette méthode donne de bons résultats avec les germes aérobies et aéro-anaérobies.

A- Technique de numération dans la masse de la gélose Les milieux gélosés (répartis en erlenmeyer ou en flacon de 15 ml) sont liquéfiés en bouillant au bain-marie ou mieux au four à micro-ondes, puis maintenus en surfusion dans un bain-marie à 45 ± 1°C. 1 ml du liquide dans lequel on veut connaître le nombre de micro-organismes est introduit au centre de la boîte de Pétri posée bien à plat dans la zone de protection du bec Bunsen. L’inoculum peut être réparti en gouttes sur le fond de la boîte. Afin de n’utiliser qu’une seule pipette stérile pour toutes ces opérations il est recommandé de commencer l’ensemencement par la dilution la plus grande pour terminer avec le liquide non dilué. Noter avec soin sur chaque boîte l’origine de l’analyse, le milieu utilisé et la dilution correspondante (sur le côté de façon à ne pas être géné par la suite pour le comptage). On procède de la même façon pour chaque dilution en réalisant, dans la mesure du possible, deux essais par dilution.

A- Technique de numération dans la masse de la gélose La suite Le milieu gélosé en surfusion dans lequel l’inoculum sera incorporé doit être à 45°C± 1°C. § Si sa température est supérieure à cette valeur il se produira une destruction partielle de la flore ; § au contraire, si sa température est inférieure à 45°C le milieu se solidifiera irrégulièrement et ne se mélangera pas de façon homogène avec l’inoculum. § Pour réaliser l’introduction du milieu gélosé : retirer le milieu du bain marie à 45°C, essuyer le récipient, l’ouvrir aseptiquement, flamber son ouverture et couler le milieu dans la boîte de Pétri contenant l’inoculum après l’avoir entrouverte dans la zone stérile. § Ne pas appuyer le récipient sur la boîte. § Mélanger rapidement par agitations circulaire et alternative horizontales ; éviter les mouvements brusques qui risquent de projeter le milieu inoculé sur les bords ou même à l’extérieur de la boîte. § Laisser refroidir les boîtes bien à plat jusqu’à solidification complète (environ 30 minutes). § Retourner les boîtes et les placer à l’étuve dans cette position à la température requise.

A- Technique de numération dans la masse de la gélose La suite Ø Pour éviter la formation de colonies de grande taille en surface (par rapport à celles qui se développeront dans la masse de la gélose) on peut couler § à la surface de la gélose ensemencée une fine couche de milieu de culture identique à celui déjà présent dans la boîte § ou couler à la surface une mince couche de gélose non nutritive (technique de la double couche). Remarque : on peut recouvrir le milieu d’une couche de milieu stérile (double couche) pour limiter l’envahissement des colonies en surface et avoir des colonies présentant toutes le même aspect.

B- Technique de numération en surface de la gélose 100 à 500 microlitres (pipette graduée ou mieux pipette automatique) du milieu à analyser sont déposés à la surface de la gélose et immédiatement répartis de façon uniforme à la surface du milieu au moyen d’un ensemenceur stérile du type pipette râteau. La pipette râteau est “stérilisée” entre deux étalements par immersion dans de l’éthanol, l’éthanol adsorbé sur le verre étant ensuite enflammé (cette opération ne déforme pas l’ensemenseur). Incubation à la température adaptée à la flore recherchée pendant 18 h à 72 heures. Dénombrement des colonies Ø En surface : elles ont un aspect macroscopique classique et caractéristique ; Ø En profondeur : elles ont un aspect lenticulaire.

Exploitation des résultats Ø Elle peut être effectuée selon la norme ISO 7218 (manipulation réalisée en ensemençant deux boites par dilution). Ø Elle peut être effectuée selon la norme ISO 7218 modifiée en octobre 2007, qui officialise l’utilisation d’une seule boite par dilution. Ø Choix des essais : choisir deux dilutions successives dont : § L’une au moins présente un minimum de dix colonies, § Le « nombre maximal de colonies en totalité est de trois cents par boite » . • Pour les levures et les moisissures, on retient pour le calcul les dilutions présentant entre dix et cent cinquante colonies par boite. Calcul de la concentration bactérienne N en UFC par ml ou par g de produit : Arrondir le résultat calculé à deux chiffres significatifs et l’exprimer en nombre compris entre 1, 0 et 9, 9. 10 n UFC par m. L ou par g.


Numération à partir d’un milieu liquide : UFT Ø Cette méthode présente certains avantages tels que la possibilité d’étudier un caractère biochimique du germe difficilement mis en évidence sur milieu gélosé comme la production de gaz (cloche) ou encore d’effectuer facilement la numération avec une phase de revivification. Dans cette technique, la disponibilité des nutriments pour le micro-organisme est excellente. Ø Cette méthode repose sur le fait qu’un inoculum contenant au minimum 1 germe (UFT) donnera, après introduction dans un milieu liquide donné, une culture positive.

Numération à partir d’un milieu liquide : UFT Principe Ø Si les conditions optimales de croissance sont réunies, un seul micro-organisme présent dans l’inoculum introduit dans un milieu liquide se développe en y créant un trouble (et une modification visible du milieu). La lecture des tubes contenant le milieu liquide et ensemencés avec l’inoculum est donc de type binaire : Résultat négatif si absence de trouble et de modification du milieu : il y avait moins d’ un microorganisme présent dans l’inoculum introduit dans le milieu liquide ; Résultat positif si présence de trouble (et de modification du milieu si celui-ci est discriminant) : il y avait au moins un micro-organisme présent dans l’inoculum introduit dans le milieu liquide. Le résultat sera positif, que l’inoculum introduit dans le tube de milieu liquide contienne 1, 100, 1 000… micro-organismes. La méthode repose sur la répartition aléatoire des microorganismes dans le prélèvement (méthode statistique reposant sur l’utilisation de la loi de Poisson). § On ensemence donc une série de tubes avec un volume donné du produit à analyser ou ses dilutions, à raison de 1, 2, 3, 5 voire même 10 tubes par dilution testée. § Connaissant le nombre de résultats positifs obtenus dans la série de tubes, on peut déterminer la concentration en micro-organismes présents dans une unité de volume ou de masse du produit analysé.

Mode opératoire La méthode décrite ci-dessous (NF ISO 7218, mai 1996) est techniquement lourde, mais utilisée lorsque les bactéries cultivent difficilement en milieu gélosé ou lorsque le nombre de bactéries présentes dans l’échantillon est relativement faible. 1 - Volume de l’inoculum : le plus souvent V inoculum = 1 m. L (parfois 10 m. L) ; 2 - Choix du milieu à ensemencer : . Milieu de croissance sans indicateur : la présence de micro-organismes se traduit par un trouble, Milieu sélectif et discriminatif du micro-organisme à quantifier : sa présence se manifeste par un trouble et le virage d’un indicateur de p. H par exemple ; 3 - Choix des dilutions à tester : dépend de la population estimée, pour une analyse statistique optimale des résultats : . Une dilution contenant moins d’un micro-organisme dans l’inoculum utilisé, . Une dilution contenant plus d’un micro-organisme dans l’inoculum utilisé ; 4 - Choix du nombre d’essais par dilution (dépend de la précision souhaitée pour les résultats en fonction de leur analyse statistique) : En général trois tubes sont ensemencés par dilution, Un ou deux tubes sont ensemencés si une précision moins importante est suffisante, Cinq ou même dix tubes sont ensemencés si une précision plus importante est demandée

Organigramme d’un dénombrement en milieu liquide Produit solide Préparation d’une « suspension mère » correspondant le plus souvent à une dilution au 1/10 e du produit (X g de produit introduit dans 9 X ml de diluant) Réaliser une série de dilutions 1/10 e ( de produit liquide à analyser ou de la « suspension mère) Ensemencer 1 ml du produit pur et de chaque dilution dans 1, 2, 3, 5 ou 10 tubes contenant un milieu liquide correctement choisi. Incuber les tubes à la température et pendant le temps adaptés. Après incubation; noter pour chaque tube si le résultat est positif (+) ou négatif (-) puis exploiter les résultats.

Exploitation des résultats 1 - Dénombrement à un seul essai Ø Ce dénombrement s’effectue sans recourir aux tables de Mac Grady. Ø On ensemence 1 tube par dilution avec 1 m. L d’inoculum. Exemple de résultats : Dilution 100 10 -1 10 -2 10 -3 10 -4 Résultats + + + - - Il y a au moins un micro-organisme dans l’inoculum (1 m. L) de la plus grande dilution (10 -2) présentant encore un trouble : la concentration est donc au moins 102 micro-organismes par m. L de produit ou de «suspension mère » non dilués ; Il y a moins de un micro-organisme dans l’inoculum (1 m. L) de dilution (10 -3) ne présentant plus de trouble : la concentration est donc strictement inférieure à 103 micro-organismes par m. L de produit ou de «suspension mère » non dilués.

On peut exprimer le résultat selon l’intervalle 102 ≤ N micro-organismes/m. L < 103 La concentration du produit analysé est comprise entre 102 et 103 micro-organismes dans 1 m. L. 2 - Dénombrement à essais multiples Ce dénombrement s’effectue en utilisant les tables de Mac Grady. Mise en place du nombre caractéristique Le nombre caractéristique de la série réalisée est une combinaison de trois chiffres : Ø Chaque chiffre correspond au nombre de tubes « positifs » pour une dilution donnée ; Ø Les trois chiffres correspondent à trois dilutions successives ; Ø Le chiffre des centaines correspond à la plus faible dilution (donc à la plus forte concentration en microorganismes), celui des dizaines à la dilution intermédiaire et celui des unités à la plus grande dilution. Parmi les différentes combinaisons, on choisit celle correspondant au nombre le plus grand et, si possible, inférieur à 330 (correspond à une meilleure répartition des micro-organismes dans les dilutions).

Exemple : v cinq dilutions ont été ensemencées à raison de trois essais par dilution ; v trois combinaisons (de trois chiffres) sont possibles avec les résultats obtenus (tableau). v Parmi les trois combinaisons de trois chiffres possibles (332 ; 321 ; 210), laquelle choisir ? v Le nombre le plus élevé et inférieur à 330 est sélectionné ; dans cet exemple, il s’agit de 321. v Si les dilutions sont insuffisantes, on peut être amené à utiliser des nombres caractéristiques comme 333, 332 ou 331

Lecture du NPP (Nombre le Plus Probable) dans la table statistique de Mac Grady Ø On reporte le nombre caractéristique de la série dans une table statistique de Mac Grady. Ø On y lit le Nombre le Plus Probable (NPP) de microorganismes présents dans l’inoculum de la dilution correspondant au chiffre des centaines du nombre caractéristique. Exemple : 321 correspond au NPP de 15. Cela signifie qu’il y a statistiquement quinze bactéries dans l’inoculum de la dilution 10 -(n+1). Expression du résultat
- Slides: 37