MANAGEMENTUL FARMACEUTIC I AL MEDICAIEI Farm primar GHIESCU
































- Slides: 39

MANAGEMENTUL FARMACEUTIC ȘI AL MEDICAȚIEI Farm. primar GHIȚESCU MIHAELA Farm. șef Spitalul Clinic de Urgență Sf. Spiridon Iași Și Farm. primar FLOREA SIMONA Farm. șef Spitalul Clinic Municipal de Urgență Timișoara - evaluator de servicii de sănătate

ORDIN nr. 962 din 29 iulie 2009 - pentru aprobarea Normelor privind înfiinţarea, organizarea şi funcţionarea farmaciilor şi drogheriilor ART. 31 Farmacia cu circuit închis asigură asistenţa cu medicamente de uz uman pentru bolnavii internaţi în spitale şi în alte instituţii cu reţea sanitară proprie, serviciul de ambulanţă, precum şi pentru ambulatoriu în cadrul programelor naţionale de sănătate şi ambulatoriul instituţiilor cu reţea sanitară proprie, conform legislaţiei în vigoare. ART. 32 Farmacia de circuit închis se organizează ca secţie în structura organizatorică a unităţilor sanitare sau în altă formă prevăzută de structura instituţiei sau asociaţiei care o deţine.

• LEGEA FARMACIEI 266/2008 prevede la articolul 9: Autorizația de funcționare a farmaciei conferă dreptul de a deține, de a prepara și de a elibera, în condițiile legii substanțe și medicamente stupefiante ori precursori ai acestora, folosite în scop medical.

Exemple de farmacii de spital din România



FARMACIA MODERNĂ FARMACIA VIITORULUI


Din păcate încă mai avem în spitalele din țara noastră astfel de farmacii:


OARE ACREDITAREA SPITALELOR ÎNSEAMNĂ DOAR ÎNTOCMIRE DE H RTII ȘI MULTĂ BIROCRAȚIE ? ? ?

PRINCIPALELE PROBLEME ALE FARMACIEI DE SPITAL DIN ROM NIA - lipsa personalului raportat la numărul de paturi - lipsa spațiului raportat la numărul de paturi și a condițiilor de depozitare a medicamentelor si materialelor sanitare - spitale pavilionare unde transportul medicamentelor din farmacie către secții se face cu mașini care nu corespund ( fara monitorizarea temperaturii) - spitale a căror spații au fost revendicate de către vechii proprietari - manageri care nu înțeleg că diluția soluțiilor perfuzabile nu se face în spații improprii - spitale unde încă se depozitează pe secție medicamentele din studiile clinice - spitale unde înca eliberarea medicamentelor se face pe condici scrise de mana ( lipsă program informatic/lipsa condica electronica) - legislatie incompletă - lipsa medicamentelor de pe piaţă - lipsa banilor pentru medicamente

PRINCIPALELE PROBLEME ALE FARMACIEI DE SPITAL DIN ROM NIA - sistemul greoi de aprovizionare cu medicamente și materiale sanitare - sistem greoi de transfer fără plată între spitale a medicamentelor care au termen de expirare apropiat din programe ( blocaj CAS ). - în unele farmacii de spital nu s-a mai făcut igienizare de mulți ani (motivul-lipsa banilor ) - lipsa farmaciștilor clinicieni din spitale - spitale care au externalizat serviciul de curațenie, iar în farmacie este repartizată o îngrijitoare pentru 1 -2 ore maxim - lipsa personalului necalificat în farmacii, pentru manipularea soluţiilor perfuzabile, materialelor sanitare, medicamentelor, sub supravegherea strictă a farmacistului şi asistentului de farmacie

ACREDITAREA FARMACIEI DE SPITAL • Lista de verificare nr. 21 – Managementul medicației • Lista de verificare nr. 46 - Managementul medicației oncologice • Lista de verificare nr. 62 - Managementul farmaciei

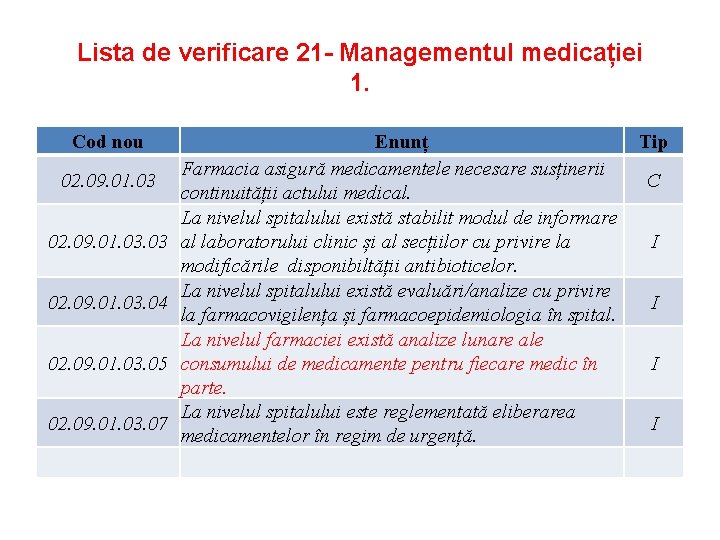
Lista de verificare 21 - Managementul medicației 1. Cod nou 02. 09. 01. 03. 03 02. 09. 01. 03. 04 02. 09. 01. 03. 05 02. 09. 01. 03. 07 Enunț Farmacia asigură medicamentele necesare susținerii continuității actului medical. La nivelul spitalului există stabilit modul de informare al laboratorului clinic și al secțiilor cu privire la modificările disponibiltății antibioticelor. La nivelul spitalului există evaluări/analize cu privire la farmacovigilența și farmacoepidemiologia în spital. La nivelul farmaciei există analize lunare ale consumului de medicamente pentru fiecare medic în parte. La nivelul spitalului este reglementată eliberarea medicamentelor în regim de urgență. Tip C I I

Lista de verificare 21 - Managementul medicației 2. Cod nou Enunț Organizarea activităţii farmaceutice se face pe baza unor proceduri şi instrucţiuni de lucru specifice. La nivelul spitalului există reglementare cu privire la 02. 09. 02. 06 depozitarea, predarea spre distrugere și casarea medicamentelor expirate. Circuitul informaţional al produselor farmaceutice este 02. 09. 02. 04 respectat. Responsabilitățile privind monitorizarea trasabilității 02. 09. 02. 04. 01 medicamentului sunt stabilite. Eticheta de identificare a preparatului magistral sau a celui elaborat conține numărul de înregistrare din registrele corespunzătoare, date de identificare ale persoanei care a 02. 09. 02. 04. 03 preparat și a celei care a ambalat medicamentul magistral sau oficinal, data de preparare, termenul de valabilitate și condițiile de păstrare. 02. 09. 02 Tip C I I

Lista de verificare 21 - Managementul medicației 3. Cod nou Enunț Spitalul a stabilit structurile funcţionale cu atribuţii în 02. 10. 01 implementarea şi monitorizarea bunelor practici de utilizare a antibioticelor. La nivelul spitalului este stabilită lista cu antibiotice 02. 10. 01. 09 pentru antibioprofilaxie, în funcție de antibioticorezistența analizată. Farmacia asigură necesarul de antibiotice, luând în considerare evoluția antibioticorezistenței și 02. 10. 03. 01 monitorizează consumul de antibiotice şi traseul complet al produselor eliberate, inclusiv al celor care nu au fost administrate. La nivelul spitalului există planificarea aprovizionării 02. 10. 03. 01 cu antibiotice. La nivelul spitalului este reglementat modul de 02. 10. 03. 01. 03 recuperare a antibioticelor neutilizate pe secții. Tip C I I

Lista de verificare 21 - Managementul medicației 4. Cod nou 02. 10. 03. 02. 01 02. 10. 05. 01. 02 02. 12. 02. 02 Enunt Farmacia verifică respectarea bunelor practici în prescrierea şi utilizarea antibioticelor. La nivelul spitalului există reglementare cu privire la respectarea înregistrării datelor necesare asigurării trasabilitatății unităților de antibiotice prescrise, eliberate, administrate sau returnate. Serviciile clinice au implementat reglementări de antibioticoterapie şi antibioticoprofilaxie, specifice specialității și secției, pentru principalele situații clinice. Informații privind incompatibilitățile în soluții (injectabile sau perfuzabile) și interacțiunile farmacocinetice generatoare de modificări ale efectului terpeutic/efecte adverse sunt disponibile permanent pentru personalul medical. Depozitarea şi manipularea medicamentelor cu risc înalt sau a medicamentelor a/al căror denumire/ambalaj este asemănător, sunt reglementate în spital. La nivelul spitalului este reglementat modul de monitorizare a depozitării, etichetării, prescrierii și utilizării medicamentelor cu risc înalt și a celor cu denumire/ambalaj asemănător. Tip C I C I

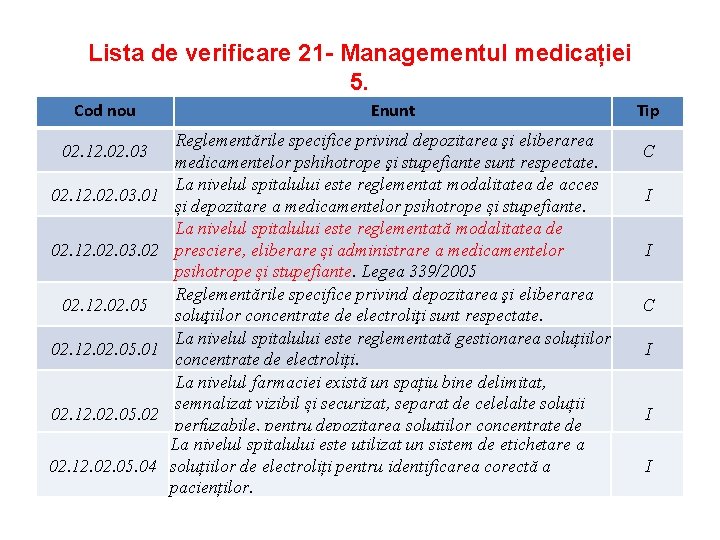
Lista de verificare 21 - Managementul medicației 5. Cod nou 02. 12. 02. 03. 01 02. 12. 03. 02 02. 12. 02. 05. 01 02. 12. 05. 02 02. 12. 05. 04 Enunt Reglementările specifice privind depozitarea şi eliberarea medicamentelor pshihotrope şi stupefiante sunt respectate. La nivelul spitalului este reglementat modalitatea de acces și depozitare a medicamentelor psihotrope și stupefiante. La nivelul spitalului este reglementată modalitatea de presciere, eliberare și administrare a medicamentelor psihotrope și stupefiante. Legea 339/2005 Reglementările specifice privind depozitarea şi eliberarea soluţiilor concentrate de electroliţi sunt respectate. La nivelul spitalului este reglementată gestionarea soluțiilor concentrate de electroliți. La nivelul farmaciei există un spațiu bine delimitat, semnalizat vizibil și securizat, separat de celelalte soluții perfuzabile, pentru depozitarea soluțiilor concentrate de La nivelul spitalului electroliti electroliți. este utilizat un sistem de etichetare a soluțiilor de electroliți pentru identificarea corectă a pacienților. Tip C I I I

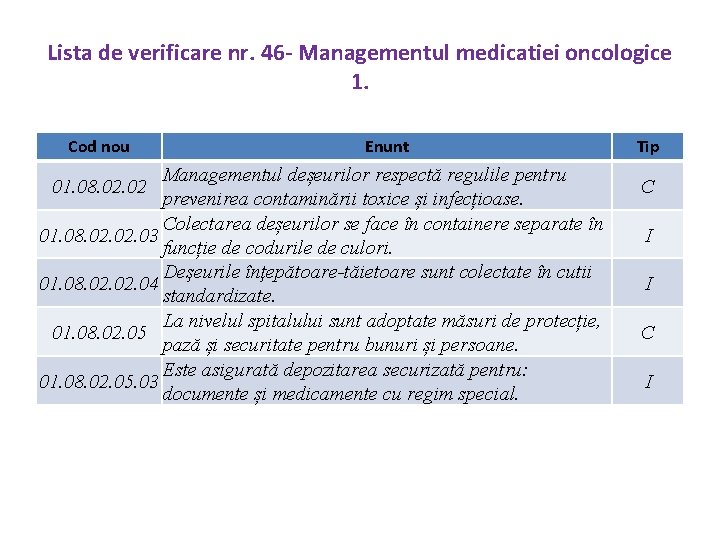
Lista de verificare nr. 46 - Managementul medicatiei oncologice 1. Cod nou Enunt Managementul deșeurilor respectă regulile pentru prevenirea contaminării toxice și infecțioase. Colectarea deșeurilor se face în containere separate în 01. 08. 02. 03 funcție de codurile de culori. Deşeurile înţepătoare-tăietoare sunt colectate în cutii 01. 08. 02. 04 standardizate. La nivelul spitalului sunt adoptate măsuri de protecție, 01. 08. 02. 05 pază și securitate pentru bunuri și persoane. Este asigurată depozitarea securizată pentru: 01. 08. 02. 05. 03 documente și medicamente cu regim special. 01. 08. 02 Tip C I I C I

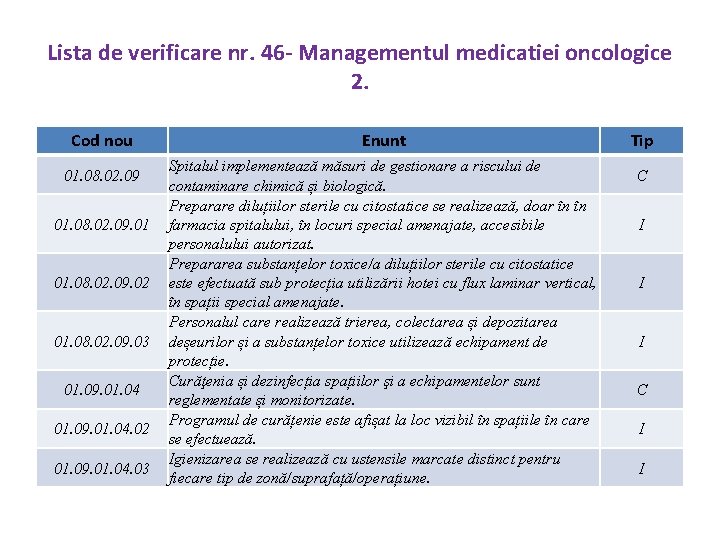
Lista de verificare nr. 46 - Managementul medicatiei oncologice 2. Cod nou 01. 08. 02. 09. 01 01. 08. 02. 09. 02 01. 08. 02. 09. 03 01. 09. 01. 04. 02 01. 09. 01. 04. 03 Enunt Spitalul implementează măsuri de gestionare a riscului de contaminare chimică și biologică. Preparare diluțiilor sterile cu citostatice se realizează, doar în în farmacia spitalului, în locuri special amenajate, accesibile personalului autorizat. Prepararea substanțelor toxice/a diluțiilor sterile cu citostatice este efectuată sub protecția utilizării hotei cu flux laminar vertical, în spații special amenajate. Personalul care realizează trierea, colectarea și depozitarea deșeurilor și a substanțelor toxice utilizează echipament de protecție. Curăţenia și dezinfecția spațiilor şi a echipamentelor sunt reglementate și monitorizate. Programul de curățenie este afișat la loc vizibil în spațiile în care se efectuează. Igienizarea se realizează cu ustensile marcate distinct pentru fiecare tip de zonă/suprafață/operațiune. Tip C I I I C I I

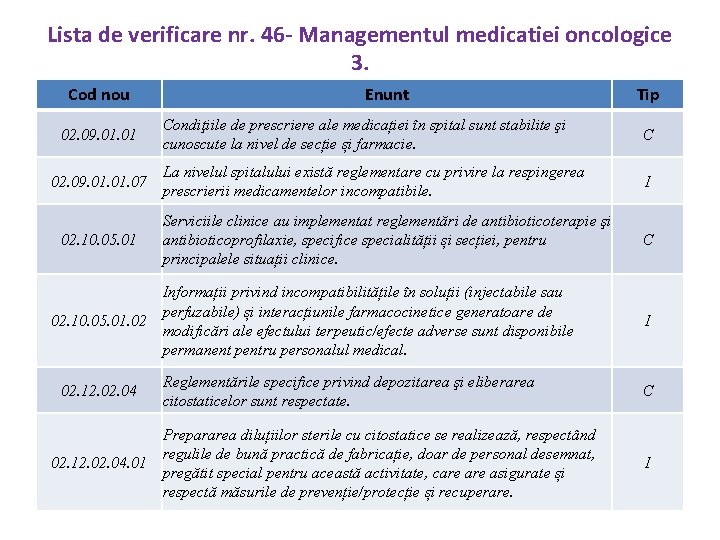
Lista de verificare nr. 46 - Managementul medicatiei oncologice 3. Cod nou 02. 09. 01. 01. 07 02. 10. 05. 01 Enunt Condiţiile de prescriere ale medicației în spital sunt stabilite şi cunoscute la nivel de secție și farmacie. C La nivelul spitalului există reglementare cu privire la respingerea prescrierii medicamentelor incompatibile. I Serviciile clinice au implementat reglementări de antibioticoterapie şi antibioticoprofilaxie, specifice specialității și secției, pentru principalele situații clinice. C Informații privind incompatibilitățile în soluții (injectabile sau perfuzabile) și interacțiunile farmacocinetice generatoare de 02. 10. 05. 01. 02 modificări ale efectului terpeutic/efecte adverse sunt disponibile permanent pentru personalul medical. 02. 12. 04 Tip Reglementările specifice privind depozitarea şi eliberarea citostaticelor sunt respectate. Prepararea diluțiilor sterile cu citostatice se realizează, respectând regulile de bună practică de fabricație, doar de personal desemnat, 02. 12. 04. 01 pregătit special pentru această activitate, care asigurate și respectă măsurile de prevenție/protecție și recuperare. I C I

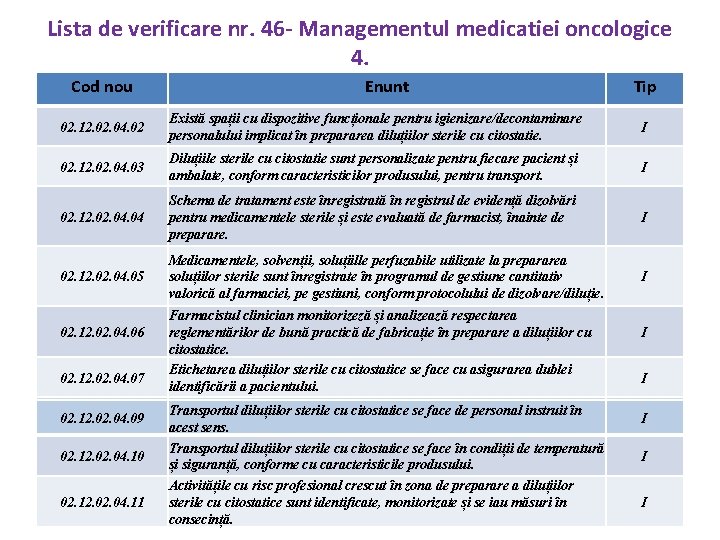
Lista de verificare nr. 46 - Managementul medicatiei oncologice 4. Cod nou Enunt Tip 02. 12. 04. 02 Există spații cu dispozitive funcționale pentru igienizare/decontaminare personalului implicat în prepararea diluțiilor sterile cu citostatie. I 02. 12. 04. 03 Diluțiile sterile cu citostatie sunt personalizate pentru fiecare pacient și ambalate, conform caracteristicilor produsului, pentru transport. I 02. 12. 04. 04 Schema de tratament este înregistrată în registrul de evidență dizolvări pentru medicamentele sterile și este evaluată de farmacist, înainte de preparare. I 02. 12. 04. 05 Medicamentele, solvenții, soluțiille perfuzabile utilizate la prepararea soluțiilor sterile sunt înregistrate în programul de gestiune cantitativ valorică al farmaciei, pe gestiuni, conform protocolului de dizolvare/diluție. I 02. 12. 04. 06 02. 12. 04. 07 02. 12. 04. 09 02. 12. 04. 08 02. 12. 04. 10 02. 12. 04. 11 Farmacistul clinician monitorizeză și analizează respectarea reglementărilor de bună practică de fabricație în preparare a diluțiilor cu citostatice. Etichetarea diluțiilor sterile cu citostatice se face cu asigurarea dublei identificării a pacientului. Transportul diluțiilor sterile cu citostatice se face de personal în Diluțiile sterile cu citostatice care nu se administrează imediatinstruit sunt păstrate acest sens. de temperatură și siguranță conforme cu caracteristicile în condiții produsului. Transportul diluțiilor sterile cu citostatice se face în condiții de temperatură și siguranță, conforme cu caracteristicile produsului. Activitățile cu risc profesional crescut în zona de preparare a diluțiilor sterile cu citostatice sunt identificate, monitorizate și se iau măsuri în consecință. I I I

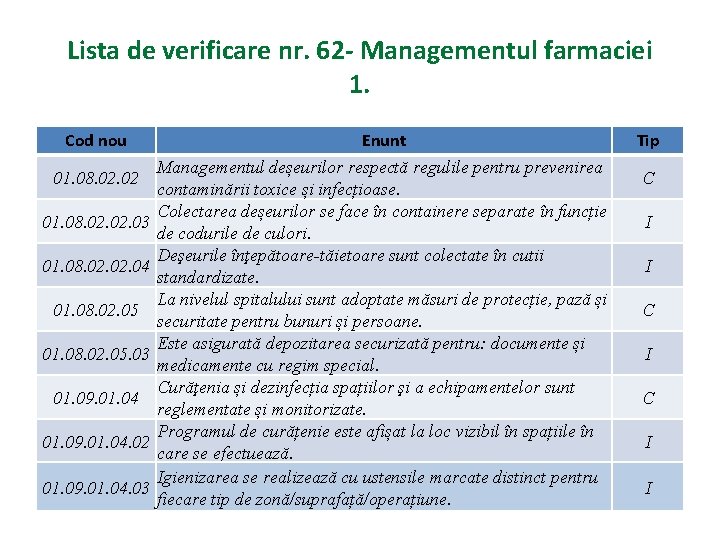
Lista de verificare nr. 62 - Managementul farmaciei 1. Cod nou 01. 08. 02. 02. 03 01. 08. 02. 04 01. 08. 02. 05. 03 01. 09. 01. 04. 02 01. 09. 01. 04. 03 Enunt Managementul deșeurilor respectă regulile pentru prevenirea contaminării toxice și infecțioase. Colectarea deșeurilor se face în containere separate în funcție de codurile de culori. Deşeurile înţepătoare-tăietoare sunt colectate în cutii standardizate. La nivelul spitalului sunt adoptate măsuri de protecție, pază și securitate pentru bunuri și persoane. Este asigurată depozitarea securizată pentru: documente și medicamente cu regim special. Curăţenia și dezinfecția spațiilor şi a echipamentelor sunt reglementate și monitorizate. Programul de curățenie este afișat la loc vizibil în spațiile în care se efectuează. Igienizarea se realizează cu ustensile marcate distinct pentru fiecare tip de zonă/suprafață/operațiune. Tip C I I

Lista de verificare nr. 62 - Managementul farmaciei 2. Cod nou 02. 01. 03. 01. 16 02. 09. 01. 01. 06 02. 09. 01. 07 02. 09. 01. 09 02. 09. 01. 02. 05 02. 09. 02. 02. 04 Enunt Spitalul asigură asistența medicală de urgență, în limitele competențelor sale, permanent. La nivelul spitalului este asigurat stocul stabilit de medicamente necesare pentru serviciile medicale de urgență. Condiţiile de prescriere ale medicației în spital sunt stabilite şi cunoscute la nivel de secție și farmacie. Codificarea medicației eliberate din farmacie permite identificarea pacientului. La nivelul spitalului există reglementare cu privire la respingerea prescrierii medicamentelor incompatibile. Eliberarea medicamentelor cu costuri mari se face doar cu aprobarea prealabilă a managementului. Farmacologul/Farmacistul clinician este implicat activ în activitatea de prescriere şi monitorizare a medicaţiei. Farmacistul clinician supervizează activitatea de dizolvare, diluție pentru preparatele parenterale special stabilite de Consiliul medical. Organizarea activităţii farmaceutice se face pe baza unor proceduri şi instrucţiuni de lucru specifice. La nivelul spitalului există personal nominalizat cu monitorizarea mișcării medicamentelor și produselor farmaceutice, monitorizarea termenelor de valabilitate și retragerea produselor farmaceutice care expiră. Tip C I I I C I

Lista de verificare nr. 62 - Managementul farmaciei 3. Cod nou 02. 09. 02. 05 02. 09. 02. 10 02. 09. 02. 11 02. 09. 02. 04 Enunt La nivelul spitalului există reglementare cu privire la modul de atenționare a sefilor de secție referitor la medicația cu mișcare încetinită. La nivelul spitalului este reglementată activitatea de dizolvare/diluție pentru preparatele parenterale (soluții injectabile sau perfuzabile). Soluțiile sterile sunt preparate în farmacie, într-un spațiu special amenajat (separat, izolat, aseptic). Tip I I I Circuitul informaţional al produselor farmaceutice este respectat. C 02. 09. 02. 04. 02 Seria și lotul substanțelor utilizate la prepararea magistralelor sunt înregistrate în registrul preparatelor magistrale și al produselor elaborate. I 02. 09. 02. 04 Registrele de evidență stupefiante sunt completate la zi și securizate în farmacie și pe secțiile din spital. I 02. 09. 02. 04. 05 02. 09. 02. 05. 01 02. 09. 02. 05. 02 Înregistrările monitorizării temperaturii și umidității pentru fiecare încăpere a farmaciei și înregistrările de temperatură pentru instalațiile frigorifice sunt completate la zi. Medicaţia din studiile clinice este păstrată şi gestionată în condiţii optime de farmacia spitalului/farmacistul şef, utilizarea ei fiind monitorizată de farmacologul/farmacistul clinician. Medicaţia din studiile clinice este păstrată în farmacia spitalului, conform specificațiilor individuale şi gestionată de către farmacistul-şef. Monitorizarea produselor farmaceutice și materialelor sanitare utilizate în studii clinice este reglementată. I C I I

Lista de verificare nr. 62 - Managementul farmaciei 4. Cod nou 02. 09. 02. 05. 03 02. 10. 03. 01. 04 02. 10. 03. 02. 02 02. 10. 03. 03. 01 02. 10. 03. 02 02. 10. 03. 03 Enunt Monitorizarea produselor farmaceutice și materialelor sanitare utilizate în studii clinice se efectuează de către farmacistul-şef / farmacolog / farmacistul clinician, după caz. Farmacia asigură necesarul de antibiotice, luând în considerare evoluția antibioticorezistenței și monitorizează consumul de antibiotice şi traseul complet al produselor eliberate, inclusiv al celor care nu au fost administrate. Ora eliberării antibioticelor din farmacie este stabilită pentru a asigura respectarea ritmului de administrare și este consemnată în documentele farmaciei și în FO. Farmacia verifică respectarea bunelor practici în prescrierea şi utilizarea antibioticelor. Pentru monitorizarea globală, farmacia exprimă consumul de antibiotice pe secții și pe spital sub forma DDD. Farmacia informează periodic prescriptorii si conducerea spitalului cu privire la antibioticele disponibile, precum şi consumul de antibiotice realizat pe secţii/compartimente cu paturi şi pe medici. Farmacia informează lunar prescriptorii cu privire la antibioticele disponibile. Spitalul are definite și comunicate medicilor curanți antibioticele cu regim special. Farmacia informează lunar consiliul medical cu privire la consumul de antibiotice și returul acestora, pentru fiecare secție. Tip I C I C I I I

Lista de verificare nr. 62 - Managementul farmaciei 5. Cod nou Enunt Farmacia informează lunar consiliul medical cu privire la consumul de antibiotice per medic. Compartimentul de microbiologie al laboratorului clinic are 02. 10. 04. 01 proceduri de control intern de calitate a invetigațiilor pentru detectarea antibioticorezistenţei. Antibioticele/antifungicele utilizate pentru executarea 02. 10. 04. 01. 06 antibiogramei/antifungigramei sunt disponibile în farmacia spitalului. 02. 10. 03. 04 Tip I C I

IMPACTUL DESERIALIZĂRII MEDICAMENTELOR ASUPRA ACTIVITĂȚII FARMACIEI

IMPACTUL DESERIALIZĂRII MEDICAMENTELOR ASUPRA ACTIVITĂȚII FARMACIEI • Începând cu data de 9 februarie 2019 va intra în vigoare Regulamentul delegat 161/2016 al Comisiei Europene din 2 octombrie 2015, de completare a Directivei 2001/83/CE a Parlamentului European pentru a preveni pătrunderea pe piață a medicamentelor falsificate, în ceea ce privește identitatea, istoricul sau sursa acestora.

IMPACTUL DESERIALIZĂRII MEDICAMENTELOR ASUPRA ACTIVITĂȚII FARMACIEI • Începând cu data amintită, pot fi puse în circulație numai medicamente cu prescripție medicală care poartă noile caracteristici de siguranță. • În acest scop MS a pus în transparență decizională Ordinul privind aprobarea Normelor Metodologice de implementare a prevederilor Regulamentului Delegat 161/2016.

• • • La Art. 1. (1) - se explică definițiile prevăzute în Regulamentul Delegat (UE) 2016/161 al Comisiei din 2 octombrie 2015 de completare a Directivei 2001/83/CE a Parlamentului European și a Consiliului, - se stabilesc norme detaliate pentru elementele de siguranță care apar pe ambalajul medicamentelor de uz uman, - Autoritatea Națională Competentă în sensul Regulamentului Delegat este Agenția Națională a Medicamentului și a Dispozitivelor Medicale (ANMDM). În înțelesul prezentului ordin, termenii și noțiunile folosite au următoarele semnificații: a) Ambalaj - ambalajul secundar conform art. 699 pct. 26 din Legea nr. 95/2006, republicată, b) Asociația Organizația de Serializare a Medicamentelor (OSMR) - persoană juridică de drept privat fără scop patrimonial, responsabilă cu crearea și gestionarea repertoriului naţional, numit Sistem Național de Verificare a Medicamentelor (SNVM), c) Locație Utilizator Final (LUF) - orice locație fizică sau funcțională stabilită de utilizatorul final ce accesează SNVM în scopul ȋndeplinirii obligațiilor stabilite de prezentul ordin, d) Numărul de lot - numărul seriei de fabricație prevăzut la art. 774 lit. m) din Legea 95/2006, republicată, e) Organizația Europeană pentru Verificarea Medicamentelor (EMVO) – persoană juridică fără scop patrimonial responsabilă de crearea și administrarea Sistemului European de Verificare a Medicamentelor (EMVS);

• • • f) Sistemul European de Verificare a Medicamentelor (European Medicines Verification System – EMVS/Hub european) – router central de informații și de date, creat și gestionat de către EMVO; g) Punct Tehnic de Conectare (PTC) - terminal IT conectat la scaner, cu acces la internet, pe care este instalat certificatul digital, utilizat pentru autentificare la SNVM şi care instalată aplicația ce permite conectarea la SNVM, prin care se trimit și se primesc mesaje automate către/dinspre SNVM; h) IU - identificator unic; i) Status inactiv - statusul unui IU care a fost scos din uz; j) Utilizator final (UF) - entitate juridică ce are responsabilități cu privire la verificarea și/sau schimbarea statutului unui medicament identificat cu un IU prin intermediul SNVM, respectiv: distribuitor angro, farmacie comunitară, oficină locală de distribuție, farmacie cu circuit închis, drogherie, precum și orice altă entitate autorizată de Ministerul Sănătății pentru oferirea de asistență medicală, cu sau fără farmacie de circuit închis, precum și persoanele îndreptățite să furnizeze medicamente către populație în România, potrivit legislației în vigoare; k) Verificare sau scoatere din uz colectivă - operațiunea de verificare sau de schimbare a statusului a două sau mai multe ambalaje de medicament cu IU, simultan, prin includerea identificatorilor unici într-un singur mesaj trimis către SNVM.

IMPACTUL DESERIALIZĂRII MEDICAMENTELOR ASUPRA ACTIVITĂȚII FARMACIEI • La Art. 2. este prevazută activitatea ANMDM-ului care publică și actualizează pe pagina web proprie lista cu medicamentele autorizate de punere pe piață care trebuie să prezinte elemente de siguranță în conformitate cu art. 774 lit. o) din Legea nr. 95/2006, republicată, cu modificările și completările ulterioare.

IMPACTUL DESERIALIZĂRII MEDICAMENTELOR ASUPRA ACTIVITĂȚII FARMACIEI • În Art. 3 sunt prevăzute medicamentele exceptate de la deserializare: • - medicamentele care sunt distribuite/eliberate în baza unei Autorizații privind furnizarea de medicamente pentru nevoi speciale, în situația unei suspiciuni de epidemie sau în cazul unei epidemii confirmate cu agenţi patogeni, toxine, precum şi în cazul unei suspiciuni de răspândire confirmată de agenţi chimici sau radiaţii nucleare care ar putea pune în pericol sănătatea populației; • - medicamentele distribuite/eliberate în baza avizului de donaţie emis de ANMDM, respectiv Ministerul Sănătăţii în condițiile Ordinului ministrului sănătății nr. 1032/2011 pentru aprobarea Normelor privind donaţiile de medicamente, materiale sanitare, dispozitive medicale, vaccinuri, seruri şi consumabilele aferente care poartă deja elemente de siguranță conforme cu prevederile Regulamentului Delegat (UE) 2016/161, persoana autorizată sau îndreptățită să furnizeze medicamentul va efectua verificarea şi scoaterea din uz a IU la momentul furnizării medicamentului către pacient.

IMPACTUL DESERIALIZĂRII MEDICAMENTELOR ASUPRA ACTIVITĂȚII FARMACIEI • Art. 5. a) Deținătorii de autorizații de punere pe piață (DAPP) din România, deținătorii de autorizaţii de import paralel (DAIP) şi titularii de autorizații privind furnizarea de medicamente pentru nevoi speciale au obligaţia de a se conecta la EMVS și la SNVM; • b) Utilizatorul final este obligat să asigure condițiile necesare în vederea conectării la SNVM, dacă nu se prevede altfel în legislația națională în acord cu prevederile art. 23 din Regulamentul Delegat.

IMPACTUL DESERIALIZĂRII MEDICAMENTELOR ASUPRA ACTIVITĂȚII FARMACIEI • Art. 6. Elementele de date stabilite ca fiind obligatorii a fi incluse în IU al medicamentului pentru punerea pe piață în România sunt următoarele: • - codul produsului, • - numărul de serie, • - numărul de lot, • - data expirării. • Aceste elemente sunt prezentate în Anexa 1 la prezentele norme.

IMPACTUL DESERIALIZĂRII MEDICAMENTELOR ASUPRA ACTIVITĂȚII FARMACIEI • Deserializarea medicamentelor, obligatorie fiind, va îngreuna mult activitatea farmaciei de spital care va avea nevoie de spaţiu pentru depozitarea medicamentelor pâna la realizarea decomisionării și de personal care să efectueze această operațiune. • În România la ora actuală sunt foarte multe farmacii care nu respectă normativele de personal (un singur farmacist și un singur asistent). De altfel întreaga medicație care asigură buna desfașurare a actului medical în toate spitalele (aproximativ 450) din țară se află sub supravegherea unui număr de circa 650 de farmaciști.

La revedere !
 Managementul proceselor
Managementul proceselor Managementul stresului profesional
Managementul stresului profesional Managementul performantei
Managementul performantei Locuri de munca managementul
Locuri de munca managementul Curs managementul proiectelor
Curs managementul proiectelor Ovolum
Ovolum Analiza concurentilor
Analiza concurentilor Managementul cunostintelor
Managementul cunostintelor Managementul temelor pentru acasa
Managementul temelor pentru acasa Managementul operatiunilor de productie
Managementul operatiunilor de productie Managementul calitatii in educatie
Managementul calitatii in educatie Chestionar managementul timpului
Chestionar managementul timpului Managementul conflictelor in scoala
Managementul conflictelor in scoala Managementul calitatii totale
Managementul calitatii totale Managementul cercetarii ubb
Managementul cercetarii ubb Strategii de imbunatatire a calitatii serviciilor medicale
Strategii de imbunatatire a calitatii serviciilor medicale Managementul calitatii in educatie
Managementul calitatii in educatie Plan de lucru
Plan de lucru Types of farm planning
Types of farm planning Harmouns
Harmouns What does benjamin represent in animal farm
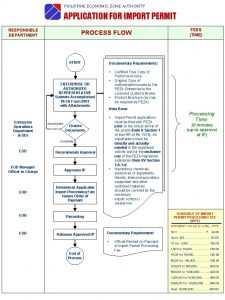
What does benjamin represent in animal farm Peza process flow
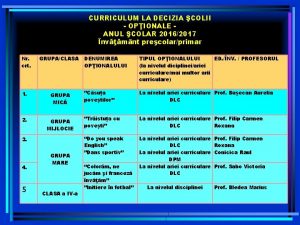
Peza process flow Tipuri de optionale invatamant prescolar
Tipuri de optionale invatamant prescolar Repere metodologice in invatamantul primar
Repere metodologice in invatamantul primar Primar chart
Primar chart Dppd ulbs
Dppd ulbs Mijloace de instruire
Mijloace de instruire Vad menas med socialisation?
Vad menas med socialisation? Omencs 5893/2016
Omencs 5893/2016 Etalonul de lucru este un etalon primar
Etalonul de lucru este un etalon primar Icoala
Icoala Disociativ
Disociativ Primär sensorischer kortex
Primär sensorischer kortex Metode interactive de predare-invatare invatamant primar
Metode interactive de predare-invatare invatamant primar Unterschied aufwand kosten
Unterschied aufwand kosten Vad är socialisation
Vad är socialisation Primaria camarzana
Primaria camarzana Mesolimbisches dopaminsystem
Mesolimbisches dopaminsystem Sozialisationsinstanzen primär sekundär tertiär
Sozialisationsinstanzen primär sekundär tertiär Interdisciplinaritatea in invatamantul primar
Interdisciplinaritatea in invatamantul primar