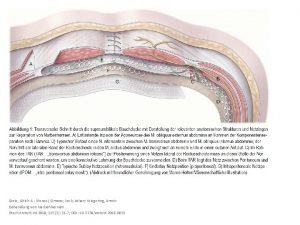
Magnesium Copyright 2006 Armin Glaser Magnesium 2 hufigstes






















- Slides: 30

Magnesium Copyright 2006 Armin Glaser

Magnesium • 2. häufigstes Kation im Meerwasser • 1284 mg/kg (Ca = 412 mg/kg) • 52, 8 m. Mol/kg (Ca = 10, 28 m. Mol/kg)

Magnesium • bildet mit Carbonationen Ionenpaare • lagert sich an Kalkoberflächen an (Calcifikationsinhibitor) • verhindert Kalkausfällung in Ca. CO 3 -übersättigtem Meerwasser

Wer verbraucht Magnesium ? nein ja

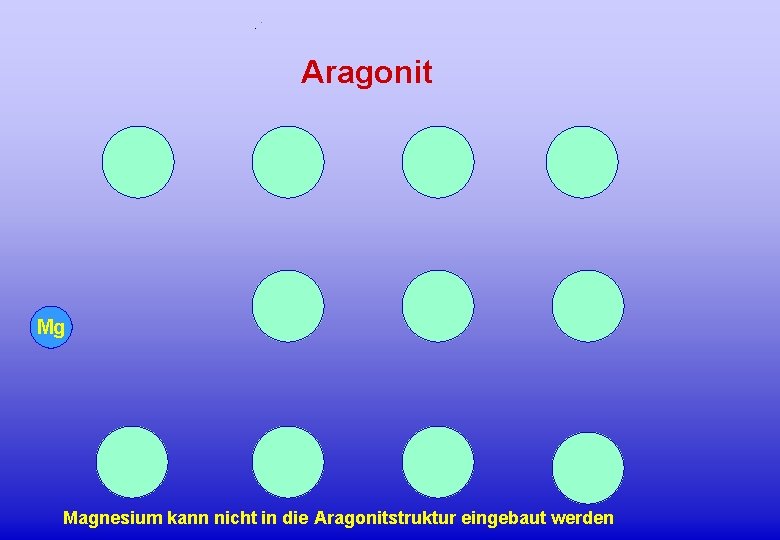
Steinkorallen brauchen kein Magnesium ! Warum ?

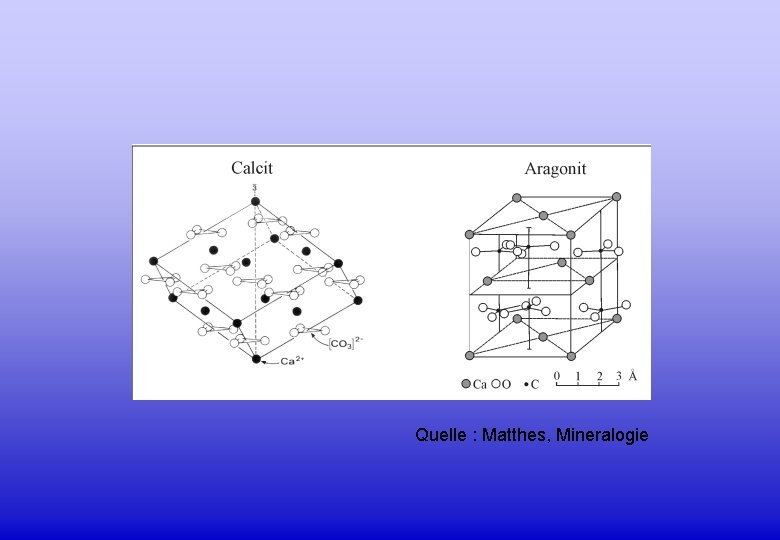
Quelle : Matthes, Mineralogie

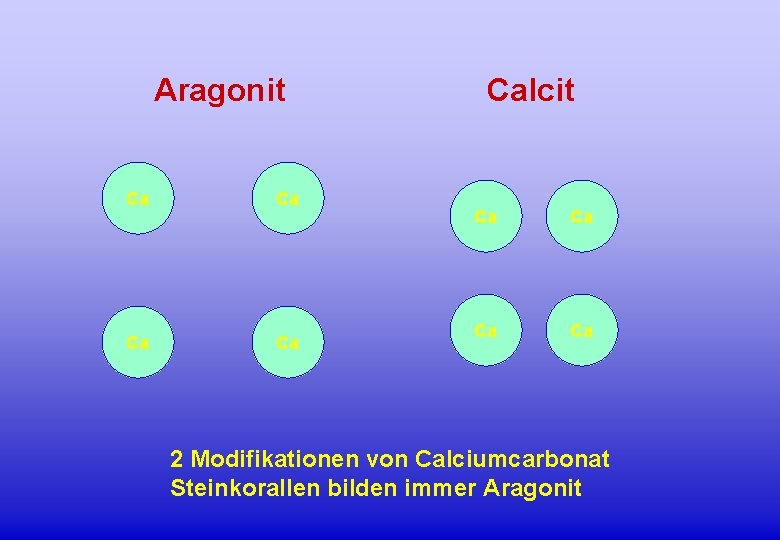
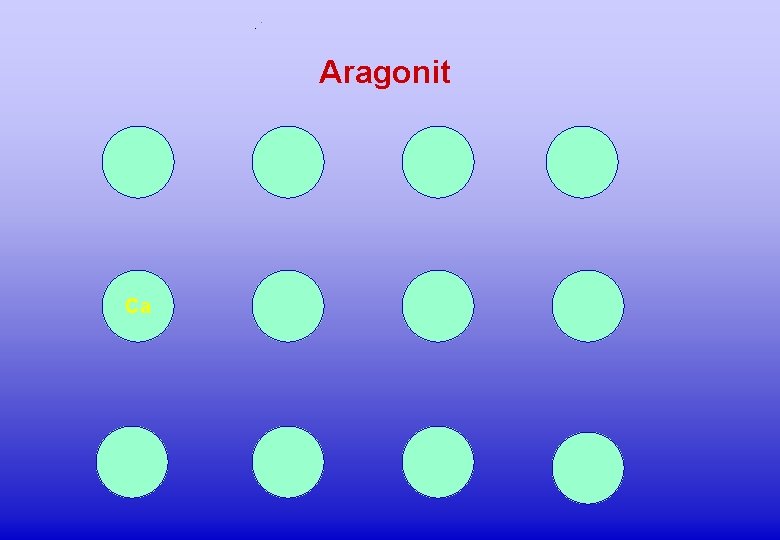
Aragonit Ca Ca Calcit Ca Ca 2 Modifikationen von Calciumcarbonat Steinkorallen bilden immer Aragonit


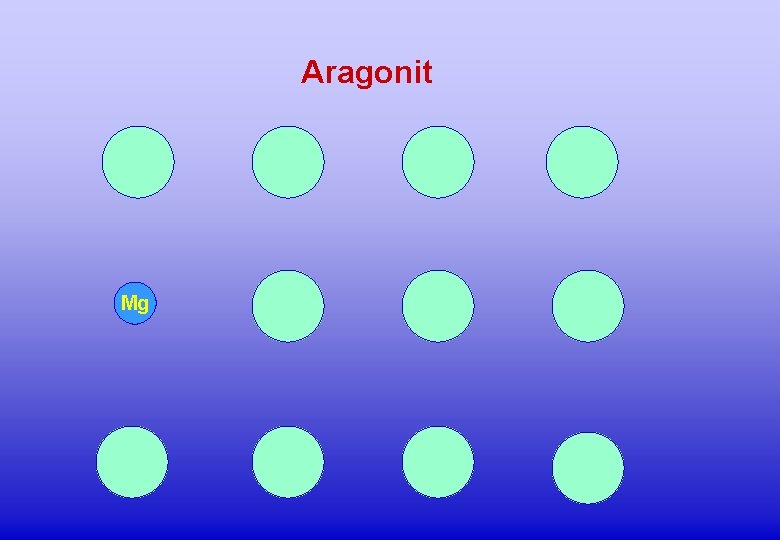
Aragonit Mg

Aragonit Mg Magnesium kann nicht in die Aragonitstruktur eingebaut werden

g Aragonit

Aragonit Ca

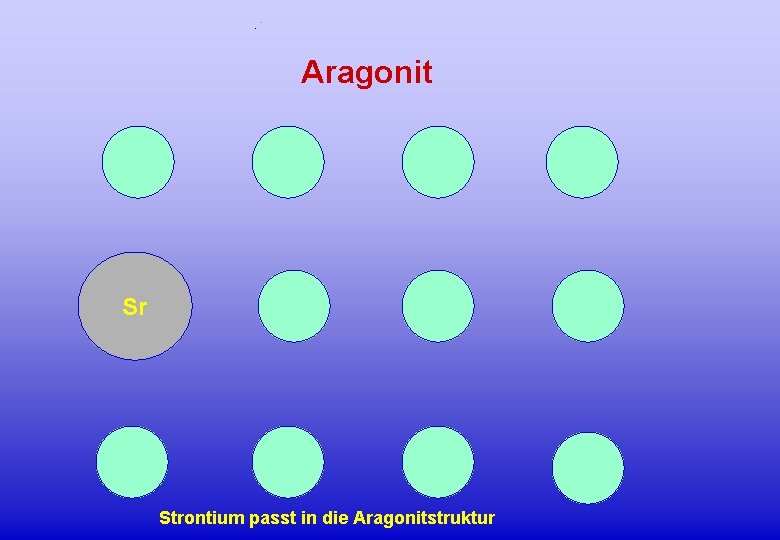
Aragonit Sr Strontium passt in die Aragonitstruktur

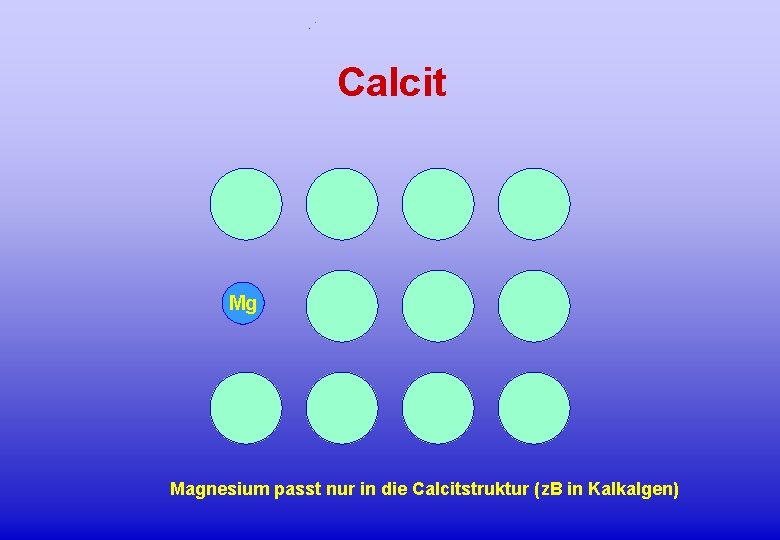
Calcit Mg Magnesium passt nur in die Calcitstruktur (z. B in Kalkalgen)

Wer verbraucht Magnesium ?

Wer verbraucht Magnesium ?

Wer verbraucht Magnesium ? Stein aus einem Becken, in das viel Magnesium gegeben wurde

Überschüssiges Magnesium lagert sich auf dem Gestein ab ! • Hoch Mg-Calcit Ca 0, 87 Mg 0, 13 Ca. CO 3 • Dolomit Mg. Ca(CO 3)2 • Huntit Mg 3 Ca(CO 3)4 • Magnesit Mg. CO 3 • Magnesiumhydroxidcarbonat Mg 5(CO 3)4(OH)2*5 H 2 O • Artinit Mg 2 CO 3(OH)2*3 H 2 O • Brucit Mg(OH)2

Überschüssiges Magnesium lagert sich auf dem Gestein ab ! • Silicatgesteine • Aragonit • Calcit • Dolomit • Magnesit zunehmend

Überschüssiges Magnesium lagert sich auf dem Gestein ab ! abhängig von : • p. H • CO 2 -Gehalt • k. H

Starke Magnesium-Zugabe ist nicht notwendig !

Wenn Mg zugegeben wird. . . wie ?

Übliche Mg-Zugabe : 1000 -Liter-Becken 100 mg/L Mg-Anhebung 758 g Mg. Cl 2 * 6 H 2 O + 95 g Mg. SO 4 * 7 H 2 O

Übliche Mg-Zugabe : Herleitung : 1 kg Meerwasser enthält 19, 35 g Chlorid und 2, 71 g Sulfat

Übliche Mg-Zugabe : Mg. CO 3 Mg 2+ Cl. SO 42 - Mg 5(CO 3)4(OH)2 - CO 3 - p. H + Cl+ SO 42 -

Die Zugabe von Magnesium mit Hilfe von Magnesiumchlorid und Magnesiumsulfat bewirkt : - Überschuss an Chlorid und Sulfat Mangel an Carbonathärte Senkung des p. H

Gegenmaßnahmen : • Sulfat- und Chloridüberschuss unbedingt durch häufigen Wasserwechsel begrenzen • KH und p. H-Verringerung durch Zugabe von Natron (Na. HCO 3) und/oder Soda (Na 2 CO 3) ausgleichen

Bessere Vorgehensweise : • Magnesium nur als Magnesiumchlorid zugeben • KH als Soda (Na 2 CO 3) zugeben • mit Na. Cl-freiem Salz ausgleichen

Rechenbeispiel : • 1000 Liter-Becken soll um 100 mg/L Mg erhöht werden = 100 g Mg • Zugabe 836 g Mg. Cl 2 * 6 H 2 O • + 436 g Na 2 CO 3 (Soda) • + 120 g Na. Cl-freies Salz

VORSICHT. . . denn jedes Becken ist anders ! • KH + p. H kontrollieren • zu niedrige KH mit Natron ausgleichen • bei zu hoher KH weniger Soda zugeben • bei zu niedrigem p. H mehr Kalkwasser anwenden • bei zu hohem p. H Soda tlw. durch Natron ersetzen (je g Soda 1, 6 g Natron)
 Copyright 2006
Copyright 2006 Copyright 2006
Copyright 2006 Milton glaser born
Milton glaser born Gagne zihinsel beceriler
Gagne zihinsel beceriler Fassadenbau vom glaser
Fassadenbau vom glaser Dr david glaser
Dr david glaser Clinoïde antérieure
Clinoïde antérieure Dr rebecca glaser
Dr rebecca glaser Glaser verfahren
Glaser verfahren Armin andergassen
Armin andergassen Armin wiegering
Armin wiegering Armin kasapovic
Armin kasapovic Armin kuster
Armin kuster Armin bachmann
Armin bachmann Armin teskeredzic
Armin teskeredzic Stapfenacker schulhaus
Stapfenacker schulhaus Dr. armin andergassen
Dr. armin andergassen Armin lohmann
Armin lohmann Armin pullen
Armin pullen Magnesium sulfate and urine output
Magnesium sulfate and urine output Pharmaceutical uses of group 1 elements
Pharmaceutical uses of group 1 elements How to tell how many valence electrons on periodic table
How to tell how many valence electrons on periodic table Bohrs model of magnesium
Bohrs model of magnesium Is carbon malleable
Is carbon malleable Percent composition of magnesium carbonate
Percent composition of magnesium carbonate Berotec nebs
Berotec nebs Magnesium stent
Magnesium stent Magnesium reacting with nitric acid equation
Magnesium reacting with nitric acid equation Frequency dependence of dielectric constant
Frequency dependence of dielectric constant Positive ions are atoms that have
Positive ions are atoms that have Gerald da roza
Gerald da roza